联合肠系膜上/门静脉汇合部胰十二指肠切除术后左侧门静脉高压症的研究现状
2023-07-05梁鸿寅周明梅石珂辉汤礼军
邹 洪, 朱 桥, 文 艺, 梁鸿寅, 周明梅, 石珂辉, 吴 俊, 汤礼军
中国人民解放军西部战区总医院 a.普通外科, b.妇产科, c.创伤中心, 成都 610083
国内外大量研究发现,尽管胰腺导管腺癌根治术后5年生存率不足10%,但随着近年来术前新辅助化疗,术后的辅助治疗以及多学科协同合作治疗模式的开展,大大提高了胰腺癌患者的远期生存。临床上,许多胰头及胰腺钩突肿瘤由于解剖毗邻关系,往往会牵涉或侵犯到肠系膜上/门静脉汇合部,考虑肿瘤生物学行为,对于上述患者时常会施行联合肠系膜上/门静脉汇合部(或者脾静脉结扎)胰十二指肠切除术(pancreaticoduodenectomy,PD)。现有报道表明这种手术方式是安全可行的,并且对于患者术后生存能获益。但该种术式会增加患者术后的特殊并发症,对于肠系膜上/门静脉联合切除或者脾静脉结扎未给予脾静脉重建者会并发严重的左侧门静脉高压症,并产生一系列脾脏淤血性肿大,血小板减少,胃食道静脉、空肠及结肠静脉曲张以及曲张静脉破裂出血等严重并发症[1-4]。因此,本文旨在对于联合肠系膜上/门静脉汇合部胰十二指肠切除术后左侧门静脉高压症的发生、发展,治疗方案及防治策略进行系统性分析。
1 胰腺导管腺癌外科治疗现状
众所周知,胰腺导管腺癌作为常见的消化系统恶性肿瘤,由于恶性程度较高,侵袭性强被称为当今世界的“癌中之王”,据2020年美国研究数据[5-6]统计,胰腺癌在所有恶性肿瘤中发病率位居第9位,死亡率高居第4位,且发病率呈逐年上升趋势,预计其死亡率到2030年上升到第2位。手术、化疗、放疗联合靶向治疗等相结合的综合治疗模式已成为胰腺癌治疗的标准[7]。
自1935年Whipple成功施行PD以来[8],手术切除成为胰腺癌最主要的治疗手段。胰腺头部或钩突部导管腺癌由于解剖毗邻或肿瘤侵犯因素常常导致肠系膜上静脉、脾静脉与门静脉汇合处受侵。根据美国国立综合癌症网络胰腺癌根治术指南[9-10],为达到肿瘤根治的阴性切缘以及淋巴结的en-block,常常需要联合肠系膜上/门静脉汇合部PD。对于胰体尾癌,有研究[11-12]倡导施行根治性顺行性模块化胰脾切除术,可清扫更多的淋巴结,提高R0切除率,改善预后。目前,大量研究和分析都证实了联合肠系膜上/门静脉汇合部PD无论是开放手术或者微创方式,在术中失血、手术时间、医疗花费,以及术后并发症方面并未明显增加,是安全可行的,该类患者术后生存获益[13]。在日本,胰腺癌临床实践指南对于胰腺癌患者常规推荐行腹腔镜下PD。胰腺癌微创手术的指征把握一直是外科治疗的核心问题,微创胰腺体尾部切除由于不存在消化道重建,已在胰体尾癌患者中广泛应用,微创PD由于切除范围广、步骤复杂,涉及消化道切除重建等对主刀提出了更高的要求,手术指征的把握至关重要[14]。国内外目前针对胰腺癌患者微创手术仅仅在一些大的医学院校附属中心或者较大的胰腺专科中心开展,且临床研究数量较少,多数研究中胰腺癌患者占比较低,难以真实反映微创手术在胰腺癌中的作用。因此,微创手术在胰腺癌患者中的疗效仍需前瞻性研究进一步证实。
2 联合肠系膜上/门静脉汇合部PD后左侧门静脉高压症的发生率及发病原因
当前研究报道显示,在联合肠系膜上/门静脉汇合部PD术后左侧门静脉高压症静脉曲张发生率为10.3%~62.8%,这些患者中术后平均20个月左右发生消化道出血的概率将近10%[3,15-16]。Tanaka等[15]的研究结果显示其静脉曲张发生率为10.3%~22.6%,而Rosado等[17]研究中其术后静脉曲张发生率更是低于20%。Turrill等[18]于1969年最先报道左侧门静脉高压,并于1970年描述了左侧门静脉高压的相关病因包含:胰腺肿瘤、胰腺炎、创伤、假性囊肿、感染以及混合因素造成脾静脉回流受阻或栓塞。其后,Sakorafas等[19]将患者包含肝功能正常、门静脉血流通畅,出现脾静脉血栓,脾脏淤血性肿大,甚至上消化道出血的这一系列临床综合征定义为左侧门静脉高压。Fortner等[20]指出在对联合肠系膜上/门静脉汇合部PD后左侧门静脉高压症的定义中除上述症状外,还包含脾静脉结扎或离断以及持续性腹痛现象。有研究[21-22]定义左侧门静脉高压的诊断基于既往手术史、临床表现、实验室检查和影像学评估。术后6到12个月腹部超声、增强CT或内镜检查可见胃底静脉宽大、蜿蜒、多余的充盈缺损静脉直径大于5 mm,食管壁静脉直径大于3 mm,脾脏最大长径超过13 cm,血容量大于700 cm3。
对于PD后左侧门静脉高压的发病机理。首先要清楚脾脏的静脉回流途径,包括体循环回流途径和门静脉回流途径。在体循环途径中,大约10%的联合肠系膜上/门静脉汇合部PD后患者可见脾脏血液回流于左肾静脉,左肾上腺静脉或者腹膜后,食管黏膜下静脉丛开放现象[17]。对于门静脉回流途径,有学者[20,22]引入了两种主要途径即上途径和下途径(图1)。在他们的理念中,上通道主要是脾静脉以及周围静脉丛穿过胃,通过胃左静脉回流入门静脉。也即是经典的左侧门静脉高压回流途径,也被强调为PD联合门静脉-肠系膜上静脉-脾静脉汇合部切除后预防左侧门静脉高压的重要SV引流途径。下通道描述为SV经肠系膜根部(网膜后静脉)、网膜拱廊(Barkow弧线)或结肠静脉至肠系膜上静脉(superior mesenteric vein,SMV)。有研究[20,22]也强调了残留较长的SV对于保留网膜后静脉或胃网膜左静脉的重要性,这些静脉有时会形成侧支静脉。另外一条静脉回流途径也至关重要,即右侧结肠静脉上支,在Strasberg等[23]和Ono等[24]的前期研究中发现,一旦胃左静脉及结肠中静脉在手术中离断,结肠静脉曲张发生率达62.8%。在肠系膜下静脉汇合脾静脉的患者中,单纯结扎脾静脉保留IMV-SV汇合部,术后未发现左侧门静脉高压。
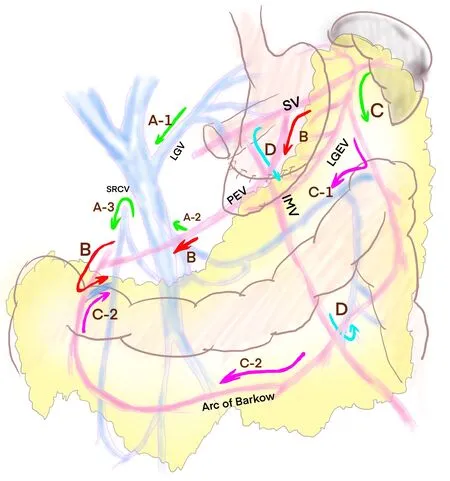
注:C-1,横结肠左侧Barkow弧与结肠边缘静脉的连接;C-2,横结肠右侧Barkow弧与结肠边缘静脉的连接。IMV,肠系膜下静脉;LEGV,胃左静脉; MCV,结肠中静脉;PEV,网膜后静脉;SV,脾静脉;SRCV,右上结肠静脉。绿色箭头表示关键回路:A-1、LGV、A-2、MCV、A-3和SRCV拱廊;红色箭头表示从SV到PEV和结肠边缘静脉的路径;粉色箭头表示从SV到LGEV的路线和巴科弧;蓝色箭头表示从SV到IMV和结肠边缘静脉的路径。图1 联合门静脉-肠系膜上静脉汇合部切除术后脾脏静脉回流各种侧支循环Figure 1 Splenic venous return to various collateral circulation after combined portal veno-superior mesenteric vein confluence resection
因此,大多数学者建议进行胰腺肿瘤根治性手术的同时尽量保留IMV-SV合流。LSPH发生的主要中心环节是脾静脉回流受阻,管腔狭窄或血栓形成,当脾静脉回流受阻,血流淤滞,背压升高,继发性脾脏淤血性肿大,脾功能亢进,侧支循环形成,通过压力相对较低的胃短静脉、胃冠状静脉、胃网膜静脉回流至门静脉,最终导致脾脏肿大和胃底静脉曲张。
3 联合肠系膜上/门静脉汇合部PD后左侧门静脉高压症的危害及预防策略
联合肠系膜上/门静脉汇合部PD后左侧门静脉高压症常见四种消化道静脉曲张区域:结肠静脉曲张、胰空肠吻合区域静脉曲张、食道静脉曲张和胃空肠吻合区域静脉曲张[1]。另外,由于术后回流静脉侧支循环的建立有些患者还可见肾静脉或者结肠左曲静脉曲张。因此,对于联合肠系膜上/门静脉汇合部PD后除导致上述静脉曲张破裂出血,还可造成脾脏淤血性肿大,全血细胞减少,甚至影响患者术后辅助化疗。
尽管联合肠系膜上/门静脉汇合部PD对于胰腺癌侵犯门静脉系统的病例来说是安全可行的,然而对于肠系膜上/门静脉汇合部联合切除后脾静脉的处理仍然存在争议,一些外科医生认为脾静脉结扎后不会产生严重并发症[9,13,25],因此,对于脾静脉的重建是不必要的,相反为了减少术后并发左侧门静脉高压的潜在风险强烈建议行脾静脉重建[26]。为了更好的预防和降低联合肠系膜上/门静脉汇合部PD后左侧门静脉高压症的发生,一方面,术前要评估患者肝功能情况,Child-Pugh A级肝功能是门静脉高压的潜在危险因素,并可促进PD术后左侧门静脉高压的发生。术前外科医生必须仔细阅片,若术前CT发现区域淋巴结有肿大怀疑转移者,在术中进行淋巴结清扫时有可能导致边缘静脉(如:IMV、LGV、胃短静脉)的损伤或切除也会增加PD术后左侧门静脉高压的发生。尽可能在术中保留胃左静脉、结肠中静脉、右结肠静脉上支及其分支,脾静脉肠系膜下静脉自然通道以及大网膜腹膜后侧支循环。然而,由于肿瘤的侵犯以及R0,在手术操作中很难保证完全保留上述重要静脉,即使在术中保留了也不能确定术后上述静脉能保持通畅引流。因此,除了在术中保留上述重要静脉通道以外,下面几项外科技术可能起到预防作用:(1)对于肿瘤对肠系膜上/门静脉汇合部侵犯范围较少者,保留脾静脉正常回流;(2)对于胰头部或胰颈部肿瘤对肠系膜上/门静脉汇合部广泛侵犯患者,且肠系膜下静脉未汇入脾静脉者,在联合切除后脾静脉建议与门静脉重建,也可置入人工血管、同种异体血管或脾静脉左肾静脉重建技术;(3)对于肿瘤仅对PV/SMV侵犯的患者,为了保护脾静脉的回流可施行PV楔形切除术;(4)术中脾静脉切除联合脾动脉结扎,可减少脾脏血供,降低脾静脉压力从而降低术后左侧门静脉高压的发生率(图2)[27-31]。此外,脾静脉-左肾静脉重建具有更高的通畅率可广泛应用于胰腺癌侵犯肠系膜/门静脉回流部的患者。但以上措施均取决于外科医生的解剖专业知识和外科技术操作水平。
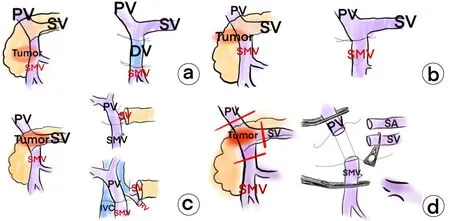
注:IJV,颈内静脉;IVC,下腔静脉;LRV,左肾静脉;PV,门静脉;SMV,肠系膜上静脉;SA,脾动脉。红线表示PV、SMV和SV的切线。a,在肠系膜上静脉汇合门静脉区域MV进行广泛切除,以IJV为移植物;b,对SMV进行楔形切除,并以横向方式直接缝合重建SMV;c, PV、SMV、SV尽量靠近标本切除,SV-PV吻合(上侧)、SV-LRV吻合(下侧);d,PV、SMV、SV尽量靠近标本切除,SV-PV吻合(上侧)并联合脾动脉结扎。图2 PD中SMV或SV重建前后示意图Figure 2 Before and after reconstruction of superior mesenteric vein (SMV) or splenic vein (SV) in pancreaticoduodenectomy (PD)
4 联合肠系膜上/门静脉汇合部PD后左侧门静脉高压症的治疗
临床上对于联合肠系膜上/门静脉汇合部PD后左侧门静脉高压症患者出现消化道静脉曲张未发生出血的现象可密切观察。对于反复出血,甚至消化道大出血患者需要积极的治疗。首先,需要明确消化道出血部位及出血量,积极止血、输血、补液、抗休克治疗的同时,针对多发曲张静脉出血、消化道溃疡出血可考虑介入栓塞治疗;对于食道曲张静脉出血、胃肠吻合口、胰肠吻合口和结肠曲张静脉出血可考虑在内镜下止血夹止血或组织胶注射止血技术[32-33]。在现有资料的报道中,为了预防反复出血的发生,根据患者基础情况强烈建议行脾脏切除术,也可更好地控制肿瘤的复发。脾切除术是治疗左侧门静脉高压引起的胃底静脉出血的传统方法,可减少进入左门静脉系统的动脉流入,实现胃静脉曲张减压,使上消化道出血患者明显获益。对于有症状的左侧门静脉高压患者施行脾切除术可纠正危及生命的出血、减少多次输血相关的风险、预防脾功能亢进以及减少或消除再次出血。对于血流动力学不稳定或晚期恶性肿瘤等全身情况较差、不适合手术治疗的患者,可选择微创手术如脾动脉栓塞术和内镜硬化治疗作为暂时性措施来治疗胃底静脉曲张出血。然而,对无症状患者是否进行预防性脾切除术尚未达成共识[34-36]。临床上常常几种治疗措施联合应用。
5 总结与展望
从目前的研究数据来看,胰腺癌患者进行联合肠系膜上/门静脉汇合部PD后3年内发生左侧门静脉高压症的比率在10.6%~62.8%,这类并发症患者中约10%会发生曲张静脉破裂出血,甚至可导致低血容量性休克危及生命。因此,胰腺外科医生一方面在术前应该养成仔细阅片的良好习惯,充分了解胰腺肿瘤与周围血管的关系以及肠系膜/门静脉汇合区域尤其是肠系膜下静脉及右结肠静脉汇合情况,术前决定是否需要静脉重建;术中还可以通过如下手术技术如:PD联合脾动、静脉结扎或者脾静脉-左肾静脉重建来降低术后左侧门静脉高压的发生,从而减少这类患者消化道大出血等严重并发症的发生。在术后发生消化道出血后,可以通过内镜治疗、放射介入脾动脉栓塞或者脾脏切除来进行抢救治疗。但是在报道的病例资料中,对于胰腺癌患者脾静脉、肠系膜上静脉、门静脉汇合的分型,尤其是许多肠系膜下静脉未直接汇入脾静脉,可直接汇入门静脉、门静脉脾静脉分叉处或肠系膜上静脉者,未进行上述手术方式的讨论和研究。因此,还需要进一步多中心、大样本的前瞻性分层研究来进一步证明这些举措的有效性和可行性,从而使广大患者受益并促进胰腺外科医学技术的进步。
利益冲突声明:本文不存在任何利益冲突。
作者贡献声明:邹洪、文艺、梁鸿寅、吴俊负责课题设计,资料分析,撰写论文;朱桥、周明梅参与收集数据,修改论文;石珂辉负责文章图片的绘制;汤礼军负责拟定写作思路,指导撰写文章并最后定稿。
