重庆养殖中华鳖群体遗传多样性的RAPD分析
2023-07-04赵华一刁晓明李华杨焕超陈彦伶涂全宇刘钊
赵华一 刁晓明 李华 杨焕超 陈彦伶 涂全宇 刘钊


摘要 [目的]利用RAPD标记技术对重庆4个养殖地区中华鳖的遗传多样性进行分析。[方法]选取(潼南、永川、江津、长寿)4个地区养殖中华鳖样本,运用RAPD方法对4个地区的中华鳖遗传多样性与其遗传距离进行了分析。[结果]用20个随机扩增引物得到142个扩增片段,多态片段数量为95个,4个地区的多态位点比例范围为50.78%~64.54%,总多态位点比例为66.90%,总基因多样性为0.227,种群内基因多样性为0.135,遗传分化系数为0.307,基因流为1.127。4个养殖中华鳖群体的遗传距离为0.049~0.151。[结论]重庆4个地区养殖中华鳖遗传多样性较高,且大部分遗传变异存在于种群内,个体间亲缘关系较近,遗传变异度较小。
关键词 中华鳖;遗传多样性;RAPD;重庆地区
中图分类号 S 966.5 文献标识码 A 文章编号 0517-6611(2023)05-0067-03
doi: 10.3969/j.issn.0517-6611.2023.05.017
开放科学(资源服务)标识码(OSID):
RAPD Analysis of Population Genetic Diversity of Pelodiscus sinensis in Chongqing
ZHAO Hua-yi1, DIAO Xiao-ming2, LI Hua1 et al
(1. Fisheries Research Institute, Sichuan Academy of Agricultural Sciences, Chengdu, Sichuan 611730;2. College of Fisheries,Southwest University/Chongqing Three Gorges Ecological Fisheries Industry Technology Research Institute, Beibei, Chongqing 400715)
Abstract [Objective] This article uses RAPD marker technology to analyze the genetic diversity of four Pelodiscus sinensis in Chongqing area. [Method] In this study, we mainly selected farmed Pelodiscus sinensis samples from 4 regions (Tongnan, Yongchuan, Jiangjin, and Changshou). [Result] By using 20 random amplification primers, 142 amplified fragments were obtained, of which the number of polymorphic fragments was 95. The polymorphism ratio in the four regions ranged from 50.78% to 64.54%, and the total polymorphism ratio was 66.90%. The total genetic diversity of the four populations was 0.227, the genetic diversity within the population was 0.135, the genetic differentiation coefficient was 0.307, and the gene flow data was 1.127. The genetic distance of the four farmed Pelodiscus sinensis populations is between 0.049 and 0.151. [Conclusion] The genetic diversity of farmed Pelodiscus sinensis in the 4 regions of Chongqing is high, and most of the genetic variation exists within the population, and the genetic relationship between individuals is relatively close, and the degree of genetic variation is small.
Key words Pelodiscus sinensis;Genetic diversity;RAPD;Chongqing area
中华鳖(Pelodiscus sinensis)俗称团鱼、甲鱼、王八等,隶属于爬行纲龟鳖目鳖科中华鳖属。我国已报道的中华鳖有2种,均属于鳖亚科[1]。中华鳖在我国除宁夏、新疆、青海及西藏未见报道外,其余各省、市、自治区均有分布[2]。中华鳖在我国是一种重要的经济养殖水生生物。
RAPD是于20世纪90年代发展起来的第2代分子标记技术,是一种基于PCR技术的DNA标记技术[3]。20世纪90年代,Williams等[4]运用随机引物扩增技术,即RAPD技术扩增出的多态DNA片段作为分子遗传标记。Welsh等[5]研究也发现,RAPD技术检测具有灵敏方便、多态性强的优点。在水产方面,郭珂等[6]运用RAPD技术对赣州水系的鲤鱼进行遗传多样性分析,得出了赣江水系鲤鱼遗传多样性较高的结论。石洪玥等[7]运用RAPD技术对七里海中华绒螯蟹第6代繁育群体进行了遗传多样性分析,得到了107个不同的多态位点。林基亮等[8]则利用RAPD技术对青岛鳌山卫和红岛的2个四角蛤蜊自然群体进行遗传多样性研究,并在2个群体中共检测出37个多态位点。刘至治等[9]对黄河鳖、淮河鳖、洞庭湖鳖、鄱阳湖鳖及太湖鳖5个群体进行RAPD分析,结果表明,中华鳖的遗传多样性较丰富,其多态位点比例顺序为:太湖鳖>洞庭湖鳖>鄱阳湖鳖>淮河鳖>黄河鳖;黄丽英[10]利用23条随机引物在日本种群、台湾种群、乌鳖种群、太湖种群4个种群中共检测出多样位点110个,其中DNA总多态百分率占67.90%。中華鳖作为我国优质名特优水产品种,在全国范围内都有大量的养殖,但在重庆市中华鳖的养殖上,养殖户追求的是中华鳖的产量与销量及其品质,很少在意其种质及来源,致使重庆地区的中华鳖品种品系较为混乱。且目前关于重庆养殖中华鳖群体的种质研究与遗传研究较少,因此利用分子技术研究重庆养殖中华鳖的遗传多样性对重庆地区中华鳖的养殖与繁育有积极的推进作用。为此,笔者利用RAPD技术从分子水平对重庆地区养殖中华鳖进行遗传多样性分析,旨在为今后如何保护其种质资源及基因库、防止在规模化养殖后造成的基因流失提供理论指导,同时为中华鳖合理开发利用及选择育种提供科学依据。
1 材料与方法
1.1 材料
试验用中华鳖样本采样于重庆4个地区(永川来苏、江津珞璜、潼南塘坝、长寿双龙)的中华鳖养殖场。每个地区各取20只中华鳖样本,取裙边肌肉,置于-70 ℃冰箱保存,后期用来提取DNA。Taq DNA 聚合酶采购于上海生工科技有限公司,PCR随机引物和DNA提取试剂盒采购于上海擎科有限公司,试验仪器主要有PCR仪、电泳仪和WD-9413A凝胶成像分析仪。
1.2 基因组DNA的提取与RAPD扩增
1.2.1
基因组DNA的提取与RAPD扩增反应体系。取14~20 mg中华鳖裙边肌肉组织材料,用上海擎科有限公司Ezup柱式动物基因组DNA试剂盒提取基因组DNA。
RAPD扩增引物的选择主要参考刘至治等[9]与肖亚梅等[11]关于中华鳖RAPD相关研究数据,筛选出20对引物。RAPD反应体系总体积为25 μL:10×PCR Buffer 3.0 μL,Ndtps 1.0 μL,MgCl2 2.5 μL,Taq酶0.2 μL,引物2.0 μL,DNA模板2.0 μL,ddH2O 14.3 μL。扩增程序为:94 ℃预变性3 min,然后94 ℃变性45 s、36 ℃复性(退火)45 s、72 ℃延伸90 s,循环次数为45,最后在72 ℃继续延伸7 min。完成后置于4 ℃环境保存。
1.2.2
RAPD扩增产物的检测。RAPD扩增产物的检测用20对引物对样品进行PCR扩增,将PCR产物在1.5%的琼脂糖凝胶上进行电泳分离,电压为3~4 V/cm,电泳结束后用WD-9413A凝胶成像分析仪进行观察。
1.3 数据的分析与处理
琼脂糖凝胶电泳过后,在凝胶成像仪上进行观察,如有清晰可見的扩增条带,则进行试验记录。对于不同个体扩增出来的RAPD条带,如果在胶板上有同一个位置的迁移都视为显性,可以将其赋值为1;如果此位置无条带的迁移则视为隐性,将其赋值为0。1与0可以构成2元数据矩阵,用计算机统计软件Popgen3.2统计其相应结果。将以上统计可以算出多态位点的比例,多态位点比例(P)=多态位点数/位点数×100%,算出Nei氏遗传相似指数(F)[12]。将其共有的扩增带(NXY)和各自的扩增带(NX与Ny)作比较,则可以得出遗传相似指数。而遗传距离(D)[13]则为D=1-F,同时也可得出基因流NM[14],Nei基因多样性指数[15]与Shannon信息指数I[16]。多态性位点的选择主要参考刘至治的相关方法,引物主要参考黄丽英的随机引物,PCR反应体系则用标准的25 μL总反应体系,PCR程序的选择则在退火温度上设置梯度退火温度,退火温度设置为32~55 ℃,预备试验后优选退火温度36 ℃。
2 结果与分析
2.1 RAPD扩增结果
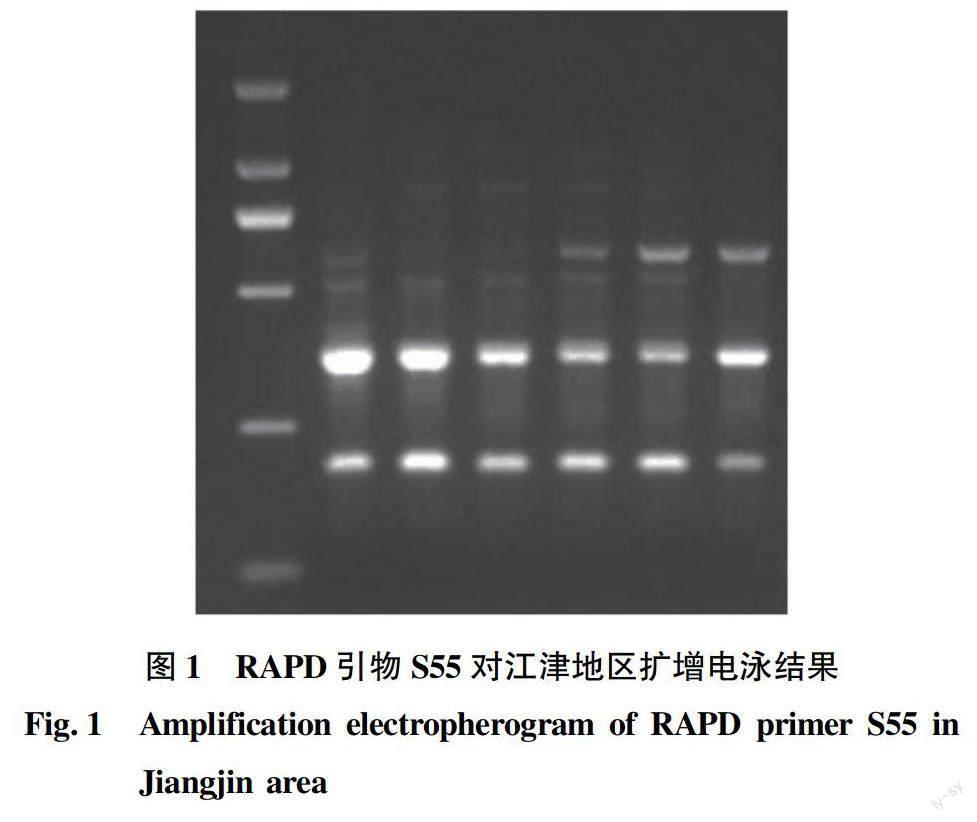
该试验用20对随机引物对80只4个地区养殖中华鳖的基因组DNA进行了PCR扩增,其中S55引物对江津地区养殖中华鳖基因组DNA扩增电泳图如图1所示。每个引物得到的扩增片段在3~12个之间,20个引物总共检测到142个DNA扩增片段,多态片段数量为95个,多态位点比例约为66.90%。
2.2 重庆4个地区养殖中华鳖内部的遗传变异
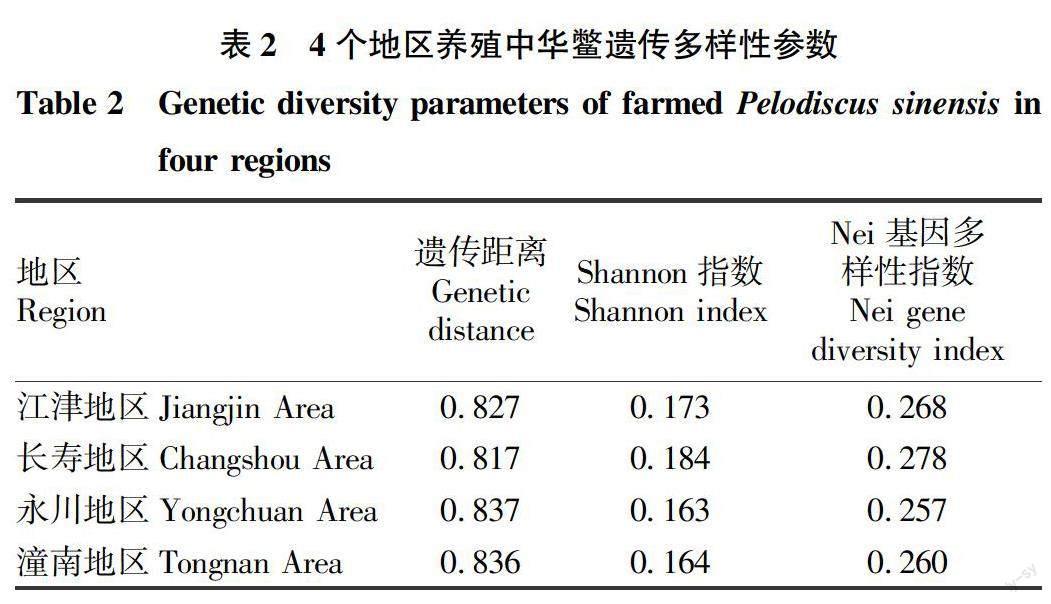
表2表明,4个地区养殖中华鳖的Nei基因多样性指数数值范围为0.260~0.278;Shannon指数数值范围为0.163~0.184。可以看出4个地区养殖中华鳖种群内的遗传多样性并不高。
2.3 重庆4个地区养殖中华鳖不同种群间的遗传变异
4个地区中华鳖的种群遗传多样性参数结果表明,重庆养殖中华鳖总基因多样性(HT)数值为0.227,而各种群内的基因多样性(Hs)数值为 0.135,种群内的基因多样性所占总基因多样性的数值(Hs/HT)为59.31%。根据种群内的基因占总基因多样性的占比可以看出,4个种群的遗传变异主要集中于种群内;根据种群遗传分化系数的数值(Gst)0.307可看出,4个种群在不同种群间也产生了一定的遗传分化,而根据种群遗传分化系数的数值得出的基因流(Nm)为1.127,其数值大于1,说明种群间存在某些量的基因交流。
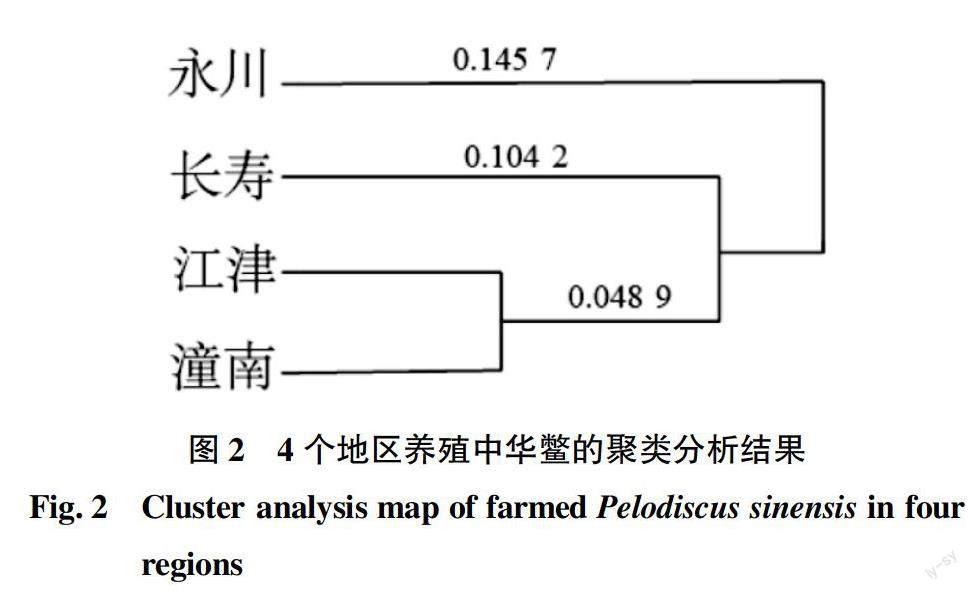
通过聚类分析的树状图可以看出,江津与潼南地区的养殖中华鳖先聚为一支,而长寿与永川的养殖中华鳖则分别单独聚为一支。从表3中可以看出,江津地区和潼南地区养殖中华鳖种群的遗传相似性指数为0.934,遗传距离为0.066,此结论与聚类树状图结果一致。长寿地区养殖中华鳖与江津地区养殖中华鳖遗传相似度指数最低,仅有0.049;从地区上看,江津地区与其他3个地区的养殖中华鳖遗传相似度均高于0.8,而潼南地区与其他3个地区的养殖中华鳖遗传相似度均低于0.2。
3 讨论
3.1 重庆4个地区养殖群体的遗传多样性
遗传多样性[16]与一个物种对生态环境的适应性、在生态环境中的生存能力与其繁殖后代的存活率等都有密切关系,没有遗传多样性,整个生物界将会失去活力与基础。而多态位点的比例就是衡量遗传多样性的一个重要指标。黄丽英[10]对太湖种群、日本种群、乌鳖种群、台湾种群4个养殖品系进行了RAPD遗传多样性分析,得出4个品系的平均多态位点比例为67.90%,略高于该研究得出的平均多态位点比例(66.90%)。就野生水生生物而言,平均多态位点比例为30.06%。王广银等[17]报道的关于野生香鱼的平均多态位点比例为30.71%;符书源等[18]报道的野生鞍带石斑鱼的平均多态位点比例为48.09%;李明云等[19]报道的花鲈多态位点比例范围为24.08%~31.18%。从以上报道可看出,野生种类遗传多样性都较低,且很大程度上低于该研究的养殖中华鳖群体多态性,也低于黄丽英[10]研究中4种养殖品系的平均多态性,可见人工养殖对多态性有一定程度的影响。在遗传距离上,4个地区的遗传距离范围为0.049~0.151,与黄丽英得出的遗传距离相似。Thorpe[20]认为,不同物种间遗传相似度范围应该为0.2~0.8;而同种不同群体间遗传相似度范围应该为0.80~0.97,与该试验得出的遗传距离结论一致。4个地区养殖中华鳖的种群内基因多样性为0.135,占总基因遗传多样性的59.31%,说明4个地区种群间也存在一定的遗传分化。而根据聚类分析来看,永川养殖中华鳖群体聚为单独一支,长寿养殖中华鳖群体聚为单独一支,潼南养殖中华鳖群体和江津养殖中华鳖群体聚为一支。总体而言,养殖中华鳖遗传多样性明显低于野生中华鳖,鱼类也相同。在我国,已经建立了一些中华鳖的良种场对其种质资源进行保护,其中在浙江、湖南和广东都设立了国家级中华鳖良种场,但在重庆地区的中华鳖良种场较少,因此重庆应对中华鳖的种质保护进行重视。同时重庆存在一种俗名为紫砂鳖的当地土鳖,但近年来对其研究接近空白,后期可以对其进行相关研究。
3.2 关于RAPD试验和试验数据的统计
RAPD是20世纪基于PCR分子技术发展而来的一项分子标记技术,其引物不需要单独设计,而是用随机引物进行扩增,因此更加简便高效。但其也存在一定的不稳定性,其反应体系如受到污染则对试验结果会有较大影响,因此离心管、PCR小管、移液枪头等试验器材的灭菌操作非常必要。同时PCR体系的DNA模板浓度与引物浓度也会对试验数据有一定的影响。该试验发现,DNA模板浓度过高则容易造成拖带,而引物浓度过低会出现条带看不清甚至没有条带的现象。而退火温度的选择也是影响试验结果的一个非常重要的因素,因此该试验在退火温度上设置了一个梯度,即进行了梯度RAPD扩增试验,退火温度设置为32~55 ℃,从而寻求该试验的最佳退火温度。在RAPD试验数据的统计上,容易由于试验人员的主观原因影响试验结果,因此需要探寻更好的电泳条带分析方法。也有学者使用其他分子标记方法对中华鳖的遗传多样性进行研究,如王利华等[21]运用SSR标记法对淮河品系中华鳖的遗传多样性进行了分析,今后可考虑运用其他分子标记法对重庆地区的养殖中华鳖进行遗传多样性研究。
参考文献
[1] 张孟闻,宗愉,马积藩,等.中国动物志:爬行纲 第一卷 总论 龟鳖目 鳄形目[M].北京:科学出版社,1998:110.
[2] 王培潮.中国的龟鳖[M].上海:华东师范大学出版社,2000:55-56.
[3] KARP A,EDWARDS K J.Molecular techniques in the analysis of the extent and distribution of genetic diversity[M]//AYAD W G,HODGKIN T,JARADAT A,et al.Molecular genetic techniques for plant genetic resources.Rome:IPGRT,1997.
[4] WILLIAMS J G K,KUBELIK A R,LIVAK K J,et al.DNA polymorphisms amplified by arbitrary primers are useful as genetic markers[J].Nucleic Acids Res,1990,18(22):6531-6535.
[5] WELSH J,PETERSEN C,MCCLELLAND M.Polymorphisms generated by arbitrarily primed PCR in the mouse:Application to strain identification and genetic mapping[J].Nucleic Acids Res,1991,19(2):303-306.
[6] 郭珂,朱學春,赵丽丽,等.RAPD分析江西贡江水系鲤鱼种群遗传多样性[J].南昌大学学报(理科版),2007,31(3):294-297.
[7] 石洪玥,刘阳,王晓梅,等.七里海中华绒螯蟹遗传多样性的RAPD和ISSR分析[J].水产科学,2016,35(3):255-260.
[8] 林基亮,王春德,吕倩,等.青岛地区四角蛤蜊(Mactra veneriformis)2个自然群体遗传多样性RAPD分析[J].青岛农业大学学报(自然科学版),2020,37(4):289-293,303.
[9] 刘至治,蔡完其,李思发.中华鳖五群体遗传变异的RAPD分析[J].水产学报,2004,28(2):119-126,303.
[10] 黄丽英.中华鳖4个不同种群的遗传结构和分子遗传标记研究[D].重庆:西南大学,2006.
[11] 肖亚梅,陈丽莉,陈合格,等.中华鳖种群RAPD分析[J].湖南师范大学自然科学学报,2005,28(3):72-75.
[12] NEI M,LI W H.Mathematical model for studying genetic variation in terms of restriction endonucleases [J].Proc Natl Acad Sci USA,1979,76(10):5269-5273.
[13] NEI M.Genetic distance between populations[J].Am Nat,1972,106(949):283-292.
[14] MCDERMOTT J M,MCDONALD B A.Gene flow in plant pathosystems[J].Annu Rev Phytopathol,1993,31:353-373.
[15] LEWONTIN R C.The apportionment of human diversity[M]//DOBZHANSKY T,HECHT M K,STEERE W C.Evolutionary biology:Volume 6.New York:Springer US,1972:381-398.
[16] 庞广昌,姜冬梅.群体遗传多样性和数据分析[J].林业科学,1995,31(6):543-550.
[17] 王广银,丁文勇,陈少波,等.浙闽香鱼4个群体遗传多样性的RAPD分析[J].科技通报,2011,27(6):863-868.
[18] 符书源,尹绍武,陈国华,等.海南近海野生鞍带石斑鱼群体遗传多样性的RAPD分析[J].海洋通报,2008,27(3):25-31.
[19] 李明云,赵明忠,钟爱华,等.山东日照和福建厦门沿海花鲈(Lateolabrax japonicus)遗传多样性的RAPD研究[J].海洋与湖沼,2003,34(6):618-624.
[20] THORPE J P.The molecular clock hypothesis:Biochemical evolution,genetic differentiation and systematics[J].Annu Rev Ecol Syst,1982,13:139-168.
[21] 王利华,张英萍,邹桂伟,等.基于微卫星标记的中华鳖淮河品系遗传多样性分析[J].中国农学通报,2020,36(23):134-141.
