几种药食两用类物质对酒精性胃黏膜损伤的保护及其抑制幽门螺旋杆菌作用
2023-07-04王雨阳杨焱吴迪李文陈万超张忠
王雨阳 杨焱 吴迪 李文 陈万超 张忠



摘要:通過体外抑制幽门螺旋杆菌和抗炎试验,考察了猴头菌、茯苓、甘草、黄芪、葛根、蒲公英、陈皮几种药食两用类物质的提取物对幽门螺旋杆菌的抑制作用以及缓解炎症的效果,结果表明:黄芪提取物、甘草提取物具有良好的体外抑制幽门螺旋杆菌的作用;葛根提取物、甘草提取物具有较好的缓解炎症的效果。通过构建人胃黏膜上皮细胞GES-1损伤模型,明确了猴头菌和茯苓的提取物对酒精损伤的人胃黏膜上皮细胞GES-1增殖具有促进作用。根据试验结果,筛选出猴头菌、茯苓、黄芪和甘草4种药食两用物质的提取物,将其按照一定比例混合,制成3种组方,考察其对大鼠急性酒精性胃黏膜损伤的保护作用,结果表明:3种组方对胃黏膜损伤均具有一定的保护作用,组方2(猴头菌43.0%、茯苓35.5%、黄芪15.9%、甘草5.6%)在0.375 g/kg时对大鼠急性酒精性胃黏膜损伤具有更好的保护作用。
关键词:药食两用;胃黏膜损伤;幽门螺旋杆菌;抑菌;抗炎
中图分类号R285文献标识码A
文章编号0517-6611(2023)06-0157-06
doi:10.3969/j.issn.0517-6611.2023.06.038
Protective Effects of Several Dualpurpose Substances on Alcoholic Gastric Mucosal Injury and Inhibition of Helicobacter pylori
WANG Yuyang1,2,YANG Yan1,WU Di1 et al
(1.Key Laboratory of Edible Fungi Resources and Utilization (South)/Ministry of Agriculture,National Engineering Research Center of Edible Fungi/Institute of Edible Fungi,Shanghai Academy of Agricultural Sciences,Shanghai 201403;2.College of Food Sciences & Technology,Shanghai Ocean University,Shanghai 201306)
AbstractIn vitro inhibition of Helicobacter pylori and antiinflammatory experiments were conducted to investigate the inhibitory effects and relief of Hericium erinaceus,Wolfiporia cocos,Glycyrrhiza uralensic,Astragalus membrahaceus,Pueraria lobata,Taraxacum mongolicum,tangerine peel and other medicinal and edible substances on Helicobacter pylori.The results show that Astragalus membranceus extract and Glycyrrhiza uralensic extract had a good effect of inhibiting Helicobacter pylori in vitro;Pueraria lobata extract and Glycyrhiza uralensis extract have a good effect of relieving inflammation.By constructing a GES1 injury model of human gastric mucosal epithelial cells,it is clear that the extracts of Hericium erinaceus and wolfiporia cocos can promote the proliferation of human gastric mucosal epithelial cells GES1 damaged by ethanol.According to the experimental results,four medicinal and edible extracts of Hericium erinaceus,Wolfiporia cocos,Astragalus membranaceus and Glycyrrhiza uralensic were screened out,and they were mixed according to a certain ratio to make 3 kinds of prescriptions to investigate their effects on the acute alcoholic gastric mucosa of rats.Tthe results show that the three prescriptions have a certain protective effect on gastric mucosal injury,and the prescription 2 (Hericium erinaceus 3.0%,Wolfiporia cocos 35.5%,Astragalus membranaceus 15.9%,Glycyrrhiza uralensic 5.6%) is 0.375 g/kg It has a better protective effect on acute alcoholic gastric mucosal injury in rats.
Key wordsMedicine and food;Gastric mucosal injury;Helicobacter pylori;Antibacterial;Antiinflammatory
近年来,随着人们生活节奏的加快,过度饮酒、刺激性食物等外源性损伤因素引起的胃损伤逐渐增多,特别是饮酒引起的急性胃黏膜损伤病变临床日益常见[1]。人们饮酒后,高浓度酒精在胃内滞留,侵蚀胃黏膜组织,使胃黏膜屏障受损,直接引起胃黏膜急性炎症,黏膜出现充血、水肿、出血、糜烂及溃疡形成等症状[2]。随着饮酒人数的增加,酒精性胃黏膜损伤相关疾病的发病率呈逐年上升趋势[3]。幽门螺旋杆菌(Helicobacter pylori) 是一种革兰氏阴性微需氧杆菌,也是胃黏膜损伤、慢性胃炎和胃十二指肠溃疡发生的主要因素之一[4]。现有临床治疗胃黏膜损伤的药物还存在一些弊端,如副作用大、易复发和需长期使用等[5]。因此,从营养预防的角度出发,寻找安全、有效、能保护胃黏膜免受损伤的有效产品,具有重要的实际应用价值。
在胃黏膜保护方面,已有研究表明,猴头菌、茯苓、黄芪和陈皮等药食两用类物质对胃黏膜损伤具有一定的保护作用[6-11]。杨行堂等[12-14]研究发现,甘草、葛根和蒲公英具有预防幽门螺旋杆菌感染及降低胃癌发病危险性的作用。Raish等[15]研究发现,苦瓜多糖可以通过抗炎作用机制对胃黏膜损伤起保护作用,这一机制与炎性细胞因子介导的抗氧化能力有关。关于利用猴头菌和茯苓、黄芪、甘草等组方进行胃黏膜损伤方面的研究鲜见报道,因此,笔者通过体外抗炎,抗幽门螺旋杆菌和酒精损伤的人胃黏膜上皮细胞GES-1增殖模型,探讨猴头菌等几种药食两用类物质潜在的胃黏膜损伤修复活性,筛选出几种药食两用类物质制成组方,建立无水乙醇诱导的大鼠胃黏膜损伤模型,探讨组方对大鼠胃黏膜损伤的保护作用,为胃黏膜损伤类疾病的防治提供理论和试验依据,也为猴头菌、茯苓等药食两用类物质应用于胃黏膜保护类功能食品的开发利用提供科学依据。
1材料与方法
1.1试剂与仪器
细菌脂多糖(Lipopolysaccharides,LPS)、Alamar Blue 美国Sigma公司;DMEM 培养基、RPMI1640培养基、胎牛血清,美国Gibco公司;青霉素、链霉素,美国Amersco公司;葡萄糖、氯化钠、磷酸等,国药集团药业股份有限公司; 脑心浸液粉、哥伦比亚琼脂,上海信裕生物科技有限公司;脱纤维羊血,上海源叶生物科技有限公司。AL104 电子天平,梅特勒-托利多仪器(上海)有限公司;水套式三气培养箱,美国Thermo Fisher Scientific 公司;JJ-CJ-2FD 金净洁净操作台,吴江市净化设备总厂;Synergy HT96 孔板酶标仪,美国Bio-Tek公司。
1.2供试细胞与菌株
RAW264.7细胞株(小鼠巨噬细胞株)购自中国科学院上海生命科学研究院细胞资源中心。用含体积分数10%胎牛血清、100 U/mL青霉素及100 U/mL链霉素的DMEM培养基,在37 ℃ 5% CO2条件下培养,取对数生长期细胞,用无色RPMI1640培养基将细胞稀释到5×105个/mL。
幽门螺旋杆菌标准菌株Helicobacter pylori。ATCC43504和临床标准菌株Helicobacter pylori SS1 购自广东省微生物菌种保藏中心。幽门螺旋杆菌培养基:脑心浸液粉9.6 g、哥伦比亚琼脂23.4 g、蒸馏水780 mL,121 ℃高压灭菌20 min后降至46 ℃后加入33~40 mL去纤维羊血。脑心浸液肉汤:蛋白胨10.0 g、脑心浸液粉17.5 g、氯化钠5.0 g、葡萄糖2.0 g、磷酸氢二钠2.5 g、蒸馏水1 000 mL,121 ℃高压灭菌20 min,备用。
1.3样品制备
称取猴头菌、茯苓、黄芪、蒲公英、陈皮、甘草、葛根,分别按照重量比加10倍的蒸馏水浸泡0.5 h后,用文火煎煮1.0 h,倒出药液,药渣再加等量蒸馏水煎煮1.0 h,2次药液合并,8 000 r/min离心15 min,倒出上清液,蒸发浓缩后冻干。将冻干后的各类药液破碎成粉即为提取物。
精确称取猴头菌、茯苓、黄芪、蒲公英、陈皮、甘草、葛根提取物各50 mg溶于5 mL蒸馏水中,沸水浴30 min,冷却至室温,13 000 r/min离心15 min,过0.22 μm滤膜备用。
1.4不同提取物抑制幽门螺旋杆菌的活性试验
1.4.1幽门螺旋杆菌菌悬液制备。
将保存的菌株活化后转接到培养基上,37 ℃、10% CO2,5% O2孵育72 h。用腦心浸液肉汤洗下菌落,收集菌液。以脑心浸液肉汤校正菌悬液浓度,测量抑菌圈所用菌悬液浓度约2×108 CFU/mL,测定最小抑制浓度用1×108 CFU/mL菌悬液。
1.4.2抑菌圈的测定。
采用牛津杯法对抑菌圈进行测定。取直径9 cm,培养基厚度约4 mm的羊血培养基的平板,每块平板加入约100 μL 幽门螺旋杆菌ATCC43504/SS1的菌悬液,立即用涂布棒涂布均匀。然后,每个培养皿放置4个牛津杯,呈均匀分布。往每个杯中加入100 μL不同的样品溶液。37 ℃,10% CO2,5% O2培养5 d,观察抑菌圈,测量其直径,每个样品重复3次。
1.4.3最小抑菌浓度的测定方法。
采用96孔板法测定最小抑菌浓度。配置样品浓度梯度为10.000 000、5.000 000、2.500 000、1.250 000、0.625 000、0.312 500、0.156 250和0.078 125 mg/mL。依次加入96孔板中,每个样品3组平行。趁热加入羊血培养基,混合均匀。待培养基凝固后,每个孔中加入10 μL ATCC43504或者SS1的菌悬液。37 ℃,10% CO2,5% O2培养5 d。观察细菌状态,确定最小抑菌浓度[16]。
1.5不同提取物对LPS刺激巨噬细胞RAW264.7释放NO的影响
1.5.1
Griess试剂的配制。在烧杯中加入6.25 mL H3PO4,加入蒸馏水250 mL,分别加入2.50 g sulfanilamide和0.25 g naphthylethyylenedia mine dihydrochloride,用磁力搅拌器搅拌至全部溶解,4 ℃避光保存。
1.5.2样品的配制。将样品分别用PBS配制成5.0、2.0、0.5 mg/mL 待测样品。
1.5.3标准曲线的绘制。配成不同浓度的亚硝酸钠溶液,浓度梯度为0、5、10、15、20、25、30、35、40 μmol/L共9个,取100 μL 于96孔板,加入50 μL Griess试剂,反应10 min,测定543 nm吸光值,每个浓度3个平行,根据吸光值绘制标准曲线。
1.5.4对LPS刺激巨噬细胞RAW264.7释放NO的影响。计算细胞个数,将RAW264.7用无色1640培养液稀释成5×105个/mL 的细胞悬液,每组160 μL于96孔板中,37 ℃培养4~6 h至细胞完全贴壁后,样品组加入20 μL LPS(作用浓度10 μg/mL)和20 μL待测液(作用浓度50、200、500 μg/mL)。LPS组每孔加入20 μL LPS和20 μL PBS,PBS组每孔加入40 μL PBS,37 ℃培养48 h后吸取上清液100 μL加入50 μL Griess试剂,反应10 min,酶标仪测定吸光值,根据标准曲线计算NO释放量[17-19]。
1.6不同提取物对胃黏膜上皮细胞GES-1的损伤修复研究
1.6.1细胞毒性试验。
将人胃黏膜上皮细胞GES-1用无色1640培养液稀释成1×105个/mL的细胞悬液,每组160 μL于96孔板中,37 ℃培养细胞12 h,分别加入上述配制的不同浓度待测样品液20 μL,37 ℃培养24 h后,每孔加入20 μL Alamar Blue试剂继续培养,以Alamar Blue法测定所选作用浓度范围内不同样品对GES-1细胞活力的影响,每个样品设置3个重复。
1.6.2乙醇处理及细胞损伤模型的构建。
将处于对数生长期的GES-1细胞以1×105个/mL的密度培养12 h。加入不同浓度的样品(作用浓度分别为50、200、500 μg/mL)预保护24 h,然后去除培养液,使用5%乙醇损伤GES-1细胞6 h。对照组细胞用相同的培养液处理,但不加乙醇。每孔加入20 μL Alamar Blue试剂继续培养,以Alamar Blue法测定所选作用浓度范围内不同样品对GES-1细胞活力的影响,每个样品设置3个重复。将样品组与对照组和模型组进行比较。所有结果均以GES-1细胞增殖抑制率表示。
1.7不同提取物组方对乙醇损伤的大鼠胃溃疡的抑制作用研究
1.7.1动物模型建立及试验分组。
根据以上试验结果,将猴头菌提取物、茯苓提取物、黄芪提取物和甘草提取物按照药典和相关保健产品的要求,以一定比例均匀混合制成3种组方(表1)。
通过急性乙醇诱导胃黏膜损伤模型评价其预保护作用。将SD大鼠随机分为11组(n=10)。胃溃疡模型(模型组)和正常对照组(对照组)给予生理盐水(0.9%),其余组分别给予组方1、组方2和组方3,各组方分为低剂量(0.188 g/kg)、中剂量(0.375 g/kg)和高剂量(0.75 g/kg),分别对应于L组、M组和H组。生理盐水和样品均通过灌胃给药,每天2 mL,持续14 d。用不同浓度的组方1、组方2和组方3灌胃预保护14 d后,除对照组大鼠外,其余大鼠在最后一次给药前禁食并自由饮用自来水24 h,然后每只大鼠给予1.0 mL无水乙醇诱导胃溃疡。1 h后,将大鼠颈椎脱臼处死,取出胃。每组大鼠的胃随机分为2个亚组。一个亚组中的样品立即用5 mL 10%磷酸盐缓冲福尔马林(pH 7.0)填充,并浸没在相同的溶液中30 min,用于组织学研究[20-23]。
1.7.2胃溃疡评价。大鼠胃沿大弯切开,用生理盐水清洗,仔细观察胃黏膜层溃疡的发生情况。同时记录出血斑数,用游标卡尺测量溃疡条纹的长度和宽度。溃疡程度宏观评价得分按中国食品药品监督管理局标准(CFDA出版物第107号,2012年修订)计算:
潰疡抑制率=(损伤组溃疡面积-给药组溃疡面积)/损伤组溃疡面积×100%
2结果与分析
2.1不同提取物抑制幽门螺旋杆菌的活性差异
2.1.1抑菌圈的测定。
以幽门螺旋杆菌ATCC43504和SS1为试验菌株,测定各提取物溶液抑菌圈直径大小,结果见表2。由表2可知,黄芪提取物、甘草提取物的抑菌圈直径均大于10.00 mm,对幽门螺旋杆菌ATCC43504和SS1抑菌作用强,说明黄芪提取物和甘草提取物具有较强的抗幽门螺旋杆菌活性。对ATCC43504而言,蒲公英提取物、陈皮提取物、葛根提取物抑菌圈均为9.00 mm,抗菌活性弱;对SS1而言,陈皮提取物、葛根提取物的抑菌圈大于10.00 mm,表现出一定的抗菌活性。
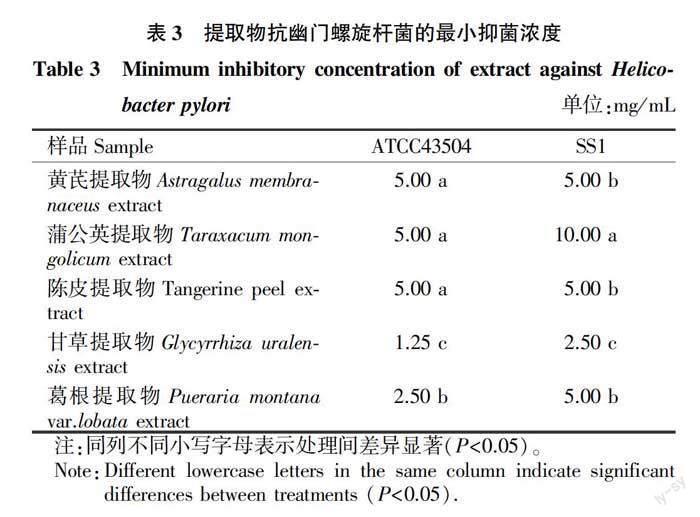
2.1.2最小抑制浓度的测定。
由表3可知,甘草提取物对幽门螺旋杆菌的抑制浓度最小,为1.25~2.50 mg/mL,抑菌作用强;葛根提取物对幽门螺旋杆菌的抑制浓度较小,为2.50~5.00 mg/mL,抑菌作用较强。黄芪提取物、蒲公英提取物、陈皮提取物对ATCC43504和SS1最小抑制浓度均大于5.00 mg/mL,抑菌活性弱。
2.2不同提取物的体外抗炎活性分析
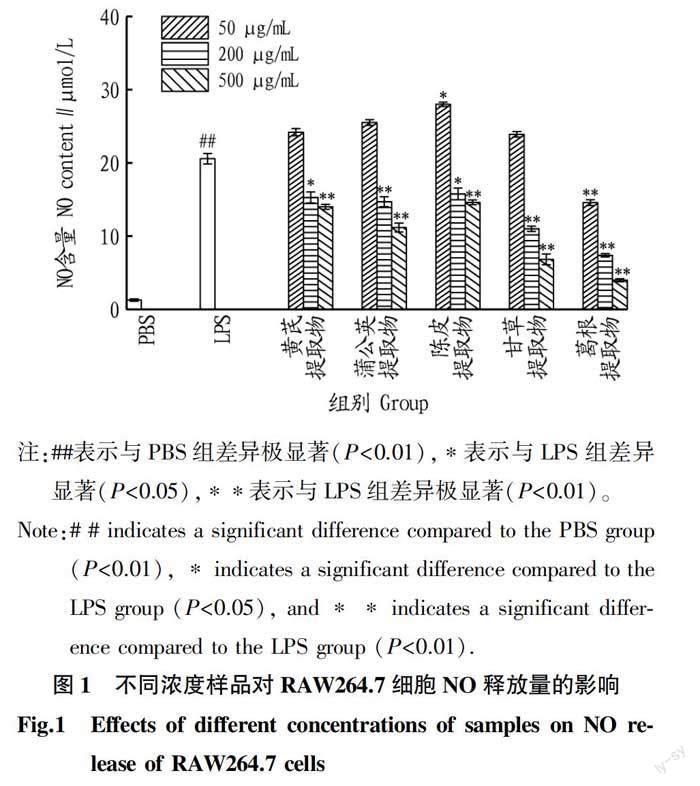
通过典型的Greiss法检测不同浓度提取物对LPS诱导的巨噬细胞炎症反应模型中降低NO释放量的效果,结果如图1所示。从图1可见,RAW264.7细胞经过LPS刺激后,NO含量相对于对照组(PBS)明显升高。黄芪提取物、蒲公英提取物、陈皮提取物、甘草提取物在低浓度时抗炎效果不明显,浓度达到500 μg/mL 时甘草提取物、葛根提取物表现出较强的抗炎活性,其中葛根提取物缓解炎症的效果最好。
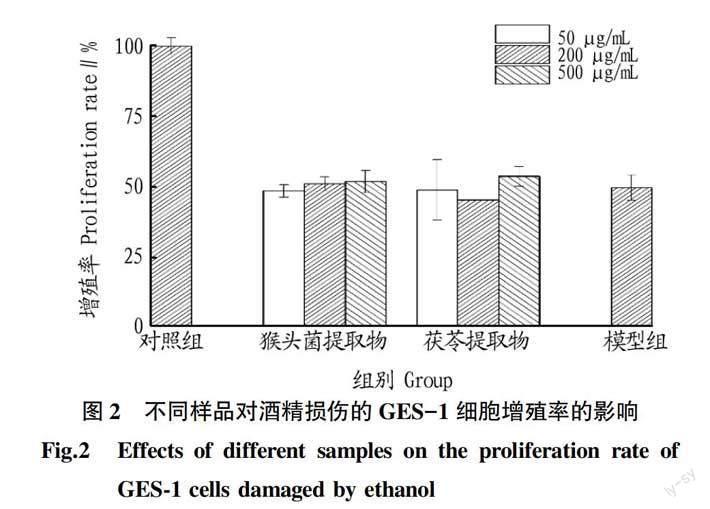
2.3不同提取物对胃黏膜上皮细胞的损伤修复分析分别考察了不同样品的作用浓度(50、200、500 μg/mL)对GES-1细胞活力的影响,结果如图2所示。从图2可见,在设置浓度范围内,细胞的增
殖率均在50%附近,表现出明显的促进细胞生长的作用。猴头菌提取物对细胞增殖的促进作用具有浓度依赖性,随浓度的增大效果越好;茯苓提取物在200 μg/mL时的增殖率低于50和500 μg/mL,其中500 μg/mL时增殖率最高。
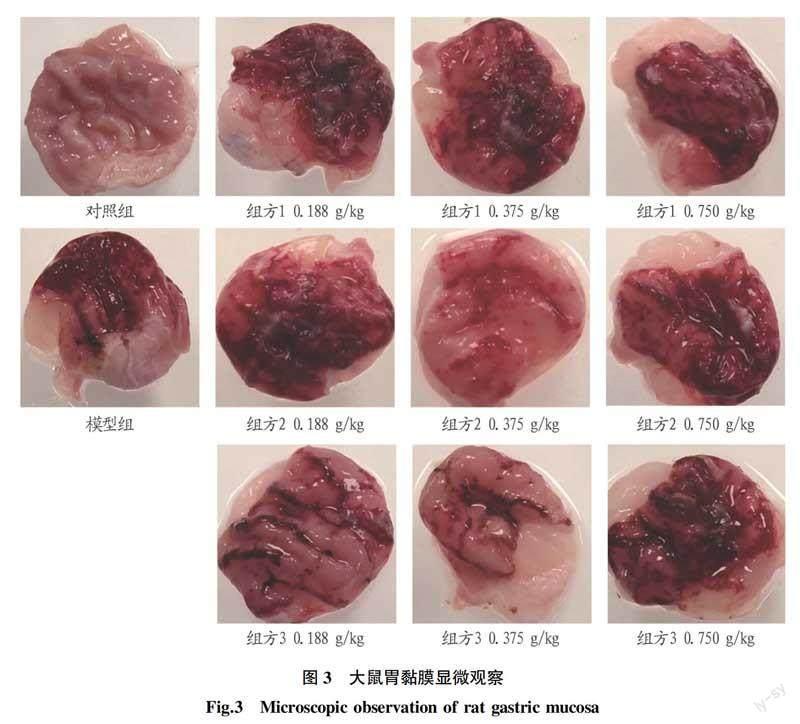
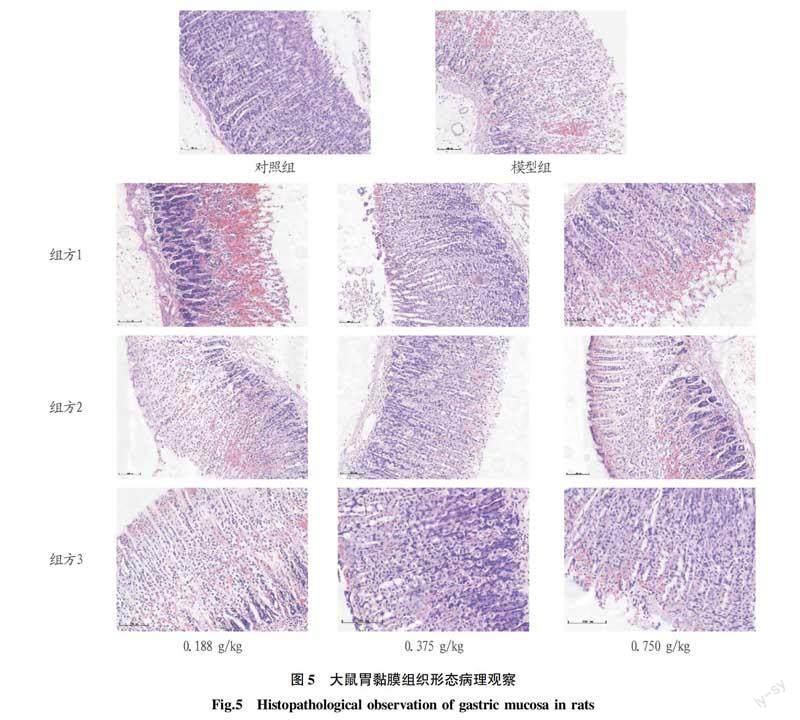
2.4不同提取物对酒精损伤大鼠胃溃疡的抑制作用为观察各组方的胃保护作用,对胃黏膜病变进行了显微观察。如图3所示,对照组未见病变条带,模型组大鼠胃黏膜有明显的充血或坏死。与模型组相比,各组方处理组胃黏膜损伤明显减轻。
溃疡抑制率如图4所示,结果表明,组方1在低浓度和高浓度时对胃黏膜上皮细胞的保护作用不明显。组方2和组方3在低浓度和高浓度时也具有较好的保护作用,各组方均在中浓度时(0.375 g/kg)时抑制效果最好,均能明显保护胃黏膜上皮细胞,抑制胃溃疡的形成,其中,组方2对大鼠胃溃疡抑制率最为明显。
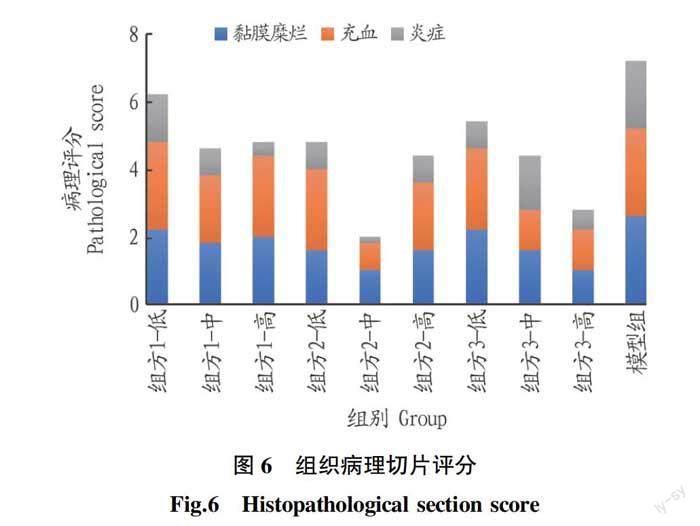
为检测胃组织的病理状态,采用HE染色和组织学评分法观察胃组织的组织学变化。胃黏膜组织HE染色结果显示(图5),对照组胃黏膜组织结构完整,无上皮细胞脱落坏死,未见明显炎性细胞浸润。模型组胃黏膜组织腺体结构紊乱,上皮细胞脱落严重,可见多处坏死灶,
伴有广泛的血细胞浸润,且炎症细胞浸润明显。组方1~3预处理后,上述症状均有不同程度的缓解。病理切片结果表明,组方1~3具有保护胃黏
膜上皮免受酒精损伤和预防溃疡的作用。值得注意的是组方2中0.375 g/kg组胃黏膜基本光滑,未见明显的腺结构紊乱,黏膜充血、炎症细胞浸润。组织病理评分结果如图 6所示,组方3对胃黏膜具有显著的剂量依赖性保护作用,高浓度时,病理评分较低,说明组方3可能通过降低炎症反应起到胃黏膜保护作用。
3讨论
胃黏膜类疾病,包括消化性溃疡、急慢性胃炎等,是临床常见及多发疾病。随着现代社会生活节奏的加快,该病的发与工作压力过大、创伤、幽门螺旋杆菌感染、大量饮酒、胃酸分泌过多等多种因素引起的胃黏膜防御与攻击因素平衡的破坏密切相关[24-25]。急性胃黏膜损伤病变的机制比较复杂,包括乙醇、细菌等侵袭因素对胃黏膜的直接损伤、促进炎症介质的释放、诱导细胞凋亡等,目前认为炎症是胃黏膜抵御内源性和外源性损伤因子的重要病理过程,炎症损害可以导致胃黏膜的损伤和修复过程的受损[26-28]。
该研究首先通过幽门螺旋杆菌抑菌试验考察了几种药食两用类物质的提取物对幽门螺旋杆菌的抑制作用,结果表明,黄芪、甘草提取物具有良好的抑菌作用,如果作为胃黏膜损伤修复类产品,能抑制细菌的生长,防止细胞滋生,从而在胃黏膜恢复的过程中减少细菌损害;通过体外抗炎试验,发现葛根、甘草提取物具有较好的缓解炎症的效果。通过构建乙醇处理的胃黏膜上皮细胞GES-1的损伤修复模型,明确了猴头菌、茯苓提取物对损伤的胃上皮细胞增殖具有促进作用[29-30]。篩选出猴头菌、茯苓、黄芪和甘草提取物按照一定比例混合,制成3种组方,利用体内动物试验考察其对急性胃黏膜损伤的修复作用,结果表明组方2(猴头菇43.0%、茯苓35.5%、黄芪15.9%、甘草5.6%)在0.375 g/kg时对胃急性胃黏膜损伤的修复效果最好。
综上所述,笔者利用体外抗幽门螺旋杆菌和抗炎活性试验及体外胃黏膜上皮细胞GES-1的损伤修复试验,以及大鼠体内胃黏膜损伤试验评估了不同药食两用类物质提取物组成的组方的胃黏膜损伤保护作用,该研究结果可为开发具有胃黏膜损伤保护作用的功能食品、保健食品及药品提供科学的理论依据和参考价值。
参考文献
[1]阮研硕,赵江燕,李艳梅,等.岩藻多糖对急性酒精性胃黏膜损伤的保护作用[J].中国食品学报,2015,15(1):19-24.
[2]孙晓艳,常冰,王炳元,等.急性酒精性胃黏膜损伤大鼠胃黏膜组织中TNFα和血浆PGE2、血清NO的改变[J].现代医药卫生,2007,23(8):1108-1110.
[3]SIDAHMED H M A,HASHIM N M,ABDULLA M A,et al.Antisecretory,gastroprotective,antioxidant and antiHelicobcter pylori activity of Zerumbone from Zingiber zerumbet (L.) Smith[J].PLoS One,2015,10(3):1-21.
[4]SILVA O,VIEGAS S,DE MELLOSAMPAYO C,et al.AntiHelicobacter pylori activity of Terminalia macroptera root[J].Fitoterapia,2012,83(5):872-876.
[5]刘睿,珠娜,郝云涛,等.核桃低聚肽对大鼠胃黏膜损伤的保护作用[J].食品科学,2021,42(7):191-197.
[6]周春晖,廖兵武,段迪,等.三种猴头菇口服液对大鼠胃黏膜损伤的保护作用研究[J].食品工业科技,2020,41(14):270-275.
[7]冯小东.赤土茯苓苷对运动后小鼠应激性胃溃疡的保护作用[J].动物医学进展,2018,39(3):70-74.
[8]蔡甜甜,潘华峰,张成哲,等.黄芪甲苷保护胃癌前病变大鼠胃黏膜损伤研究[J].中华中医药杂志,2018,33(9):4066-4070.
[9]虎喜成,田文荣,刘敬霞,等.加味陈皮膏治疗慢性萎缩性胃炎临床观察[J].中国中西医结合消化杂志,2014,22(9):517-520.
[10]QIN S M,HUANG K E,FANG Z G,et al.The effect of Astragaloside IV on ethanolinduced gastric mucosal injury in rats: Involvement of inflammation[J].International immunopharmacology,2017,52:211-217.
[11]潘世杰,丁丽婷,胡婕伦,等.茯苓多糖对乙醇致小鼠急性胃黏膜损伤的辅助保护作用[J].食品研究与开发,2021,42(17):1-6.
[12]杨行堂,林永辉,张俊杰,等.甘草活性成分抗幽门螺杆菌实验研究[J].同济大学学报(医学版),2013,34(6):26-30.
[13]刘海昀.幽门螺旋菌患者应用葛根芩连汤治疗的临床观察[J].健康导报(医学版),2014,19(9):250.
[14]赵家彪,廖军.蒲公英联合奥美拉唑治疗幽门螺杆菌阳性糜烂性胃炎66例疗效观察[J].中华现代内科学杂志,2007(7):634-635.
[15]RAISH M,AHMAD A,ANSARI M A,et al.Momordica charantia polysaccharides ameliorate oxidative stress,inflammation,and apoptosis in ethanolinduced gastritis in mucosa through NFkB signaling pathway inhibition[J].International journal of biological macromolecules,2018,111:193-199.
[16]谢勇,谢正兴,周南进,等.壳聚糖及其衍生物体外抗幽门螺杆菌作用及影响因素[J].中国药理学通报,2005,21(11):1343-1347.
[17]杨阳,张绪阳,常利华,等.5种鸢尾属药用植物甲醇提取物体外抗炎活性研究[J].中南药学,2019,17(2):199-203.
[18]丁丽婷,潘世杰,胡婕伦,等.燕麦多糖对小鼠急性胃黏膜损伤的保护作用[J].食品科学,2022,43(9):150-157.
[19]张晓凤,薛延团,张育浩,等.沙棘甾醇对酒精性胃黏膜损伤的保护作用[J].华西药学杂志,2020,35(1):37-42.
[20]CHEN W C,WU D,JIN Y L,et al.Preprotective effect of polysaccharides purified from Hericium erinaceus against ethanolinduced gastric mucosal injury in rats[J].International journal of biological macromolecules,2020,159:948-956.
[21]WANG X Y,YIN J Y,ZHAO M M,et al.Gastroprotective activity of polysaccharide from Hericium erinaceus against ethanolinduced gastric mucosal lesion and pylorus ligationinduced gastric ulcer,and its antioxidant activities[J].Carbohydrate plymers,2018,186:100-109.
[22]ZENG Q,KO C H,SIU W S,et al.Polysaccharides of Dendrobium officinale Kimura & Migo protect gastric mucosal cell against oxidative damageinduced apoptosis in vitro and in vivo[J].Journal of ethnopharmacology,2017,208:214-224.
[23]LIAO B W,HUANG H H.Structural characterization of a novel polysaccharide from Hericium erinaceus and its protective effects against H2O2induced injury in human gastric epithelium cells[J].Journal of functional foods,2019,56:265-275.
[24]徐仙赟,李洪亮,孙立波,等.2味中药复方对大鼠胃黏膜损伤保护作用及血液指标的影响[J].安徽农业科学,2012,40(5):2636-2637,2719.
[25]沈玖君,邓利玲,帅天罡,等.魔芋粉对小鼠急性酒精性胃黏膜损伤和慢性酒精性肠损伤的影响[J].食品科学,2018,39(9):163-169.
[26]张书,时昭红.微米大黄炭对乙醇诱导大鼠急性胃黏膜损伤的保护作用及炎症因子的影响[J].中国医院药学杂志,2017,37(10):926-928.
[27]王浩.除幽汤联合四联疗法对HP相关性胃溃疡患者胃黏膜愈合及炎症反应的影响[J].临床研究,2021,29(3):127-129.
[28]袁奕清,胡小军.芍药甘草汤加减对急性胃溃疡患者血清炎症因子、胃黏膜表皮生长因子及受体表达的影响[J].世界中西医结合杂志,2021,16(1):92-95,99.
[29]潘猛,徐德昌,孙永敢,等.药食同源食品对大鼠酒精性胃黏膜损伤的影响[J].中国食品学报,2021,21(7):115-122.
[30]李丽华,章圣朋,秦加旭,等.香椿子提取物对实验性小鼠胃黏膜损伤保护作用[J].中国临床药理学与治疗学,2021,26(5):546-551.
作者简介王雨陽(1998—),男,江苏连云港人,硕士研究生,研究方向:食药用菌的功能营养。*通信作者,副研究员,硕士,从事食药用菌的研究与开发。
收稿日期2022-02-20
