水稻果皮花青素含量的全基因组关联分析
2023-07-04何展坤崔延春徐庆国毛东海
何展坤,崔延春,徐庆国,毛东海
(1.湖南农业大学农学院,湖南 长沙 410128;2.中国科学院亚热带农业生态研究所亚热带农业生态过程重点实验室,湖南 长沙 410125)
花青素是植物的主要次生代谢产物之一,属于类黄酮化合物,广泛存在于高等植物如谷物、瓜果及蔬菜中,是一种水溶性的天然色素,具有强抗氧化性[1]。动物代谢试验表明,食用花青素能够降低心脑血管疾病以及癌症风险[2]。陈琦等[3]研究发现,花青素能够下调p53基因DNA 甲基化,抑制人口腔表皮样癌细胞增殖及诱导细胞凋亡。而花青素的主要成分矢车菊素-3-O-葡萄糖苷(C3G)对于脑缺血等脑部疾病以及帕金森综合征和阿尔茨海默症都起到了有效的预防和控制作用[4-6]。此外,花青素还能起到降血脂的作用。Liu 等[7]通过对小鼠的研究发现,花青素能够调节小鼠肠道中的微生物群,降低小鼠的血脂,从而达到控制体重的目的。利用有色稻米中的花青素生产的复方胶囊能有效防治肝脏损伤,特别是对血脂高的人群具有明显的辅助降血脂效果[8]。
水稻是人类最为重要的粮食作物之一,世界60%以上的人口以稻米为主食。米麸中含有许多对人体有用的活性物质,在防癌、抗菌、抗氧化、预防糖尿病等具有重要的保健功效[9]。花青素在稻米果皮中的累积,会产生有色稻米,根据花青素含量的不同,可使稻米果皮呈现黑(紫)、红、黄等不同颜色,其中以黑米和红米最为常见[8]。与普通白米相比,有色稻米具有提高人体免疫力,预防疾病等功效,具有重要的营养及保健价值。随着我国居民生活水平提高,对稻米品质及健康功能性稻米的要求越来越高,水稻产业发展不仅要解决人们的温饱问题,还要满足人们对健康高品质生活的向往。因此,未来稻米产业绿色发展,必须选育开发“药食同源”有色健康功能性稻米新品种,实现有色稻米主食化及其优质功能性稻米产业的升级[10]。
功能性稻米产业的发展离不开种质资源的创新及品种的改良,而优异基因的发掘是种源创新和品种改良的关键。当前可用于健康功能性水稻品种培育的果皮花青素基因资源还十分有限。已克隆的控制水稻果皮颜色的主效基因包括Rc、Rd、OsKala1,OsMYB3(也称为OsKala3)、OsKala4和OsTTG1基因[11-12]。植物组织中花青素的生物合成主要由三种转录因子R2R3MYB、bHLH 和WDR 组成的MBW(MYB-bHLH-WD40)三聚体转录因子复合物激活[13]。Rc和OsKala4负责编码bHLH 蛋白,分别控制水稻红色和黑色果皮性状[14]。OsMYB3编码一个R2R3-MYB 转录因子,是水稻果皮中花青素合成的关键基因,其在黑米中的表达水平明显高于白米,黑米中敲除该基因会导致谷物中19 种花青素代谢物和许多其他类黄酮的显著下调[15]。OsTTG1负责编码WD40 蛋白,东兰墨米敲除OsTTG1后,其谷粒、颖尖和叶耳的花青素积累量显著减少或消失[12]。Rd和OsKala1负责编码DFR 蛋白,在花青素合成途径中负责将二氢槲皮素的羰基还原,产生不稳定的中间体无色花青素[16]。在最新的研究中揭示了OsKala4的等位基因OsS1控制水稻茎秆和颖壳的着色,在花青素合成通路中S1位于OsC1的上游,通过调控C1的表达,达到高效调控下游花青素结构基因表达的目的[17]。此外,其他已克隆的花青素相关基因都是影响水稻叶片花青素含量,与籽粒无关,例如,水稻OsC1、OsRb和OsP1是水稻叶片花青素合成的关键基因[18],其中C1和Rb基因的某些突变导致的人工选择,是造成野生稻和栽培稻叶片颜色出现性状分离的原因之一。水稻OsP1能够与MYB-bHLH-WD40互作共同调节水稻叶片中花青素生物合成基因,同时OsP1能够特异性激活花青素生物合成的上游基因[19]。由此可见,可用于健康功能性水稻种质创新及品种改良的基因屈指可数,有待更多发掘。
全基因组关联分析(genome-wide association studies, GWAS)是一种可以用于连锁作图、寻找特定表型性状有关的候选基因,以及揭示表型和基因型关系的一种有效方法[20]。它可直接利用自然群体在全基因组层面发掘与农艺性状关联的遗传位点,在水稻遗传改良上已被广泛应用。例如,Lu 等[21]利用523 份水稻种质资源共定位了17 个与水稻株型相关的QTL,Tan 等[22]通过测量575 份亚洲栽培稻品种在不同环境中的微量元素积累,并利用GWAS 解析了稻米中矿质元素累积的遗传基础。然而,目前尚无水稻果皮花青素含量性状的GWAS 研究。为此,我们开发了水稻果皮花青素含量的无损伤检测技术,获得533 份水稻种质群体材料的测量数据,结合全基因组关联分析,试图剖析水稻果皮花青素含量的遗传基础,为健康功能性水稻品种的选育提供理论基础与基因资源。
1 材料与方法
1.1 供试材料与田间种植
水稻供试种质材料主要来自于东亚、东南亚和南亚的水稻产区,共533 份亚洲栽培稻(Oryza satiνa L.)种 质,包 括294 份 籼 稻(Oryza satiνa subsp. indica)种质材料,239 份粳稻(Oryza satiνa subsp. japonica)种质材料,其中有色稻米共含有29份,27 份红米以及2 份黑米。水稻种质材料分别种植于湖南省长沙市芙蓉区与海南省三亚市中国科学院亚热带农业生态研究所基地。田间种植采用随机区组,每个种质材料种植1 行(共8 株),株行距为15 cm×15 cm。整个生育期田间管理按一般水稻大田生产管理措施进行。待水稻种子充分成熟后,将每行中间的4 株水稻人工收获、脱粒后保存。为防止收种及后续处理过程中的污染,收获后的种子立即装入羊皮纸袋中密封保存。
1.2 水稻的花青素表型测定
为防止机械去壳导致水稻糙米的果皮受到损伤,采用人工去壳的方式,采集533 份水稻种质材料的糙米并保存到EP 管中。利用活体成像仪以及分光光度计法对不同颜色稻米进行定量测量,并对两种方法所测量的数据进行相关性比较分析。
1.2.1 稻米花青素含量的植物活体成像仪分析 水稻糙米果皮花青素含量的植物活体成像仪(VILBER FUSION FX7.EDGE SPECTRA)分析的具体方法如下:分别从每份水稻种质材料中,挑选发育成熟饱满的糙米作为测量材料,各供试样品均采用相同的一粒白色米作为对照,然后对测量数据进行分析,以经过535 nm 波长过滤后的可见光为光源,设置白色稻米的反射光值为“1”作固定对照,以有色稻米样品的反射光值作为其花青素的相对含量,每个样品重复测定3 次,取平均值。
1.2.2 稻米花青素含量的分光光度计分析 水稻糙米果皮花青素含量的分光光度计分析,按照中华人民共和国农业行业标准[NY/T 832-2004]附录A 黑米色素检验方法并稍做修改,具体方法如下:称取1 g糙米,放置于50 ml 的离心管中,分批次加入20 ml、20 ml、10 ml 的1.5 mol/L 酸化乙醇(HCL/95%乙醇=15/85),在80 ℃的恒温水浴锅中浸提1 h。然后将浸提溶液采用高速离心机12 000 r/min 离心5 min,收集上清并定容至50 ml,采用分光光度计在535 nm 处测定其吸光度值(Abs)。根据以下公式计算各供试糙米样品花青素的相对含量:

1.3 基因型检测与分析
533 份供试水稻种质材料的单核苷酸多态性(SNP)基因型数据,均来自5 k 高密度SNP 数组,利用TASSEL 5.2.81 软件过滤掉低质量的SNP 位点,选择最小等位基因频率(minor allele frequency,MAF)>0.05,最小计数<150 及缺失率≥20%后,剩余65 523 个SNP 用于后续的全基因组关联分析。
1.4 水稻种质材料的重测序
供试水稻种质材料的基因型分析,采用第二代测序技术(Next generation sequencing, NGS)对各供试水稻种质材料进行全基因组重测序(Wholegenome resequencing,WGRS)。在去除低质量碱基和接头序列后,总共产生9 627 694 000 条高质量的读序列(reads),1 245.30 Gbp 的碱基数据,重测序数据从课题组已有数据中获得[22-23]。
1.5 全基因组关联分析
利用TASSEL 对50 K SNP 标记与供试水稻种质糙米果皮的表型数据间进行关联分析,为减少GWAS结果中的假阳性,全基因组范围阈值根据0.05水平的Bonff eroni 校正法进行筛选,即全部材料中阈值为1e-6,位点的P值小于阈值,则记为显著关联位点(Signif icant association loci,SAL)。
为了比较各供试水稻种质稻米花青素含量,通过植物活体成像仪和分光光度计两种不同方法获得的糙米果皮颜色数据,进行相关性分析,并对活体成像测量的结果进行全基因组关联分析。分析采用TASSEL 5.2.81 软件和混合线性模型算法(MLM)完成。GWAS 结果用Manhattan 图和QQ-Plot 图显示,Manhattan 图表示水稻全基因组中与花青素有关的显著位点以及P值,QQ-Plot 图表示该模型下的关联分析效果。然后在国家水稻数据中心(http://www.ricedata.cn)以及NCBI 数据库(https://www.ncbi.nlm.nih.gov/)中,寻找已克隆或定位的与水稻花青素相关基因的位置信息,与本研究所检测的QTL 进行共定位。
1.6 数据统计与分析
本研究中的数据分析采用SPSS 13.0 进行T检验等统计分析。利用国家水稻数据中心(http://www.ricedata.cn)以及NCBI 数据库(https://www.ncbi.nlm.nih.gov/)下载候选基因的蛋白序列;rapdb网站(https://rapdb.dna.aff rc.go.jp/tools/blast)对候选基因的蛋白序列进行同源性比对,并利用MEGA_11.03.13 软件进行进化树构建;利用表达谱数据库(http://www.bar.utoronto.ca/efprice/cgi-bin/efpWeb.cgi)分析候选基因在不同组织、不同时期的表达情况。
2 结果与分析
2.1 水稻果皮花青素含量的检测
通过活体成像仪,获取不同果皮颜色水稻种质的糙米在535 nm 波长下的显色图(图1)。如图1所示,不同果皮颜色水稻种质的糙米按照其颜色深浅依次由低到高排列,将排列第1 位的白色米作为对照水稻种质(图1 A),随后对各供试水稻种质果皮颜色获取的图片分别做进一步的花青素含量的定量分析。分析过程中将水稻种质白色米对照的反射光值设为1,各供试水稻种质有色稻米的反色光值则为1~0 之间,其果皮颜色越深,则其反射光值越低。
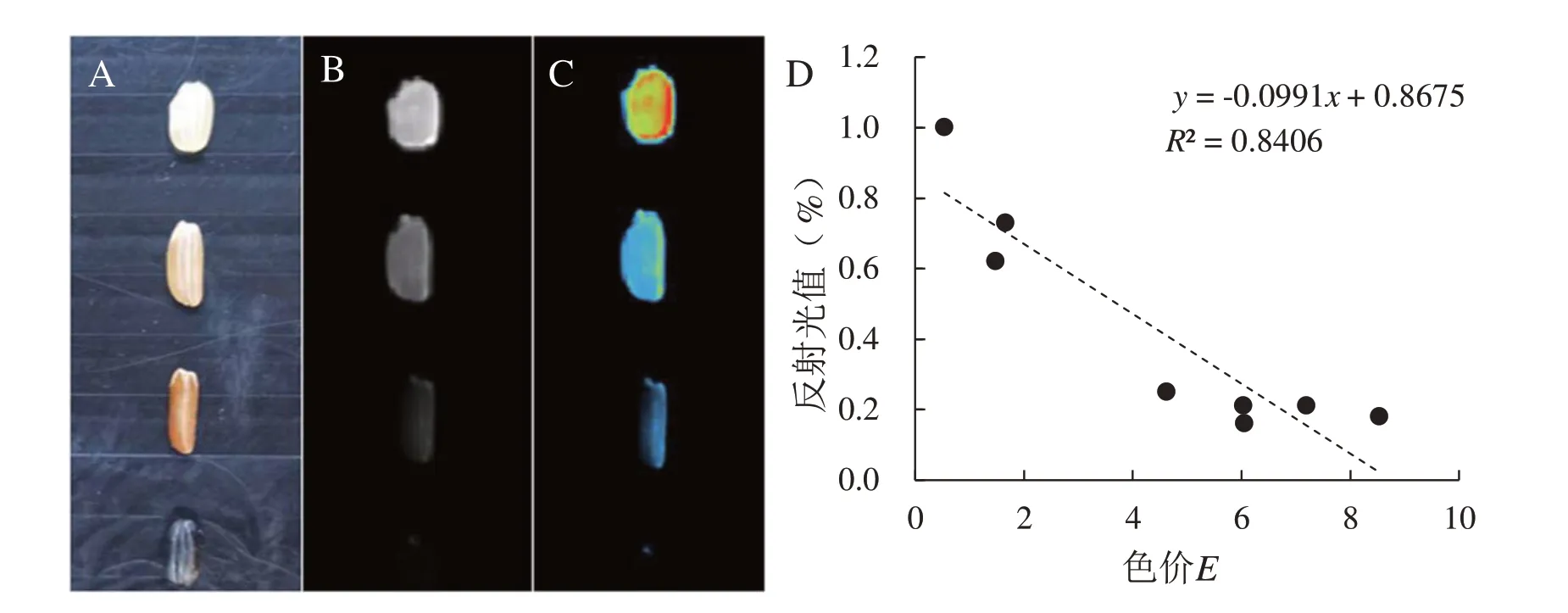
图1 不同水稻种皮颜色表型以及相关性分析Fig. 1 Rice phenotypes and correlation analysis of diff erent rice coats
同时,将测量结果与中华人民共和国农业行业标准[NY/T 832-2004]的稻米花青素测量方法的结果进行对比,二者呈现明显的负相关,与预期一致,即水稻种质糙米果皮颜色越深,其反射光值越低,其花青素含量越高。相关性分析表明,水稻种质糙米反射光值与花青素含量两者的相关系数达到了0.840 6(图1 D),表明利用活体成像仪分析水稻糙米果皮花青素相对含量的方法是可行的。
2.2 水稻果皮花青素含量的全基因组关联性分析
水稻花青素全基因组关联性分析前,首先利用活体成像仪对533 个水稻种质糙米的花青素相对含量进行定量测量,并将此表型数据结果绘制成柱形图(图2A)。
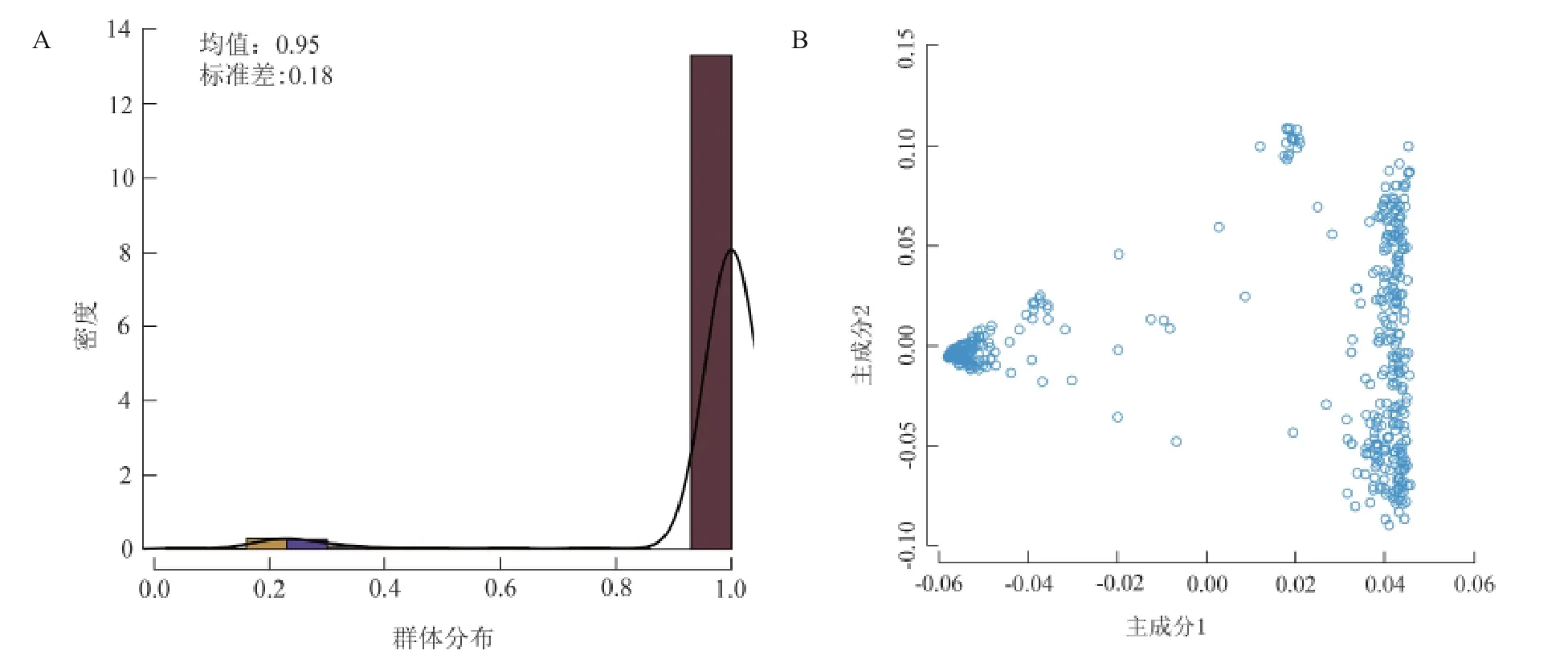
图2 GWAS 群体表型汇总以及主成分分析Fig. 2 GWAS population phenotypic summary and PCA
利用TASSLE 软件分别对533 份核心群体进行数据分析。首先通过群体基因型进行主成分分析(图2B),发现本研究中的自然群体存在明显的群体结构,当使用主成份1 和主成份2 作散点图,可以观察到整个群体存在明显的籼粳分化,随后进行全基因组关联性分析,并选择以混合线性模型(MLM)鉴定与控制水稻糙米果皮颜色以及花青素有关的显著遗传位点(图3)。根据曼哈顿图所示(图4),整个基因组共检测到了725 个与水稻糙米果皮花青素含量有关的SAL,由于受7 号染色体上控制果皮颜色性状的RC基因连锁不平衡的影响,7 号染色体上存在633 个假阳性SNP,排除掉假阳性后共检测到了92 个SAL。
图3 水稻果皮性状全基因组关联分析的QQ 图(n=533)Fig. 3 GWAS for rice pericarp traits was showed in quantile-quantile (QQ) plots (n=533)
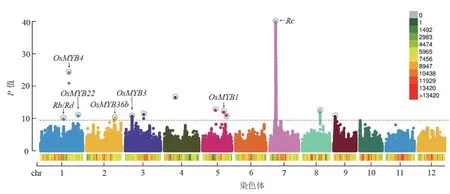
图4 水稻糙米果皮性状全基因组关联分析的曼哈顿图(n=533)Fig. 4 GWAS for rice brown rice pericarp traits was showed in Manhattan (n=533).
为了降低假阳性概率,在SNP 上下游200 kb范围内如果存在2 个显著相关SNP 位点则记为1 个QTL 位点,对水稻花青素全基因组关联(GWAS)结果所检测到的SNP 进行了QTL 分析,共定位到了13 个与花青素显著相关的位点(表1)。将定位到的QTL 与已克隆或定位的水稻花青素相关基因进行共定位,共定位到21 个基因,包括定位到了两个控制水稻果皮色泽的主效基因,即位于7 号染色体上RC基因与位于1 号染色体上Rd基因,一个参与叶片花青素合成的关键基因Rb,以及与MYB 家族有关的15 个基因,其中包括7个 已 被 克 隆 基 因(OsRL3、OSMYB1、OSMYB3、OSMYB4、OSMYB22、OsMYB36b和OsMYB55)和8 个未被克隆的基因OsMYB4-2(LOC_Os01g50720)、OsMYB58-1(LOC_Os02g46780)、LOC_Os02g47190、LOC_Os02g49250、LOC_Os02g49986、OsMYB9-1(LOC_Os02g51799)、LOC_Os02g53670 和LOC_Os03g13310,此外还定位到了OsSRT1、OsMADS78及OsbHLH038基因。

表1 13 个与花青素显著相关位点Table 1 13 loci signif icantly associated with anthocyanins
2.3 水稻果皮花青素含量关联位点的候选基因分析
2.3.1 候选基因的同源性分析 对定位到的MYB家族以及bHLH家族候选基因利用MEGA_11.03.13 软件进行同源性分析后发现,MYB家族中的OsMYB4、OsMYB22、OsMYB1、OsMYB36b、OsMYB55、OsMYB4-2、OsMYB58-1、LOC_Os02g49986、OsMYB9-1与已知的花青素合成相关基因OsMYB3和OsC1的同源关系较近(图5),bHLH家族中的OsbHLH038与已知基因Rb和OsKala4同源关系较近,表明上述候选基因与已知花青素相关基因在功能上存在一定的相似性。

图5 花青素候选基因中MYB(A)和bHLH(B)家族成员进化树Fig. 5 Phylogenetic tree of MYB (A) and bHLH (B) family members in anthocyanin candidate genes
2.3.2 候选基因的表达模式分析 利用表达谱数据库对21 个候选基因进行了表达模式分析,在4 个已知的与花青素相关基因中,Rd基因在种子的生长发育期表达量最高(图6A),Rb基因则在种子开始休眠后表达量上升,且在叶片中有高表达(图6B),而Rc基因在胚的发育过程中表达量逐步上升并在种子成熟期表达水平达到顶峰(图6C),MYB家族成员中的OsMYB3基因在胚的发育过程中保持着高表达,并随着种子发育成熟表达量逐步下降(图6D),对上述四个基因的表达模式分析表明,果皮中花青素的合成与积累与胚的发育和种子的形成有关。bHLH家族中的OsbHLH038基因在整个花粉发育期以及胚根中表达量最高,其次是在种子发育期表达水平较高(图7A)。除OsMYB3外的其余14 个MYB 转录因子,目前尚未有研究报道是否与花青素的合成有关。表达谱分析表明,OsMYB4和OsMYB36b基因表达模式与OsMYB3相似,均在种子的生长发育过程中保持高表达(图7B~7C),而OsMYB22、OsMYB1在种子发育的球形胚早期表达量最高(图7D~7E),因此,推测它们可能与果皮中花青素的合成和积累有关。OsMYB58-1在胚根中表达量最高,进入生殖生长期后其表达量呈现出先升后降的趋势(图7F),LOC_Os02g49250在胚根和整个种子发育时期表达量最高(图7G),OsMYB9-1在胚根和叶片中表达量最高,在种子发育后期也有一定的表达(图7H),LOC_Os03g13310在叶片、顶端分生组织萌发期、花粉发育期以及种子发育期都有较高表达(图7I),从这四个基因在种子发育期的表达量可以推测,它们很可能参与了果皮中花青素的调控。而其他6 个MYB家族基因中,OsRL3、LOC_Os02g4719、0LOC_Os02g53670虽 在种子中也有表达(图8A,8D,8F),但与OsMYB3的同源关系较远,OsMYB55、OsMYB4-2与LOC_Os02g49986基因在种子中的表达水平较低(图8B,8C,8E),因此它们作为花青素候选基因的可能性很小。OsSRT1基因在茎尖分生组织和幼穗以及幼根中表达量最高(图8G)。OsMADS78是具有M-α型的MADS-box 家族基因,该基因在花药和幼穗其次是种子中表达量最高(图8H)。

图6 花青素主效基因表达图谱Fig. 6 The expression prof iles from anthocyanin potent gene microarray data
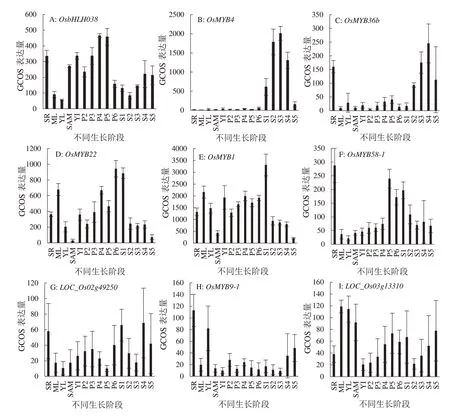
图7 花青素候选基因表达图谱Fig. 7 The expression prof iles of anthocyanin candidate genes
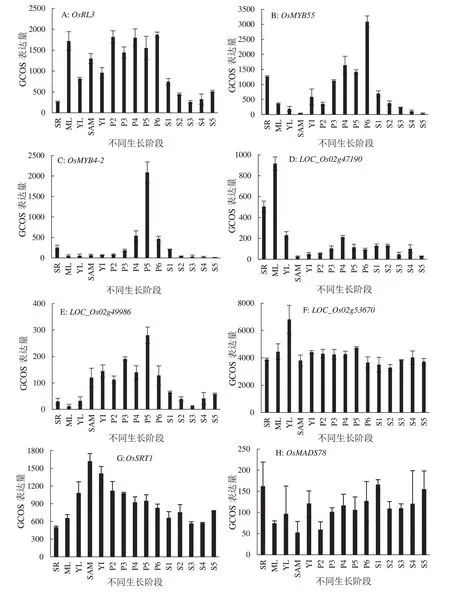
图8 花青素非候选基因表达图谱Fig. 8 The expression prof iles of anthocyanin non-candidate genes
3 讨论
3.1 利用植物活体成像系统开发了稻米花青素的无损伤定量检测技术
本研究所发明的活体成像技术检测水稻花青素相对含量的方法,具有高效、精准、无损伤、无污染的优点。此方法不仅能够节约成本,而且能在不损伤水稻种胚的情况下完成数据的测量,同时对所测量的数据与中华人民共和国农业行业标准[NY/T 832-2004]的传统测量方法得到的数据进行相关性分析,发现两种方法所获得的数据间的正相关达极显著水平(R=0.840 6),进一步验证了该方法的可靠性。以往传统花青素的提取工艺主要为传统溶剂萃取法,花青素溶剂主要包括酸化水、乙醇和甲醇等,这种方法虽简单,但耗时长,且易对环境造成污染。而本研究研发的花青素含量定量分析方法是利用了光学原理,包括最近张东方等[24]发明的利用光谱技术测量花青素含量,刘秀英等[25]发明的高光谱遥感反演测量花青素相对含量的新方法。这些方法都能高效、无损伤、无污染地对花青素含量进行定量分析,为植物花青素测定提供了新的技术方法参考。
3.2 基于全基因组关联分析发掘了多个与水稻果皮花青素含量相关的新基因
3.2.1 已知果皮花青素相关基因的定位 本研究首次对水稻果皮花青素性状进行全基因组关联分析,共鉴定到13 个与果皮花青素相关的QTL 位点,通过对候选基因分析后,确定了9 个新的与花青素合成相关候选基因。在这13 个QTL 位点中,包括已报道的控制水稻叶色的Rb基因以及控制水稻果皮色泽的关键基因Rc、Rd和OsMYB3。Hu 等[26]将PSH1划分为两个紧密连接的bHLH基因Rb1和Rb2,这两个基因的异位表达导致花青素3-O-葡萄糖苷和牡丹素3-O-葡萄糖苷在叶片、叶鞘和果皮中大量积累,通过进一步研究发现OsC1和Rb(Rb1和Rb2)之间的显性互补互作控制了水稻紫色叶鞘性状,但目前并没有研究报道Rb基因与果皮花青素的合成相关。Rc与OsKala4基因是已报道的与水稻果皮色泽相关的基因,分别控制红色和黑色果皮性状[27]。OsMYB3编码一个R2R3-MYB 转录因子,与黑米中花青素的合成有关,Kim 等[27]在对黑米的研究中表明bHLH转录因子OsKala4是决定黑米性状的主效基因,并发现OsMYB3编码的R2R3 MYB 蛋白能够与OsKala4相互作用介导种子内部花青素生物合成基因的活化,进而影响水稻果皮中的色素积累。定位到的这4 个已知花青素相关基因表明我们基于花青素相对含量的全基因组关联分析方法的有效性。
3.2.2MYB家族候选基因的定位 除了以上4 个已报道的与花青素有关的基因外,还定位到了8 个已克隆的基因,其中6 个是来自MYB转录因子家族,分 别 是OsMYB4、OsMYB22、OsRL3、OsMYB1、OsMYB36b和OsMYB55。已有研究表明,OsMYB4与水稻耐冷性有关[28],OsMYB22参与水稻抗稻瘟病基因的调控[29],OsMYB1为水稻穗期调节的候选基因[30],OsMYB36b与水稻根部矿物质选择性吸收有关[31],目前尚无研究报道它们是否与花青素的合成有关。通过对候选基因蛋白同源比对及表达谱分析发现,OsMYB4、OsMYB36b与OsMYB3的同源关系较近,且三者表达模式基本一致,在种子发育的五个阶段均有较高的表达,因此,OsMYB4、OsMYB36b为花青素合成相关候选基因的可能性极高。而OsMYB22、OsMYB1基因系统进化树分析表明,同样与花青素合成相关基因OsMYB3和OsC1同源,虽表达模式与OsMYB3不同,但在种子不同发育阶段中都具有较高的表达水平,推测OsMYB22和OsMYB1同样为果皮花青素合成相关的候选基因。Park 等[32]的研究表明,OsRL3能够通过ABA 信号通路促进叶片衰老并延迟盐胁迫反应,但并无与花青素相关的报道,而Hiratsuka 等[33]的研究中表明ABA 可以促进花青素的合成,由此推断OsRL3是否能够通过调节ABA 来影响花青素的合成,有待进一步的验证。此外还定位到8 个未被克隆的MYB家族成员OsMYB4-2、OsMYB58-1、LOC_Os02g47190、LOC_Os02g49250、LOC_Os02g49986、OsMYB9-1、LOC_Os02g53670 和LOC_Os03g13310。系统进化树分析表明,除LOC_Os02g47190 与LOC_Os02g53670 外,其余6 个成员与已知花青素相关基因OsMYB3同源关系较近,结合表达谱分析发现OsMYB58-1、LOC_Os02g49250、OsMYB9-1与LOC_Os03g13310 在种子中都具有较高的表达水平,与OsMYB3相似,因此,这4 个基因也很可能与果
皮花青素含量相关。
3.2.3 其它可能性候选基因的定位 除MYB家族成员外,还定位到了一个bHLH基因OsbHLH038,位于4 号染色体上的组蛋白去乙酰化酶基因OsSRT1以及9 号染色体上的OsMADS78基因。OsbHLH038是个尚未被克隆的新基因,系统进化树分析表明,其与已知的果皮花青素相关基因Oskala4具有一定的同源性,且在种子中具有较高表达水平,很可能参与果皮花青素的调控。Zhang 等[34]的研究表明,OsSRT1可以直接参与种子和幼苗中代谢相关基因的表观调控,位于9 号染色体上的OsMADS78基因能够影响水稻种子胚乳的发育进而影响种子的大小[35],上述两个基因都参与种子的代谢和发育,那么猜测是否也会参与水稻果皮中的花青素合成,尚需进一步的研究证实。
4 结论
1)本研究发明了一种利用植物活体成像仪测量水稻果皮花青素相对含量的新方法。该方法具有高效、精准、无损伤、无污染等优点,为花青素等植物色素含量的定量分析提供了新的方法参考。
2)通过对核心群体中的花青素测量数据进行全基因组关联分析,共定位到了包括Rd、Rb、Rc和OsMYB3基因在内的21 个候选基因;通过系统进化树及表达谱分析,最终确定了8 个MYB家族基 因OsMYB4、OsMYB22、OsMYB1、OsMYB36b、
OsMYB58-1、LOC_Os02g49250、OsMYB9-1、LOC_Os03g13310和1 个bHLH基 因OsbHLH038为 新 的花青素合成相关的候选基因。新的候选基因的发掘可为水稻果皮花青素含量的遗传基础研究提供参考,对功能性水稻种质资源创新与品种改良具有重要意义。
