典型的草甸和冠层型沉水植物对内源污染物削减效果研究
2023-07-01谢孟颖李鑫宇陈桂珠种云霄
谢孟颖,李鑫宇,陈桂珠,种云霄
(华南农业大学资源环境学院/广东省农业农村污染治理与环境安全重点实验室,广东 广州 510642)
【研究意义】当前我国许多受污染地表水体中的外源污染已经得到控制,但是底泥中仍然沉积大量污染物,成为影响水体环境质量的内源污染[1]。底泥中的亚铁〔Fe(Ⅱ)〕和酸可挥发性硫化物(AVS)等还原态物质对底栖生物具有毒害性,影响底栖生物群落的发育;同时,氮、磷等营养物质会向上覆水扩散,导致水中氮、磷浓度升高、刺激藻类生长[2]。因此,如何有效削减内源污染物总量,控制底泥中污染物向水体中释放,逐渐成为水体污染控制与生态修复的重要目标。【前人研究进展】已有研究表明,以沉水植物为主导的原位生态治理与修复是控制内源污染较为经济的技术措施,具有操作简单、所需能耗低、低投资和高效益的优点,还可提升景观,具有生态效益等[3]。沉水植物在生长过程中会与藻类竞争水中的养分,同时释放一些抑制或杀死藻类的化学物质(如化感物质)[4];其根、茎、叶可吸收和富集水体、底泥中的氮、磷元素,同时释放氧气,为好氧生物提供生长环境,净化水质,改善水环境[5]。沉水植物根系能通过泌氧和吸收作用去除底泥中的还原态物质,然而底泥中有毒害作用的还原态物质,如硫化氢、亚铁、有机胺等含量过高,则会对根系生长造成抑制,甚至引起植珠死亡、腐败,对底泥造成二次污染[6]。由此可见,沉水植物可通过其复杂的生长代谢过程改善水体环境,然而底泥中有毒物质也会对植物造成威胁,且会因植物类型的不同而有所差异。因此,选取合适的沉水植物对于原位生态治理与修复技术尤为重要。根据生长发育特点,可将沉水植物分为草甸型和冠层型,目前关于这两种典型沉水植物对内源污染物削减效果的研究较少。【本研究切入点】轮叶黑藻(Hydrilla verticillata)为冠层型沉水植物,常见于淡水生态系统中,在池塘、溪流及湖泊等淡水水体中均有分布,具有生长速度快、营养盐吸收速率快等特点,通过直立茎的分枝来扩增生物量,常用于水体生态修复研究。矮慈姑(Sagittaria pygmaeaMiq)为草甸型沉水植物,直立茎短缩,个体较矮小,主要依靠横走的根茎来扩增生物量,是近年新筛选的对黑臭重污染底泥具有较强耐受性的沉水植物[2]。选取两种不同生长模式且对内源污染具有一定耐受作用的沉水植物进行比较,分析不同的生长模式在污染水体中的净化优势。【拟解决的关键问题】本研究以上述两种典型的草甸型和冠层型沉水植物为研究对象,利用采自重污染水体底泥构建实验模拟系统,比较两种沉水植物对内源污染物的控制效果,为受污染水体的生态修复提供参考。
1 材料与方法
1.1 试验材料
矮慈姑(Sagittaria pygmaeaMiq)为本研究团队于2014 年采自广东河源东江流域稻田野外,带回华南农业大学实验基地利用水稻土培养扩增;轮叶黑藻(Hydrilla verticillata)于2020 年采自广州南沙某河涌,带回实验室后采用水稻土扩增培养。两种植物均通过逐渐加入污染底泥的方式,进行3 个月污染底泥耐受性驯化,直至植株在污染底泥中存活[2]。
污染底泥采自广东江门某重污染河涌,外观呈黑色,带有刺激性气味。经测定,污染底泥的初始性质如下:含水率30.45%、全氮(TN)含量740 mg/kg、全磷(TP)含量519 mg/kg、有机质含量15 g/kg、亚铁Fe(Ⅱ)含量188.29 mg/kg、酸可挥发性硫化物(AVS)含量321.3 mg/kg、氨氮()含量24 mg/kg、pH7.31。底泥中各项污染物含量较高,属于污染较严重的厌氧还原态底泥。
1.2 试验方法
实验培养装置采用上下口直径20 cm、高150 cm 透明塑料圆桶,底部铺入30 cm 的污染底泥,设置矮慈姑和轮叶黑藻系统各1 组,每组3个平行装置。每个装置中,初始移栽的植株数量均为10 株,其中,矮慈姑有4~10 条根/株,根长4~10 cm,平均约5 cm,1~2 条匍匐茎,4~6 枚直立叶片,叶长约10 cm 左右;轮叶黑藻株高统一修剪为10 cm,3~8 条根/株,根长4~10 cm,平均约6 cm,4~9 分枝/株。植物移栽后,每个装置加入双蒸水10 L,水位高约30 cm,整个装置置于露天环境中。试验时间为2020 年8 月中旬—12 月中旬,期间定期补充双蒸水维持水位高度,避免因上覆水蒸发或取水样导致水位低于30 cm,降雨时最高水位不控制,暴雨时水位高于水桶高度自行溢流。
试验期间每7 d 对6 个装置的上覆水取样1次,使用200 mL 透明塑料瓶分别在上覆水表层与水面下30 cm 处取水200 mL,混合于500 mL 聚乙烯瓶,用于测定上覆水TN、TP 和叶绿素a 含量,共取样18 次。试验结束时,将各装置上覆水缓慢排出,使水位降至0~5 cm 处,首先对各系统植物的株数、株高及生长情况等进行测定,再用木铲取表层0~10 cm 处底泥样品500 mL,最后将表层底泥剥离,取10~20 cm 处下层底泥样品500 mL。取回的表层底泥和下层底泥一部分风干后用于测定底泥TN、TP、Fe(Ⅱ)、AVS、NH4+-N等污染物指标;每个表层底泥样品取50mL 用于底泥沉降性能的测定;另取0~10 cm处表层底泥(根系集中分布区域)贮存于4 ℃冰箱,随后送往广东美格基因科技有限公司完成建库及测序工作。
1.3 指标测定
上覆水:总氮含量测定采用碱性过硫酸钾光度法(HJ 636-201)、总磷含量测定采用钼酸铵分光光度法(GB/T11893-1989)、叶绿素a 含量测定采用乙醇免研法。
底泥:Fe(Ⅱ)含量测定采用紫外分光光度法(FHZDZTR0158)、酸可挥发性硫化物(AVS)含量采用酸性挥发硫测定法、NH4+-N 含量测定采用氯化钾溶液提取-分光光度法(HJ 634-2012);底泥的沉降性能测定参照序批式活性污泥法污水处理工程技术规范(HJ 577-2010)中活性污泥沉降性能的测定方法,按以下步骤操作:取表层底泥50 mL 放入100 mL 量筒中,逐步加入纯水到100 mL,搅拌混匀,静置,观察水底泥界面的下降情况,定期测定沉降的底泥的容积。
微生物高通量测序:使用带barcode 的特异引物及TaKaRa Premix Taq® Version 2.0(TaKaRa Biotechnology Co.,Dalian,China)进行PCR 扩增,前端引物序列为:GTGCCAGCMGCCGCGGTAA,后端引物序列为:GGACTACHVGGGTWTCTAAT。用1%琼脂糖凝胶电泳检测PCR 产物的片段长度和浓度,主带长度在正常范围内的样品可用于进一步实验。利用GeneTools Analysis Software(Version4.03.05.0,SynGene)对PCR 产物进行浓度对比后,按照等质量原则计算各样品所需体积,将各PCR 产物进行混合。使用 E.Z.N.A.® Gel Extraction Kit(Omega,USA)凝胶回收试剂盒回收PCR 混合产物,TE缓冲液洗脱回收目标DNA 片段。委托广东美格基因科技有限公司完成建库及测序工作。
1.4 数据处理与统计
数据处理与统计使用Excel 2010,用误差棒表示标准误,实验结果用平均值±标准偏差表示,使用Origin 2022 绘制图表,使用IBM SPSS 22 中的One-way ANOVA(Ducan法)比较数据的显著性。
底泥微生物数据使用SMRT Link Analysis 软件6.0 版处理PacBio 原始reads,以获得环形一致性序列(CCS)reads:参数设置最小通过次数为3,最小预测准确度为0.99。原始reads 通过SMRT Portal 处理,以筛选序列的长度和质量。使用UPARSE 将分类操作单元(OTU)以98.65%的相似性阈值聚类,并使用UCHIME 去除嵌合序列。进行物种组成分析和α 多样性分析前,以最低的OTU 序列数组别为标准进行抽平处理。
2 结果与分析
2.1 两种沉水植物生长扩增情况
如图1 所示,两种植物在污染底泥中呈现不同的生长情况,矮慈姑的株高没有变化,但株数扩增达10 倍以上,约106(±40)株,根长由初始的5 cm 增长至10 cm,每株植物根的数量仍维持在4~10 条,由于株数大量增加,相应根的数量也成倍增加,在底泥中形成了密集的根系层。轮叶黑藻的株数和根长较试验开始时变化不大,株数保持在10(±2)株,根长由起初的平均6 cm增长到8 cm,但株高大幅提升,达到初始时的3~4 倍,约为30~40 cm,且分枝数量也从每株4~9分枝增加到9~13 分枝,在整个上覆水中形成紧密的茎叶冠层。综合比较来看,矮慈姑地上和地下生物量同步扩增,轮叶黑藻则是地上生物量扩增且占据较大的水下空间,地下生物量维持不变。
2.2 两种沉水植物生长对上覆水水质的影响
由图2 可知,矮慈姑和轮叶黑藻系统上覆水TN 和TP 的浓度均控制在较低水平,矮慈姑系统的TN、TP 范围分别为0.2~1.2、0.03~0.1 mg/L,轮叶黑藻系统的分别为0.3~1.1、0.01~0.09 mg/L,差异不显著。主要原因是系统内上覆水来自雨水和双蒸水补水,氮磷浓度较低,大部分氮磷等营养物质来源于底泥,可以被沉水植物和藻类直接或间接吸收利用或被底泥吸附和沉降。
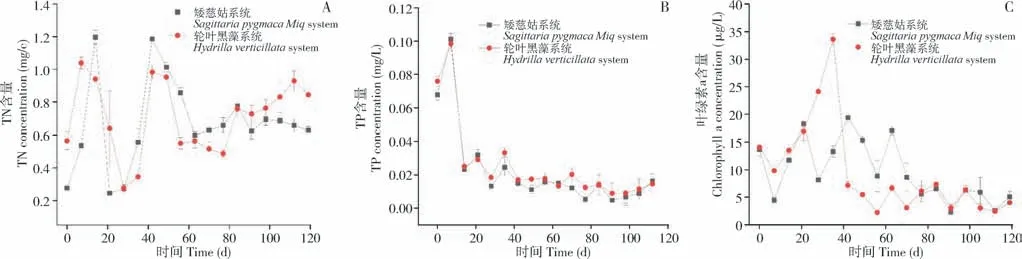
图2 矮慈姑系统和轮叶黑藻系统上覆水中TN(A)、TP(B)和叶绿素a(C)含量变化Fig.2 Cocentration changes of TN (A),TP (B) and chlorophyll a(C)in the overlying water of Sagittaria pygmaea Miq a dn Hydrilla verticillate system
随着试验进展,两个系统上覆水的叶绿素a含量均呈下降趋势,矮慈姑上覆水叶绿素a 含量为2.29~19.35 μg/L、平均值为9.61 μg/L;轮叶黑藻上覆水叶绿素a 含量为2.45~50.59 μg/L,平均值为9.39 μg/L。大部分时间轮叶黑藻低于矮慈姑系统,只有两个时间点高于矮慈姑系统,该时间点为暴雨期,大量降水导致轮叶黑藻系统底泥被搅动悬浮,沉降在底部的藻类沉浮在上覆水中,而矮慈姑系统由于密集生物量覆盖和根系固定作用,底泥悬浮情况较轻,降雨带来的温度和光照下降致使藻类生长不活跃,因此上覆水中叶绿素a 含量下降。
2.3 两种沉水植物生长对底泥的影响
2.3.1 沉降性能 从图3 可以看出,矮慈姑系统的底泥沉降性能优于轮叶黑藻系统,在沉降试验进行到120 min 时,矮慈姑系统底泥沉降至72 mL处,而轮叶黑藻系统底泥只沉降至84 mL 处;当沉降试验进行到24 h,矮慈姑系统底泥沉降至63 mL,而轮叶黑藻系统底泥沉降至69 mL 处。总体来看,矮慈姑系统表层底泥在受扰动时更易沉降。

图3 矮慈姑系统与轮叶黑藻系统底泥沉降性能变化Fig.3 Changes in sedimentation performance of sediment of Sagittaria pygmaea Miq and Hydrilla verticillate system
2.3.2 底泥中还原态物质的去除效果 如图4 所示,与初始底泥相比,矮慈姑系统表层底泥的AVS 含量由初始的321.3 mg/kg 下降至64.2 mg/kg,差异显著,去除率达80.57%,而矮慈姑系统下层底泥AVS 含量略有上升;轮叶黑藻系统表层和下层底泥中的AVS 含量分别较初始底泥相比上升13.6%和19.2%,但差异不显著。综合来看,4 部分底泥样品,只有矮慈姑系统表层(0~5 cm)底泥中的AVS 被有效去除,该部分底泥含有密集的矮慈姑根系层,表明底泥中AVS 的去除主要是依赖根系作用,轮叶黑藻由于根系不发达,无法对AVS 去除起到有效作用。AVS 可被氧化性物质直接化学氧化或在微生物作用下氧化,因此,矮慈姑密集根系释放的氧应该是表层底泥中AVS 大量去除的原因[7]。

图4 矮慈姑系统和轮叶黑藻系统底泥中AVS(A)、Fe(Ⅱ)(B)和NH4+-N(C)含量变化Fig.4 Concentration changes of AVS(A), Fe(Ⅱ)(B)and NH4+-N(C) in sediment of Sagittaria pygmaea Miq and Hydrilla verticillate system
矮慈姑和轮叶黑藻的生长使底泥中的Fe(Ⅱ)含量发生较大变化(图4)。与初始底泥相比,矮慈姑系统和轮叶黑藻系统的表层底泥中Fe(Ⅱ)含量均显著降低,分别下降67.43%、24.75%,而下层底泥的Fe(Ⅱ)含量下降不显著,下降率分别为24.75%、4.46%。从整个底泥Fe(Ⅱ)含量的变化来看,矮慈姑系统表层和下层底泥亚铁浓度的下降幅度均大于轮叶黑藻系统,其中表层底泥的变化更为显著。与AVS 相同,Fe(Ⅱ)在氧化环境中也可被氧化。此外,铁也是植物生长所需的重要元素,矮慈姑和轮叶黑藻生物量的大幅扩增对Fe(Ⅱ)吸收利用量较大,因此矮慈姑系统表层底泥中Fe(Ⅱ)含量下降应是根系泌氧和吸收利用两种作用所致,而轮叶黑藻系统主要是吸收利用,因此去除量低于矮慈姑系统。
与初始底泥相比,矮慈姑表层和下层底泥中NH4+-N 含量均显著下降,分别降低72.48%和19.68%。轮叶黑藻表层底泥含量较初始下降61.41%,而下层底泥NH4+-N 含量则小幅增加。N是沉水植物生长所需的主要营养元素,而NH4+-N是沉水植物可直接吸收利用的氮形式,本试验中上覆水补水主要来自雨水和双蒸水,氮含量较低,矮慈姑和轮叶黑藻的生长扩张所需的氮元素主要来自于底泥,是导致两个系统底泥NH4+-N 含量下降的主要因素。此外,NH4+-N 还通过硝化、反硝化作用去除,矮慈姑系统根系表层具有丰富的好氧环境条件,有利于硝化反应发生。而远离根系区域(深度10~20 cm)则处于缺氧环境,有利于反硝化反应,使得部分NH4+-N 通过硝化、反硝化作用去除,因此矮慈姑系统底泥-N 的去除率高于轮叶黑藻系统。
2.3.3 底泥中TN、TP含量变化 与初始底泥相比,试验结束后,矮慈姑和轮叶黑藻表层和下层底泥中TN、TP 含量均有所升高,这可能是因为植物生长后期,部分叶片或根部组织枯萎、腐烂和藻类生长凋亡后沉积到底泥表层,将植物体内的氮、磷释放到底泥中,从而导致表层底泥TN、TP 含量升高[8]。但矮慈姑系统下层底泥中TN、TP 较上层底泥浓度上升不显著,说明矮慈姑的发达的根系有效减少了氮、磷向下层底泥的富集。此外,由于根系的泌氧作用,部分N、P 元素可能会在好氧微生物的作用下通过硝化、反硝化作用去除[9](图5)。
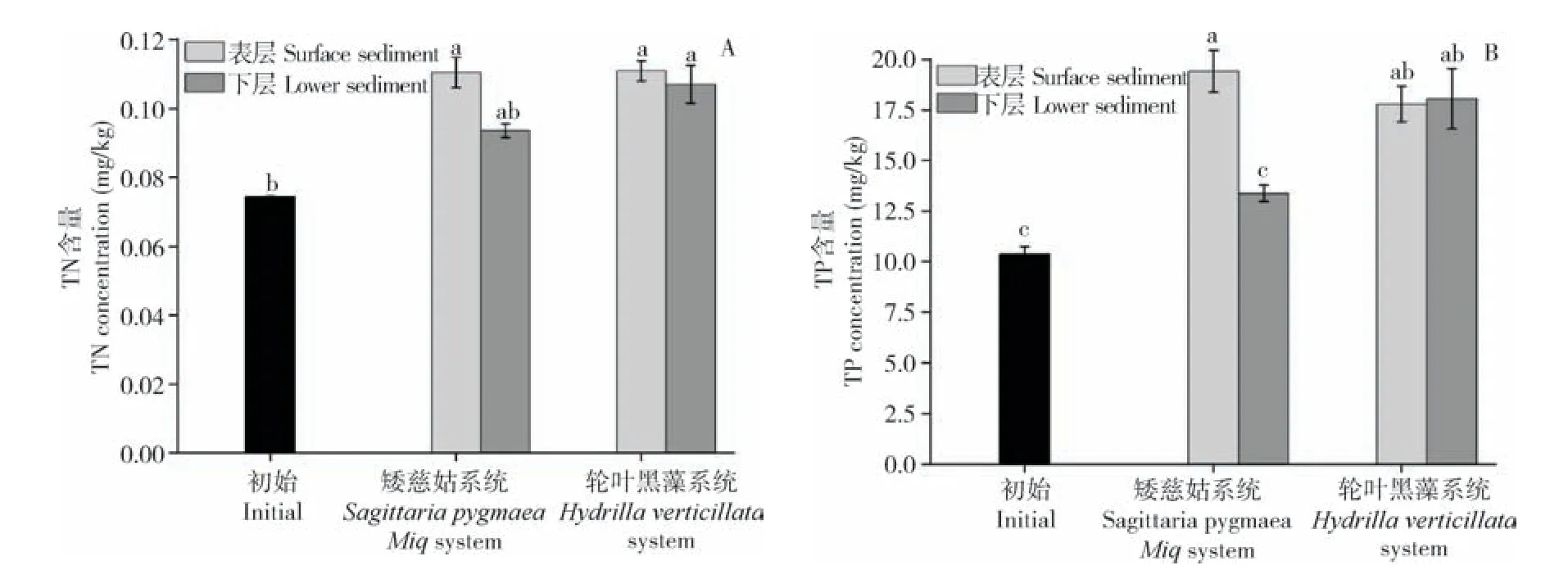
图5 矮慈姑系统和轮叶黑藻系统底泥中TN(A)和TP(B)含量变化Fig.5 Concentrations changes of TN(A)and TP(B)in sediment of Sagittaria pygmaea Miq and Hydrilla verticillate system
2.4 底泥微生物群落结构分析
2.4.1 Alpha多样性分析 基于16S rRNA 高通量测序数据,对两种沉水植物表层底泥种微生物多样性进行分析,采用reads 指数反映物种差异度,采用Chao1 指数反映物种丰富度,采用Shannon指数、Simpson 指数反映群落物种的丰富度和均匀度[10-11]。由图6 可知,reads 指数反映矮慈姑与轮叶黑藻系统微生物在OTU 间差异不显著,轮叶黑藻的Chao1 指数高于矮慈姑系统,表明轮叶黑藻系统底泥中物种总数更多、物种更丰富;而Simpson 指数和Shannon_e 指数分别高于和低于矮慈姑系统,表明轮叶黑藻系统的物种丰富度和群落多样性均高于矮慈姑系统。轮叶黑藻和矮慈姑系统在物种丰富度上差异性显著,而在群落种类方面差异不显著。

图6 矮慈姑系统和轮叶黑藻系统底泥微生物Alpha 多样性指数Fig.6 Alpha diversity index of sediment microorganism in Sagittaria pygmaea Miq and Hydrilla verticillata system
微生物多样性通常与环境条件相关,异质性越高,多样性越高[10]。沉水植物根系泌氧和释放有机酸等可改变周围底泥环境条件,影响范围则与根系密集程度有关[12],矮慈姑表层底泥中密集分布的根系使得受影响底泥范围较大,导致环境条件趋向一致,异质性降低,而轮叶黑藻表层底泥中由于根系生物量较小,根系影响范围有限,环境条件异质性增大,因此微生物多样性更高[13]。
2.4.2 微生物群落结构组成 两种沉水植物系统底泥门水平上的微生物类群相对丰度如图7 所示,矮慈姑和轮叶黑藻系统内前5 的优势门皆为:变形菌门(Proteobacteria)、绿弯菌门(Chlorof lexi)、泉古菌门(Crenarchaeota)、硝化螺旋菌门(Nitrospirae)和酸杆菌门(Acidobacteria),变形菌门在矮慈姑和轮叶黑藻系统中所占相对丰度最高,分别为47.35%和33.9%,这与钱燕对池塘底泥中微生物群落结构分析结果类似[14]。将相对丰度前15 门水平的细菌进行聚类分析(图7),发现矮慈姑系统硝化螺旋菌门、变形菌门较轮叶黑藻系统中的丰度更高,而轮叶黑藻系统中广古菌门(Euryarchaeota)、拟杆菌门(Bacteroidetes)、疣微菌门(Verrucomicrobia)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、浮霉菌门(Planctomycetes)的丰度高于矮慈姑系统。
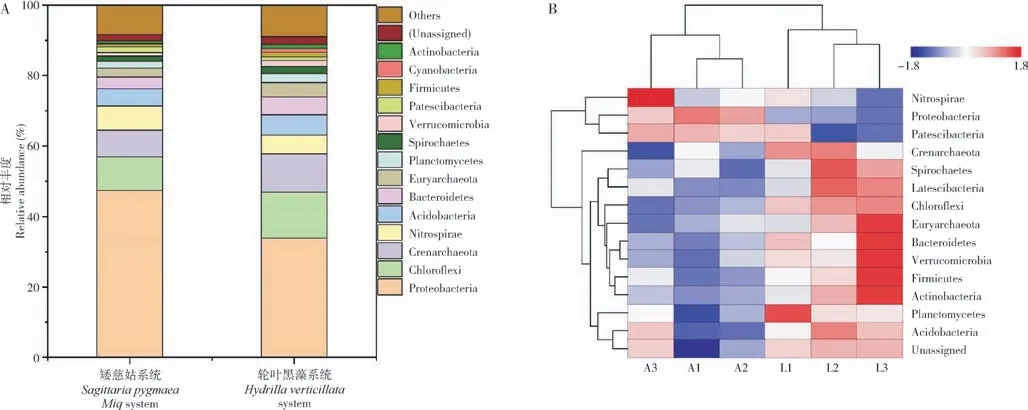
图7 矮慈姑和轮叶黑藻系统门水平上细菌的相对丰度(A)与聚类图(B)Fig.7 Relative abundance(A)and cluster(B)diagram of bacteria at the phylum level of Sagittaria pygmaea Miq and Hydrilla verticillata system
图8 为矮慈姑与 轮叶黑藻系统底泥微生物属水平上的相对丰度。两种沉水植物系统内前5 位的优势属主要为硫曲菌属(Sulfurifustis)、硫碱螺旋菌属(Thioalkalispira)、RBG-16-58-14、硫杆菌属(Thiobacillus)和螺旋体属(Spirochaeta_2)。对属水平上相对丰度前15 的类群进行聚类分析发现,矮慈姑系统中,硫曲菌属(Sulfurifustis)和硝化螺旋菌属(Nitrospira)相对丰度高于轮叶黑藻系统,轮叶黑藻系统中Cyanobium_PCC-6307、螺旋体菌属(Spirochaeta_2)、假平胞菌属(Sphingomonas)和地杆菌属(Geothermobacter)的相对丰度更高。

图8 矮慈姑和轮叶黑藻系统属水平上细菌的相对丰度(A)与聚类图(B)Fig.8 Relative abundance(A)and cluster(B)diagram of bacteria at the genus level of Sagittaria pygmaea Miq and Hydrilla verticillata system
硫曲菌属(Sulfurifustis)、硝化螺旋菌(Nitrospira)是与氮循环相关的硝化反硝化细菌,含有一种特定的酶,通过酶的催化作用,可以迅速将Fe2+氧化成Fe3+,也可以将还原态硫氧化成硫酸或单元素硫,从而获取能量以供自身循环[15]。矮慈姑系统表层底泥中亚铁、AVS 和氨氮浓度大幅下降可能与上述类群的作用有关[16]。而轮叶黑藻系统中丰度更高的螺旋体菌属(Spirochaeta_2)能分化有机营养,具有专性或兼性厌氧菌,大部分存在于活性污泥、污水中。假单胞菌属(Pseudomonas)、假平胞菌属(Sphingomonas)能抵抗多种植物疾病,产生铁吞噬细胞,与铁竞争,能有效促进根际定殖,轮叶黑藻根系不发达却对污染底泥具有一定耐受性的原因可能与上述微生物有关[17]。
3 讨论
不同沉水植物因对光和空间竞争能力的差异而呈现不同的生长发育特点,根据其生长特点将沉水植物分为草甸型和冠层型[18]。其中,草甸型沉水植物具有茎或分枝短、植冠低矮、生长较慢的生物学特征,绝大部分生活在沉积物附近,对光和生存空间具有相对较弱的竞争能力,如轮藻类、苦草、矮慈姑、篦齿眼子菜和微齿眼子菜等物种;相反,冠层型植物具有较长的茎或分枝,植冠高大、生长迅速,可生长到水面附近,对光和空间具有较强的竞争能力,如穗花狐尾藻、轮叶黑藻和金鱼藻等物种[19]。草甸型植物比冠层型植物更有利于维持湖泊的清水稳态。草甸型沉水植物多具有相对稠密的须根,且绝大部分生活在沉积物附近,能有效阻止沉积物向水体释放营养盐,具有显著提升沉积物滞留营养盐的能力[20]。冠层型沉水植物生长较快,其衰败腐烂时会释放大量腐殖质和营养盐进入水体,导致浮游植物快速繁殖,从而引起透明度下降。
矮慈姑和轮叶黑藻系统生物量扩增及占据的空间呈现不同的模式。矮慈姑在水底泥界面上下10 cm 范围内大量扩增生物量,对表层底泥的特性产生明显影响。首先是底泥的悬浮与沉降性能,底泥受到扰动后在上覆水中悬浮分散会促使其中的氮、磷等内源污染物向上覆水迁移[21]。这是底泥中内源污染物向上覆水扩散的主要途径,矮慈姑在水底泥界面的大量发育有利于控制底泥的悬浮,沉降结果也表明,即使受扰动后悬浮也更容易沉降,这可能是根系的大量发育,使得底泥的氧化性增加所致[22]。其次是对底泥中还原性物质的影响,NH+4-N、AVS 和Fe(Ⅱ)3 个还原性物质的大量去除有利于缓解污染底泥对底栖生物的胁迫性,可以促进底栖生物的发育,从而促进水体底栖生态系统的恢复[2,23]。因此,矮慈姑在防控底泥内源污染物和促进底栖生态系统恢复方面具有较好的效果。
轮叶黑藻的生长更侧重对整个上覆水空间的占据,在上覆水中形成密集的冠层,对藻类的生长具有显著影响。浮游藻类主要生长于上覆水表层,轮叶黑藻茎叶的大量发育可以与藻类大量竞争空间和光照。已有研究表明,轮叶黑藻的茎叶可释放酚类化感物质、抑制铜绿微囊藻生长,培养3 d 后可向水中释放含量为0.3%的总酚类化合物(TPC)[24],因此,在本研究轮叶黑藻系统中非暴雨期间,叶绿素a 含量一直低于矮慈姑系统。
总体来看,矮慈姑更有利于底泥内源污染的改善,轮叶黑藻更有利于上覆水中藻类的控制,在富营养化水体修复实践中,沉水植物组合较单一植物更能抵抗磷负荷导致的藻类入侵[13]。单一采用矮慈姑或轮叶黑藻,难以实现底泥污染和藻类控制的双重目标。若两类植物能形成复合群落,则有利于双重目标实现,但也有研究显示,对于底层型沉水植物苦草,轮叶黑藻的生长会对其产生抑制作用,两者难以形成复合群落,共生时轮叶黑藻是否也会抑制矮慈姑生长目前尚不清楚,有待进一步研究。
4 结论
本研究中,矮慈姑和轮叶黑藻对污染底泥均具有生长耐受性,生物量均大量扩增,但扩增生长模式不同。矮慈姑在水底泥界面上下10 cm 范围内大量扩增,即地上地下生物量同步扩增,并可在底泥中形成密集根系层;轮叶黑藻生物量在整个上覆水空间内大量扩增,形成密集的茎叶冠层,根系生物量未增加。
矮慈姑通过根系泌氧、植物吸收和微生物的共同作用,使根系所处的表层底泥中AVS、亚铁和氨氮被大幅去除,去除率分别达80.57%、67.43%和72.48%,显著高于轮叶黑藻系统。轮叶黑藻对底泥中亚铁和氨氮表现出一定的去除作用,但对AVS 的去除无明显效果。
矮慈姑和轮叶黑藻系统表层底泥微生物群落优势属具有一定差异,矮慈系统硫曲菌属(Sulfurifustis)和硝化螺旋菌属(Nitrospira)相对丰度更高,轮叶黑藻系统中Cyanobium_PCC-6307、螺旋体菌属(Spirochaeta_2)、假平胞菌属(Sphingomonas)和地杆菌属(Geothermobacter)的相对丰度更高。
