深旋耕配施有机肥对盐碱地玉米根际土壤细菌群落结构及其功能的影响*
2023-06-29麻仲花刘吉利杨永森胡永琪者永清
麻仲花,刘吉利,吴 娜,杨永森,胡永琪,者永清
深旋耕配施有机肥对盐碱地玉米根际土壤细菌群落结构及其功能的影响*
麻仲花1,刘吉利2, 3**,吴 娜1,杨永森1,胡永琪1,者永清1
(1.宁夏大学农学院,银川 750021;2.宁夏大学生态环境学院,银川 750021;3.西北土地退化与生态恢复国家重点实验室培育基地, 银川 750021)
采用16SrRNA基因高通量测序技术,分析不同耕作方式(A1传统翻耕、A2深旋耕)和有机肥水平(B1:0kg·hm−2、B2:7500kg·hm−2、B3:15000kg·hm−2、B4:22500kg·hm−2)对玉米根际盐碱土壤细菌群落结构的影响,并对其功能进行预测分析。结果表明:(1)深旋耕和增施有机肥两因素交互效应显著提高了土壤Observed指数、Chao1指数、ACE指数及香浓指数(P<0.05)。(2)玉米根际细菌群落主要由变形菌门(37.4%~54.4%)、酸杆菌门(8.6%~12.9%)、放线菌门(5.2%~13.3%)等31个门及497个属的细菌组成,细菌群落分析表明不同耕作方式间细菌群落结构较为相似,各有机肥施用水平间丰度表现出差异性。(3)相关分析表明,土壤pH值与ACE指数、Observed指数及Chao1指数呈极显著负相关(r=−0.56, P=0.004);蔗糖酶(IA)活性与ACE指数、Observed指数及Chao1指数呈显著正相关(r=0.52, P=0.01)。冗余分析发现,碱解氮、有效磷、速效钾、有机质、碱性磷酸酶、蔗糖酶及pH值是影响玉米农田土壤细菌群落结构的关键环境因子。(4)深旋耕配施有机肥明显提高了碳水化合物代谢、氨基酸代谢、其他氨基酸代谢、聚糖生物合成与代谢、辅助因子和维生素的代谢等玉米农田根际土壤细菌信号转导功能基因丰度,以A2B3处理下土壤细菌各功能基因丰度均最高。本研究中,深翻耕和有机肥施用量为15000kg·hm−2处理,对改善玉米农田的细菌多样性和功能最有利。
深旋耕;有机肥;盐碱地;细菌群落结构;玉米
随着经济社会的不断发展,可耕种土地面积逐渐下降,盐碱地作为重要的后备土地资源,对其合理的利用具有十分重要的意义[1]。盐碱土壤是广泛分布的低产土壤类型,土壤的盐渍化使土壤盐分大量积累,并引发一系列农业生产和生态问题[2]。同时,长期浅耕和过量施用化肥,是导致土壤耕层结构退化、盐碱化加重和土壤肥力降低等一系列问题的主要原因[3]。目前,深旋耕和增施有机肥技术是优化土壤耕层质量和提高作物产量的关键措施[4−5]。施有机肥可促进农田生态系统中养分平衡,从而提高耕作土壤肥力,降低土壤盐碱化[4−7]。垂直深旋耕可以疏松土壤、均匀粉碎土粒、有效改善农田微环境,提高土壤的保肥性,增加土壤中的速效养分含量[8]。多项研究表明,土壤速效养分含量、酶活性是土壤耕层环境的重要组成成分和土壤肥力综合特性的体现[9−10]。陈明刚等研究表明,深旋耕和配施有机肥可合理改善作物生育期土壤耕层质量,显著提高土壤酶活性[11−13]。因此,合理耕作和有机肥施用对盐碱地土壤质量提升具有重要作用,其作用效果和机制尚有待深入研究。
根际细菌作为盐碱土壤质量的又一重要影响因子,也是根际微生物群体中最敏感的一部分[14]。根际细菌对保持土壤肥力、作物生长发育和土壤环境的适应起重要作用[15]。根际细菌群落多样性、细菌群落结构和功能特性对维持土壤生态系统的稳定性起关键作用[16]。在盐碱土壤中,细菌多样性指数随着土壤盐碱度的增加而降低,其厚壁菌门、变形菌门属于优势菌门,假单胞菌属于优势菌属[12,17]。粉垄耕作可优化土壤耕层后显著提高了芽单胞菌属、寡养单胞菌属和交替赤杆菌属[18]。合理的增施有机肥可显著提高根际土壤放线菌门、酸杆菌门和变形菌门相对丰度[19]。目前,耕作方式和施有机肥对耕层土壤理化性状、土壤细菌多样性和群落结构方面研究报道较多。与传统耕作施肥相比,深旋耕能有效降低土壤中的有机质矿化分解,促进作物根系的生长,维护细菌群落多样性,增加土壤酶活性,进而提高保墒保肥能力[11−12]。深旋耕处理较传统耕作,可明显降低对土壤的扰动,从而使土壤酶活性、土壤氮磷钾含量、细菌多样性指数及微生物的种类提高。根际土壤细菌群落和土壤酶活性是影响碱解氮、有效磷和速效钾、有机质含量的主要因子[17,19]。蔗糖酶、过氧化氢酶、脲酶及磷酸酶活性又与土壤细菌群落多样性呈显著正相关关系[20]。因此,细菌群落、土壤养分和酶活性三者相辅相成是衡量土壤质量关键因子[18]。但关于深旋耕配施有机肥对作物根际土壤细菌群落结构功能预测方面研究较少,尤其对盐碱土壤细菌的相关研究鲜见报道。为了对盐碱农田土壤细菌群落进行较深入的探究,本研究通过深旋耕配施有机肥对玉米根际土壤细菌进行16SrRNA基因测序,分析群落结构,同时研究土壤环境因子与根际细菌群落结构的关系,并基于KEGG(Kyoto encyclopedia of genes and genomes)数据库对根际土壤细菌进行功能预测,旨为宁夏盐碱地玉米农田合理耕作和有机肥施用提供科学依据。
1 材料与方法
1.1 试验地概况
试验在宁夏大学西大滩盐碱地试验站开展,位于宁夏石嘴山市平罗县前进农场,地理位置为38o50′ N, 106o24′ E。海拔高度1150m,年平均降水量205mm,年蒸发量1875mm,年平均气温9.5℃,属于典型的半干旱大陆性气候。该地区阳光充足,降水稀少,昼夜温差大,该试验地块耕层(0−40cm)有机质含量14.20g·kg−1,碱解氮30.29mg·kg−1,速效磷22.00mg·kg−1,速效钾214.27mg·kg−1,pH值为8.70,全盐含量为3.88g·kg−1,属中度盐碱土壤。
1.2 试验设计
采用裂区试验设计,主区为耕作方式,分别为传统翻耕(A1)和深旋耕(A2),其深度分别为25−30cm、40−45cm;副区为有机肥施用量,设4个水平,分别为0kg·hm−2(B1)、7500kg·hm−2(B2)、15000kg·hm−2(B3)、22500kg·hm−2(B4),共计8个处理,分别为A1B1、A1B2、A1B3、A1B4、A2B1、A2B2、A2B3、A2B4。每个处理重复3次,小区面积48m2。供试玉米品种为先玉1225,种植密度为75000株 hm−2。各处理化肥施用量一致,均为N 300kg·hm−2、P2O5180kg·hm−2及K2O为90kg·hm−2,磷肥、钾肥和有机肥全部基施,50%氮肥基施,50%氮肥在大喇叭口期追施。肥料为尿素(N 46%)、磷酸二铵(N + P2O5≥64%)、硫酸铵钾(K2O 50%),有机肥为羊粪鸡粪混合堆肥(有机质≥35%,总养分≥3%),由某公司生产。除施肥外,其它田间管理同当地玉米生产。4月16日播种,9月22日收获。7月29日开花期取根际土样,每个处理取3个重复,共采集24个样品。
1.3 样品采集
于2021年7月29日玉米开花期随机采集根际土壤样品。采集方法参照Yang等[14]的方法,具体操作为,用75%乙醇喷洒铁铲进行消毒,并于每个处理下,随机选取5株长势一致的玉米植株,以玉米茎为中心挖深度约40cm,形成疏松、环形的根际圈。然后手握植株茎基部用力将整个植株连根带土拔起,抖掉附着在根部的土壤,每5株相同处理所取的根际土壤样品混合为1个生物学土壤重复样本,共进行3次生物学重复,分别标记后装入无菌密封袋放入有冰袋的冰盒带回实验室。
1.4 土壤指标的测定
1.4.1 理化性质
土壤pH采用水土比 2.5∶1提取,pH计测定;EC采用 5∶1水土比提取,电导法测定;有机质采用重铬酸钾容量法测定;碱解氮含量采用碱解扩散法测定;有效磷含量采用碳酸氢钠提取钼蓝比色法测定;速效钾含量采用乙酸铵提取火焰光度计法测定[21]。
1.4.2 酶活性
脲酶活性采用苯酚钠比色法测定、磷酸酶活性采用磷酸苯二钠比色法测定、蔗糖酶活性采用3,5-二硝基水杨酸比色法测定、过氧化氢酶活性采用高锰酸钾滴定法测定[22]。
1.5 土壤样品DNA的提取及高通量测序
DNA抽提PCR扩增:24个土样各取0.5g,根据FastDNA Spin Kit for Soil 试剂盒(美国)说明书进行总DNA抽提,使用NanoDrop2000 分光光度计(美国)检测DNA浓度和纯度,即DNA提取质量利用1%琼脂糖凝胶电泳进行检测,并以提取的土壤微生物DNA为模板,选择338F(5′-ACTCCTACGGGAGGC AGCAG-3′)和806R (5′-GGACTACHVGGGTWTC TAAT-3′)为引物对细菌V3−V4可变区进行PCR扩增。PCR扩增在ABI GeneAmp 9700 (ABI, 美国)上进行。
Illumina Miseq测序:将同一样本的PCR产物混合后使用2%琼脂糖凝胶回收PCR产物,利用AxyPrep DNA Gel Extraction Kit (USA)进行回收产物纯化,2%琼脂糖凝胶电泳检测,并用Quantus Fluorometer (USA)对回收产物进行检测定量。使用NEXTFLEX Rapid DNA−Seq Kit进行建库。利用MiseqPE300平台进行测序。参照陈德乐等[19]的研究方法对测序数据进行处理和分析。
1.6 数据处理
使用QIIME对序列进行优化和数据质控,使用Usearch软件平台对所有序列进行OTU在97%的相似度水平下进行划分,生成OTU表格。采用RDP classifier贝叶斯算法对 97%相似水平的 OTU代表序5列进行分类学分析。使用 Mothur 软件计算细菌α多样性指数,SPSS 25.0软件进行土壤养分、酶活性及细菌α多样性指数等数据的方差分析。运用R软件绘制土壤细菌群落OTUs的花瓣图、土壤细菌优势门相对丰度图、属水平土壤细菌群落结构图及功能热图;采用Pearson相关系数对多样性指数与环境因子进行相关性分析;利用Canoco5.0进行冗余分析。
2 结果与分析
2.1 深旋耕配施有机肥对玉米根际土壤特性的影响
2.1.1 土壤理化性质
由表1可见,在深旋耕和配施有机肥条件下,玉米农田根际土壤化学性质表现出了差异性。传统翻耕条件下,未施用有机肥处理中(即 A1B1),土壤碱解氮(AN)、有效磷(AP)以及有机质(OM)含量均较低,随着有机肥施用量的增加,这些指标均有所增加,与施肥量成正比,但有些处理间差异显著,有些不显著;传统翻耕条件下增施有机肥对土壤理化性质其它指标pH值、EC值以及速效钾(AN)含量的影响不显著。深旋耕条件下,随着有机肥含量的增加,土壤碱解氮(AN)、有效磷(AP)以及有机质(OM)均在A2B4处理下达到最大值,而速效钾(AK)在A2B3处理下达到最大值,但各指标处理间差异显著性不一致。土壤pH值和EC值分别在A2B3和A2B4处理达到最大值,处理间差异不显著。与传统耕作配施有机肥各处理比较,深旋耕配施有机肥各处理间土壤碱解氮(AN)、有效磷(AP)、速效钾(AK)以及有机质(OM)均有所提高,pH值和EC值均有所降低。双因素方差分析结果表明(表1),深旋耕处理显著降低了土壤pH和EC值,显著增加了碱解氮的含量(P<0.05);配施有机肥显著降低了土壤pH值,显著增加了碱解氮、有效磷、速效钾及有机质的含量(P<0.05);深旋耕配施有机肥两因素交互效应显著降低了pH值,提高了碱解氮和有机质含量(P<0.05)。
2.1.2 土壤酶活性
由表2可见,传统翻耕下,碱性磷酸酶活性在A1B3处理下最大,较A1B1显著增加38.3%(P<0.05),蔗糖酶活性A1B3处理达到最大值,较A1B1、A1B2、A1B4分别显著增加93.5%、90.7%、16.7%(P<0.05);脲酶活性A1B3处理达到最大值,较A1B1显著增加55.1%(P<0.05);过氧化氢酶活性A1B3处理达到最大值,但处理间均无显著差异。深旋耕下,磷酸酶活性在A2B3处理达到最大值,较A2B1、A2B2、A2B4分别显著增加93.5%、90.7%、16.7%(P<0.05);蔗糖酶和过氧化氢酶活性分别在A2B3和A2B1处理达到最大值,但2种酶活性在处理间均无显著差异;脲酶活性A2B3活性处理达到最大值,较A2B1和A2B4分别显著增加25.7%、27.3%。双因素方差分析表明(表2),深旋耕处理显著增加了碱性磷酸酶、蔗糖酶和脲酶活性(P<0.05);配施有机肥显著增加了碱性磷酸酶和脲酶活性(P<0.05);深旋耕配施有机肥两因素交互效应显著增加了蔗糖酶和脲酶活性(P<0.05)。

表1 不同处理间玉米根际土壤理化性质的比较
注:小写字母表示处理间在0.05水平上的差异显著性,NS表示差异不显著。*和**分别表示达到0.05、0.01显著水平。AN、AP、AK、OM分别表示碱解氮、有效磷、速效钾、有机质。A表示耕作方式,B表示有机肥水平。下同。
Note:Lowercase indicates the difference significance among treatments at 0.05 level, NS indicates that the difference is not significant.*is P<0.05,**is P<0.01. AN, AP, AK, OM is alkali-hydrolyzable nitrogen, available phosphorus, available potassium, organic matter, respectively. A indicates tillage methods, B indicates organic fertilizer level. The same as below.

表2 不同处理间土壤中各种酶活性比较
注:ALP、IA、UA、HPA分别表示碱性磷酸酶、蔗糖酶、脲酶、过氧化氢酶。
Note : ALP, IA, UA and HPA represent alkaline phosphatase, sucrase, urease and catalase, respectively.
2.2 深旋耕配施有机肥对玉米根际土壤细菌组成的影响
2.2.1 土壤细菌DNA测序分析
依据物种Venn图(图1)分析各处理测得的总OTU数目为10080个,其中各处理共有的OTU数为138个。传统翻耕下特有OTU数目A1B1(647)、A1B2(782)、A1B3(841)、A1B4(1427),OTU数量与样品中的细菌丰度呈正相关,说明传统耕作A1B4处理OTU数目最多;深旋耕下特有OTU数目A2B1(1160)、A2B2(1341)、A2B3(2431)、A2B4(1451),说明深旋耕A2B3处理OTU数目最多。各处理土壤细菌OTU数目综合排名从高到低依次为A2B3> A2B4>A1B4>A2B2>A2B1>A1B3>A1B2>A1B1。
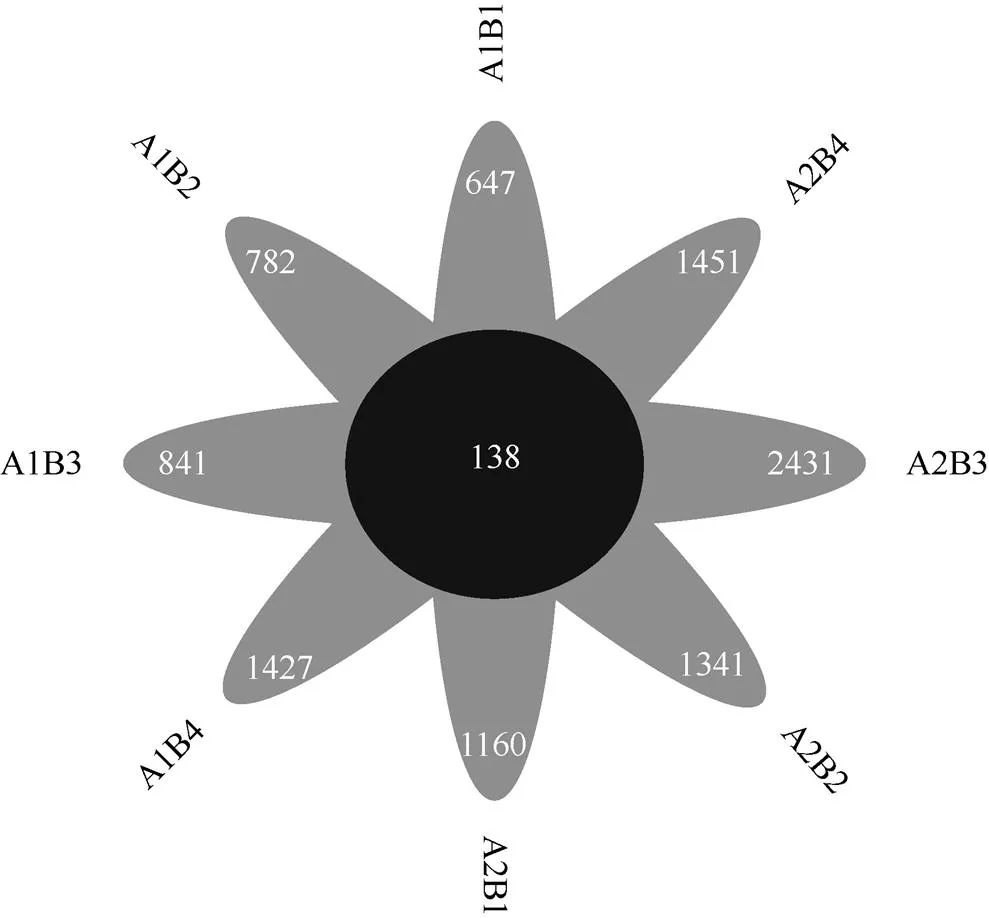
图1 不同处理间玉米农田盐碱土中细菌的OTU数量比较
2.2.2 土壤细菌群落α多样性
由表3可以看出,传统翻耕下,A1B4处理Chao1指数与ACE指数均显著高于A1B1、A1B2(P<0.05),表明传统耕作下AIB4处理细菌落丰富度和多样性最高。深旋耕下,A2B3处理Observed指数、Chao1指数及ACE指数均显著高于A2B1、A2B2、A2B4(P<0.05),表明深旋耕下A2B3处理菌落丰富度和多样性最高。深旋耕配施有机肥两因素交互效应显著增加了Observed指数、Chao1指数、ACE指数及香浓指数(P<0.05)。
2.2.3 土壤细菌群落结构分析
由图2可知,不同耕作各施有机肥处理下,土壤中优势菌门包括变形菌门(Proteobacteria,37.4%~54.4%)、酸杆菌门(Acidobacteriota,8.9%~12.9%)和放线菌门(Actinobacteria,5.2%~13.3%),这3种菌门的总丰度在各处理中共占70%以上。其他相对丰度大于1.5%以上的主要菌门有Microgenomates菌门、绿弯菌门(Chloroflexi)、芽单胞菌门(Gemmatimonadetes)、Unassigned菌门、Candidatus- Saccharibacteria菌门、拟杆菌门(Bacteroidetes)、浮霉菌门(Planctomycetes)和厚壁菌门(Firmicutes)。
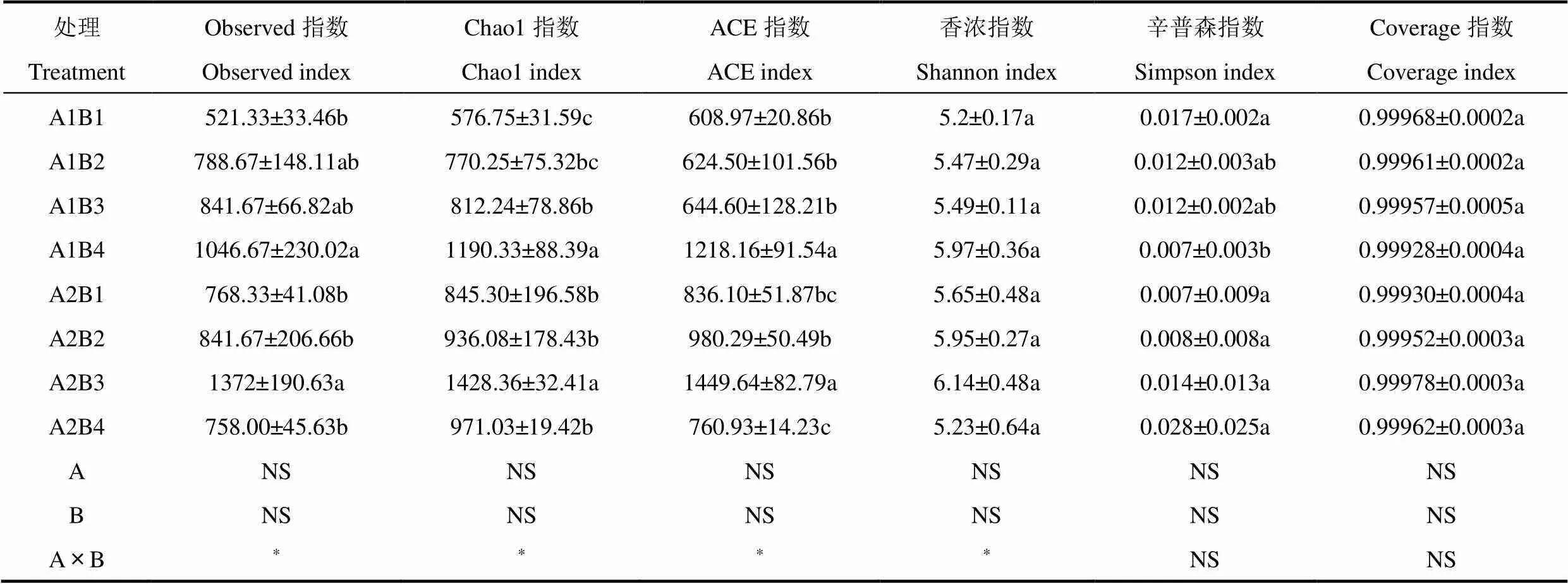
表3 不同处理间的土壤细菌α多样性指数的比较

图2 不同处理间玉米根际土壤细菌门水平相对丰度比较
传统翻耕下,A1B2变形菌门(Proteobacteria)较其他处理相对丰度高11.3%~22.6%;A1B3酸杆菌门(Acidobacteriota)较其他处理间相对丰度高9.6%~35.9%;A1B1放线菌门(Actinobacteria)较其他处理相对丰度高27.2%~78.4%。深旋耕下,A2B3变形菌门(Proteobacteria)较其他处理相对丰度高22.5%~45.3%;A2B2酸杆菌门(Acidobacteriota) 和放线菌门(Actinobacteria)较其他处理相对丰度分别高14.9%~35.8%和4.8%~45.7%。
由图3可见,不同耕作各施有机肥处理下,位于前三位的细菌属水平上的优势菌属为菌属、假单胞菌属()和菌属,在各处理间平均相对丰度分别为12.7%、11.2%和6.6%。其他相对丰度>1%以上的菌属有菌属、芽单胞菌属()、菌属、菌属、寡养单胞菌属()、柯克斯体菌属()、菌属、砂单胞菌属()、交替赤杆菌属()、菌属、沙雷氏菌属()及其他菌属。
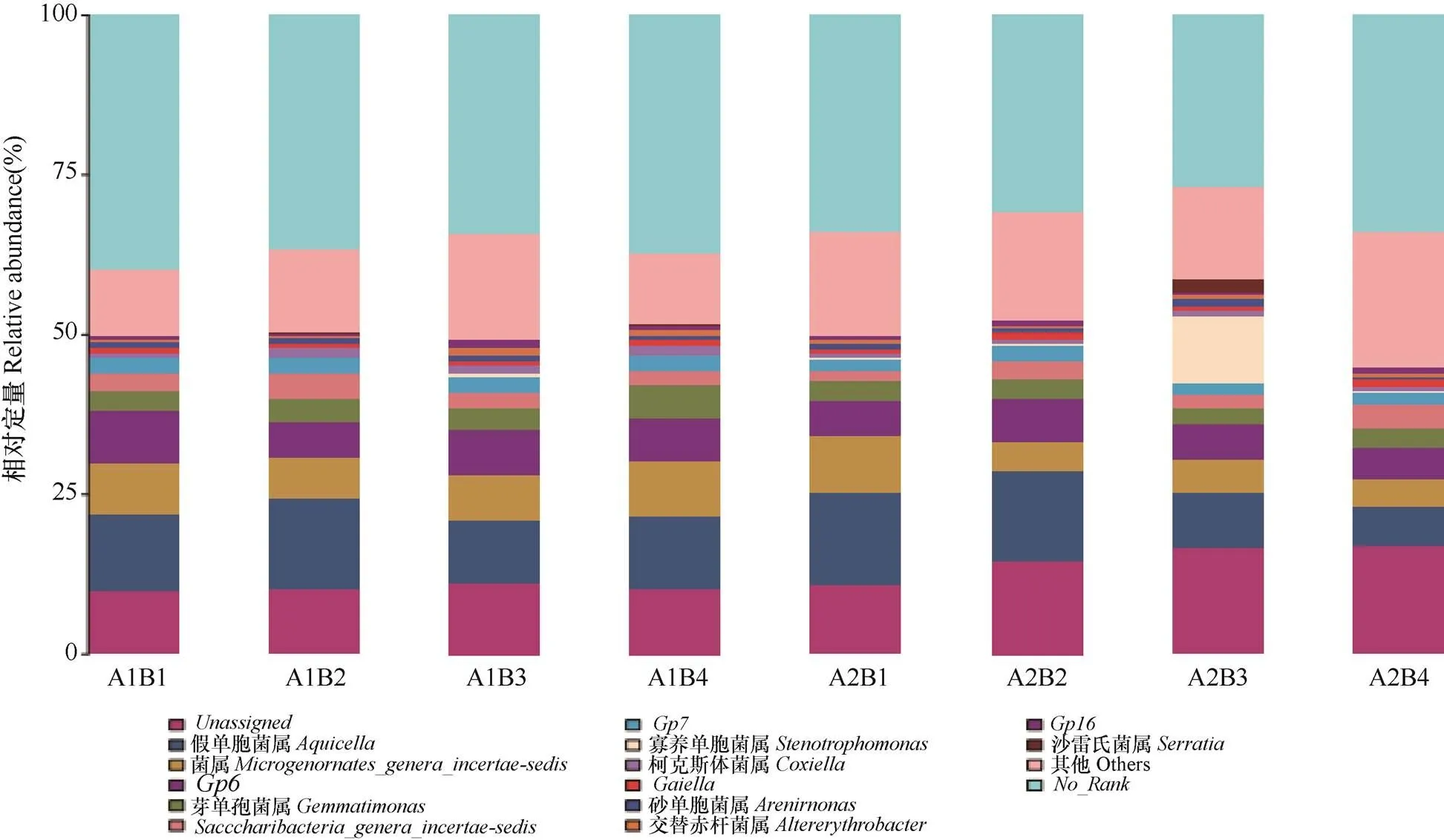
图3 不同处理间玉米根际土壤细菌属水平相对丰度比较
传统翻耕下,A1B3菌属较其他处理间相对丰度高9.6%~13.0%;A1B2假单胞菌属()较其他处理间相对丰度高19.2%~46.4%;A1B4菌属较其他处理间相对丰度高2.2%~30.6%。深旋耕下,A2B4菌属较其他处理间相对丰度高1.5%~55.6%;A2B1假单胞菌属()和菌属较其他处理间相对丰度分别高1.0%~72.8%、70.4%~97.4%。
2.3 土壤细菌群落α多样性与环境因子的关系
由土壤环境因子与根际土壤细菌α多样性之间的相关性可见(图4),pH值与ACE指数、Observed指数及Chao1指数极显著负相关(P<0.01),与Coverage指数显著正相关(P<0.05);AK值与Coverage指数显著负相关(P<0.05);IA值与ACE指数、Chao1指数呈显著正相关(P<0.05),与Observed指数极显著正相关(P<0.01)。
2.4 土壤细菌群落结构与环境因子的关系
为揭示影响土壤细菌群落组成的主导环境因子,以土壤细菌群落属水平已分类且相对丰度大于1.0%的类群为响应变量,以土壤pH值、EC值、AN(碱解氮)、AP(有效磷)、AK(速效钾)、OM(有机质)、ALP(碱性磷酸酶)、IA(蔗糖酶)、UA(脲酶)、HPA(过氧化氢酶)等指标为解释变量进行冗余分析。由图5可见,PC1轴和PC2轴对样本组成差异的贡献值分别为53.8%和13.8%。RDA第一轴与碱解氮、速效钾、有机质、碱性磷酸酶和蔗糖酶呈极显著正相关关系(P<0.01),与有效磷呈显著正相关关系(P<0.05),与pH值呈显著负相关关系(P<0.05)。由表4可知,碱解氮、有效磷、速效钾、有机质、碱性磷酸酶和蔗糖酶是影响玉米农田细菌群落结构的关键环境因子。
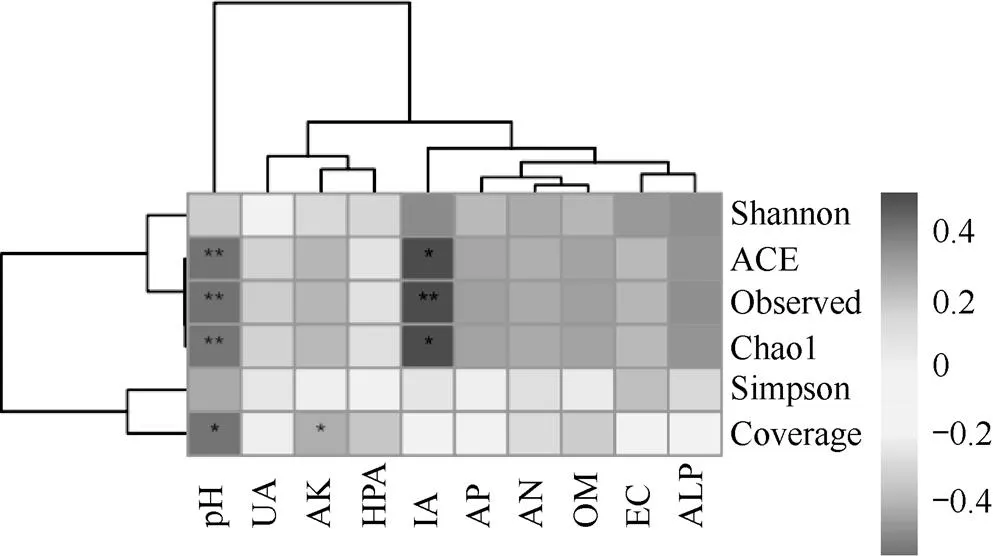
图4 土壤细菌α多样性指数与环境因子的相关性分析
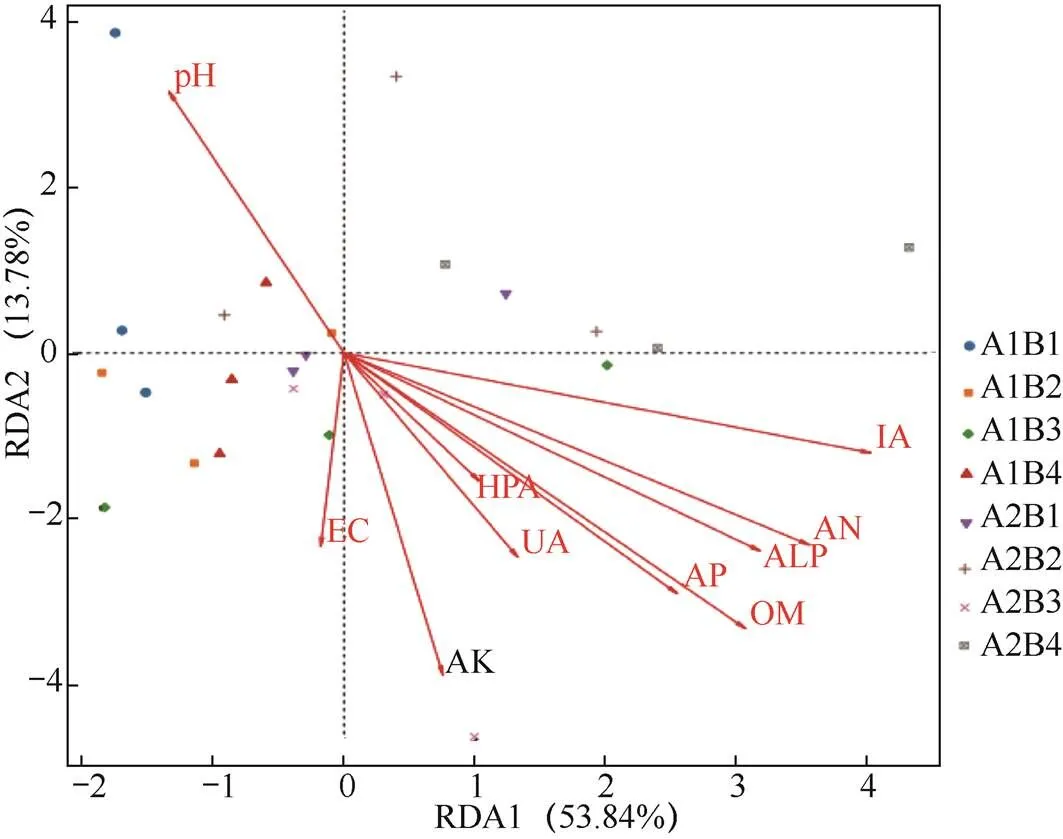
图5 土壤细菌群落与环境因子冗余分析(RDA)
2.5 深旋耕配施有机肥对玉米根际土壤细菌组成的影响及PICRUSt2功能预测
采用PICRUSt2对细菌功能进行预测分析,并基于KEGG数据库进行比对注释。由表5可知,不同处理的玉米根际土壤样品中共含有6类一级生物代谢通路,各功能通路在样本中的丰度从大到小依次为新陈代谢(metabolism)约占81.5%,环境信息处理(environmental information processing)约占9.90%,细胞过程(cellular processes)约占5.9%,遗传信息处理(genetic information processing)约占4.3%,人类疾病(human diseases)约占2.1%及有机系统(organismal systems)约占0.5%。传统翻耕条件下,A1B4处理新陈代谢途径、环境信息处理、遗传信息处理、细胞过程、人类疾病和有机系统最高。深旋耕下,A2B3处理新陈代谢途径、环境信息处理、细胞过程、遗传信息、人类疾病与有机体系统最高。深旋耕增施有机肥两因素交互效应显著提高了新陈代谢、环境信息处理、细胞过程、人类疾病及有机体系统5类一级代谢通路(P<0.05)。
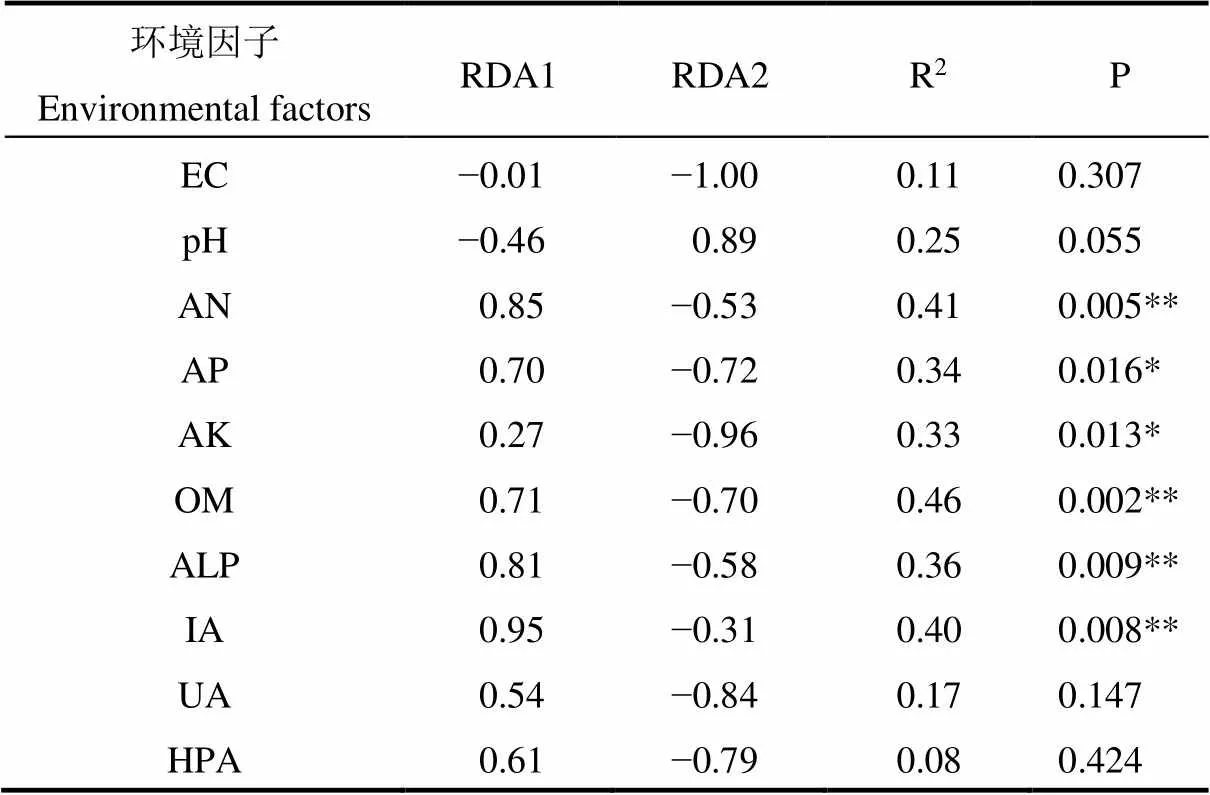
表4 环境因子对玉米农田土壤细菌群落结构的影响
不同处理的玉米根际盐碱土壤样品中含有41类二级代谢通路,筛选出相对丰度大于1.5%的主要功能通路(共有13类)进行比较分析,其中包括细胞过程(1类)、遗传信息处理(3类)和新陈代谢(9类)等一级功能。基于KEGG数据对土壤细菌二级功能层预测,由图6可见,土壤细菌群落二级功能主要由碳水化合物代谢(6.3%~9.5%)、脂质代谢(2.3%~5.5%)、其他次级代谢物的生物合成(4.2%~5.6%)、氨基酸代谢(16.8%~20.4%)、其他氨基酸代谢(1.9%~3.5%)、聚糖生物合成与代谢(3.1%~5.1%)、辅助因子和维生素的代谢(17.2%~20.9%)、能量代谢(3.4%~6.5%)、萜类化合物和聚酮类药物的代谢(9.0%~13.9%)、细胞活力(2.8%~5.1%)、翻译和折叠(2.3%~6.3%)、复制与修复(4.3%~8.3%)、分拣和降解(4.0%~6.4%)等13个主要子功能组成。深旋耕水平和配施有机肥作用下明显提高了碳水化合物代谢、氨基酸代谢、其他氨基酸代谢、聚糖生物合成与代谢、辅助因子和维生素的代谢、能量代谢、萜类化合物和聚酮类药物的代谢、翻译和折叠、复制与修复、分拣和降解等玉米农田根际土壤细菌信号转导功能基因丰度,以A2B3处理下土壤细菌各功能基因丰度均最高。
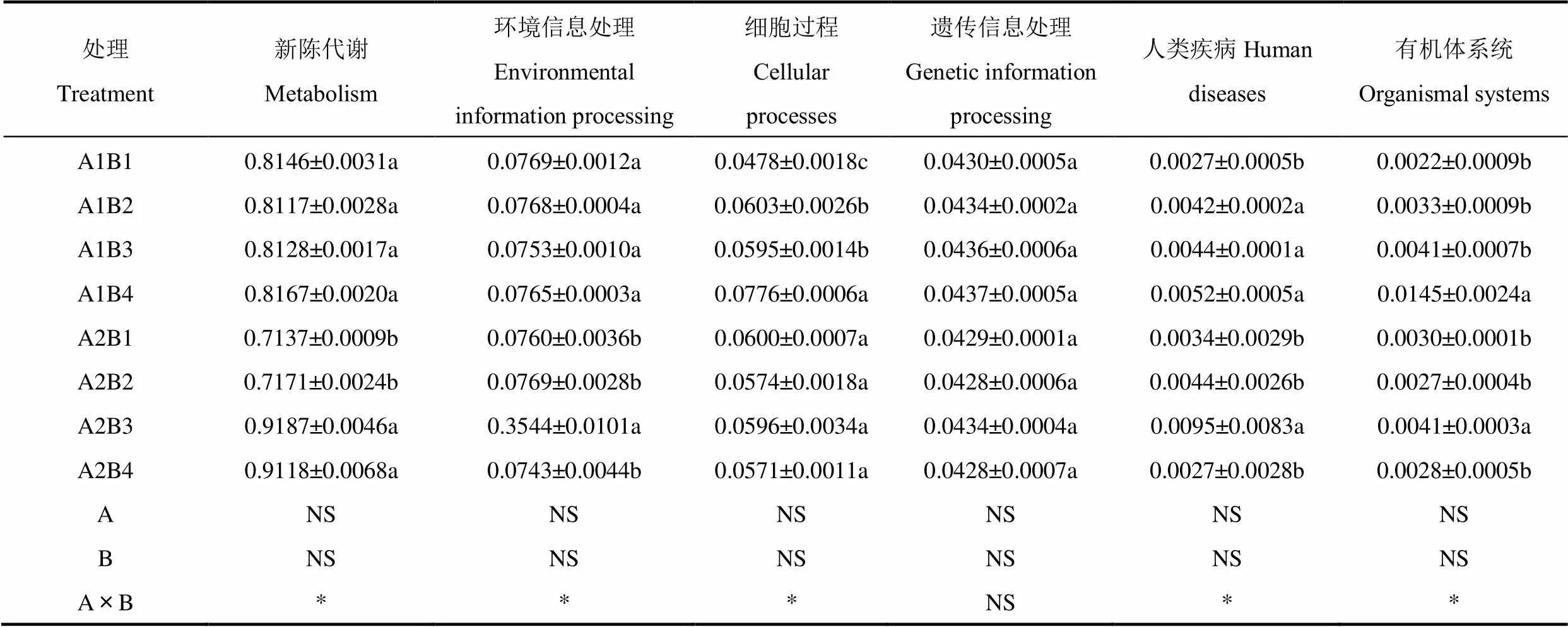
表5 不同处理间土壤细菌群落一级功能代谢通路的比较
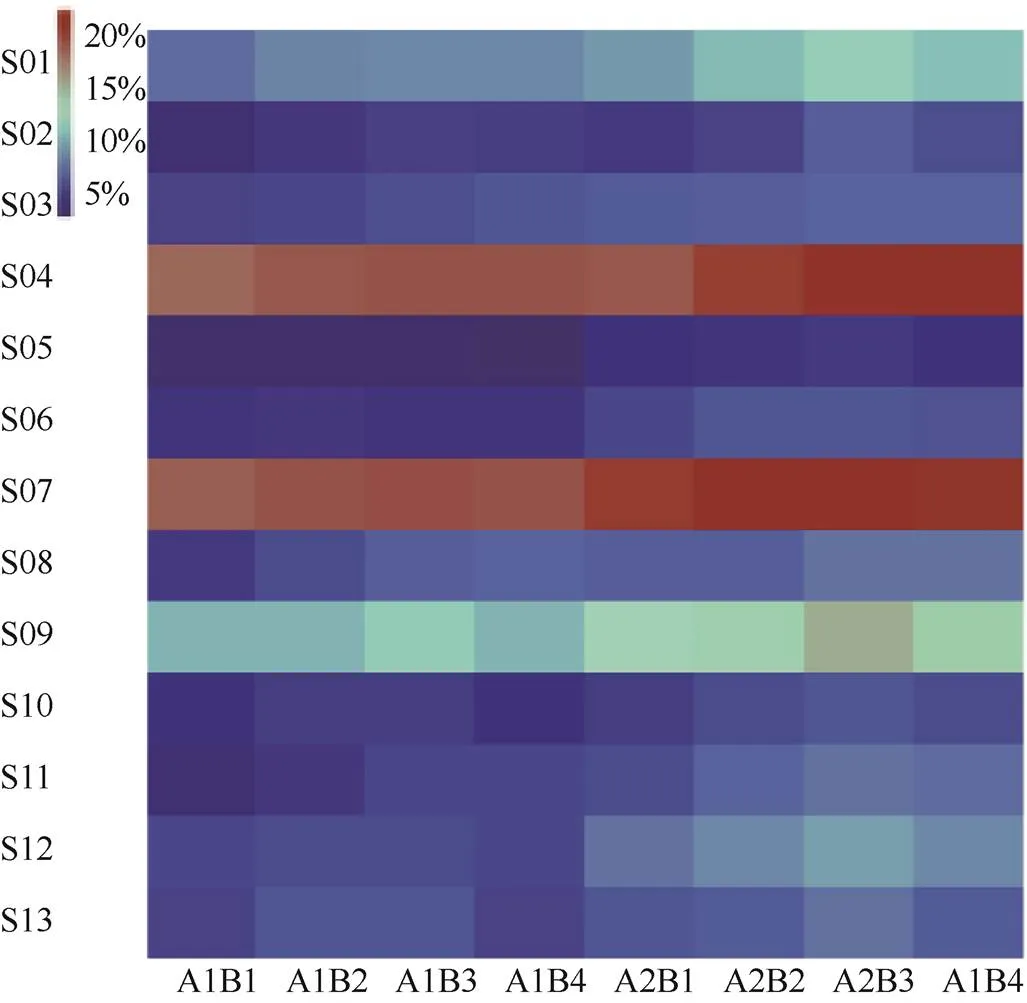
图6 土壤细菌二级功能多样性热图
注 Note:S01碳水化合物代谢Carbohydrate metabolism,S02脂质代谢Lipid metabolism,S03其他次级代谢物的生物合成Biosynthesis of other secondary metabolites,S04氨基酸代谢Amino acid metabolism,S05其他氨基酸代谢Metabolism of other amino acids,S06聚糖生物合成与代谢Glycan biosynthesis and metabolism,S07辅助因子和维生素的代谢Metabolism of cofactors and vitamins,S08能量代谢Energy metabolism,S09萜类化合物和聚酮类药物的代谢Metabolism of terpenoids and polyketides,S10细胞活力Cell motility,S11翻译Translation,S12复制与修复Replication and repair,S13折叠、分拣和降解 Folding, sorting and degradation.
3 讨论与结论
3.1 讨论
3.1.1 深旋耕配施有机肥对玉米根际土壤细菌群落结构的影响
深旋耕和施有机肥均可在一定程度上提高盐碱地玉米根际土壤细菌群落的Observed指数、Chao1指数、ACE指数及香浓指数,但处理间差异不显著,这与岳衡等[24−25]研究结果类似;深旋耕和施有机肥两因素交互效应影响下均显著提高了Observed指数、Chao1指数、ACE指数及香浓指数,说明深旋耕和增施有机肥两因素共同作用能降低盐碱危害,显著提高土壤细菌丰富度和均匀度[22]。一方面,施入生物有机肥虽将细菌带入土壤中,但如果没有良好耕层环境,会使盐碱土壤中细菌丰富度受到影响[26];另一方面,深旋耕虽然能合理优化和改良土壤结构,但盐碱土壤本身比较贫瘠,也会影响细菌群落[27]。而深旋耕和施有机肥两因素交互效应下既能合理改善了土壤结构又能提高土壤养分含量,从而促进了细菌迅速繁殖。因此,深旋耕配施有机肥有利于提高土壤肥力,从而对提高土壤细菌多样性发挥重要的作用[22−23]。
深旋耕配施有机肥在改变农田盐碱土壤细菌群落丰富度的同时,也促进了土壤细菌群落结构发生变化[28]。本研究结果表明,在传统翻耕和深旋耕两种耕作方式下农田盐碱土壤中变形菌门、酸杆菌门、放线菌门等细菌均为主要优势菌群没有发生变化,这可能是由于两种耕作方式下土壤细菌群落组成较为相近[29−30];而不同有机肥施用水平使得细菌群落丰度产生差异,这可能是因为群落结构主要受有机肥的影响较显著。相似地,Zhang等[31−32]研究结果也显示配施有机肥能够提高土壤中变形菌门、放线菌门和酸杆菌门的相对丰度。变形菌门作为盐碱土壤的优势菌门,可缓解因盐分的抑制而造成的土壤养分含量降低[33],酸杆菌门具有促进土壤能量循环的作用,进而有利于土壤酶活性的提高[34],放线菌门也是一类非常喜微碱环境的菌类,可减轻土壤盐害[35]。在属水平上,菌属、假单胞菌属、菌属相对丰度较大。多项研究表明,这些菌属具有促进碱解氮、有效磷含量的累积及有机质含量的提高,同时还具有优化根际土壤的作用[25,36−37]。此外,玉米根系发达,大量根系分泌物可能刺激根际微域中菌群及其相互作用,共同改变土壤理化性质并重塑了根际的细菌群落结构[38]。说明深旋耕和施有机肥共同作用可有效地降低土壤盐碱,增加土壤养分,从而优化细菌群落结构。
3.1.2 环境因子与根际盐碱土壤微生物群落结构的关系
农田环境因子对土壤细菌群落具有促进作用,也是土壤微生物群落组成的重要影响因素[39]。多项研究充分证实,土壤细菌多样性受土壤理化性质的影响显著[19,40],本研究中,pH值与ACE指数、Observed指数及Chao1指数极显著负相关,蔗糖酶(IA)活性与Observed指数、ACE指数、Chao1指数呈显著正相关,表明高pH值会对玉米农田土壤细菌群落多样性产生一定的影响,而蔗糖酶有助于促进细菌群落多样性增加。Coverage指数与pH值呈显著正相关,与速效钾呈显著负相关,这主要是土壤盐碱虽得到了缓解,但由于土壤本身条件较贫瘠,使养分分布不均等所致,这与杨鑫等[22]研究结果一致。同时也印证了土壤理化性质和酶活性是影响根际土壤细菌群落分布的关键因素[20]。利用冗余分析农田土壤细菌信息,直观地展现出土壤环境因子对土壤细菌群落结构特征的影响,表明碱解氮、有效磷、速效钾、有机质、碱性磷酸酶、蔗糖酶及pH值是改善玉米农田细菌群落结构的关键环境因子。同时也印证了深旋耕和增施有机肥的交互效应影响下,在一定程度上缓解了土壤盐碱危害,使土壤养分含量与细菌群落结构呈现正比关系[17]。此外还验证了土壤细菌群落结构组成和土壤理化性质及酶活性变化可反映土壤质量情况,土壤化学性状和酶活性的改变均会影响细菌群落结构和功能[39]。因此,深旋耕配施有机肥有助于改善盐碱地土壤环境因子,从而优化玉米根际土壤细菌群落结构。
3.1.3 深旋耕配施有机肥对玉米根际盐碱土壤细菌群落PICRUSt2功能的影响
细菌群落功能预测表明,一级功能中新陈代谢相对丰度最高,表明新陈代谢通路是玉米农田细菌群落的主要功能,这与丁钰珮等[41]的研究结果一致。耕作方式和有机肥施用单一因素对土壤细菌群落新陈代谢功能影响不显著,但两者交互作用对新陈代谢功能影响显著,尤其以A2B3处理最突出。这主要是因为盐碱地土壤结构不良且养分贫瘠,只有在两因素交互效应的影响下才能缓解这一问题。本研究中主要的二级功能代谢通路有13类,主要是氨基酸、辅助因子和维生素以及碳水化合物的代谢,其次是能量代谢与萜类化合物和聚酮类药物的代谢。碳水化合物代谢对土壤中速效氮、有效磷含量积累起促进作用[28],氨基酸代谢对土壤细菌生存繁殖起到重要作用[28],能量代谢、辅助因子和维生素代谢、萜类化合物和聚酮类药物功能都与细菌群落结构的丰富度有着紧密联系[42]。此外,深旋耕配施有机肥处理的各二级代谢通路高于传统耕作配施有机肥处理,这与一级功能代谢通路相似。说明深旋耕和增施有机肥两因素交互效应对盐碱土壤细菌群落二级功能代谢中也有较大的贡献率。本研究表明PICRUSt2功能预测能清晰分析盐碱土壤细菌群落的功能,但其预测范围基于数据库有一定局限性[28,43−44],未来可以与宏基因组技术结合,进一步揭示深旋耕配施有机肥技术对细菌群落功能的影响机制。
3.2 结论
与传统耕作施有机肥方式相比,深旋耕配施有机肥降低了玉米根际土壤EC和pH值,提高了土壤养分含量和酶活性。深旋耕配施有机肥提高了盐碱地玉米根际土壤细菌多样性,优化了细菌群落结构,变形菌门、酸杆菌门、放线菌门成为玉米农田根际盐碱土壤主要的优势菌门,总丰度在各处理中均占到70%以上。深旋耕配施有机肥量15000kg·hm−2处理能够显著增加土壤细菌各功能基因丰度,主要提高了新陈代谢等5类一级功能和碳水化合物等13类二级功能。
[1] 王国丽,常芳弟,张宏媛,等.河套灌区不同秋浇年限对土壤细菌群落的影响[J].中国农业科学,2019,52(19): 3380-3392.
Wang G L,Chang F D,Zhang H Y,et al.Effects of different autumn irrigation years on soil bacterial communities in Hetao irrigation area[J].Scientia Agricultura Sinica,2019, 52(19):3380-3392.(in Chinese)
[2] 信志红,慈敦伟,张洪卫,等.黄河三角洲盐碱地花生高产最佳播种期探究[J].中国农业气象,2021,42(2):134-145.
Xin Z H,Ci D W,Zhang H W,et al.Study on the best sowing date of high yield peanut in saline-alkali land of Yellow River Delta[J].Chinese Journal of Agrometeorology,2021, 42(2): 134-145.(in Chinese)
[3] Guo J H,Liu X J,Zhang Y,et al.Significant acidification in major Chinese croplands[J].Science,2010,327:1008-1010.
[4] Zhong W H,Cai Z C.Long-term effects of inorganic fertilizers on microbial byiomass and community functional diversity in a paddy soil derived from quaternaryred clay[J].Applied Soil Ecology,2007,36:84-91.
[5] Fischer G,Winiwarter W,Ermolieva T.Integrated modeling framework for assessment and mitigation of nitrogen pollution from agriculture: Concept and case study for China[J].Agriculture, Ecosystems and Environment,2010, 136(1/2):116-124.
[6] Velthof G L,Oudendag D,Witzke H P.Integrated assessment of nitrogen emissions from agriculture in EU-27 using MITERRA-Europe[J].Journal of Environmental Quality, 2009,38:402-417.
[7] Guo J H,Liu X J,Zhang Y,et al.Significant acidification in major Chinese croplands[J].Science,2010,327:1008-1010.
[8] 邓永晟,张敏,李伟,等.垂直深旋耕对植烟土壤理化性状和烤烟生长的影响[J].中国烟草科学,2020,41(6):30-36.
Deng Y S,Zhang M,Li W,et al.The effect of vertical deep rotary tillage on soil physical and chemical properties and flue-cured tobacco growth[J].Chinese Tobacco Science, 2020,41(6):30-36.(in Chinese)
[9] Johnston A E,Poulton P R,Coleman K.Soil organic matter:Its importance in sustainable agriculture and carbon dioxide fluxes[J]. Advances in Agronomy,2009,101:1-57.
[10] 赵晓红,张国良,宋振,等.刺萼龙葵入侵对不同类型土壤特性的影响[J].中国农业气象,2017,38(2):76-87.
Zhao X H,Zhang G L,Song Z,et al.Effects ofinvasion on different types of soil characteristics[J]. Chinese Journal of Agrometeorology,2017,38(2):76-87.(in Chinese)
[11] 陈明刚,向剑明,刘勇军,等.垂直深旋耕配施有机碳肥对植烟土壤pH和物理性状及养分的影响[J].作物研究, 2020,34(4):349-353.
Chen M G,Xiang J M,Liu Y J,et al.Effects of vertical deep rotary tillage combined with organic carbon fertilizer on soil pH,physical properties and nutrients [J].Crop Research,2020,34(4):349-353.(in Chinese)
[12] Karmaker R,Das I,Dutta D,et al.Potential effects of climate change on soil properties: a review[J].Science International Journal,2016,4(2):51-73.
[13] 李巧珍,丁军军,李玉中,等.种衣剂和起垄栽培对玉米生长和产量的影响[J].中国农业气象,2018,39(8):512-517.
Li Q Z,Ding J J,Li Y Z,et al.Effects of seed coating and ridging on maize growth and yield[J].Chinese Journal of Agrometeorology,2018,39(8):512-517.(in Chinese)
[14] Yang S D,Xiao J,Liang T,et al. Response of soil biological properties and bacterial diversity to different levels of nitrogen application in sugarcane fields[J].AMB Express, 2021,11:172.
[15] Wang H,Wang S L,Wang R,et al.Conservation tillage increased soil bacterial diversity and improved soil nutrient status on the Loess Plateau in China[J].Archives of Agronomy and Soil Science,2020,66(11):1509-1519.
[16] Li C,Liu X,Meng M J,et al.The use of Biolog Eco- microplates to compare the effects of sulfuric and nitric acid rain on the metabolic functions of soil microbial communities in a subtropical plantation within the Yangtze River Delta region[J].Catena,2021,198:105039.
[17] 葛东颖,仇港,赵楠,等.盐渍藠头盐水细菌多样性及基因功能预测分析[J].中国酿造,2022,39(10):157-161.
Ge D Y,Qiu G,Zhao N,et al.The prediction analysis of bacterial diversity and gene function in saline water of[J].China Brewing,2022,39(10):157-161. (in Chinese)
[18] 刘洪,韦本辉,党柯柯,等.粉垄耕作对甘蔗土壤微生物群落的影响[J].热带作物学报,2022,43(3):597-605.
Liu H,Wei B H,Dang K K,et al.Effect of flour ridge cultivation on soil microbial community of sugarcane[J]. Chinese Journal of Tropical Crops,2022,43(3):597-605.(in Chinese)
[19] 陈德乐,王兴祥,张亚楠,等.持续施用生物有机肥对花生产量和根际细菌群落的影响[J].土壤,2021,53(3):537-544.
Chen D L,Wang X X,Zhang Y N,et al.Effects of continuous application of bio-organic fertilizer on peanut yield and rhizosphere bacterial community[J].Soils,2021,53(3):537- 544.(in Chinese)
[20] 张雪丽,董文怡,刘勤,等.有机肥替代化肥氮对水稻田面水和土壤中氮素含量的影响[J].中国农业气象,2018, 39(4):256-266.
Zhang X L,Dong W Y,Liu Q,et al.Effects of organic manure replacing chemical fertilizer nitrogen on nitrogen content in surface water and soil of paddy fields[J].Chinese Journal of Agrometeorology,2018,39(4):256-266.(in Chinese)
[21] Sun L,Li J,Wang Q,et al.The effects of eight years of conservation tillage on the soil physicochemical properties and bacterial communities in a rain-fed agroecosystem of the Loess Plateau,China[J].Land Degradation & Development, 2020,31(16):2475-2489.
[22] 杨鑫,樊吴静,唐洲萍,等.不同覆盖栽培对马铃薯根际土壤细菌多样性、酶活性及化学性状的影响[J].核农学报, 2021,35(9):2145-2153.
Yang X,Fan W J,Tang Z P,et al.Effects of different mulching cultivation on bacterial diversity,enzyme activity and chemical properties of potato rhizosphere soil[J]. Journal of Nuclear Agricultural Sciences,2021,35(9): 2145- 2153.(in Chinese)
[23] 丁新景,敬如岩,黄雅丽,等.基于高通量测序的4种不同树种人工林根际土壤细菌结构及多样性[J].林业科学,2018, 54(1):81-89.
Ding X J,Jing R Y,Huang Y L,et al.Bacterial structure and diversity of rhizosphere soil of four different tree species plantations in high-throughput sequencing[J].Scientia Silvae Sinicae,2018,54(1):81-89.(in Chinese)
[24] 岳衡,李闪闪,段雅欣,等.深松耕对宁南山区马铃薯田土壤细菌多样性的影响[J].中国农业气象,2021,42(12): 998-1008.
Yue H,Li S S,Duan Y X,et al.Effects of subsoiling tillage on soil bacterial diversity in potato fields in southern Ningxia[J].Chinese Journal of Agrometeorology,2021,42 (12):998-1008.(in Chinese)
[25] 钱远超,何久兴,孔梦,等.寡糖对土壤微生物多样性及群落结构的调节作用[J].中国农业气象,2022,43(6):464-473.
Qian Y C,He J X,Kong M,et al.Regulatory effects of oligosaccharides on soil microbial diversity and community structure[J].Chinese Journal of Agrometeorology,2022, 43(6): 464-473.(in Chinese)
[26] 赵文超.有机肥施用对烟田土壤细菌多态性的影响[D].泰安:山东农业大学,2016.
Zhao W C.Effect of organic fertilizer application on bacterial polymorphism in tobacco field soil[D].Tai’an: Shandong Agricultural University,2016.(in Chinese)
[27] 邓超超,李玲玲,谢军红,等.耕作措施对陇中旱农区土壤细菌群落的影响[J].土壤学报,2019,56(1):207-216.
Deng C C,Li L L,Xie J H,et al.Effects of tillage measures on soil bacterial communities in dry farming areas in central Gansu[J].Acta Pedologica Sinica,2019,56(1):207- 216.(in Chinese)
[28] 南镇武,刘柱,代红翠.不同轮作休耕下潮土细菌群落结构特征[J].环境科学,2021,42(1):4977-4987.
Nan Z W,Liu Z,Dai H C.Characteristics of bacterial community structure in fluvo-aquic soil under different rotation fallow[J].Environmental Science,2021,42(1):4977- 4987.(in Chinese)
[29] 梁悦萍,李科江,张俊鹏,等.咸水灌溉棉田休耕期土壤胞外酶活性和微生物多样性研究[J].农业环境科学学报, 2018,37(4):732-740.
Liang Y P,Li K J,Zhang J P,et al.Study on soil extracellular enzyme activity and microbial diversity in fallow period of saline water irrigated cotton fields[J].Journal of Agro- Environment Science,2018,37(4):732-740.(in Chinese)
[30] 王娟娟,朱紫娟,钱晓晴,等.减施化肥与不同有机肥配施对稻季土壤细菌群落结构的影响[J].土壤,2021,53(5): 983-990.
Wang J J,Zhu Z J,Qian X Q,et al.Effects of reduced application of chemical fertilizers and different organic fertilizers on the structure of soil bacterial community in rice season[J].Soils,2021,53(5):983-990.(in Chinese)
[31] Zhang L C,Li J,Zhang M Q.Effect of rice-rice-rape rotation on physicochemical property and bacterial community of rhizosphere soil[J].Oil Crop Science,2020,5(3):149-155.
[32] Zhang M L,Zhang M H,Zhang C H, et al.Pattern extraction of structural responses of gut microbiota to rotavirus infection via multivariate statistical analysis of clone library data[J].Fems Microbiology Ecology,2009,70(2):21- 29.
[33] 徐慧敏,闫海,马松,等.鞘氨醇单胞菌USTB-05对微囊藻毒素的生物降解[J].中国环境科学,2014,34(5):1316-1321.
Xu H M,Yan H,Ma S,et al.Biodegradation of microcystins by sphingomonas USTB-05[J].China Environmental Science, 2014,34(5): 1316-1321.(in Chinese)
[34] 何宇,吕卫光,郑宪清,等.菜田种养结合模式下施肥方式对土壤编码碱性磷酸酶基因微生物群落的影响[J].中国农业气象,2022,43(7):538-550.
He Y,Lv W G,Zheng X Q,et al.Effects of fertilization methods on soil microbial communities encoding alkaline phosphatase genes under planting-breeding system in vegetable fields[J].Chinese Journal of Agrometeorology, 2022,43(7):538-550.(in Chinese)
[35] 吴宪,王蕊,胡菏,等.潮土细菌及真菌群落对化肥减量配施有机肥和秸秆的响应[J].环境科学,2020,41(10):4669- 4681.
Wu X,Wang R,Hu H,et al.Response of bacterial and fungal communities in fluvo-aquic soil to reduced application of organic fertilizer and straw[J].Environmental Science,2020, 41(10):4669-4681.(in Chinese)
[36] 黄荣,姚博,王晓芬,等.CQ10-LPSP对紫花苜蓿幼苗内生细菌多样性及其根瘤菌的影响[J].草地学报,2021(10): 2126-2134.
Huang R,Yao B,Wang X F,et al.Effects of CQ10-LPSP on the diversity of endophytic bacteria and rhizobia in alfalfa seedlings[J].Acta Agrestia Sinica,2021(10):2126-2134.(in Chinese)
[37] 刘卜榕,徐秋芳,秦华,等.亚热带四种主要植被类型土壤细菌群落结构分析[J].土壤学报,2012,49(6):1185-1193.
Liu P R,Xu Q F,Qin H,et al.Analysis of soil bacterial community structure of four main subtropical vegetation types[J].Acta Pedologica Sinica,2012,49(6):1185-1193.(in Chinese)
[38] Gao S,Liang J D,Teng T T,et al.Petroleum contamination evaluation and bacterial community distribution in a historic oilfield located in Loess Plateau in China[J]. Applied Soil Ecology,2019,136:30-42.
[39] Hassan E,Dinesh K.Maheshwari.Use of plant growth promoting rhizobacteria(PGPRs)with multiple plant growth promoting traits in stress agriculture:action mechanisms and future prospects[J].Ecotoxicology and Environmental Safety,2018,156:225-246.
[40] 闫冰,付嘉琦,夏嵩,等.厌氧氨氧化启动过程细菌群落多样性及PICRUSt2功能预测分析[J].环境科学,2021,42(8): 3875-3885.
Yan B,Fu J Q,Xia S,et al.Prediction and analysis of bacterial community diversity and PICRUSt2 function during the start-up process of anammox[J].Environmental Science,2021,42(8):3875-3885.(in Chinese)
[41] 丁钰珮,杜宇佳,高广磊,等.呼伦贝尔沙地樟子松人工林土壤细菌群落结构与功能预测[J].生态学报,2021,41(10): 4131-4139.
Ding Y P,Du Y J,Gao G L,et al.Prediction of soil bacterial community structure and function ofvar.plantation in Hulunbeier sandy land[J].Acta Ecologica Sinica,2021,41(10):4131-4139.(in Chinese)
[42] 马欣,罗珠珠,张耀全,等.黄土高原雨养区不同种植年限紫花苜蓿土壤细菌群落特征与生态功能预测[J].草业学报,2021,30(3):54-67.
Ma X,Luo Z Z,Zhang Y Q,et al.Soil bacterial community characteristics and ecological function prediction of alfalfa in different planting years in rain-fed areas of the Loess Plateau[J].Acta Prataculturae Sinica,2021,30(3):54-67.(in Chinese)
[43] Bahram M,Hildebrand F,Forslund S K,et al.Structure and function of the global topsoil microbiome[J].Nature,2018, 560(7717):233-237.
[44] Romaniuk R,Giuffré L,Costantini A,et al.Assessment of soil microbial diversity measurements as indicators of soil functioning in organic and conventional horticulture systems[J].Ecological Indicators,2011,11(5):1345-1353.
Effects of Deep Rotary Tillage Combined with Organic Fertilizer on Bacterial Community Structure and Function of Maize Rhizosphere Soil in Saline Alkali Land
MA Zhong-hua1,LIU Ji-li2,3,WU Na1,YANG Yong-sen1,HU Yong-qi1,ZHE Yong-qing1
(1.College of Agriculture, Ningxia University, Yinchuan 750021, China; 2.Institute of Environmental Engineering, Ningxia University, Yinchuan 750021; 3.National Key Laboratory for Land Degradation and Ecological Restoration in Northwest China, Yinchuan 750021)
The 16 SrRNA gene high-throughput sequencing technology was used to analyze the effects of different tillage methods (A1 traditional tillage, A2 deep rotary tillage) and organic fertilizer levels (B1: 0kg·ha−1, B2: 7500 kg·ha−1, B3: 15000kg·ha−1, B4: 22500kg·ha−1) on the bacterial community structure of maize rhizosphere saline alkali soil, and predict their functions. The results showed that: (1) the interaction effect of deep rotary tillage and organic fertilizer application significantly increased the observed index, Chao1 index, ACE index and aromatic index(P<0.05). (2)The bacterial community in maize rhizosphere was mainly composed of 31 phyla and 497 genera, including Proteobacteria(37.4%−54.4%), Acidobacteria(8.6%−2.9%), Actinobacteria(5.2%−13.3%). The analysis of bacterial community showed that the bacterial community structure was similar among different tillage methods, and the abundance of bacteria was different among organic fertilizer application levels. (3)The correlation analysis showed that the soil pH value was significantly negatively correlated with ACE index, Observed index and Chao1 index(r=−0.56, P=0.004); The activity of invertase (IA) was positively correlated with ACE index, Observed index and Chao1 index(r=0.52, P=0.01). Redundancy analysis showed that alkali hydrolyzed nitrogen, available phosphorus, available potassium, organic matter, alkaline phosphatase, sucrase and pH value were the key environmental factors affecting the bacterial community structure of corn farmland soil. (4)Deep rotary tillage combined with organic fertilizer significantly increased the gene abundance of bacterial signal transduction function in the rhizosphere soil of maize fields, such as carbohydrate metabolism, amino acid metabolism, other amino acid metabolism, carbohydrate biosynthesis and metabolism, cofactor and vitamin metabolism. The functional gene abundance of soil bacteria was the highest under A2B3 treatment. In this study, the treatment of deep tillage and organic fertilizer application rate of 15000kg·ha−1was the most beneficial ways to improve the bacterial diversity and function of corn farmland.
Deep rotary tillage; Organic fertilizer; Saline-alkali land; Bacterial community structure; Corn
10.3969/j.issn.1000-6362.2023.06.003
麻仲花,刘吉利,吴娜,等.深旋耕配施有机肥对盐碱地玉米根际土壤细菌群落结构及功能的影响[J].中国农业气象,2023,44(6):479-491
2022−07−21
国家重点研发计划课题(2021YFD1900603)
刘吉利,研究员,主要从事盐碱地改良与作物生理生态研究,E-mail:tim11082003@163.com
麻仲花,E-mail:2504075822@qq.com
