胎儿体内SaCas9蛋白抗体的研究
2023-06-28化春晓薛淑文郭依琳杨宇霞孔祥东
化春晓 薛淑文 郭依琳 杨宇霞 孔祥东
遗传病是指由遗传物质结构或功能改变所引起的疾病。目前临床上遗传病主要通过替代疗法、饮食药物干预、手术矫正、器官移植等方法减轻患者症状,但并未从根本上解决问题,因此大部分严重遗传性疾病的最终有害结局不能改变。基因编辑技术的出现为遗传病的治疗带来了希望。近年来,成簇规律的间隔短回文重复相关蛋白[clustered regularly interspaced short palindromic repeats (CRISPR)/CRISPR-associated proteins,CRISPR/Cas]基因编辑技术发展非常迅速,目前已应用于多种人类疾病治疗的临床试验中,如HIV、遗传病及肿瘤的治疗等[1]。
CRISPR/Cas系统根据Cas蛋白的不同可分为3种类型,其中Ⅰ型和Ⅲ型依靠多个效应蛋白共同发挥作用,Ⅱ型仅需单一效应蛋白。其中Cas9蛋白与CRISPR组成的CRISPR/Cas9 Ⅱ型基因编辑系统应用最为广泛[2]。Cas9蛋白具有多种同源物,其中最常用的是来自化脓性链球菌的Cas9 (streptococcus pyogenes Cas9,SpCas9) 和来自金葡球菌的Cas9 (staphylococcus aureus Cas9,SaCas9)。由于SaCas9蛋白的体积较小,可以克服腺相关病毒(adeno-associated virus,AAV)载体插入大小的限制,更易包装成AAV载体,故SaCas9蛋白主要用于体内基因编辑[3]。然而,与所有的新技术一样,CRISPR/Cas9基因编辑技术也面临着巨大挑战。临床应用面临的主要问题包括基因编辑的特异性和准确性、CRISPR/Cas9系统的免疫原性和基因编辑的长期有效性等。
既往研究发现,在正常成人体内预先存在对Cas9蛋白的体液免疫反应,因此CRISPR/Cas9基因编辑技术在成人体内应用可能会产生免疫反应,从而影响基因治疗的效果[4,5]。但关于胎儿体内SaCas9蛋白抗体的研究情况较少,本研究通过检测孕妇血清、羊水、胎儿脐带血样本中是否存在SaCas9蛋白抗体,观察成人及胎儿体内针对SaCas9蛋白的特异性体液免疫情况,从而研究更为合适的遗传病治疗方法。
对象与方法
1.研究对象:本研究为回顾性研究,随机选取2020年11月1日~12月20日于郑州大学第一附属医院产前诊断中心就诊的75例孕妇的产前筛查或诊断样本,其中孕妇血清42例,羊水23例,胎儿脐带血10例。所有孕妇均为健康个体且产前筛查或诊断结果正常,采血前未使用过血液制品、皮质激素和免疫制剂等,也无急慢性感染或肿瘤等疾患。所有孕妇均签署知情同意书,本研究经郑州大学第一附属医院医学伦理学委员会审核通过(伦理学审批号:KS-2018-KY-36)。
2.样本收集与处理:取孕妇外周血和胎儿脐带血各2ml,EDTA(美国Thermo Fisher公司)抗凝;孕妇行羊水穿刺术后抽取羊水2ml。所有样本均离心后取上清用于检测。
3.ELISA法检测抗体:人黄色葡萄球菌的Cas9蛋白抗体试剂盒购自上海纪宁实业有限公司,检测步骤按照说明书进行具体操作:设置样本孔及标准品孔,分别加入50μl待测样本和不同浓度的标准品,空白孔不加;除空白孔外,各微孔中加入辣根过氧化物酶(horseradish peroxidase,HRP)标记的检测抗体100μl;于37℃恒温箱中进行温育60min后;向微孔中加入350μl洗涤液,充分洗涤5次;然后向微孔中加入底物A、B各50μl,再温育15min后,向微孔中加入50μl终止液,于15min内,在450nm波长处测定各孔的吸光度(A)值,使用标准品绘制标准曲线,根据标准曲线计算样本中的SaCas9蛋白抗体浓度。
4.评价指标:阳性:SaCas9蛋白抗体≥1ng/ml;阴性:SaCas9蛋白抗体<1ng/ml。本实验检测样本A值与空白对照A值进行对比,低于空白对照A值的样本认为是阴性,抗体浓度为0ng/ml。
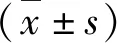
结 果
1.样本中的SaCas9蛋白抗体检测结果:75例孕妇年龄为18~44岁,平均年龄为26.74±4.98岁,孕周16~28周,平均孕周为19.31±3.81周。42例血清中均检测出SaCas9蛋白抗体,血清抗体阳性率为100%。23例羊水及10例脐血样本中均未检测出SaCas9蛋白抗体,抗体阳性率均为0。样本的检测结果如表1。

表1 75例孕妇样本中的SaCas9蛋白抗体检测结果
2.42例血清样本中的SaCas9蛋白抗体水平与年龄的关系:42例孕妇年龄为18~36岁,平均年龄为26.57±5.63岁。将孕妇根据年龄分为6组,分析血清抗体浓度与孕妇年龄的关系。经统计学分析,血清抗体水平与孕妇年龄无相关性(P>0.05),详见图1。

图1 42例血清样本中的SaCas9蛋白抗体检测结果
讨 论
基因编辑技术近年来蓬勃发展,相继出现了锌指核酸酶(zinc finger nucleases,ZFNs)、转录激活因子样效应物核酸酶(transcription activator-like effector nucleases,TALENs)、CRISPR/Cas基因编辑系统、单碱基编辑器(base editing,BE)和先导编辑器(prime editing,PE) 等基因编辑技术,其中CRISPR/Cas系统因其应用难度小,准确性高和构建时间较短等优点而被广泛应用于各领域中,因此也是研究最为深入的基因编辑方法[6]。CRISPR/Cas系统存在于约50%的细菌和90%的古细菌基因组中,是细菌的一种获得性免疫系统,用来保护细菌免受外源遗传物质的入侵。目前最常用的Cas9蛋白同源物之一是SaCas9蛋白[3]。金黄色葡萄球菌广泛存在于自然环境中,大约有40%的人口存在金黄色葡萄球菌感染,人体预先暴露于该菌中可能会诱导机体产生免疫应答,从而产生针对Cas9蛋白的抗体。
在CRISPR/Cas9系统介导的基因治疗过程中,AAV载体携带Cas9蛋白进入机体并介导Cas9蛋白在体内持续表达。若患者体内预先存在针对Cas9蛋白的抗体,体内免疫系统将会识别并清除Cas9蛋白,影响治疗效果,甚至有可能引发严重的免疫反应,导致器官衰竭,CRISPR/Cas9基因编辑技术的安全性和有效性难以得到保证。在先前的基因治疗试验中,体内对Cas9蛋白抗体具有适应性免疫的患者由于抗体的中和作用,基因治疗没有产生相应的效果。Charlesworth等[4]通过ELISA法检测健康成人体内Cas9蛋白抗体的存在情况,结果在78%的样本中检测到针对SaCas9蛋白的抗体。在此之前,Simhadri 等[5]使用ELISA检测法对200份美国人的血清样本进行筛查,发现SaCas9蛋白抗体的存在率为10%。全球罕见病患者约3.6亿人,其中我国罕见病患者超2000万,且每年新增人数超过20万。我国罕见病患者数量庞大,因此中国人群中Cas9蛋白的适应性免疫情况更值得关注。本研究通过收集成人外周血、羊水、胎儿脐带血样本,经ELISA法检测样本中是否存在针对SaCas9蛋白的抗体。为进一步评价CRISPR/Cas9系统临床应用的安全性和治疗策略提供依据,并为遗传病的治疗提供新方案。
SaCas9蛋白抗体在成人体内广泛存在,而在羊水和脐血中均未检出,证明胎儿体内可能不存在针对CRISPR/SaCas9系统的特异性体液免疫,因此对胎儿进行宫内基因治疗可能避免因产生针对SaCas9蛋白的体液免疫反应而造成的不良后果。
此外对胎儿进行宫内基因治疗还具有以下几个方面的优点:(1)与幼儿或成人比较,胎儿个体较小,可最大限度地提高每公斤体重内的载体效价,从而可有效促进基因转导,且较小的个体可避免需要大规模构建体所造成的时间与经济限制[7]。(2)妊娠早期的胎儿免疫系统发育不成熟,此时胎儿不会对外源抗原产生免疫反应,并诱导抗原特异性免疫耐受[8]。若在此时对胎儿进行基因治疗,则可避免机体产生针对载体系统或基因编辑产物的免疫反应,从而避免对正常组织产生损伤,且无需使用免疫抑制药物作预处理。(3)胎儿体内具有丰富的干细胞群体,因其在发育过程中具有很高的增殖能力成为基因治疗的理想靶点,可对载体进行长期有效的转导,且减少了再次给药的必要性[9]。而在成人体内绝大多数干细胞都处于静止状态,这大大降低了基因治疗的效率和持续时间。(4)胎儿的独特解剖结构可有助于通过各种给药途径将基因治疗载体输送到特定组织,如在妊娠早期对胎儿直接进行心内注射、在妊娠中晚期通过超声引导下的脐静脉穿刺术或直接向羊水中进行注射从而将载体输注到特定的组织[10]。(5)血-脑脊液屏障的功能随着年龄增长而逐渐完善,胎儿血-脑脊液屏障的高通透性使宫内基因治疗中枢神经系统疾病成为可能,且可防止大脑发生不可逆转的病理变化。
Chan等[11]在超声引导下对患有B型血友病的食蟹猴胎儿进行基因编辑病毒载体的心内注射,出生后的食蟹猴体内表达的凝血因子Ⅸ可达到治疗水平,体内没有产生特异的免疫反应,并且在其出生后的4年内也没有因载体的存在或基因编辑产物的表达而产生不良影响。Massaro等[12]利用带有表达重组神经元葡糖脑苷脂酶的AAV9病毒载体对患有戈谢病的胎儿小鼠进行治疗,出生后小鼠的致死性神经退行性变被逆转,小鼠的寿命显著延长。且有研究人员利用经腹胚胎胎儿镜观察人类早期胚胎,认为镜下经胎儿脐静脉穿刺可作为未来宫内基因治疗载体注射的可靠途径[13]。这些都为CRISPR/Cas9基因编辑技术应用于宫内基因治疗提供了可能。
保证宫内基因治疗的安全,除了要考虑免疫因素外,还需考虑以下几个主要的因素,首先基因治疗的病毒载体必须以不干扰母亲和胎儿的方式进入胎儿循环,此外还应最大限度地转移到胎儿并最大限度地避免转移到母亲。其次,基因治疗载体一旦进入胎儿循环,必须使其转导到靶组织。但由于发育中的胚胎组织在生理上非常接近,并且胎儿细胞对所处环境的变化非常敏感,多项研究结果证明,载体除转导特定的细胞群外,也在其他组织中广泛转导,尽管水平较低[14,15]。有研究表明,在胎儿非靶标组织中表达基因编辑产物可能会产生致癌作用等严重问题[16]。所以,为避免对其他组织的意外破坏,应严格控制基因治疗载体的转导。再次要考虑胎儿对基因治疗载体的清除作用,一项关于妊娠晚期胎儿对吗啡摄取的研究表明,胎儿对该物质的代谢清除率随时间的延长而逐渐升高[17]。如果这一结果适用于基因治疗载体,那么胎儿体内的清除机制可能会降低细胞摄取转基因产物的可能性并增加基因治疗所需的载体剂量。因此在进行治疗之前应进行基因治疗载体在宫内的药代动力学研究。最后在载体转运到细胞核后,载体基因组必须在胎儿细胞内持续存在,以实现基因治疗的效果。根据载体的选择,基因编辑产物可以作为一种外源DNA分子附加体存在,但随着细胞的分裂基因编辑产物可能逐渐消失,也可以整合到宿主染色体中并在子细胞中持续存在。
基因疗法一般使用游离型载体,如果将其递送到相对静止的组织中,基因编辑产物可以长期存在[18]。然而,鉴于胎儿细胞的高度增殖性,基因编辑产物可能因细胞的快速更新而丢失。虽然插入型载体可使基因编辑产物在靶组织内持续表达,但其有可能通过插入诱变激活或破坏附近的基因而产生不可预料的风险[19]。因此,必须优化用于宫内基因治疗的转导载体,最大限度地提高基因编辑产物表达的持久性并最大限度地降低发生并发症的风险。
当然,本实验也存在一定的局限性,由于纳入的样本均为孕妇,且未观察到抗体的存在情况或效价与孕妇年龄有明显相关性,因此不能确定男性、非孕妇女性或未成年儿童体内的SaCas9蛋白抗体存在情况及抗体效价与性别和年龄的关系。未来需要进一步扩大样本量,纳入不同性别、不同年龄阶段的人群进行检测。本研究中羊水和脐血中均未检测出SaCas9蛋白抗体,与Charlesworth等[4]的研究比较,脐血中的SaCas9蛋白抗体检测的阳性率较低,可能与胎儿免疫系统尚未成熟、检测的人群、检测方法等有关。未来需进一步扩大样本量,收集来自不同性别、不同年龄、不同地区的健康成人及遗传病患儿来源的外周血、遗传病患胎来源的羊水和脐带血进行检测,从而更加全面地评测SaCas9蛋白抗体在人体内存在情况。Wagner等[20]研究发现,成人体内检测到针对SaCas9的细胞免疫,而胎儿脐血内尚未发现。本实验没有研究胎儿体内SaCas9蛋白抗体细胞免疫的存在情况,未来需对其进一步的研究。
综上所述,SaCas9蛋白抗体在成人体内广泛存在,而在胎儿体内几乎未检出,表明胎儿体内可能没有针对CRISPR/SaCas9系统的体液免疫,从而为遗传病的宫内基因治疗提供了一定的依据。
