膀胱小细胞癌临床病理特征及新辅助治疗疗效
2023-06-28阿克周力沙哈提艾力张天祥张瑞赟陈海戈
阿克周力·沙哈提艾力,钱 雷,张天祥,金 迪,张瑞赟,陈海戈
(上海交通大学医学院附属仁济医院泌尿科,上海 200127)
膀胱神经内分泌癌(neuroendocrine bladder cancer,NEBC)是极为罕见的膀胱癌类型,其中大部分为小细胞癌(small cell cancer of bladder,SCCB),约占原发性膀胱肿瘤的1%~2%[1-2]。SCCB细胞分化程度低、异质性高、侵袭性强、预后差[3-4],且较为罕见,长期以来的研究进展有限,目前暂缺乏前瞻性临床试验。本研究通过收集过去10年间于本院就诊并确诊为SCCB的47例患者的临床资料,回顾性分析其临床病理特征与预后。此外,通过分析其中37例非转移性SCCB患者的临床资料探讨SCCB预后相关因素以及新辅助治疗在其治疗中的应用价值。
1 资料与方法
1.1 一般资料收集2012年1月-2022年9月在上海附属仁济医院院就诊并确诊为SCCB患者的临床资料。纳入标准:①且病理诊断为SCCB;②临床与随访资料详尽;③患者或家属同意参与本项研究。最终纳入符合标准的SCCB患者共47例。同时纳入426例同期于我院就诊且临床资料齐全的尿路上皮癌(urothelial bladder cancer,UBC)患者作为对照组。
1.2 治疗方法37例患者接受膀胱根治性切除手术(radical cystectomy,RC),10例患者确诊为转移性SCCB,行经尿道膀胱肿瘤电切术(transurethral resection of bladder tumor,TURBT)联合系统性全身治疗(包括化疗、放疗和免疫治疗等)。接受RC的患者中有16例在术前接受了新辅助治疗(neoadjuvant therapy,NAT),包括新辅助化疗(neoadjuvant chemotherapy,NAC)患者8例和新辅助化疗联合免疫治疗(neoadjuvant chemoimmunotherapy,NACI)患者8例。在根治手术后,有8例患者接受了辅助治疗。
1.3 随访方法通过医院电子病历系统、门诊复查以及电话随访等方式收集随访资料。随访内容包括临床病理特征、随访期影像学检查结果、患者治疗信息以及生存信息等。随访日期自患者确诊开始至死亡或者最后一次随访结束,随访截止日期至2022年12月1日。无疾病生存期(disease-free survival,DFS)是指患者自接受RC至首次出现复发转移的时间,总生存期(overall survival,OS)是指患者自首次确诊SCCB至患者死亡的时间。
1.4 统计学方法使用survival软件及survminer软件进行生存分析,统计方法采用Kaplan-Meier,检验采用log-rank分析,使用ggplot2软件进行生存曲线绘制。采用IBM公司SPSS 26.0统计软件进行单因素以及多因素COX回归分析,首先对多个临床病理特征进行单因素分析,此后纳入P<0.05以及文献报道的预后相关变量进行多因素COX回归分析。计量资料的比较采用t检验或Wilcoxon检验,计数资料的比较采用χ2检验。P值采用双侧检验,P<0.05为差异有统计学意义。
2 结 果
2.1 临床病例特征与预后SCCB组纳入47例患者,年龄44.0~89.0岁,平均71.8岁,5例患者年龄小于65岁,男性35例,女性12例,与UBC组相比其发病年龄更高(P<0.001),两组性别比例的差异无统计学意义(P=0.142);SCCB组临床肿瘤T分期均大于T2期,与UBC组的差异有统计学意义(P<0.001);两组间淋巴结转移率的差异无统计学意义(P=0.632),SCCB组有14(29.8%)例患者见淋巴结转移;SCCB组更易发生肿瘤远处转移(P<0.001),10例患者在初诊时已存在远处器官转移;SCCB组中39(83.0%)例患者的癌细胞Ki67表达≥50%,显著高于UBC组(P<0.001,表1)。SCCB组中有23例患者中合并有尿路上皮癌,7例患者有既往尿路上皮癌史。生存分析显示,相较UBC组,SCCB组患者总生存率更低,差异具有统计学意义(P<0.05,图1)。SCCB组患者预估中位生存时间为13.1个月,而UBC组为56.2个月。SCCB组的1年、5年总生存率分别为53.7%和15.4%,而UBC组分别为89.5%和42.4%。

UBC:膀胱尿路上皮癌;SCCB:膀胱小细胞癌。
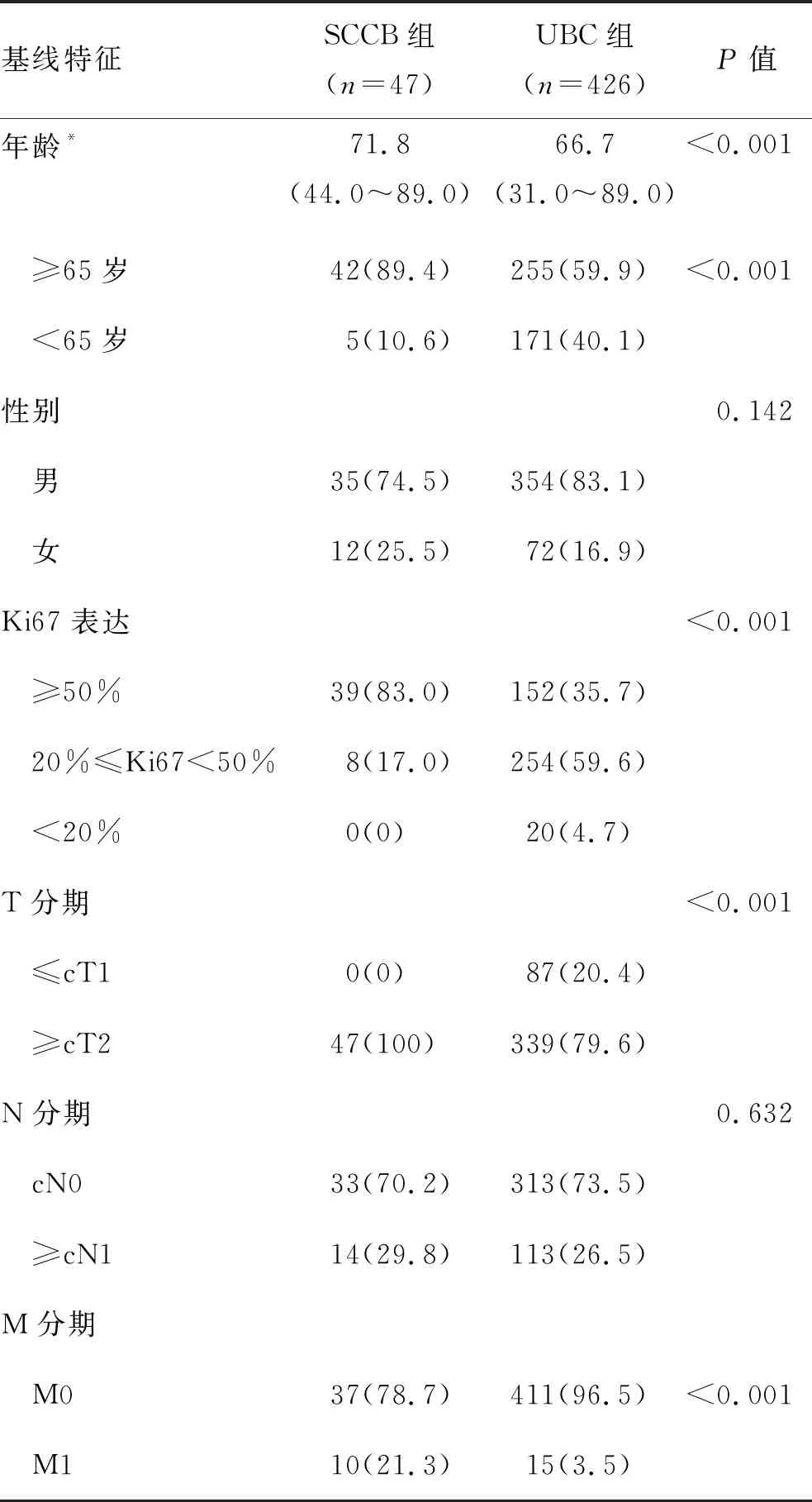
表1 SCCB组与UBC组患者临床资料特征及差异 [例(%)]
2.2 非转移性膀胱小细胞癌患者的独立预后因素对SCCB组中的37例非转移性SCCB患者的临床资料进行了COX回归分析。COX单因素分析结果显示,肿瘤T分期为影响SCCB患者无病生存率和总生存率的危险因素(P<0.05);术前接受新辅助治疗为其保护因素,患者转移复发风险和死亡风险分别是未接受者的0.308倍(95%CI:0.100~0.949,P=0.040)和0.281倍(95%CI:0.089~0.886,P=0.030,表2)。选取肿瘤T分期、N分期、新辅助治疗和辅助治疗数据进行COX多因素回归分析,结果显示,术前接受新辅助治疗为SCCB患者的独立保护因素,能显著降低其复发转移风险(HR=0.189,95%CI:0.051~0.697,P=0.012)及死亡风险(HR=0.177,95%CI:0.045~0.698,P=0.013,表3)。生存分析显示,接受新辅助治疗能显著提高其无病生存率与总生存率(P<0.05,图2)。接受新辅助治疗的患者在随访期内未达到中位无病生存时间,未接受新辅助治疗的患者中位无病生存时间为7.8个月。接受新辅助治疗的患者中位总生存时间为32.1个月,而未接受新辅助治疗的患者中位总生存时间为12.4个月。
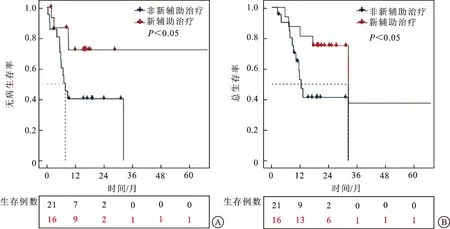
A:新辅助治疗组相比非新辅助治疗组无病生存时间更长;B:新辅助治疗组相比非新辅助治疗组总生存期更长。
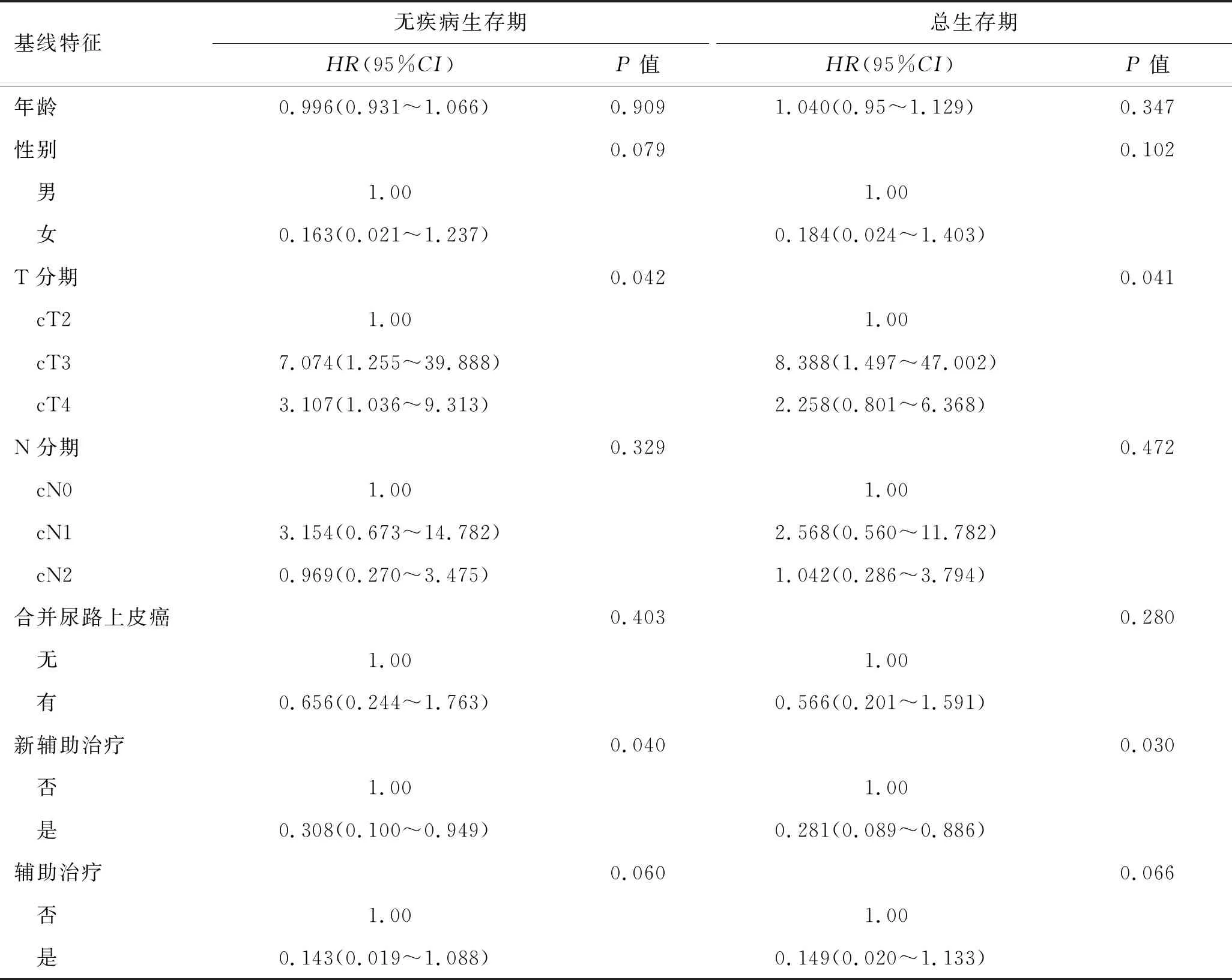
表2 非转移性膀胱小细胞癌患者预后的COX单因素分析

表3 非转移性膀胱小细胞癌患者预后的COX多因素分析
2.3 非转移性SCCB新辅助治疗方式的探索进一步对接受新辅助治疗的16例患者进行亚组分析,其中8例患者接受了NAC,8例患者接受了NACI。两组患者性别、年龄等差异无统计学意义,根治术后病理完全缓解率存在显著差异(P<0.05),其中NAC组患者病理完全缓解率为25%,而NACI组患者病理完全缓解率为75%。图3中所示为1例肿瘤临床分期为T2N0M0的SCCB患者,伴有尿路上皮癌,在经过2个疗程依托泊苷+顺铂+PD-1的联合新辅助治疗后,影像学检查提示肿瘤病灶明显缩小,新辅助化疗联合免疫治疗前病理镜下观表现为黏膜慢性炎症,治疗后达到病理完全缓解。

A:治疗前核磁共振图像,可见膀胱壁肿瘤病灶;B:治疗前肿瘤病灶病理镜下观;C:治疗后核磁共振图像,未见膀胱内病灶;D:治疗后肿瘤病灶处病理镜下观。
3 讨 论
神经内分泌肿瘤是一种多系统的肿瘤,可发生在不同的解剖部位,根据分化程度及细胞增殖程度不同可分为高分化神经内分泌肿瘤和低分化神经内分泌肿瘤,后者又可以分为大细胞癌与小细胞癌两种类型[2]。SCCB在男性中更为常见,发病年龄通常为70.0~80.0岁,本研究中男女比例为2.9∶1,平均年龄为71.8岁,与既往文献报道队列基本特征一致[4]。SCCB的细胞起源目前仍不完全明确,部分研究者认为其与UBC具有相同起源。一项基于全基因组测序分析的研究结果提示SCCB与UBC具有相似的基因组突变特征,表现为典型的年龄相关和胞嘧啶脱氨酶家族(apolipoprotein B mRNA editing catalytic polypeptide-like family,APOBEC)介导的突变模式[5]。在本研究队列中,48.9%的SCCB患者合并UBC,14.9%的患者有既往UBC史,这也提示SCCB与UBC可能具有相同的细胞起源。
SCCB侵袭性强,大部分患者确诊时已具有较高的肿瘤分期,肿瘤多已浸润肌层或膀胱全层,且易发生转移,最常见的转移部位包括肺、肝脏、骨骼等[6-7]。本研究纳入的患者均至少发生了肌层浸润,且21.3%的患者在初诊时便已发生远处实质器官转移。因此,SCCB患者初诊时即建议完善膀胱磁共振成像(magnetic resonance imaging,MRI)、胸部和腹部电子计算机断层扫描(computed tomography,CT)、骨扫描(body scan,BS)等检查,系统性评估SCCB肿瘤分期后决定诊疗方式。本研究中SCCB患者的预后相较UBC患者更差,其中位生存时间(13.1个月vs.56.2个月)、1年生存率(53.7%vs.89.55)和5年生存率(15.4%vs.42.4%)均显著低于UBC组患者。SCCB患者预后较差与多种因素有关,其中肿瘤细胞增殖活性以及侵袭转移能力为主要因素[8]。一项基于SEER数据的回顾性分析研究中提示高肿瘤T分期为SCCB患者预后的独立危险因素[9],本研究结果也提示肿瘤T分期是其预后影响因素。根据是否合并其他肿瘤,SCCB可分为单纯型和混合型,其中混合型约占29%~66%,其中合并尿路上皮癌最多见[10-11]。既往一项研究结果提示单纯型较混合型SCCB患者预后更差[12],而本研究虽然提示合并有UBC的患者预后相对更好,但差异无统计学意义,这可能与队列样本量较小有关。
目前缺少基于前瞻性临床研究建立的临床治疗策略,近30多年来,科研人员不断尝试通过各种治疗策略来改善其预后,包括RC、全身化疗、局部放疗以及联合治疗策略等。目前认为浸润型SCCB首选RC,膀胱切除术联合淋巴结清扫为非转移性浸润型SCCB的首选治疗策略,能显著改善预后[4,13]。 在根治性手术治疗的基础上,术前行NAC能进一步改善SCCB患者的预后。LYNCH等[14]的研究结果表明,基于铂类联合依托泊苷的NAC除了能显著提升术后病理缓解率,同时能提高患者的长期总生存率。2016年,美国国家癌症综合网络(National Comprehensive Cancer Network,NCCN)肿瘤学指南建议无化疗禁忌证的SCCB患者接受NAC,然后进行RC[4]。本研究结果也提示SCCB患者能从NAT中获益,术前接受基于铂类联合依托泊苷为基础的NAT能显著降低SCCB复发转移风险及患者死亡风险,并显著提高患者的DFS和OS。而NAC对患者生存预后的影响仍不十分清楚,部分早期研究提示辅助化疗对生存率的影响并不优于单纯的膀胱切除术[15],而也有一些研究提示接受辅助化疗的患者的5年总生存率比未接受辅助化疗的患者有所提升(43%vs.20%,P=0.030)[16]。本研究COX回归分析结果提示辅助治疗能降低患者肿瘤复发以及死亡风险,但差异无统计学意义,可能需要更大样本量的多中心研究进一步分析。目前,一般建议对膀胱切除术前确诊的SCCB患者进行NAC,而对于那些根治术后才诊断SCCB的患者,建议接受辅助化疗[4]。
近几年来,免疫治疗开始被用于不同器官神经内分泌癌的治疗,最早被应用于小细胞肺癌[17]。目前,美国食品药品监督管理局(Food and Drug Administration,FDA)批准卡铂、依托泊苷联合atezolizumab作为一线治疗药物,nivolumab和pembrolizumab作为三线治疗药物应用于小细胞肺癌的治疗。既往研究结果提示,SCCB具有较高的肿瘤突变负荷以及免疫原性[5],意味着SCCB患者可能从免疫治疗中获益。最近,也有部分小队列研究及个案报道结果显示免疫治疗在NEBC中的有效性及应用前景[18-20]。本研究对接受新辅助治疗患者的进一步分析结果显示,NAC联合免疫治疗能够提高SCCB的病理完全缓解率。由于本研究队列样本量较小,后续有必要通过前瞻性多中心队列研究来进一步探索NACI在SCCB中的应用价值。
总之,SCCB虽然罕见,但其恶性程度高、易转移、预后差、治疗手段少,在临床诊疗中需要更加重视。针对非转移性SCCB,以铂类为基础的NAC联合积极的RC可作为首选治疗方案。在此基础上,本研究建议对高肿瘤突变负荷、PDL1表达阳性和高肿瘤免疫原性的SCCB患者在NAC的基础上联合应用新辅助免疫治疗,或能提高SCCB的病理完全缓解率。将来有必要开展前瞻性多中心研究进一步探索免疫治疗以及其他新型治疗方式在SCCB治疗中的应用前景。
