羊致病性大肠杆菌的分离鉴定、毒力基因及耐药基因分析
2023-06-27白彪慧黄江郭颂金鑫邵百卉刘宇张泽财周玉龙朱战波
白彪慧,黄江,郭颂,金鑫,邵百卉,刘宇,张泽财,周玉龙,朱战波
(黑龙江八一农垦大学动物科技学院,大庆 163319)
大肠杆菌是一种革兰氏阴性杆菌,呈直杆状,两端钝圆,有的近似球。大肠杆菌一般不产生芽孢,是一种营养要求不高、有活动性和兼性厌氧细菌,直径为0.5 μm,长度为1.0~3.0 μm,属于肠杆菌科。大肠杆菌很容易在HiCrome ECC 营养琼脂中生长,在半乳糖苷酶裂解作用下产生玫瑰粉色菌落。曙红亚甲蓝培养基适用于分离产生独特菌落的大肠杆菌,该菌落具有特征性的绿色金属光泽,可将其与任何其他肠杆菌区分开来。大肠杆菌是氧化酶阴性的杆菌,发酵乳糖、葡萄糖和蔗糖等。它在37 ℃的温度和PH 6.0~7.0 的条件下生长,而一些引起腹泻的大肠杆菌菌株可以耐受pH 2.0 环境。uidA 编码β-d-葡萄糖醛酸酶,这可能是大肠菌群的一个重要特征,因此它通常用于大肠杆菌的特异性鉴定。
大肠杆菌广泛存在人和动物体内,一般大肠杆菌并不会致病,但是如果受到外界某种因素的影响肠道菌群的平衡被打破,大肠杆菌就会大量繁殖导致患病[1]。目前国内对大肠杆菌病的研究主要集中在禽源及猪源上,并且对该病源的防治产生了一定的指导意义。但是,近几年,国内养羊业的集约化和散养生产系统的快速扩张,养殖规模已相当庞大,使得动物将更多的接触病原体和应激,增加了大肠杆菌病的发病率。多种动物对致病性大肠杆菌均易感,且以急性败血症较为常见,发病后死亡率高[2]。羊大肠杆菌病主要是致病性大肠杆菌感染所引起的一种急性烈性传染疾病,通常表现为肠炎型和败血型,也可继脑膜炎、发肺炎、肾盂肾炎及关节炎等炎性疾病。肠炎型临床上表现为湿热下痢、剧烈腹泻等,随后病羊迅速消瘦、脱水或贫血,发病之后若不能得到有效的防治措施,很容易因为衰竭而死[3]。而羊群体内大肠杆菌对人类感染具有重要意义,因为它们的肉类及肉制品可以通过在整个制备过程中或作为消费者摄入的方式传播感染疾病。动物粪便中大肠杆菌的存在使其在屠宰过程中通过肠道内容物对肉类和奶类污染,从而进入食物链。动物与人类的直接和间接接触,人与人之间的接触在感染传播中起着关键作用。目前,主要以使用抗生素来治疗和预防大肠杆菌病,但抗生素的滥用导致了严重的耐药性问题,疗效不佳,同时还有严重的药物残留问题,不仅无法有效控制大肠杆菌病,甚至可能出现超级细菌,严重影响了大肠杆菌的防治效果[4-5]。
2021 年10 月,大庆地区某羊场存栏1 000 头肉羊,集中舍饲为主,且与外界无接触。舍内通风较差,采用羊草作为垫料,平时不更换,空气中有肉眼可见的灰尘颗粒。发病当天死亡8 只,后续陆续出现死亡,直至数日死亡数量达到104 只,死亡的羊中,有成年羊也有羔羊。春季羊群接种过口蹄疫,小反刍兽疫、梭菌病等疫苗,并且进行了驱虫。对患病羊,使用抗生素进行注射治疗,但治疗效果不明显。患病羊表现出采食量下降、反刍次数减少、眼结膜潮红、流鼻汁、呼吸困难,少数患病羊排带血的粪便。解剖可见患病羊病死羊的肺脏显著充血,肿大,肺脏切面有明显的炎性物质;心肌有出血点;气管,细支气管内有大量的粘液性物质。肠扩张,内部充满大量的气体,肠粘膜膜充血,出血,其他脏器器官没有表现出显的病变。为了确定其病因,开展了细菌的分离和鉴定,对大肠杆菌分离株进行了致病性、毒力基因和耐药性分析,研究为大庆地区肉羊大肠杆菌病的防控提供了理论基础。
1 材料与方法
1.1 主要试剂及设备
1.2 病料采集
病料来自2021 年黑龙江省大庆市某羊场,在超净台内无菌采集死亡羊的肺脏、脾脏、肝脏、肠内容物等组织。
1.3 试验动物
选取6~8 周龄雌性的BALB/c 小鼠,其购自于哈尔滨医科大学实验动物学部;在研究当中随机的将所有的小鼠分为2 组,每组共5 只BALB/c 小鼠。

表1 主要试剂Table 1 Main reagents
1.4 细菌分离纯化
无菌采取病料并接种到血平板培养基上,37 ℃恒温培养箱需氧培养和蜡缸厌氧培养。培养后挑取单菌落进行涂片、革兰氏染色、镜检。将培养好的菌在无菌操作台上用接种环取菌后分别接种伊红美蓝和麦康凯培养基鉴定。挑取典型的单菌落开始进行纯化培养,放在37 ℃恒温箱过夜培养,在分装出菌液保存在-80 ℃冰箱冷藏备用。
1.5 细菌DNA 的提取
将镜检确认后的大肠杆菌菌液分装到EP 管中,每管1 mL 菌液,放在高速冷冻离心机中设置为12 000 r·min-1,离心5 min,离心后取出EP 管后,用移液器将上清液吸走,小心不要吸取到沉淀物,弃掉含有上清液的枪头。再用移液枪吸取300 μL 超纯水,与沉淀反复的吹吸混匀,再次放到高速冷冻离心机中设置为12 000 r·min-1,离心5 min 反复此步骤3次。将EP 管插到浮漂上放到提前准备好的热水锅里水煮20 min。取出后再放进冷冻离心机里,设置为12 000 r·min-1,离心2 min 后取出上清液放到另一个离心管理,弃掉沉淀。置于-20 ℃的冰柜备用。
1.6 细菌16s rDNA PCR 鉴定
细菌的通用引物由上海生工生物工程技术服务有限公司合成,将提取出来的DNA 作为模板进行PCR 扩增,基因序列及扩增体系见表3、表4。

表3 PCR 引物Table 3 PCR Primers

表4 PCR 反应体系Table 4 PCR reaction system
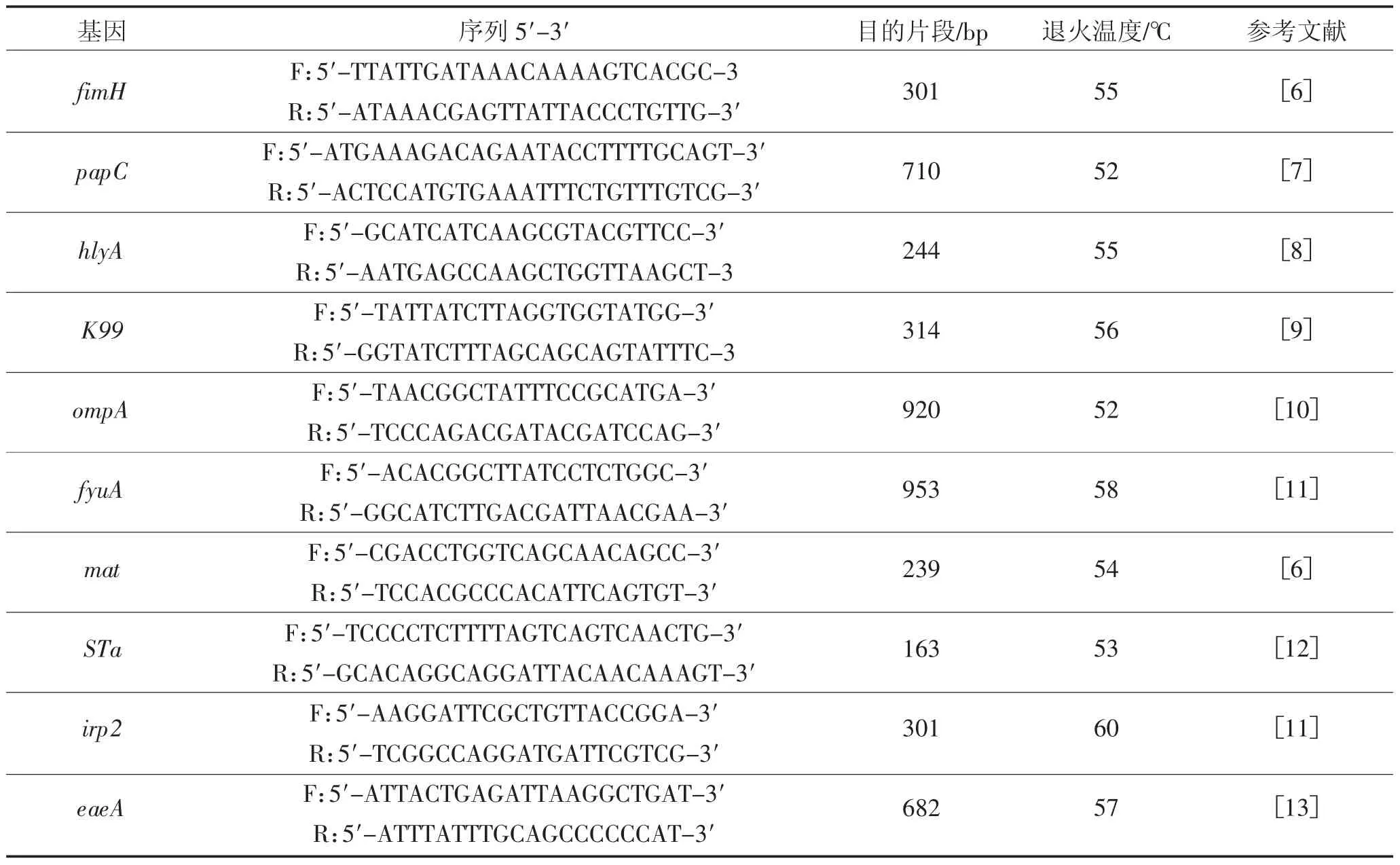
表5 毒力基因引物Table 5 Primers for virulence genes

表6 耐药基因引物Table 6 Primers for drug resistance genes
PCR 的程序条件为:94 ℃预变性10 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸3 min,循环为30,72 ℃终延伸10 min。保存温度为4℃。
1.7 动物致病性试验
分离纯化的菌液稀释到1.0×109CFU·mL-1,将小鼠分为两组,实验组和对照组;每组各5 只。腹腔注射0.2 mL 菌液,分别于注射后4 h,16 和24 h 观察小鼠,死亡后将其肝、脾等分别接种到营养琼脂平板上进行涂片,鉴定。
1.8 药敏试验
挑取单个菌落,用无菌水1∶20 稀释,吹吸混匀。取100 μL 菌液用玻璃棒均匀地涂在培养基上。挑选克拉霉素、氨苄西林等14 种药物,无菌操作将药敏片贴于培养基上,37 ℃培养16~18 h 后取出。
1.9 部分毒力基因及耐药基因检测
根据Gen Bank 和参考文献[6-15]进行设计引物,引物由上海生物工程有限公司合成。反应体系为:25 μL:Premix Taq 12.5 μL,上、下游引物各1 μL,去离子水8.5 μL,模板2 μL。1%琼脂糖凝胶电泳检测产物。
2 结果与分析
2.1 细菌分离培养及镜检结果
菌株经革兰染色镜检为革兰阴性菌;在琼脂培养基上形成光滑的菌落,看起来像灰色的露珠,边缘整齐。在麦康凯培养基上长出红色中等大小的菌落,在伊红美蓝培养基上出现黑色金属光泽的菌落。
2.2 细菌16s rDNA PCR 鉴定结果
PCR 产物通过1%琼脂糖凝胶电泳,结果如图所示:在1 560 bp 处有明亮单一的条带,与目的基因大小相符合,成功扩增出目的基因(图1)。送上海生物工程有限公司测序的基因序列与Genbank 上的参考序列比对分析确定为大肠杆菌。
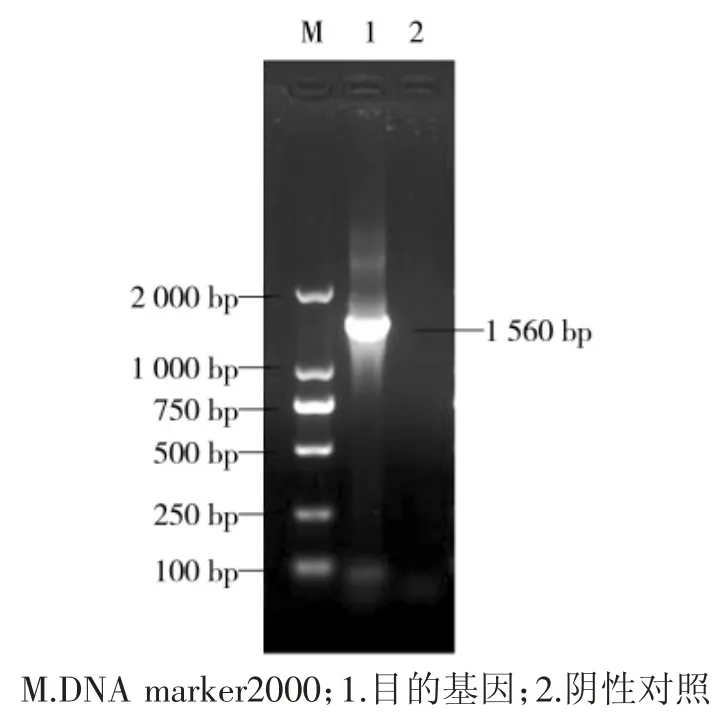
图1 16S rDNA PCR 扩增结果Fig.1 PCR amplification results of 16S rDNA
2.3 动物致病性试验结果
接种羊大肠杆菌后的5 只小鼠在16 h 小鼠表现出精神不振,食欲减少,眼睛出现粘稠的分泌物,呼吸加快。24 h 后5 只小鼠全部死亡,对照组的5 小鼠没有任何变化,将死亡小鼠进行剖检,可见肠内出现肿胀,有黄色液状内容物,肝脏和脾脏出现肿大和出血点。从肝脏、脾脏及肠内容物中分离到了大肠杆菌。
2.4 药敏试验结果
培养取出平板,抑菌环的边缘以肉眼见不到细菌明显生长为限。用卡尺量取抑菌圈的直径,并判定试验结果。结果表明该菌株对克拉霉素、氨苄西林、氧氟沙星、苯唑西林、氨曲南、链霉素、甲氧嘧啶、新霉素、红霉素、氯霉素、大观霉素、卡那霉素均不敏感,对呋喃妥因(15 mm)和多粘菌素(20 mm)敏感。
2.5 毒力基因PCR 检测结果
10 种毒力因子共检测出4 种毒力因子,分别为fimH(510 bp)、papC(710 bp)、ompA(919 bp)、mat(239 bp)。如图2 所示与预期大小一致。

图2 部分毒力基因PCR 扩增结果Fig.2 PCR amplification results of some virulence genes
2.6 耐药基因PCR 检测结果
8 种耐药基因检测出5 种,分别为aadA1(280 bp)、gyrA(810 bp)、parC(980 bp)、Sul2(435 bp)、floR(399 bp)。结果可见,与预期目的基因大小一致。如图3 所示。

图3 部分耐药基因PCR 扩增结果Fig.3 PCR amplification results of some drug-resistance genes
3 讨论
长期以来,大肠杆菌一直是家畜发病率和死亡率高的重要原因。它是胃肠道的常见菌,并且具有至少13 000 个(可能超过100 000 个)基因的广泛基因组,其中包括许多毒力因子,这使得对疾病病因学的理解变得复杂。致病性大肠杆菌诊断需要与作为正常肠道菌群组成成分的非致病性菌株区分开来。此类致病型由一种或多种可定义的大肠杆菌毒力因子的存在来定义,并且可以通过先进的分子方法和某些常规方法进行鉴定。与传统的表型方法相比,分子技术在细菌鉴定方面更加快速和精确。动物来源的大肠杆菌的致病性与多种毒力因子有关[16],例如,粘附素在大肠埃希氏菌的发病机理中至关重要,因为细菌与宿主细胞的结合是建立感染的重要步骤;铁的吸收和转运系统对细胞很重要因此,许多肠外致病性大肠杆菌菌株已经获得了多种铁转运系统,包括铁载体,以调节宿主细胞对铁的吸收,从而导致致病性[17]。细菌的表面结构,例如脂多糖,包膜蛋白和外膜蛋白,可通过促进补体系统的作用来保护细菌[18]。为探究分离到的大肠杆菌是否具有较强的致病性,通过接种BABL/c 小鼠进行动物攻毒实验,结果显示接种分离到的大肠杆菌24 h 内全部死亡,表明该菌株具有较强的致病性。应用PCR 方法检测分离株大肠杆菌的毒力基因,检测出来的4 种毒力基因分别为Ⅰ型菌毛、外膜蛋白A、P 菌毛、黏附素相关基因。此菌株共检测出3 种以上的毒力因子可以看出,结合小鼠感染试验结果,表明该菌株为致病性大肠杆菌。顾晓晓[19]对新疆部分地区132 分菌株进行对25种毒力因子进行鉴定,其中crl、hlyE、iutA、fimH、ompA、ompF、ompC、papC检出率相比之下比较高,分别是97.4%、94.69%、92.42%、91.67%、78.03%、78.03%、65.91%、57.58%,其余的都在44%以下,与实验鉴定出来的毒力因子相符合,周磊等[20]猪源实验得出ompA检出率达到96.6%,说明致病性很强。
几十年来,抗生素耐药性一直被认为是一个全球性的健康问题。食用动物被认为是抗生素耐药性细菌的关键宿主,因为在动物食品细菌中发现的某些抗生素抗性基因也已在人类中发现。许多研究发现从屠宰的反刍动物粪便中分离出的多重耐药大肠杆菌菌株。目前针对大肠杆菌的控制策略主要依赖于反复的抗生素治疗。然而,抗生素的广泛使用,包括滥用和过度使用,帮助细菌自然进化并产生抗药性。因此在养殖生产中,长期不合理使用抗生素导致各个地区的大肠杆菌对许多的不同种类的抗生素具有高度的耐药性。应对大肠杆菌感染的最有效的方法是选择敏感药物治疗,合理使用抗生素及疫苗免疫预防。试验分离获得的大肠杆菌对克拉霉素、氨苄西林、氧氟沙星等药物不敏感,14 种受试药物中仅有呋喃妥因和多粘菌素为敏感药物,表明该羊场分离的大肠杆菌已出现较为严重的耐药现象。同时分离菌株检测出5 种耐药基因,可以看出,菌株对氨基糖苷类、喹诺酮类、磺胺类、氯霉素类药物均已产生了耐药性。岳山[21]对黑龙江地区牛源大肠杆菌71 分菌株进行对15 种耐药因子进行鉴定,其中β-内酰胺类(blaTEM98.6%)、氨基糖苷类(aadA188.7%)、氯霉素类(floR73.2%、tetA97.2%)、四环素类(tetB85.9%)、喹诺酮类(GyrB98.6%、parC97.2%、GyrA98.6%)、磺胺类(sul284.5%)几种检出率最高,说明不同动物源大肠杆菌由于频繁使用这几种药物产生了很高的耐药性。顾晓晓[19]新疆地区实验中也表明出对喹诺酮类药物的耐药性同样很高。
此病的发生和饲养管理因素有直接关系,该场垫料常年不更换,空气中有肉眼可见的灰尘颗粒,反复刺激呼吸道,以及天气变化的影响,可能是引起羊群肺炎及大肠杆菌病发生的重要因素。为减少此类病的发生,首先,要加强羊群的饲养管理,及时清扫羊舍并定期消毒,确保羊舍通风良好,适当降低畜群饲养密度,羊群禁止饲喂发生霉败的饲料;在饲喂青绿饲料时,要供给足够的营养,同时添加适量的碘盐、维生素A、维生素D,提高羊群机体免疫力。其次,灭活疫苗是预防大肠杆菌性疾病的主要方法。制备类毒素疫苗,也可用多价大肠杆菌苗对种羊进行接种。最后,虽然大肠杆菌所引起的疾病发病急,死亡快,但发病初期尚未能大量产生毒素阶段,采用敏感药物治疗,可取得一定疗效。研究表明该羊场的病因是致病性大肠杆菌,药敏结果为对多粘菌素高度敏感,呋喃妥因其次,但是这两种药物已经被禁用,因此加强饲养管理、疫苗免疫是预防本病的主要措施。
