阿司匹林通过抑制SH2B1/β-catenin增强顺铂对食管鳞癌细胞的化疗敏感性
2023-06-27张黎明王少强王丽娜马鸣魏海翔
张黎明 王少强 王丽娜 马鸣 魏海翔
(1济宁医学院临床医学院,济宁 272013;2潍坊市人民医院胸外科,潍坊 261041;3济宁医学院附属医院医学研究中心,济宁 272029;4济宁医学院附属医院胸外科,济宁 272029)
食管癌是最常见的消化系统恶性肿瘤之一,多数患者确诊时已是晚期,5年总生存率仅为16.9%[1]。以顺铂(DDP)为主的辅助或新辅助治疗已成为晚期食管癌的标准疗法[2]。单用DDP易于产生耐药性,是化疗失败的主因[3]。基于耐药考量,药物联合应用是抵抗耐药性的一个重要策略。
阿司匹林(Aspirin,ASA)是临床上预防血栓形成最常用的药物。随着研究的深入,ASA展现出了抑制肿瘤的潜力,可降低结直肠癌的发病率和死亡率[4]。对于另一消化道恶性肿瘤-食管癌,ASA抗肿瘤作用中亦初显端倪[5]。Asplatin(ASA和DDP的复合物前体)在体外实验中可激活Caspase诱导细胞凋亡,在多种肿瘤细胞中展现出比单用DDP更高的细胞化疗增敏作用,并能有效克服耐药性,展现出良好的抗肿瘤前景[6]。目前对于ASA大规模临床随机对照试验多由国外牵头,且以食管腺癌为主,而对于中国高发的食管鳞癌目前还缺少有力的证据,且单一的ASA在抗肿瘤方面的结论仍有很大分歧。
SH2B1已被确定为肥胖候选基因,是接头蛋白SH2B家族一员。SH2B1除参与肥胖、糖尿病等内分泌疾病外,近期研究聚焦于SH2B1与癌症的发生发展方面,其可作为候选促癌基因参与多种癌症[7-9]。SH2B1可增强多种原癌基因相关信号转导,包括Rac、RET、mTOR和sTATs等,从而调节细胞增殖、迁移及细胞分化等。Wnt/β-catenin信号转导广泛参与肿瘤细胞的分化、增殖、维持合适的细胞连接及EMT表型转化等[8]。目前食管鳞癌细胞水平未见明确证据表明ASA作为辅助药物对癌症发展的影响以及深入的探讨相关机制。基于前期临床观察及药物代谢研究,我们开展此项研究试图在细胞水平及分子机制上提供更加全面的证据,探讨ASA在食管鳞癌辅助用药方面的潜力和局限性,为临床治疗食管鳞癌提供新的策略。
1 材料与方法
1.1 药物与试剂
ASA和DDP购自美国Sigma-Aldrich.St.Louise公司。相关一抗anti-SH2B1(ab196575)、anti-CyclinD1(ab134175)、anti-phospho-GSK-3β(ser9)(ab131097)等抗体购于美国Abcam公司,anti-phospho-β-catenin(ser33/37)购于美国Bioss公司,内参anti-GAPDH及山羊抗兔IgG二抗购于上海生工生物科技有限公司。
1.2 细胞培养
人正常食管上皮细胞HEEC和食管鳞癌细胞株(Eca-109、Kyse30和TE-10细胞)购自中国科学院(上海)生物化学与细胞生物学研究所。PRMI 1640培养基、青霉素/链霉素、胎牛血清均购于美国Thermo Fisher Scientific公司。食管鳞癌耐DDP细胞Eca-109/DDP通过在培养基中逐步增加DDP浓度的方法建立。
1.3 RNA提取及qRT-PCR分析
应用TRIzol试剂(购于美国Invitgen公司)提取细胞总RNA。应用SYBR Green Assay Kit(购于日本TAKARA公司)检测mRNA表达。使用Biosystems ViiA7 Sequence Detection System检测系统执行qRT-PCR操作,重复3次。
相关引物委托TAKARA合成:
SH2B1(F):5’-GACAACCACAGCCCTGGAGAT-3’,
(R)5’-AGACACCCAGGCCTTCACCA T-3’;
GAPDH(F):5’-CCAGCAAGAGCACAAGAGGAA-3’,
(R):5’-A TGGTACA TGACAAGGTGCGG-3’。
1.4 细胞活性检测
将2×103个ESCC细胞(Eca-109、Kyse30、TE-10)接种于96孔板中,重复三孔。应用不用浓度的ASA(0,5,10mmol/L,标记为ASA、ASA5、ASA10)和/或DDP(固定浓度5μmol/L,标记为DDP5)处理细胞,即分为空白组(DMSO组),实验组(DDP5组,ASA5+DDP5组,ASA10+DDP5组)。应用CCK-8(购于美国Dojindo公司)测定OD450吸光值间接反应细胞活性。
1.5 流式细胞凋亡检测
使用FITC Annexin V凋亡检测试剂盒(购于美国BD公司)检测药物诱导的细胞凋亡。收集经ASA、DDP或DDP+ASA处理的细胞(Eca-109、Kyse30、TE-10),即分为空白组(DMSO组),实验组(ASA5组,ASA5+DDP5组,DDP5组),Annexin V-FITC染色,应用BD公司FACScan流式细胞仪进行流式凋亡检测分析。
1.6 蛋白印迹Western blot检测
应用RIPA(购于中国碧云天公司)并添加Halt Cocktail(蛋白酶和磷酸酶抑制剂,购于美国Thermo Fisher Science公司)裂解细胞,提取蛋白。BCA试剂盒(购于中国碧云天公司)测定蛋白浓度后应用SDS-PAGE(聚丙烯酰胺凝胶,购于中国上海雅酶公司)电泳,湿转PVDF膜(购于美国Millipore公司);脱脂奶粉或BSA封闭,相应抗体孵育,应用Bio-Rad Image Lab检测系统进行蛋白条带可视化检测。
1.7 细胞转染
人SH2B1基因表达序列的慢病毒载体由上海汉尹生物技术公司提供。稳定过表达SH2B1,应用空载慢病毒或SH2B1慢病毒PHY-LVOE1.6稳定转染Eca-109细胞,即分空白组、ASA10+DDP5组、空载对照Vector组(Vector组)、过表达SH2B1组(SH2B1组)和ASA10+DDP5+过表达SH2B1组。稳定转染后,收集细胞,Western blot检测蛋白表达。
1.8 细胞划痕实验
对数生长期细胞铺6孔板,密度6×105个/孔。细胞铺满单层后用移液器枪头比着直尺划痕;PBS洗除细胞后添加2%FBS的培养基继续培养。于48h在100倍镜下拍照。
1.9 统计学方法
2 结果
2.1 ASA增强DDP肿瘤抑制作用
三株食管鳞癌细胞Eca-109、Kyse30、TE-10细胞单纯给予5mmol/L ASA与空白组(给予DMSO)相比24h细胞活性差异均无统计学意义(t=2.31,P>0.05;t=0.74,P>0.05;t=1.73,P>0.05);给予常规剂量5μmol/L DDP可降低三株细胞活性(t=8.44,P<0.05;t=5.37,P<0.05;t=7.15,P<0.05);同时给予ASA 5mmol/L+DDP 5μmol/L处理三株食管鳞癌细胞24h细胞活性抑制最明显,与单纯用药DDP 5μmol/L相比有统计学意义(图1A,t=3.49,P<0.05;t=2.80,P<0.05;t=3.10,P<0.05)。ASA 5mmol/L+DDP 5μmol/L处理三株细胞24h后,与单纯给予DDP 5μmol/L相比,细胞凋亡最多,差异具有统计学意义(图1B,t=11.44,P<0.05;t=11.68,P<0.05;t=12.24,P<0.05)。
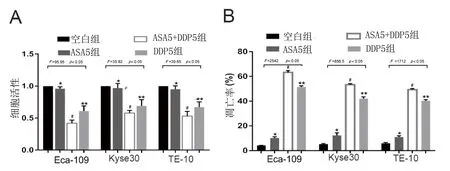
注:A与空白组相比,*P>0.05;与空白组相比,**P<0.05;与DDP5组相比,#P<0.05 。B图为使用膜联蛋白和PI的FACS分析来评估细胞凋亡。与空白组相比,*P>0.05;与空白组相比,**P<0.05;与DDP5组相比,#P<0.05。图1 ASA增强DDP抗肿瘤敏感性
2.2 ASA协同DDP抑制食管鳞癌细胞中SH2B1的表达
我们进一步检测了SH2B1在人正常食管上皮细胞HEEC、食管鳞癌细胞Eca-109以及耐DDP的Eca-109/DDP细胞中的表达情况,发现SH2B1在Eca-109/DDP中表达量最高(图2A)。予以ASA(0、5、10mmol/L)+DDP(5μmol/L)处理Eca-109/DDP细胞后,SH2B1的表达量随着ASA浓度的升高而降低(F=54.0,P<0.05)(图2B)。
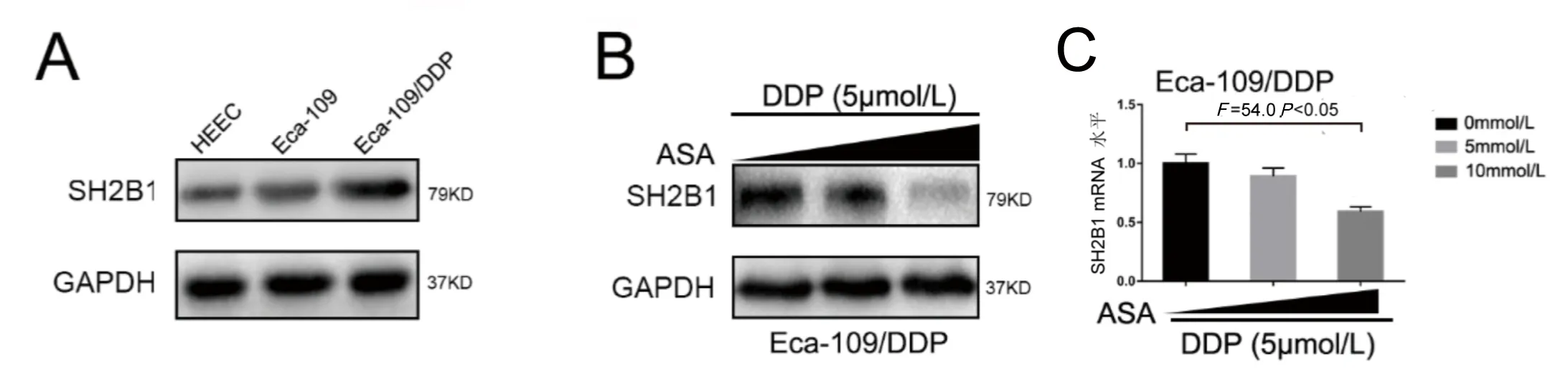
注:A图为SH2B1在HEEC、Eca-109和Eca-109/DDP细胞中的蛋白质印迹分析。B、C图为ASA 0、5、10mmol/L加DDP 5μmol/L处理的顺铂耐药Eca-109细胞(Eca-109/DDP)中SH2B1的Western印迹和mRNA水平。F=54.0,P<0.05。图2 ASA协同DDP抑制食管鳞癌细胞中SH2B1的表达
2.3 SH2B1/β-catenin途径参与ASA增强DDP对食管鳞癌细胞化疗敏感性
与Vector组相比,过表达Eca-109细胞中的SH2B1(图3A),其细胞活性(图3B)及迁移能力(图3C,t=28.2,P<0.05)均有所增强。Eca-109细胞过表达SH2B1后胞浆及胞核内β-catenin均较Vector组明显增多(图3D)。与空白组相比,ASA10+DDP5处理后细胞SH2B1、wnt通路激活的关键分子(p-GSK-3β ser9、β-catenin)以及下游转录因子(CyclinD1、TCF-4)的表达均受到不同程度抑制(t=0.96,P<0.05;t=2.68,P<0.05;t=1.25,P<0.05;t=1.98,P<0.05)。与ASA10+DDP5组相比,过表达SH2B1后Wnt通路关键蛋白GSK-3β(t=2.50,P<0.05)、β-catenin(t=2.52,P<0.05)、CyclinD1(t=1.49,P<0.05)、TCF-4(t=2.62,P<0.05)表达增高,可部分逆转ASA10+DDP5处理所带来的抑制作用(图3E)。
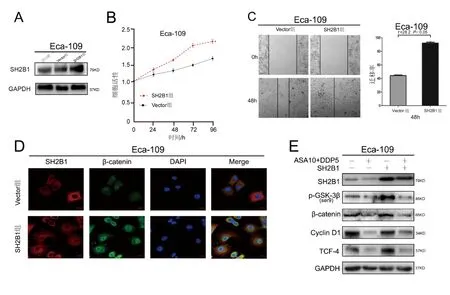
注:A图为Eca-109细胞经SH2B1稳定转染,Western blot筛选。 B图为进行CCK8测定以分析细胞活力。F时间=51.38,P<0.05。C图为进行划痕试验以分析细胞的迁移。 D图为进行免疫荧光测定以量化SH2B1和β-连环蛋白的位置和表达。与vector组相比,t=28.2,P<0.05。 E图为用或不用ASA(10mmol/L)加DDP(5μmol/L)处理具有稳定SH2B1过表达的Eca-109细胞。评估蛋白质印迹以检测SH2B1、p-GSL-3β(ser9)、β-catenin、CyclinD1和TCF-4的表达。条带归一化为GAPDH。图3 SH2B1/β-catenin途径参与ASA增强DDP对食管鳞癌细胞化疗敏感性
3 讨论
转移或复发的食管鳞癌患者预后较差,目前对于食管鳞癌的新辅助化疗在临床已广泛应用。来自流行病学研究的大量证据表明ASA可以降低结直肠癌患者的发病率和转移风险[10]。在本研究中,我们证实了ASA增加DDP对食管鳞癌细胞的化疗敏感性并可通过SH2B1/β-catenin途径抑制食管鳞癌生长。
近年来,对于ASA这一经典抗炎、抗血小板聚集药物新的适应证不断被发现,尤其是在肿瘤预防、单独或协同抗肿瘤特性[11-12]。起于结直肠癌这一消化系统肿瘤[13],并不断扩展到前列腺癌、乳腺癌、食管胃结合部癌以及肺癌等[9,14],而对其他癌症未发现其有效性,其抗肿瘤作用是不确定的[15]。我们的数据表明如果不与DDP联合使用,ASA对于食管鳞癌的抗癌效果值得怀疑(图1),这与定期或长期服用ASA在预防和治疗同样是消化系统肿瘤的结直肠癌方面显著减少的事实[16]并非一致,推测ASA抑制食管鳞癌的作用可能受药物剂量、治疗时间以及所用癌症细胞的影响。而据临床研究报道,ASA和DDP联合使用比单独使用DDP或ASA更有效地杀死癌细胞[17],然而在细胞水平中的证据相对欠缺。在本研究中,我们证实ASA增强DDP在体外显著抑制食管鳞癌细胞的活性。在ASA细胞实验中,大剂量ASA浓度为≥5mmol/L[18];而在ASA辅助癌症治疗临床随机对照试验中,小剂量和大剂量分别为75~300mg/d和300~1500mg/d[19]。在本研究中,细胞培养所用ASA浓度为5mmol/L以上的大剂量,具有增强DDP抗肿瘤毒性。尽管本实验得到了部分阳性结果,但应用大剂量的ASA所带来的副作用,尤其是出血风险,是临床不得不认真考虑的问题。
SH2B1是接头蛋白SH2B家族一员,已被确定为肥胖相关基因。我们前期研究也发现SH2B1可调控Wnt/β-catenin、PI3K/Akt等信号通路,可作为肺癌、食管癌独立的癌症分子标志物[7-9],因此,本实验我们以SH2B1为研究对象。ASA可抑制Wnt/β-catenin信号通路激活,而Wnt通路广泛参与肿瘤细胞的生长、转移以及耐药等[20]。DDP为一线食管鳞癌化疗药物,但耐药性现象不可忽视。杨静等[21]通过实验证实ASA联合DDP对食管癌Eca-109细胞增殖的抑制作用。然而与本研究相比,它只验证了Eca-109细胞并且对与具体的机制未进行深入探究。本次研究发现,SH2B1在Eca-109/DDP耐药细胞系中高表达,同时在常规DDP治疗剂量下通过增加ASA浓度(10mmol/L),可以抑制SH2B1的表达,表明SH2B1可能参与到DDP的耐药逆转。激活Wnt/β-catenin通路,导致β-catenin移位到细胞核内,是导致癌细胞阐述耐药的机制之一[22]。我们研究发现,过表达SH2B1可改变食管鳞癌细胞Eca-109的生物学功能,增强活性和迁移能力;另一方面,可诱导β-catenin入核,激活Wnt关键蛋白和转录因子,证实SH2B1/β-catenin通路参与了食管鳞癌耐DDP药物的逆转。
综上所述,我们提供了ASA增强食管鳞癌对DDP化疗敏感性的相关证据,表明ASA可能是治疗食管鳞癌患者的一种很好的辅助药物;对DDP化疗耐药的部分患者,ASA联合靶向SH2B1联合DDP化疗,以期达到副作用小、敏感性高的目的,在靶向耐药癌症的大背景下,还需要进行深入的临床前研究,以探索这一有前途的癌症治疗方法。
利益冲突:所有作者均申明不存在利益冲突。
