转录因子SREBP1通过促进SLC16A8表达调控肿瘤酸性微环境参与结直肠癌发生发展
2023-06-27彭明沙周翼刘刚冯雪雅彭洪
彭明沙,周翼,刘刚,冯雪雅,彭洪
(川北医学院第二临床医学院·南充市中心医院,1.肛肠外科;2.超声科,四川 南充 637000)
结直肠癌(colorectal cancer,CRC)是世界范围内最常见的胃肠道恶性肿瘤。2020年全球新增190万例CRC病例,有93.5万例死亡,占所有癌症死亡的1/10[1]。大多数CRC患者在早期没有明显症状,大约40%~50%的患者在诊断时已经处于晚期并有远处转移[2-3]。因此深入研究CRC的发病机制有利于该病的准确诊断、精准治疗和早期预防,也是降低CRC死亡率的有效途径。SLC16基因家族由14个成员组成,也称为单羧酸转运蛋白(monocarboxylate transporter,MCT)家族[4]。SLC16家族成员参与多种代谢途径,包括能量代谢、糖异生、T淋巴细胞活化、肠道代谢、甲状腺激素代谢和脑、骨骼肌、心脏和肿瘤细胞中的药物转运[5-6]。SLC16A8作为该基因家族成员之一,主要负责单羧酸代谢产物的运输,如丙酮酸盐、L-乳酸盐和酮体[7]。然而尚不清楚SLC16A8与CRC发生发展的关系。甾醇调节元件结合蛋白(SREBPs)是具有基本螺旋-环-螺旋亮氨酸拉链结构域的转录因子家族,可调节参与脂质合成和摄取途径的基因[8]。SREBP1由SREBF1基因编码,是控制细胞脂质代谢的调节器,可通过调控相关基因表达调节胆固醇和脂肪酸的合成及摄入[9]。越来越多的证据表明SREBP1参与了不同癌症的代谢重编程,如前列腺癌、乳腺癌和胶质母细胞瘤,是癌症治疗的潜在靶点[10]。既往研究[11]发现,肝癌微环境中乳酸浓度的增加可负反馈促进MCT1介导的乳酸摄取并下调SREBP1的表达,然而CRC中SREBP1是否参与SLC16A8介导的乳酸转运尚无报道。
本研究拟探讨SLC16A8通过调控肿瘤酸性微环境促进CRC细胞增殖和侵袭,以及转录因子SREBP1上调SLC16A8表达促进乳酸转运参与CRC发生发展的作用机制。
1 材料与方法
1.1 生物信息学分析
从TCGA数据库下载619名CRC患者的病例资料,分析SLC16A基因家族14个成员与CRC患者预后的关系。通过UALCAN (http://ualcan.path.uab.edu/analysis-prot.html)网站分析SLC16A8在结肠癌和直肠癌中的表达。通过STRING(https://cn.string-db.org/cgi/input?sessionId=bg39Tea7hbww)数据库筛选出38个SLC16A8结合蛋白,通过GEPIA2数据库(http://gepia2.cancer-pku.cn/#index)获得与SLC16A8基因表达相关的前100个基因,结合这两个数据集共138个基因。通过Metascape数据库(https://metascape.org/gp/index.html#/main/step1)对SLC16A8的功能富集进行分析。通过LinkedOmics数据库(http://www.linkedomics.org/)查询SLC16A8潜在的转录因子,再通过JASPAR(http://jaspar.genereg.net/)网站分析SLC16A8启动子序列与转录因子SREBP1可能的结合位点。通过UALCAN数据库分析SREBP1 mRNA的表达。使用Kaplan-Meier Plotter网站(http://kmplot.com/analysis/index.php?p=background)分析SREBP1表达水平与CRC预后的关系,再通过GEPIA2数据库分析SREBF1与SLC16A8表达的相关性。
1.2 细胞培养及转染
FHC(正常结直肠粘膜上皮细胞)、SW620、SW480、HCT116及HT29细胞株均购自中国科学院细胞库。FHC和HT29使用1640培养基(Gibco)培养;SW620和SW480使用L-15培养基(Gibco)培养;HCT116细胞使用10%胎牛血清DMEM培养基(HyClone;Cytiva)培养;由GenePharma合成并构建SREBP1过表达载体(OE-SREBP1)、SLC16A8过表达载体(OE-SLC16A8)及SLC16A8 siRNA。根据制造商的说明,使用Lipofectamine 3000(Invitrogen)将其转染到HCT116细胞中。阴性对照组转染阴性对照序列到HCT116细胞。SLC16A8 siRNA序列如下:5′-GCCUGUUGUUGCAGAGGAA-3′。通过拯救实验检测SREBP1是否通过正调控SLC16A8表达促进乳酸转运,分组如下:空白对照组,阴性对照组,SREBP1过表达组和SREBP1过表达+SLC16A8 siRNA组。
1.3 RT-qPCR检测细胞中SLC16A8的表达水平
吸掉培养基,PBS洗1次,吸掉PBS,加入1 mL Trizol(Invitrogen),将底部细胞吹打起来,转入1.5 mL LEP管裂解细胞,分离各细胞总RNA,在37 ℃下用RNaseR(2 U/μg)处理提取的RNA 10 min,DNA marker以ddH2O为模板作为PCR阴性对照。逆转录后,采用2-ΔΔCt法计算基因的相对表达量。SLC16A8序列如下:5- AGCCGTGAGCGTCTTCTTC-3(sense),5- GTCAGGTAGAGCTCCAGGAG-3 (antisense)。
1.4 CCK-8细胞增殖实验
设立空白对照组(不作处理),阴性对照组(添加无义序列)和SLC16A8过表达组并使用CCK-8检测细胞增殖。在96孔板中培养HCT116细胞(4×105个/mL),并根据实验目的转染48 h后向每孔添加10 μL CCK-8(Dojindo)。2 h后,测试450 nm下的OD值。
1.5 Transwell细胞体外侵袭实验
设立空白对照组(不作处理),阴性对照组(添加无义序列)和SLC16A8 siRNA组并通过Transwell检测细胞侵袭能力,使用涂有Matrigel基质的Transwell腔室测试细胞侵袭能力。将处理好的细胞悬浮在无血清培养基中,然后将无血清细胞悬液(500 μL)和添加FBS的培养基(200 μL)分别添加到上腔和下腔。进入下腔的细胞在37 ℃培养48 h后用多聚甲醛固定,然后用0.1%结晶紫染色30 min后在显微镜下拍照及计数。
1.6 细胞上清液乳酸测定
设立空白对照组,阴性对照组和SLC16A8过表达组并分析HCT116细胞上清液中乳酸表达水平,将1×104个细胞在含有10%胎牛血清和6 mmol/L葡萄糖的无糖DMEM培养基中培养,然后将细胞转移至含有5% CO2温度为37 ℃的培养箱中培养48 h。收集上清液,按照制造商的说明使用荧光乳酸测定试剂盒检测上清液中乳酸水平。
1.7Westernblot
总蛋白通过RIPA裂解物(Beyotime)收获,并通过BCA试剂盒(Invitrogen)检测。在SDS-PAGE凝胶中分离蛋白质(40 μg)后转移至PVDF膜(Millipore)。封闭后,将膜在4 ℃下暴露于一级抗体(Abcam)过夜,随后使用二级抗体(Abcam)处理1 h,并通过滴加ECL显色溶液进行显影。使用ECL化学发光后,蛋白质在凝胶成像仪(Bio-Rad)上进行显影。
1.8 双荧光素酶报告实验
分别合成荧光素酶报告基因载体pGL3-SLC16A8与荧光素酶报告基因缺失突变载体pGL3-SLC16A8-DM。将pGL3-SLC16A8或pGL3-SLC16A8-DM与pCMV-Myc-SREBP1过表达载体及内参质粒pRL-TK共转染至HCT116细胞48 h后测定荧光素酶活性。将CRC HCT116细胞接种至24孔板,将荧光素酶报告基因载体pGL3-SLC16A8或荧光素酶报告基因缺失突变载体pGL3-SLC16A8-DM与pCMV-Myc-SREBF1过表达载体或pCMV-Myc质粒及内参质粒pRL-TK共转染至细胞,设定荧光素酶报告基因载体、pCMV-Myc-SREBF1过表达载体与内参质粒pRL-TK转染比例为50∶50∶1。转染48 h后,按照Dual-Luciferase Reporter Assay System(Promega)说明书测定荧光素酶活性。
1.9 统计学分析
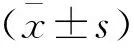
2 结果
2.1 SLC16A家族与CRC预后的关系
TCGA数据结果表明高表达SLC16A8基因的CRC患者提示预后较差(P<0.05),其余13个基因表达水平与CRC患者预后均无相关性(P>0.05)。见图1。

2.2 SLC16A8在CRC组织中高表达
UALCAN数据库结果表明SLC16A8在结肠癌和直肠癌中均高于癌旁组织(P<0.05)。见图2。

2.3 SLC16A8在CRC细胞系中的表达
RT-qPCR结果表明,SLC16A8在CRC细胞株(SW620、SW480、HCT116和HT29)中的表达水平均高于FHC细胞(P<0.05)。既往研究[12]证实SLC16A8在HCT116细胞中稳定表达,因此后续实验选择HCT116细胞。见图3。
2.4 SLC16A8对HCT116细胞增殖的影响
结果表明SLC16A8过表达组中HCT116细胞增殖能力提高(P<0.05)。见图4。

2.5 SLC16A8对HCT116细胞侵袭的影响
空白对照组(64.00±1.00)和阴性对照组(62.67±1.53)相比,SLC16A8 siRNA组(34.67±1.53)中HCT116细胞侵袭能力降低(t=27.828,22.450,P<0.05)。见图5。

2.6 SLC16A8功能富集
使用Metascape数据库对SLC16A8的功能富集进行分析,发现其主要功能聚集在乳酸转运及血管生成。见图6。

2.7 SLC16A8对细胞上清液中乳酸水平的影响
结果表明SLC16A8过表达组细胞上清液中乳酸相对表达水平增高(P<0.05)。见图7。

2.8 SREBP1可能是SLC16A8的转录因子
通过LinkedOmics数据库发现SREBP1可能是SLC16A8的转录因子,且SREBP1蛋白与SLC16A8有多个结合位点。因为评分愈高两者结合的可能性愈大,所以后续实验选择评分最高的结合位点“CTCACCCCAT”进行研究。见图8。

2.9 SREBP1蛋白可与SLC16A8靶向结合
结果显示与共转染pCMV-Myc空载体对照组(1.00±0.05)相比,过表达SREBP1可上调SLC16A8荧光素酶报告基因活性(1.79±0.03,t=-24.099,P<0.05)。将SREBP1结合位点“CTCACCCCAT”缺失后,SLC16A8荧光素酶报告基因活性降低(1.19±0.07,t=13.704,P<0.05),说明SREBP1能够通过结合“CTCACCCCAT”促进SLC16A8转录。见图9。

2.10 SREBF1基因在CRC中高表达
通过UALCAN分析SREBF1在CRC中的表达,结果表明SREBF1在CRC中的表达水平高于癌旁组织(P<0.05)。见图10。

2.11 SREBF1与患者预后相关
Kaplan-Meier Plotter网站分析结果表明高表达SREBF1的CRC患者预后较差(P<0.05)。见图11。

2.12 SREBP1正调控SLC16A8表达
GEPIA2数据库分析结果表明SREBP1与SLC16A8正相关(r=0.24,P<0.05)。接下来分析SREBP1对SLC16A8编码蛋白MCT3的影响,结果表明与阴性对照组(0.174±0.001)相比,SREBP1过表达组中MCT3蛋白相对表达水平增高(0.592±0.003,t=255.972,P<0.05)。见图12。

2.13 SREBP1通过正调控SLC16A8表达促进乳酸转运
拯救实验检测SREBP1是否通过正调控SLC16A8表达促进乳酸转运。结果显示与空白对照组(1.000±0.032)和阴性对照组(0.979±0.070)相比,SREBP1过表达组细胞上清液中乳酸表达水平增高(1.707±0.144,t=8.290,7.875,P<0.05)。但相比SREBP1过表达组,SREBP1过表达+SLC16A8 siRNA组中乳酸水平降低(1.313±0.057,t=4.403,P<0.05),说明抑制SLC16A8表达可逆转SREBP1对乳酸转运的促进作用,证实SREBP1通过正调控SLC16A8促进乳酸转运。见图13。

3 讨论
CRC是胃肠道常见的恶性肿瘤,其发病率逐年上升。大多数CRC患者确诊时已处于晚期,对于这些患者来说手术和辅助治疗效果有限且不良反应多,患者预后较差。因此深入了解CRC发生和发展的分子机制至关重要。
SLC16A8属于SLC16A基因家族,可编码单羧酸转运蛋白3(MCT3)。既往研究发现,MCT1-4蛋白主要功能为介导质子耦连的乳酸等单羧酸类物质的跨膜转运,通过参与调控肿瘤细胞能量代谢和肿瘤微环境酸化影响肿瘤细胞的生物学行为[5-6]。关于SLC16A8(MCT3)的研究较少,研究[13]发现SLC16A8在乳腺癌中低表达,但SLC16A8与CRC发生发展的关系尚无报道。TCGA数据库的分析结果表明SLC16A8与患者预后相关,高表达SLC16A8的CRC患者预后明显较差(P<0.05)。与癌旁组织相比,SLC16A8在结肠癌和直肠癌组织及CRC细胞中的表达水平均增高,表明SLC16A8可能与CRC的发生发展密切相关。CCK-8及Transwell实验结果发现,SLC16A8可促进CRCHCT116细胞的增殖和迁移,证实SLC16A8在CRC发生发展中扮演着促癌因子的角色。为明确SLC16A8发挥促癌作用的具体机制,本研究对SLC16A8的功能富集进行分析并发现其主要功能聚集在乳酸转运及血管生成。
在实体肿瘤中,由于肿瘤组织迅速增长及肿瘤组织内部血管系统不完备会导致肿瘤组织内氧气供应不足。由于氧气供给不足,肿瘤细胞只能够通过无氧酵解的方式进行能量代谢,其会造成乳酸的积累并反馈抑制糖酵解,同时导致细胞内环境酸化使细胞生长受到抑制;而SLC16A8编码的MCT3蛋白可特异性的将乳酸转运到细胞外,这对于调控糖酵解具有重要生理意义[13]。且转运至细胞外的乳酸可造成肿瘤微环境pH值降低,整体呈现酸性环境,而肿瘤酸性微环境可促进肿瘤细胞的增殖,重塑细胞外基质使肿瘤细胞侵入并转移到周围和远处的器官,还有助于建立利于免疫逃逸的免疫抑制微环境等[14]。本研究发现SLC16A8过表达组HCT116细胞上清液中乳酸表达水平明显增高,证实SLC16A8可将乳酸转运到CRC细胞外形成肿瘤酸性微环境,从而促进CRC细胞的增殖和迁移。
转录因子是指能够与真核基因的顺式作用元件发生特异性相互作用,并对基因的转录有激活或抑制作用的DNA结合蛋白。使用LinkedOmics数据库对SLC16A8的转录因子进行预测,发现其可与SREBP1结合,通过JASPAR网站发现SLC16A8启动子区与转录因子SREBP1有多个结合位点,且荧光素酶实验也证实SLC16A8可与SREBP1靶向结合。SREBP1蛋白由SREBF1基因编码,是控制细胞脂质代谢的调节器,但其与肿瘤酸性微环境的关系尚无报道[15]。通过生物信息学数据库发现SREBF1在CRC中高表达,且高表达SREBF1的CRC患者预后较差,说明SREBF1参与CRC的发生发展。研究结果表明SREBF1基因与SLC16A8基因在CRC中的表达正相关,且高表达SREBP1可促进MCT3蛋白表达,证实转录因子SREBP1可通过促进SLC16A8基因转录上调MCT3蛋白表达。通过拯救实验验证SREBP1通过正调控SLC16A8表达促进肿瘤酸性微环境的形成,结果表明SREBP1过表达组中的乳酸表达水平较空白对照组和阴性对照组增高,但与SREBP1过表达组相比,SREBP1过表达+ SLC16A8 siRNA组中的乳酸水平有所降低,说明抑制SLC16A8表达可逆转SREBP1对乳酸转运的促进作用,证实SREBP1通过正调控SLC16A8增加乳酸转运以形成肿瘤酸性微环境,并最终促进CRC细胞的增殖和迁移。
综上,本研究结果表明转录因子SREBP1可对SLC16A8的转录起到正调控作用,导致SLC16A8编码的MCT3蛋白在结直癌中高表达并促进乳酸外排以形成肿瘤酸性微环境,最终参与CRC的发生发展。SLC16A8在CRC中的研究尚少,本研究为完善CRC的发生发展机制和CRC的防治提供了新的依据和作用靶点,后续还需要更多的体外实验和体内实验对其进行验证。
