基于网络药理学及分子对接技术探讨越鞠丸加味治疗高脂血症、2型糖尿病、抑郁症“异病同治”的分子机制
2023-06-27许琳洁史大卓
许琳洁,史大卓,张 莹
高脂血症(hyperlipidemia,HL)可引起动脉粥样硬化、冠心病、脑卒中等严重心脑血管疾病。我国成人血脂异常总患病率高达40.4%[1],预计2010年—2030年心血管病病人增加约920万人[2]。国际糖尿病联盟指出,全球人群6.6%患有2型糖尿病(T2DM),且预估2030年将上升至7.8%[3]。T2DM常合并脂代谢紊乱[4],并多伴发抑郁等心理障碍,其发生率高达 30%~50%[5]。抑郁症(major depressive disorder,MDD)是目前临床常见的情感障碍性精神疾病之一,世界卫生组织(WHO)报告显示,MDD占据世界疾病负担总数的4.8%,至 2030年将跃居发病率第一位,且有发病率逐年增高、患病群体逐渐年轻化的趋势[6-7]。通过中医病机分析,以上3种疾病均有肝郁脾虚的共同证型。肝气郁结导致脾失健运,酿液为痰,日久成瘀,出现糖脂代谢紊乱及抑郁等疾患。
解诸郁之方——越鞠丸,出自朱震亨《丹溪心法》,方由苍术、香附、川芎、栀子、神曲组成,为治疗六郁证(气、血、痰、火、湿、食)之代表方。其中香附开气郁,苍术除湿郁,川芎行血郁,栀子清火郁,神曲消食郁,若五郁得解,则痰郁自消。本方诸法并举,然重在调理气机。现代研究表明,越鞠丸具有降血糖、降血脂、改善炎症反应、调节免疫等作用,对HL、T2DM、MDD等疾病疗效甚佳[8-9]。临床研究表明,在HL方面,越鞠丸可显著降低总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C),升高高密度脂蛋白胆固醇(HDL-C)水平[10],对痰浊阻遏型HL效果尤佳[11];在T2DM方面,越鞠丸可显著降低病人空腹及餐后2 h血糖[12];在MDD方面,越鞠丸可有效治疗气郁型MDD,且可升高血清脑源性神经营养因子(BDNF)水平[13]。越鞠丸可根据“六郁”的侧重进行相应加减[14],而HL、T2DM、MDD多以痰郁、火郁、气郁偏重,偏火郁可加大黄,偏痰郁可加黄芪,偏气郁多加柴胡。且通过复习文献发现,大黄、黄芪、柴胡均可对HL、T2DM、MDD“异病同治”,均具有抑制炎症、细胞增殖、氧化应激等作用。在中药功效方面,大黄清热泻火、活血祛瘀,黄芪健脾益气、利水消肿,多项动物实验证明此二味中药可有效降低TC、三酰甘油(TG)、LDL-C 及血糖水平,临床试验证明其对改善MDD症状效果显著,也有学者证明了以熟大黄微粉为活性成分的中药制剂对治疗MDD疗效确切;柴胡和解退热、疏肝解郁,对具有“肝气郁结证”诸病疗效明显。故本研究对越鞠丸加大黄、黄芪、柴胡进行网络药理学分析,以期对HL、T2DM、MDD“异病同治”的分子机制有一全面剖析。
网络药理学是以系统生物学为基础,多学科、多领域融合形成的新兴学科,其诞生和发展为探究中药成分的药理机制、复方干预疾病的分子机制提供了新思路[15]。通过构建“药物-靶点-基因-疾病”网络,研究者可从系统、整体的角度探求中药治疗疾病的物质基础和分子机制,这在很大程度上与中医的整体观念相契合[16],也为探究中医“异病同治”治疗原则的科学内涵提供了研究思路。运用这一研究模式,郭航等[4]对六味地黄丸治疗高血压、T2DM、阿尔茨海默病异病同治的机制进行探讨;吴丹等[17]挖掘出逍遥散治疗MDD、T2DM共同的分子机制,这为探究越鞠丸加味“异病同治”的机制提供了参考。本研究以网络药理学为基础,对越鞠丸加大黄、黄芪、柴胡治疗HL、T2DM 及MDD的靶点进行预测,初步探究其机制,以期为中医“异病同治”的治疗原则提供科学依据。
1 资料与方法
1.1 药物活性成分筛选及靶点预测 利用中药系统药理学分析平台(TCMSP)数据库(https://old.tcmsp-e.com/index.php)分别对香附、川芎、苍术、栀子、大黄、黄芪、柴胡的活性成分进行检索,结合文献挖掘,获得此复方的成分信息。以口服生物利用度(oral bioavailability,OB)≥30%及药物相似性(drug likeness,DL)≥0.18为过滤条件[18],筛选出此7味中药的活性成分。因神曲是由苍耳草、青蒿、苦杏仁粉等按一定比例混合发酵而成的曲剂,因此,其药效并非基于“成分-靶标”的原则来发挥,而有可能是通过调节肠道菌群发挥作用,故暂时无法基于整合药理学平台进行分析。
1.2 疾病潜在靶点筛选 利用 GeneCards(https://www.genecards.org/)、OMIM(https:// www.omim.org/)和DisGeNET(https://www.disgenet.org/)数据库分别预测关键词“hyperlipidemia”“type 2 diabetes mellitus”和“depression”的相关疾病靶点。其中GeneCards数据库筛选条件为相关性分数 (relevance score)≥20。整理并剔除重复靶点。再根据文献挖掘补充未预测到的活性成分的已知靶点,将疾病靶点与药物成分靶点取交集,分别获得越鞠丸加味治疗HL、T2DM、MDD的作用靶点。
1.3 关键靶点蛋白质-蛋白质相互作用(PPI)网络构建 通过EXCEL 2016软件,筛选出越鞠丸加味、HL、T2DM、MDD的共有靶点作为异病同治关键靶点,运用R语言Venn Diagram 1.6.20包绘制Venn图。将共同关键靶点导入STRING(https://string-db.org)软件[19]中,选择物种为“智人”,设置靶点关联的置信度为 0.40。用Cytoscape 3.8.2软件[20]美化PPI网络图,并根据节点大小和颜色深度反映其连接度(Degree)大小。
1.4 关键靶点基因本体(GO)和京都基因与基因组百科全书(KEGG)通路富集分析 GO系统包括生物学过程(BP)、分子功能(MF)和细胞组分(CC)。对关键靶点进行GO 功能分析和KEGG通路分析,挖掘各基因所代表的生物学意义。使用 R 语言Cluster Profiler 3.18.0包进行分析,并使用enrich plot 1.10.2包绘制条形图及气泡图对结果进行可视化。
1.5 关键靶点-功能-通路调控网络
1.5.1 关键靶点-功能网络 将BP、CC和MF按P值从小到大排序,分别取前20个条目及对应的关键靶点并展示,构建关键靶点-功能网络图,使用Cytoscape 3.8.2进行可视化。
1.5.2 关键靶点-通路网络 将KEGG结果按P值从小到大排序,取排名前50条通路及对应靶点,构建关键靶点-通路网络图,使用Cytoscape 3.8.2进行可视化。
1.6 关键靶点中药药理调控网络 通过提取关键靶点对应活性成分,构建中药药理调控网络,使用Cytoscape 3.8.2进行可视化。
1.7 核心靶点分子对接 从PDB(https://www.rcsb.org/)数据库得到靶点蛋白的三维晶体结构,去除原本带有的小分子及水分子,通过 AutoDock Tools 1.5.6完成蛋白质加氢、计算电荷。从 TCMSP数据库下载活性成分三维结构,并且使用 AutoDock Tools 对小分子进行电荷平衡、可旋转的键检查。后根据受体活性中心选择对接盒子范围。最后使用 AutoDock vina 计算受体、配体对接,选择输出结果中结合自由能最低的结构(结合亲和力最高)。利用 PyMol软件进行可视化。
2 结 果
2.1 越鞠丸加味活性成分筛选及靶点预测结果 通过查阅TCMSP 数据库并检索文献,得到越鞠丸加味化学成分数量:香附104个,川芎189个,苍术49个,栀子98个,大黄92个,黄芪87个,柴胡349个。按照OB≥30%、DL≥0.18筛选复方活性成分,去重后共得到87个活性成分,列出OB值排名前20位的化合物,见表1。并得到63个活性成分作用的236个药物潜在靶点(24个成分无作用靶点)。

表1 越鞠丸加味活性成分预测结果(OB值排名前20位)
2.2 越鞠丸加味治疗 HL、T2DM、MDD疾病潜在靶点及异病同治共同靶点预测 HL预测靶点数量为:GeneCards 1 485个,OMIM 3个,DisGeNET 472个,取并集获得1 669个靶点,见图1。T2DM预测靶点数量为:GeneCards 10 968个,OMIM 201个,DisGeNET 7个,取并集获得11 048个靶点,见图2。MDD预测靶点数量为:GeneCards 12 902个,OMIM 1个,DisGeNET 1 478个,取并集获得13 134个靶点,见图3 。3种疾病取交集共获得 1 246 个靶点,见图4 。将上述药物靶点与疾病靶点取交集,最终得到共有靶点127个,见图5。

图1 HL靶点

图2 T2DM靶点
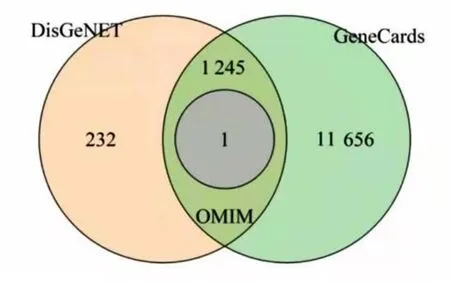
图3 MDD靶点

图4 3种疾病交集靶点

图5 药物、疾病交集靶点Venn图
2.3 越鞠丸加味“异病同治”关键靶点PPI网络 共得到127个蛋白互作关系,包括127个节点、2 409条边,见图6。将靶点按照Degree从大到小排列,列出前20项,见表2。由图6可知,蛋白激酶B1(AKT1)、白细胞介素(IL)-6、肿瘤坏死因子(TNF)、肿瘤抑制因子P53(TP53)和 IL-1β在网络中处于重要位置。
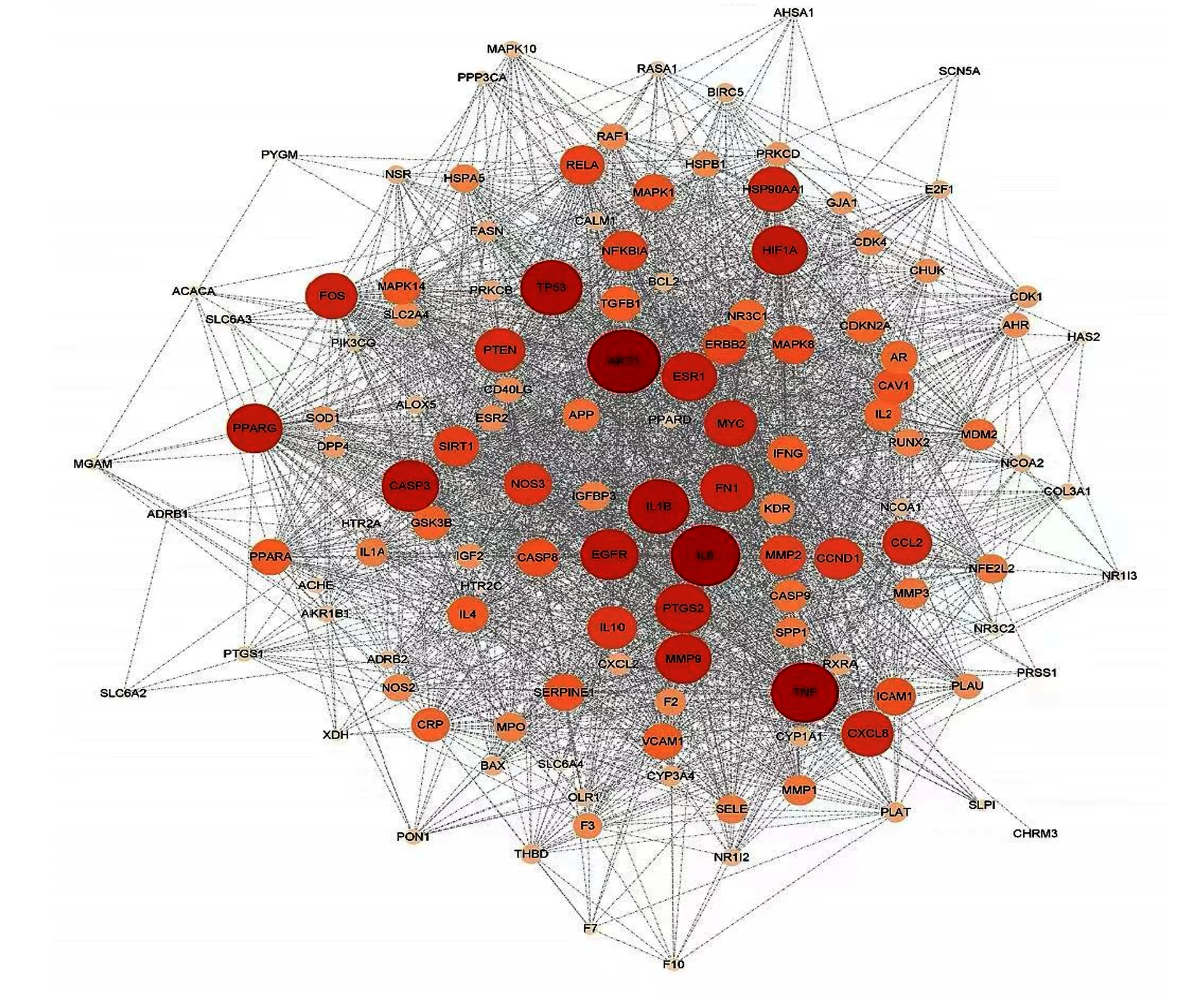
图6 关键靶点PPI网络(Degree越大,颜色越深,节点越大)

表2 越鞠丸加味治疗HL、T2DM、MDD的靶点以及对3种疾病“异病同治”的靶点预测结果(Degree排名前20位)
2.4 共有靶点GO和KEGG富集分析 使用 Cluster Profiler中默认背景基因集,共富集到 2 443 条 GO 过程(P<0.05 &Count>2),其中GO-BP 2 239 个,GO-CC 50个,GO-MF 154 个,越鞠丸加味干预HL、T2DM、MDD涉及对脂多糖反应、膜筏、核受体活性等生物学过程,见图7~图10。KEGG 分析得到脂质和动脉粥样硬化、晚期糖基化终产物(AGEs)及其受体(RAGE)信号通路、IL-17 信号通路等170 条通路(P<0.05 &Count>2),见图11~图14。

图7 关键基因 GO富集分析
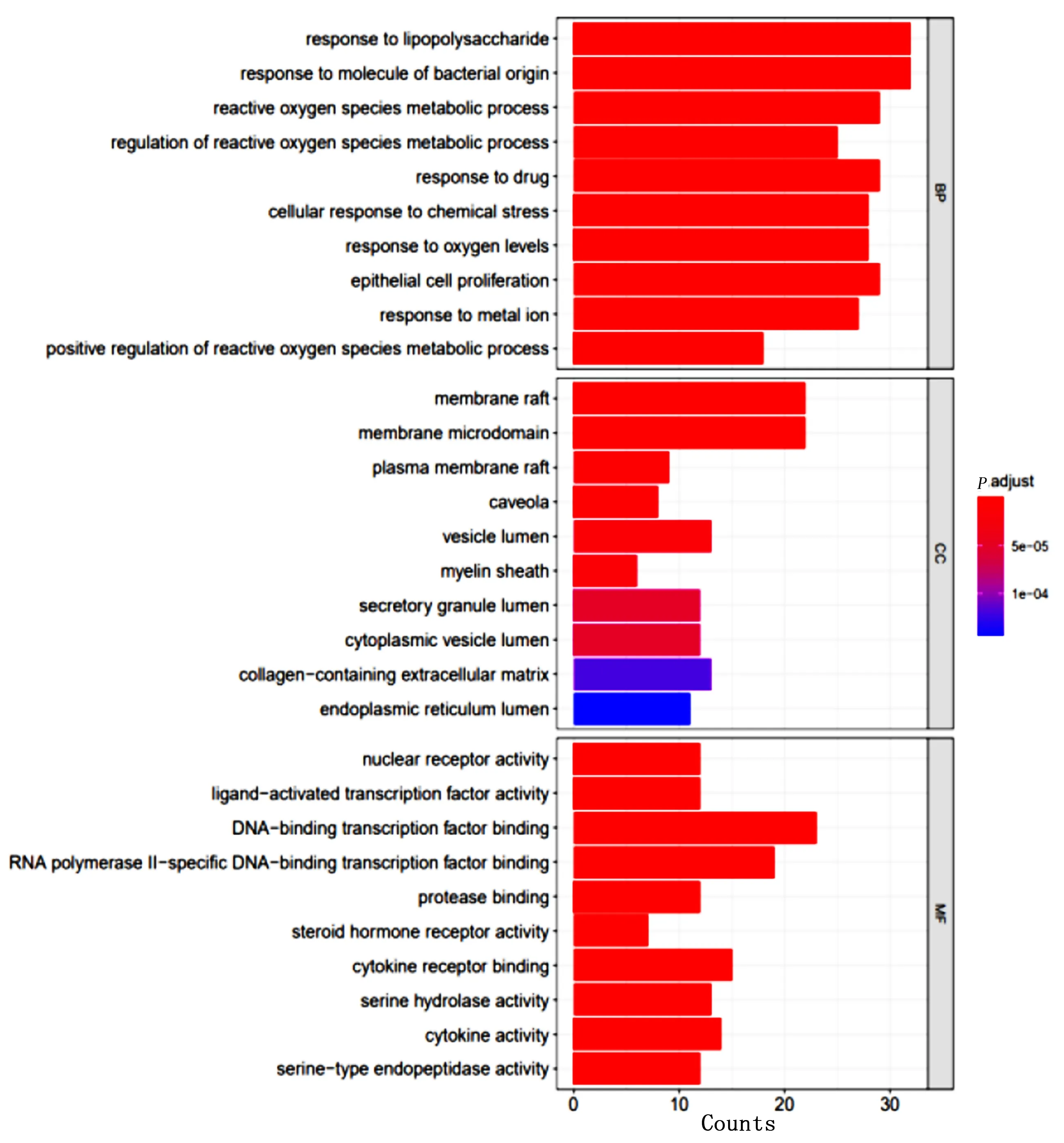
图8 HL GO富集分析

图10 MDD GO富集分析

图11 关键基因 KEGG通路富集分析

图12 HL KEGG通路富集分析

图13 T2DM KEGG通路富集分析

图14 MDD KEGG通路富集分析
2.5 关键靶点-功能-通路调控网络
2.5.1 关键靶点-功能网络 共有60个GO 条目,119个关键靶点,988个关系对。详见图15。
2.5.2 关键靶点-通路网络 包括50条KEGG通路,96个关键靶点,1 003个关系对。详见图16。
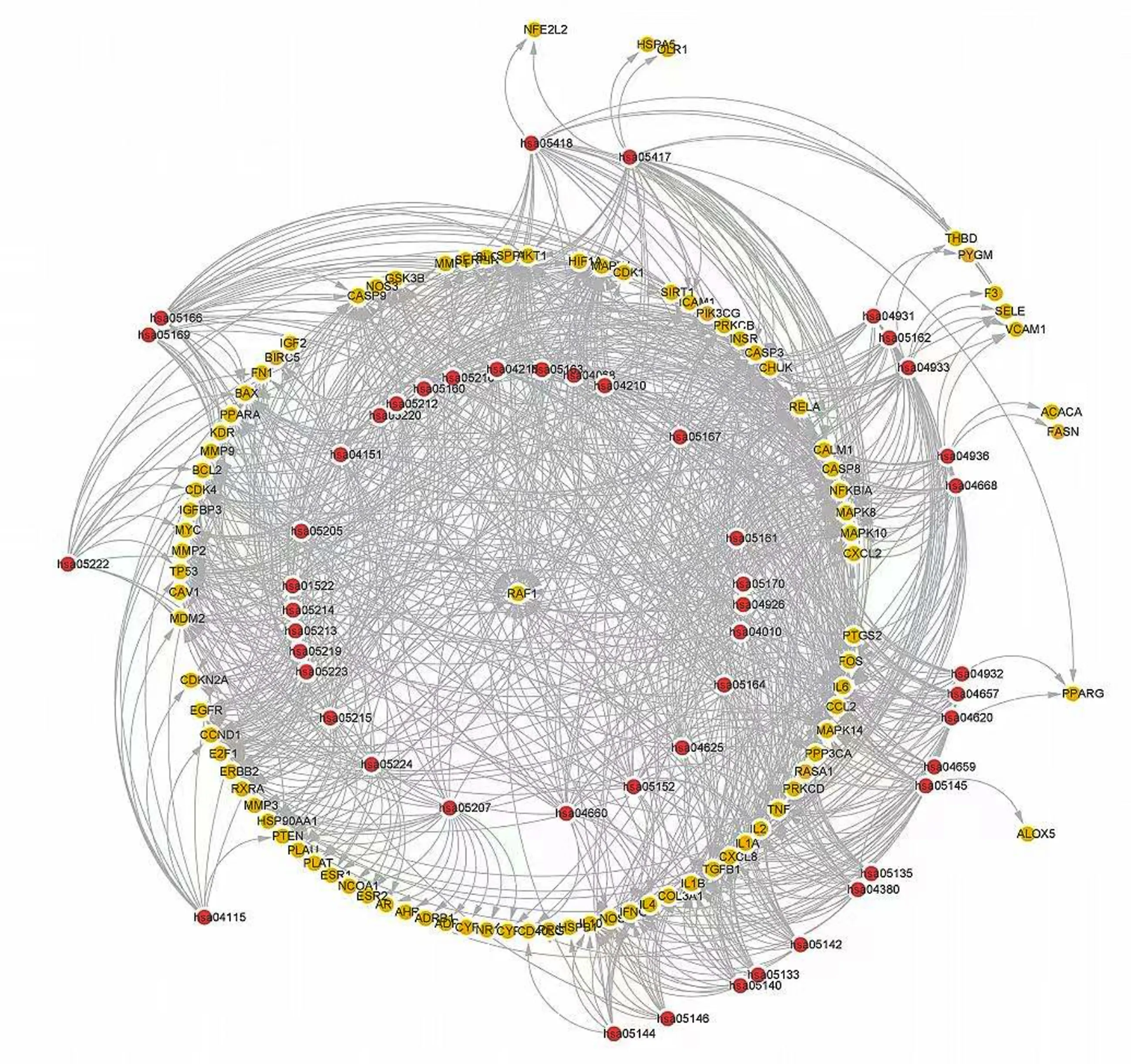
图16 关键靶点-通路网络图
2.6 关键靶点中药药理调控网络 包括越鞠丸加味7味中药,药物活性成分55个,关键靶点127个,1 270个关系对。详见图17。
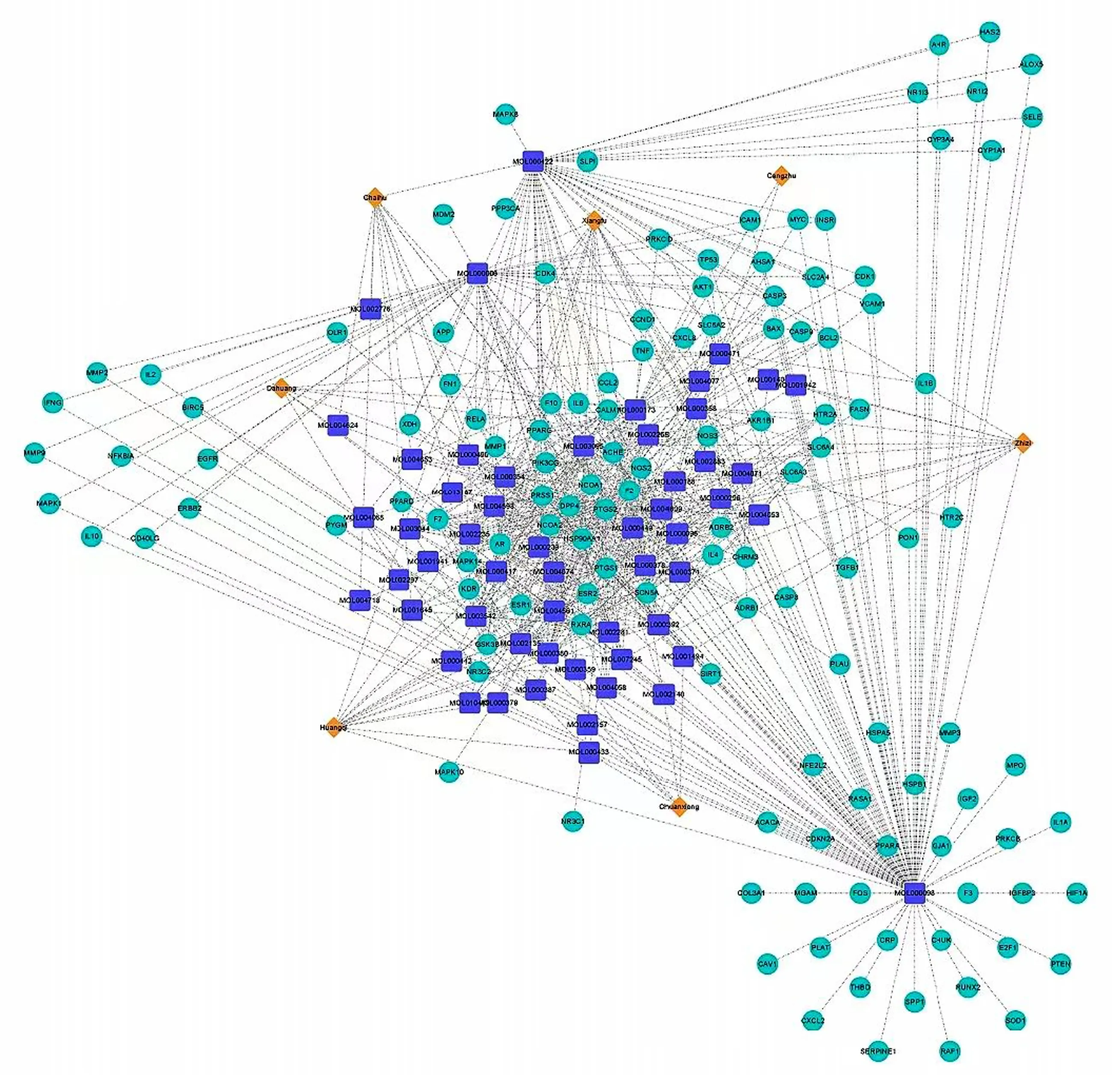
图17 关键靶点中药药理调控网络图
2.7 分子对接结果 挑选PPI 网络中Degree最高的5个靶点(AKT1、IL-6、TNF、TP53、IL-1β)作受体与其共通配体活性成分槲皮素(quercetin)进行分子对接。AKT1 对应的晶体结构PDB ID 为 1UNQ,IL-6为 1ALU,TNF 为 5UUI,TP53 为 6SL6,IL-1β为 5R8Q。一般认为对接结合能越低,配体和受体间越有可能发生作用,小于-1.2 kcal/mol(-5.0 kJ/mol)的对接结果可行,本研究选择 20 次对接结合能最低的构象绘制。分子对接模式见图18~图22。图中绿色环状模型为活性分子槲皮素,槲皮素附近的青色棍棒结构是与活性分子有氢键相互作用的氨基酸残基,黄色虚线为活性分子和氨基酸残基之间形成的氢键。

图19 槲皮素-IL-6分子对接

图20 槲皮素-TNF分子对接
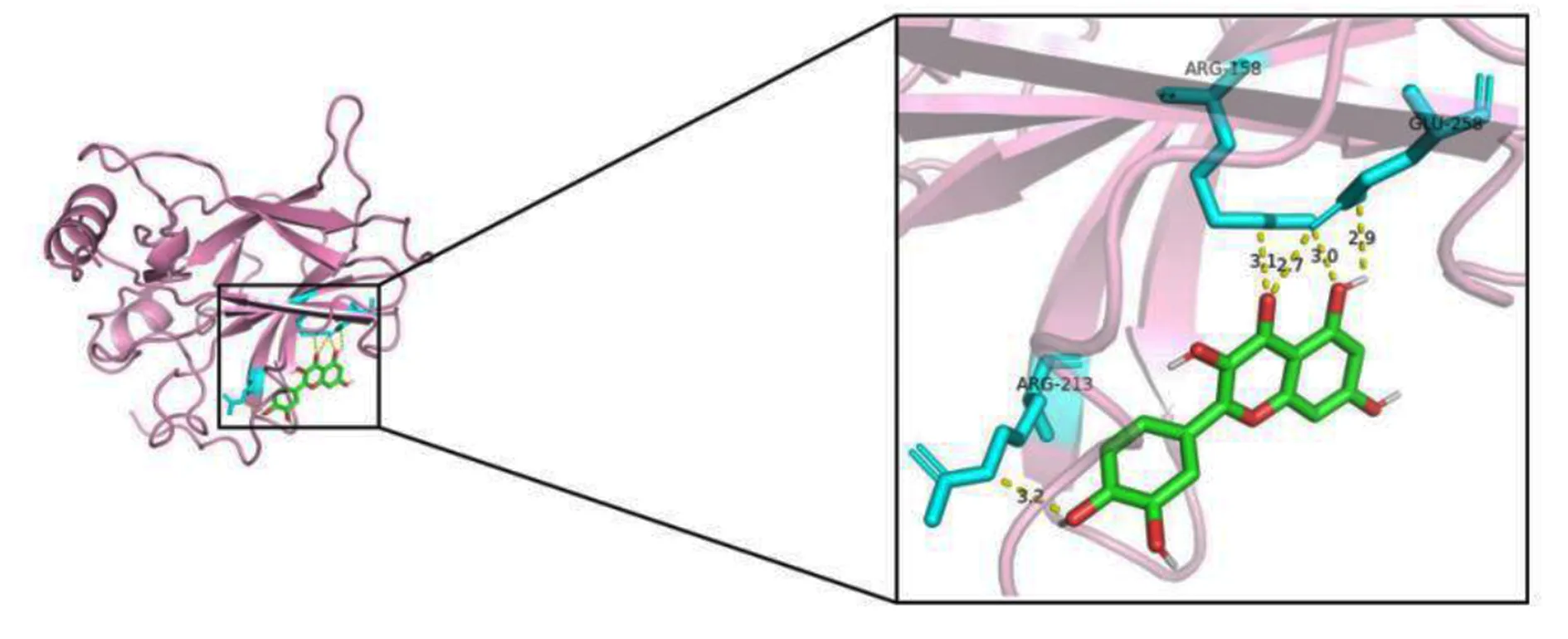
图21 槲皮素-TP53分子对接

图22 槲皮素-IL-1β分子对接
3 讨 论
HL既是临床常见独立疾病,又是导致心脑血管疾病的危险因素[21]。糖脂代谢紊乱相互影响,因此HL、T2DM常合并发生[22]。我国有30%~40%的T2DM病人伴发HL,且60岁以后更为多发[23]。研究发现,在T2DM病人中,HL可加重血管内皮细胞功能损伤,影响细胞免疫功能[24]。T2DM由于病程冗长,并发症繁多,病人多伴发抑郁状态,相关研究表明,T2DM病人心理障碍的发生率高达30%~50%[25],MDD也对T2DM的临床疗效影响较大[26]。MDD和HL之间也存在一定相关性。T2DM、HL是冠心病的危险因素,MDD不但是冠心病的高度伴发疾病,还是强危险因素[27-28],冠心病病人MDD患病率高达15%~30%,远高于普通人群(10%)[29]。查阅文献发现,HL、T2DM、MDD 3种疾病中TNF-α、IL-1β、IL-6等炎性因子均明显增多,且HL、T2DM、MDD的发病机制均可能与TNF-α、IL-1β激活Toll样受体4(TLR4)/核因子-κB(NF-κB )信号通路[30-32],促进IL-6等释放,引发细胞间炎症信号呈级联反应,从而形成“炎性因子产生-NF-κB活化-炎性因子产生”正反馈信号环,最终诱发炎症反应[33-35]有关。越来越多的研究表明,HL、T2DM、MDD病人体内炎性因子增多的同时还伴有肠道菌群失调[36]。肠道菌群和大脑间的关联枢纽主要在胆碱能抗炎通路,以调控全身/局部炎症,降低炎性反应[37]。肠道菌群失调也会导致细菌溶解,释放脂多糖,使肠黏膜屏障受损,引发并加重肠道炎性反应[38]。有研究推测其主要机制为,肠道菌群失调通过影响短链脂肪酸、脂多糖的产生并作用于肠-脑轴,引起机体炎性因子水平的改变,诱发慢性炎症,出现胰岛素抵抗和血脂代谢异常,导致糖脂代谢紊乱和神经系统受损,引发HL、T2DM、MDD[39-41]。也有其他研究认为,肠道菌群变化可影响下丘脑-垂体-肾上腺轴功能,引起机体多系统功能紊乱,导致T2DM、HL发生,并可影响海马区神经递质表达,从而出现MDD[42]。临床研究表明,HL、T2DM、MDD可通过诱发炎症反应,促进血管内斑块形成,使斑块不稳定性增加,损害血管内皮功能,导致动脉粥样硬化等心血管疾病的发生发展。HL、T2DM、MDD之间相互作用、互为因果,均存在明显的炎症反应,临床上常相伴发生,且均是心血管疾病危险因素,但目前对其共同致病机制及治疗方案尚需进一步研究。
中医学虽无“高脂血症”“2型糖尿病”“抑郁症”的病名记载,但根据其临床表现HL可归属于“肥胖”“痰湿”等病,T2DM归属于“消渴”范畴,MDD归属于“郁病”“失眠”等病,3种疾病核心病机总属“本虚标实”,以“肝郁脾虚”为共同证候,且均有肝气郁滞之标证。越鞠丸为“治诸郁之方”,根据中医治则,对病机为肝气郁滞的不同疾病均有显著疗效,如MDD、HL、T2DM、胃肠道功能紊乱、妇女月经病等[43-44]。在此基础上,越鞠丸可加大黄、黄芪、柴胡实现对HL、T2DM、MDD“异病同治”。本研究通过分析越鞠丸加味的网络药理学,对HL、T2DM、MDD“异病同治”的分子机制有了全面剖析,为临床异病同治用药提供科学依据。
HL、T2DM、MDD均存在明显炎症反应,且3种疾病与细胞免疫功能变化密切相关[45-46]。本研究结果显示,越鞠丸加味干预HL、T2DM、MDD涉及对脂多糖反应等生物学过程,以及脂质和动脉粥样硬化、AGE-RAGE信号通路等关键通路。由此可见,本方主要通过抑制炎症及调节免疫功能发挥对 HL、T2DM、MDD“异病同治”的作用。
脂多糖是革兰氏阴性菌细胞壁主要成分,可引发天然免疫应答及能量代谢重编程。HL、T2DM中,细菌细胞壁降解,大量脂多糖释放入血,刺激单核/巨噬细胞,抑制其氧化磷酸化,免疫细胞通过代谢重编程增强糖酵解及脂肪酸代谢,并激活AKT/NF-κB通路[47],诱导产生IL-1β、IL-6及TNF-α,发挥促炎作用;脂多糖诱导的抑郁模型在引起IL-1β、IL-6分泌的基础上,进一步诱发中枢神经免疫反应,影响大脑功能,最终导致愉悦感丧失,引发MDD[48]。因此,生物能量转化使代谢与炎症及免疫功能关系密切。AGE-RAGE 信号通路与T2DM、HL高度相关[49],此通路激活可调节NF-κB、血管细胞黏附分子-1(VCAM-1)和炎性因子产生,诱导炎症和氧化应激反应[50]。T2DM 病人AGEs-RAGE 结合后可启动胞内信号转导,导致胰岛细胞凋亡,或加速血管内皮损伤,引发 T2DM并发症[51]。IL-17信号通路与神经细胞凋亡密切相关[52],可通过调节免疫反应在T2DM、HL、MDD等疾病中起关键作用[53]。本研究结果显示,AKT1、IL-6、TNF等为“异病同治”关键靶点,并与槲皮素进行分子对接。其中TNF-α、IL-6与HL关系密切[54],MDD病人神经炎症与IL-1β、IL-6、TNF-α等亦有关[55]。AKT是调节细胞功能的复杂信号中心,在脂多糖诱导的促炎反应中起重要作用[56],共3种亚型,即AKT1、AKT2、AKT3。AKT1 在心、脑组织中表达最丰富,可通过一系列下游底物的丝氨酸和/或苏氨酸磷酸化介导调节血管生成过程,并通过 AKT1-内皮型一氧化氮合酶(eNOS) 信号轴调控一氧化氮(NO)产生,减轻缺血再灌注对心肌细胞的损伤[57];同时也能阻止胰岛素受体去磷酸化,调节葡萄糖转运途径,在治疗T2DM中作用重大[58]。TNF可增加脂质吸收,减少代谢,诱导脂肪和周围组织炎症反应[59],研究表明,黄芪多糖可通过调节TNF-α水平减轻胰岛素抵抗[60]。IL-6可加速巨噬细胞摄取低密度脂蛋白胆固醇(LDL-C),引起血管壁损伤并增加脂质在血管内沉积,也可调节黏附分子及其他炎性因子表达,加重炎性反应[61]。槲皮素广泛存在于黄芪、川芎等中药,具有降脂、抗炎、调节免疫及保护心肌缺血-再灌注损伤等功能[62],通过保护神经和血管,降低心血管疾病发病率,对HL、T2DM有较好疗效[63-65],其治疗潜力被广泛报道[66-67]。
4 小 结
本研究通过网络药理学、分子对接的研究方法,预测越鞠丸加味可能通过AKT1、IL-6、TNF等靶点,作用于脂质和动脉粥样硬化、AGE-RAGE等信号通路,抑制炎症及调节免疫发挥对 HL、T2DM、MDD“异病同治”的作用。但本研究手段主要依据现有数据库和已有实验数据构建网络,原始数据及图谱信息可能存在偏倚,且本研究仅在生物信息学层面进行,无法解决临床中药复方用药的量-时-效等问题,因此,本研究预测结果仍需今后进行多中心、大样本的临床研究验证。
:
