冬小麦籽粒主要品质性状的全基因组关联分析
2023-06-27董一帆任毅程宇坤王睿张志辉时晓磊耿洪伟
董一帆,任毅,程宇坤,王睿,张志辉,时晓磊,耿洪伟
冬小麦籽粒主要品质性状的全基因组关联分析
董一帆1,任毅1,程宇坤1,王睿1,张志辉1,时晓磊2,耿洪伟
1新疆农业大学农学院/新疆农业大学优质专用麦类作物工程技术研究中心/新疆小麦产业体系创新团队,乌鲁木齐 830052;2新疆农业科学院农作物品种资源研究所,乌鲁木齐 830091
【目的】小麦籽粒品质是影响小麦加工品质和营养价值的重要因素。挖掘与小麦籽粒品质性状显著关联的位点及候选基因,为拓宽对小麦品质性状遗传机理的理解和分子标记辅助优质小麦育种提供依据。【方法】通过对来自国内外259份冬小麦品种(系)的蛋白质含量、湿面筋含量、淀粉含量、沉降值和籽粒硬度等5个品质性状进行测定,并结合90K SNP芯片进行全基因组关联分析,将定位到的显著性关联位点进行单倍型分析。【结果】5个性状均符合正态分布且在不同环境间均表现出丰富的变异,沉降值的变异系数最大(20.11%—24.42%)。各性状在基因型、环境、基因型×环境间均呈现出极显著差异(<0.001),广义遗传力为0.77—0.84。通过全基因组关联分析,共检测到44个与5个性状显著关联(<0.001)的位点,分布在除1D和3D染色体外的其他19个连锁群。在2个及以上的环境中均稳定存在的位点18个,涉及蛋白质含量(12个)、湿面筋含量(9个)、淀粉含量(11个)、沉降值(12个)和籽粒硬度(7个)等5个性状,能解释遗传变异的4.27%—10.98%。其中13个为多效应位点,与蛋白质含量、湿面筋含量、沉降值和淀粉含量等性状相关联的多效应位点最多(7个)。位于2B、2D和3A染色体的、和位点同时在2个环境和BLUP值下被检测到,表型贡献率的范围为4.32%—7.07%。通过对多环境下存在且表型贡献率高的多效应位点进行单倍型分析,在5D染色体的位点发掘到与蛋白质含量、沉降值和淀粉含量等性状显著相关的Hap1、Hap2、Hap3和Hap4等4个不同单倍型,其中,Hap1是高淀粉含量单倍型(<0.001),而Hap2和Hap3均为高蛋白质含量和沉降值的单倍型(<0.05),4个单倍型分别占74.22%、16.21%、6.92%和2.65%。对不同来源冬小麦的单倍型分布频率进行分析,其中,高蛋白质含量和沉降值单倍型Hap2的分布频率由高到低为黄淮冬麦区>北部冬麦区>国外品种>长江中下游冬麦区>西南冬麦区。对稳定遗传的位点进行候选基因的挖掘,筛选到10个可能与小麦籽粒品质相关的候选基因。【结论】检测到18个与籽粒品质性状显著关联的稳定位点,鉴定到4个不同单倍型,筛选出10个与籽粒品质相关的候选基因。
冬小麦;品质;SNP标记;GWAS;单倍型;候选基因
0 引言
【研究意义】小麦因其特殊的面筋蛋白,可用于面包、馒头、面条和饺子等多种面食的制作,在我国粮食生产中占据举足轻重的地位[1-2]。随着人们生活水平的提高和消费结构的转变,人们更趋向于营养、丰富和科学的饮食消费。培育优质专用小麦和提高小麦品质已成为现阶段小麦育种的重要目标[3]。蛋白质含量、湿面筋含量、沉降值、淀粉含量和籽粒硬度是小麦籽粒的主要品质性状,也是评价小麦品质的重要指标。蛋白质含量是小麦籽粒的重要营养成分,同时也能影响面团的形成时间和稳定时间,与营养和加工品质密切相关[4]。湿面筋含量可以间接反映面粉中的蛋白质含量,并主要影响面粉的弹性和黏性等加工品质。淀粉含量对于后期的面粉加工具有重要影响,是重要的加工品质之一[5]。沉降值可以反映面筋蛋白的含量及质量,是衡量面筋强度的重要参数[6]。籽粒硬度可以通过影响小麦出粉率、面粉颗粒大小和破损淀粉含量,从而影响加工品质[7-8],这些品质指标对于小麦品质育种具有重要的指导作用。因此,研究小麦籽粒品质性状的遗传机理对小麦品质的遗传改良具有重要意义。【前人研究进展】小麦籽粒品质性状是多基因控制的数量性状[9],是基因型和环境共同作用的结果[10-12]。全基因组关联分析(genome wide association study,GWAS)利用遍布于基因组的高密度分子标记,能找到与性状相关的标记或基因,具有检测范围广、精度高等优点。因此,全基因组关联分析已成为植物数量性状基因挖掘最重要的方法之一。PU等[13]利用55K SNP芯片对236份小麦品种进行关联分析,在1B、1D、2A、2B、2D、3B、3D、5D和7D染色体上定位到15个与蛋白质含量、湿面筋含量和淀粉含量显著相关的标记,表型贡献率为4.2%—10.75%。前人研究表明籽粒硬度是由1对主效基因和一些微效修饰基因所控制,其中,主效基因是位于5DS染色体的和(和),这两个基因构成了小麦籽粒硬度的分子基础,微效基因主要位于1A、2A、2D、3A、5A、5B和6D染色体[14-16]。胡文静等[17]利用171份小麦品种在4个环境条件下对籽粒硬度进行关联分析,在1A、1B、2A和7A染色体定位到4个位点可以在所有环境下均被检测到,贡献率为7.15%—10.86%。LOU等[18]利用19 552个SNP标记对486份自然群体进行关联分析,定位到35个与蛋白质含量、淀粉含量、湿面筋含量和籽粒硬度等相关的稳定QTL,贡献率为2.60%—12.68%,其中,位于5D和6A染色体的和含有硬度基因和蛋白质含量基因。严勇亮等[10]利用23 632个SNP标记对298份春小麦品种(系)进行关联分析,定位到85个与籽粒品质显著关联的稳定位点,贡献率为3.70%—10.90%,并在1B、3A、6A和7A染色体发现了与品质相关的新位点。【本研究切入点】虽然前人已对小麦品质性状定位取得了一定的进展,但由于小麦品质性状的遗传机理较为复杂,且关联分析受限于研究材料和研究方法的不同,定位到的结果也不尽相同,因此,需深入挖掘与小麦品质性状相关的新位点。【拟解决的关键问题】本研究以来自国内外的259份冬小麦品种(系)为材料,对其蛋白质含量、湿面筋含量、淀粉含量、沉降值和籽粒硬度等品质性状进行测定,结合90K SNP芯片进行全基因组关联分析,以期发现新的控制小麦品质性状相关的SNP位点,并发掘品质性状相关单倍型,为分子标记辅助优质小麦育种提供依据。
1 材料与方法
1.1 供试材料
供试小麦品种(系)共计259份,由新疆农业大学优质专用麦类作物工程技术研究中心收集保存,包括203份我国主要冬麦区主要推广的品种(系)和56份国外冬小麦品种(系)。国内材料来自黄淮冬麦区(110份),北部冬麦区(46份),长江中下游冬麦区(28份)和西南冬麦区(19份);国外材料主要来自法国、意大利和阿根廷等,供试材料分别于2018—2019年和2019—2020年种植于新疆农业科学院玛纳斯试验站,田间种植采用随机区组设计,3次重复,3行种植,行长2 m,行距20 cm,田间管理按当地农艺规程进行。
1.2 表型测定
为保证测量数据的准确性,待小麦材料进入蜡熟后期时,人工对每一品种(系)的小麦材料进行收割,将收获的小麦材料自然晾干,并储存2个月后利用瑞典Perten IM9500型近红外谷物分析仪测定小麦每一品种(系)的蛋白质含量(grain protein content,GPC)、湿面筋含量(wet gluten content,WGC)、淀粉含量(grain starch content,GSC)、沉降值(sedimentation value,SV)和籽粒硬度(grain hardness,GH),每份品种(系)重复测定3次,使用校准样品校准测量值,校准样品的品质数据由河北省农林科学院粮油作物研究所利用国标法检测获得。
1.3 表型数据的统计分析
采用Excel 2016和SPSS 26.0软件对表型数据进行统计分析,使用QTL IciMapping V4.1软件进行方差分析,计算广义遗传力公式为:2=g2/(g2+e2),其中,g2为遗传方差,e2为环境方差。
1.4 群体结构与连锁不平衡分析
实验室前期利用90K SNP芯片对供试材料进行了基因分型,剔除最小等位基因频率(minor allele frequency,MAF)<5%和缺失率>20%的SNP标记,共获得16 737个高质量SNP标记,应用Power Marker软件计算多态性信息量(polymorphic information content,),=1-Σ2(2表示第个位点的第个等位变异出现的频率)。从筛选过的标记中,随机选取2 000个最小等位基因频率大于10%且在染色体上均匀分布的SNP标记,利用Structure 2.3.4软件进行群体结构分析。以位点间的相关系数平方(2)作为衡量多态性位点两两之间的连锁不平衡(linkage disequilibrium,LD)参数,通用Tassel 5.0软件计算2,以第95百分位的2值作为阈值估测LD衰减距离。GWAS结果中,超过LD衰减距离的位点则认为是2个不同的位点。
1.5 全基因组关联分析及候选基因的筛选
采用Meta-R软件对2个环境的籽粒品质表型数据进行联合分析,获得最佳线性无偏估计值(best linear unbiased prediction,BLUP),根据BLUP值,进行曼哈顿图和Q-Q图的作图。用导入90K SNP标记基因芯片的Tassel 5软件应用MLM(Q+K)混合线性模型对2个环境及联合环境下的BLUP值表型数据进行全基因组关联分析,以=1.0×10-3为阈值,判定SNP标记与目标性状关联的显著性。
将稳定SNP标记的延伸序列在普通小麦中国春基因组数据库(https://urgi.versailles.inrae.fr/blast_iwgsc/)进行BLAST比对,并在Wheat Omics 1.0数据库(https://wheatomics.sdau.edu.cn/)中进行基因功能注释。
1.6 单倍型分析
用Haploview软件对定位到的显著性关联位点进行单倍型分析。
2 结果
2.1 小麦籽粒品质性状的表型变异
通过对259份冬小麦品种(系)的蛋白质含量、湿面筋含量、沉降值、淀粉含量和籽粒硬度等5个籽粒品质性状的表型进行统计分析和方差分析(表1),结果表明,不同环境间各性状均表现较大差异,其中,淀粉含量变异系数最小,沉降值变异系数最大。淀粉含量的峰度接近于1,其余各性状的峰度和偏度绝对值均小于1,服从正态分布,符合数量性状特征。2019—2020年的供试小麦除淀粉含量平均值外其余各项指标与2018—2019年相比均有下降。259份供试材料的5个品质性状在基因型、环境、基因型及环境互作间均呈现出极显著差异(<0.001)。所测性状的广义遗传力(2)范围为0.77—0.84,其中,淀粉含量遗传力最低(0.77),籽粒硬度的遗传力最高(0.84)。5个性状的遗传力均较高,说明这些品质性状主要受遗传变异的影响。
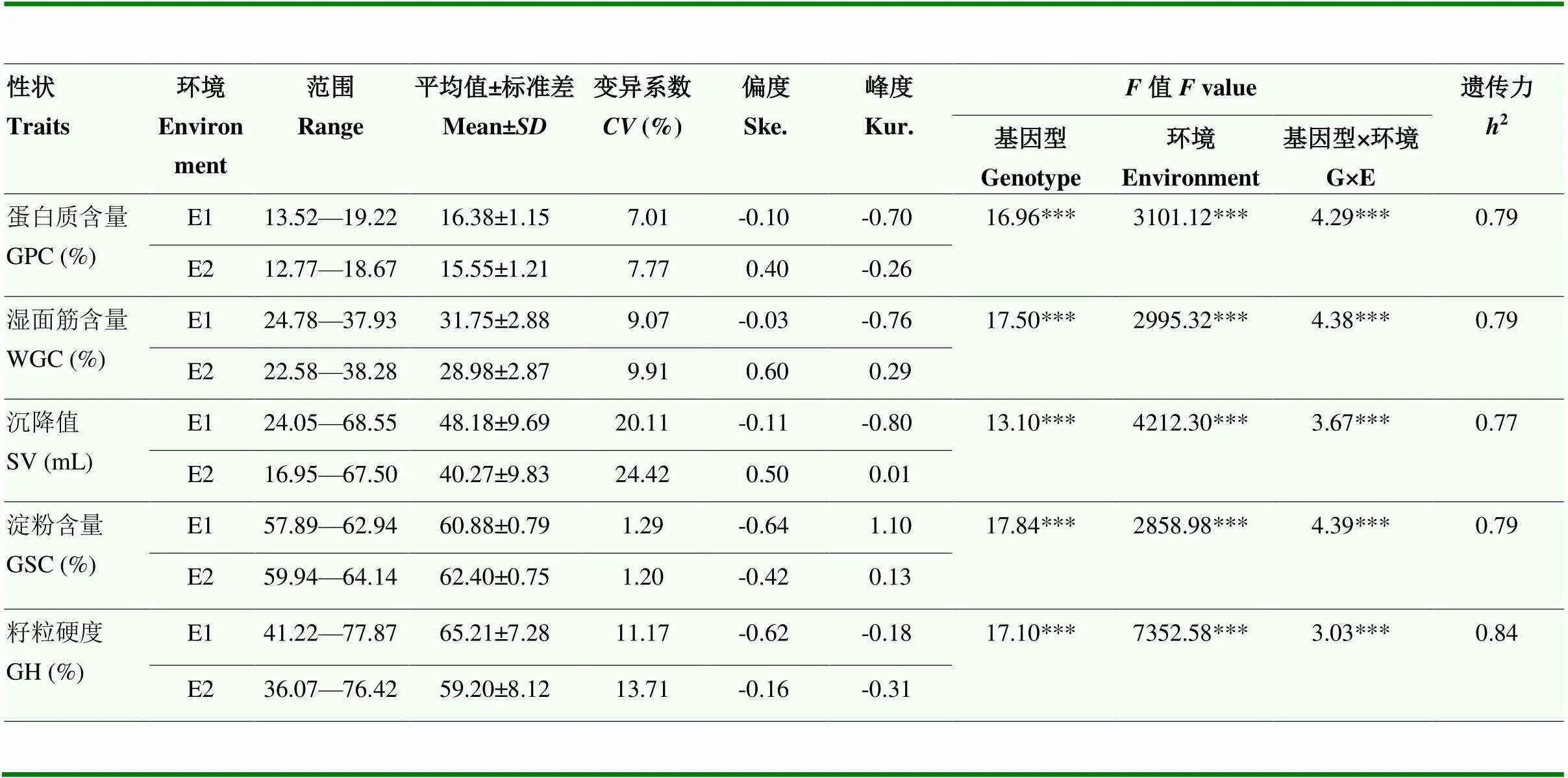
表1 259份自然群体小麦籽粒品质性状统计分析
GPC:蛋白质含量;WGC:湿面筋含量;SV:沉降值;GSC:淀粉含量;GH:籽粒硬度;E1:2018—2019环境点;E2:2019—2020环境点,下同。***代表差异显著水平<0.001
GPC: grain protein content; WGC: wet gluten content; SVsedimentation value;GSC: grain starch content; GH: grain hardness; E1: 2018-2019 environmental point; E2: 2019-2020 environmental point. the same as below.***Significant at<0.001
5个籽粒品质性状的变异特征在不同麦区中表现不尽相同,变异范围为0.67%—19.76%,其中,蛋白质含量、湿面筋含量和沉降值变异系数最小的是西南冬麦区,淀粉含量变异系数最小的是长江中下游冬麦区,籽粒硬度变异系数最小的是黄淮冬麦区,整体来看,西南冬麦区的品质性状表现最为稳定。除淀粉含量外,其余4个品质性状的均值均表现为黄淮冬麦区>北部冬麦区>长江中下游冬麦区>西南冬麦区>国外品种,黄淮冬麦区小麦品种(系)的品质表现较为优异(表2)。
2.2 SNP多态性和群体结构分析
90K基因芯片中筛选出16 737个SNP标记,物理图谱总长度为14 043.30 Mb,相邻标记间的平均物理距离为0.84 Mb。A、B和D基因组分别包含7 158(42.77%)、7 361(43.98%)和2 218个(13.25%)标记。A和B基因组的染色体组所用标记数目、标记密度、遗传多样性和多态信息含量均高于D染色体组。全基因组的变异范围为0.01—0.51,平均值为0.26(电子附表1)。
利用Structure 2.3.4软件进行群体结构分析,在K=3处ΔK值最大,并且曲线变化程度最大(图1-A)。由图1-B可以看出供试材料可以分为3个亚群,该结果与PCA分析结果一致(图1-C)。亚群1包含117份(45.17%)品种(系),主要来自河南(21份,17.90%)、陕西(21份,17.90%)和四川(15份,12.80%);亚群2包含74份(28.57%)品种(系),主要来自国外(34份,45.95%)和北京(24份,32.40%);亚群3包含68份(26.25%)品种(系),主要来自河南(29份,42.60%)。
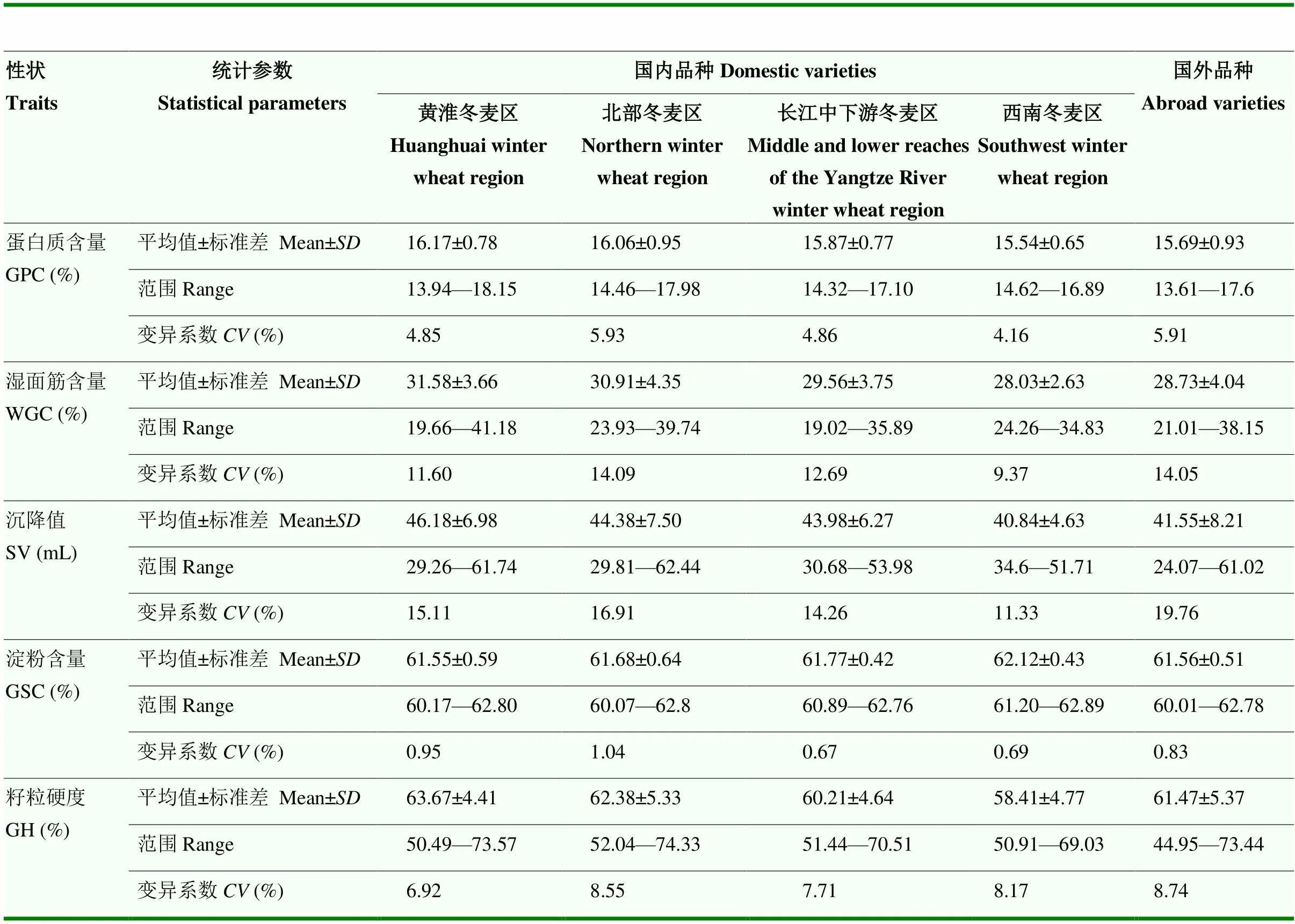
表2 基于BLUP值的国内外冬小麦品种(系)籽粒品质性状统计分析
2.3 标记-性状关联分析
基于LD衰减距离,将在物理图谱上前后10 Mb区间内的位点认定为一个候选位点,利用90K基因芯片分型的16 737个SNP标记对2个环境及BLUP值表型数据进行全基因组关联分析,共检测到94个与5个籽粒品质性状显著关联的SNP标记(<0.001),除1D和3D染色体外均有分布。其中51个标记在2个及以上的分析环境中出现,是比较稳定的SNP标记,分布于1A、2A、2B、2D、3A、3B、4A、4B、5B、5D、6A和7A染色体的18个位点内,表型贡献率为4.27%—10.98%(图2和表3)。其中,与蛋白质含量相关的12个稳定关联的标记分布于1A、2B、2D、3A、3B、4A、4B、5B、5D和7A染色体,表型贡献率为4.27%—8.55%;与湿面筋含量相关的9个稳定关联的标记分布于1A、2B、3A、3B、4A、4B、5B和7A染色体,表型贡献率为4.32%—8.91%;与沉降值相关的12个稳定关联的标记分布于1A、2B、2D、3A、3B、4A、4B、5B、5D、6A和7A染色体,表型贡献率为4.25%—8.06%;与淀粉含量相关的11个稳定关联的标记分布于1A、2B、2D、3A、4A、4B、5B、5D、6A和7A染色体,表型贡献率为4.27%—7.59%;与籽粒硬度相关的7个稳定关联的标记分布于2A、2B、3B、5D和7A染色体,表型贡献率为4.66%— 10.98%。
在这些显著关联的稳定位点中,有13个位点同时与2个及2个以上籽粒品质性状相关联。位于2B、2D和3A和染色体的、和位点同时在2个环境及BLUP值中被检测到,其中,和位点与蛋白质含量、湿面筋含量、沉降值和淀粉含量显著关联,位点与蛋白质含量、沉降值和淀粉含量显著关联,贡献率为4.32%— 7.07%。位于1A、2B(2)、3A、4A、4B和5B染色体的、、、、、和与蛋白质含量、湿面筋含量、沉降值和淀粉含量显著关联,贡献率为4.27%—7.59%。位于3B染色体的与蛋白质含量、湿面筋含量、沉降值和籽粒硬度显著关联,贡献率为4.55%— 8.91%,位于2D、5D和7A和染色体的、、与蛋白质含量、沉降值和淀粉含量显著关联,贡献率为4.53%—8.52%。位于6A染色体的与沉降值和淀粉含量显著关联,贡献率为4.44%— 5.44%。位于7A染色体的与蛋白质含量、湿面筋含量和籽粒硬度显著关联,贡献率为4.64%—6.40%(表4)。
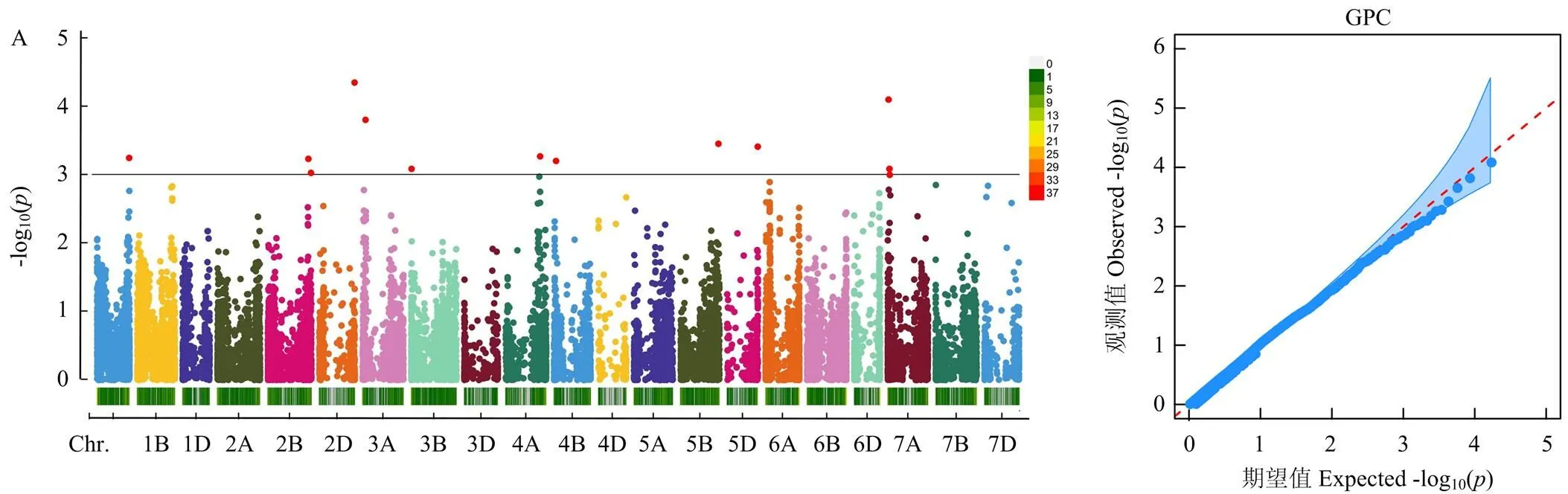
A:蛋白质含量;B:湿面筋含量;C:沉降值;D:淀粉含量;E:籽粒硬度
A: Grain protein content; B: Wet gluten content; C: Sedimentation value; D: Grain starch content; E: Grain hardness
图2 基于BLUP值的小麦籽粒品质性状的曼哈顿图和Q-Q图
Fig. 2 Manhattan and Q-Q plots of wheat grain quality traits based on BLUP values
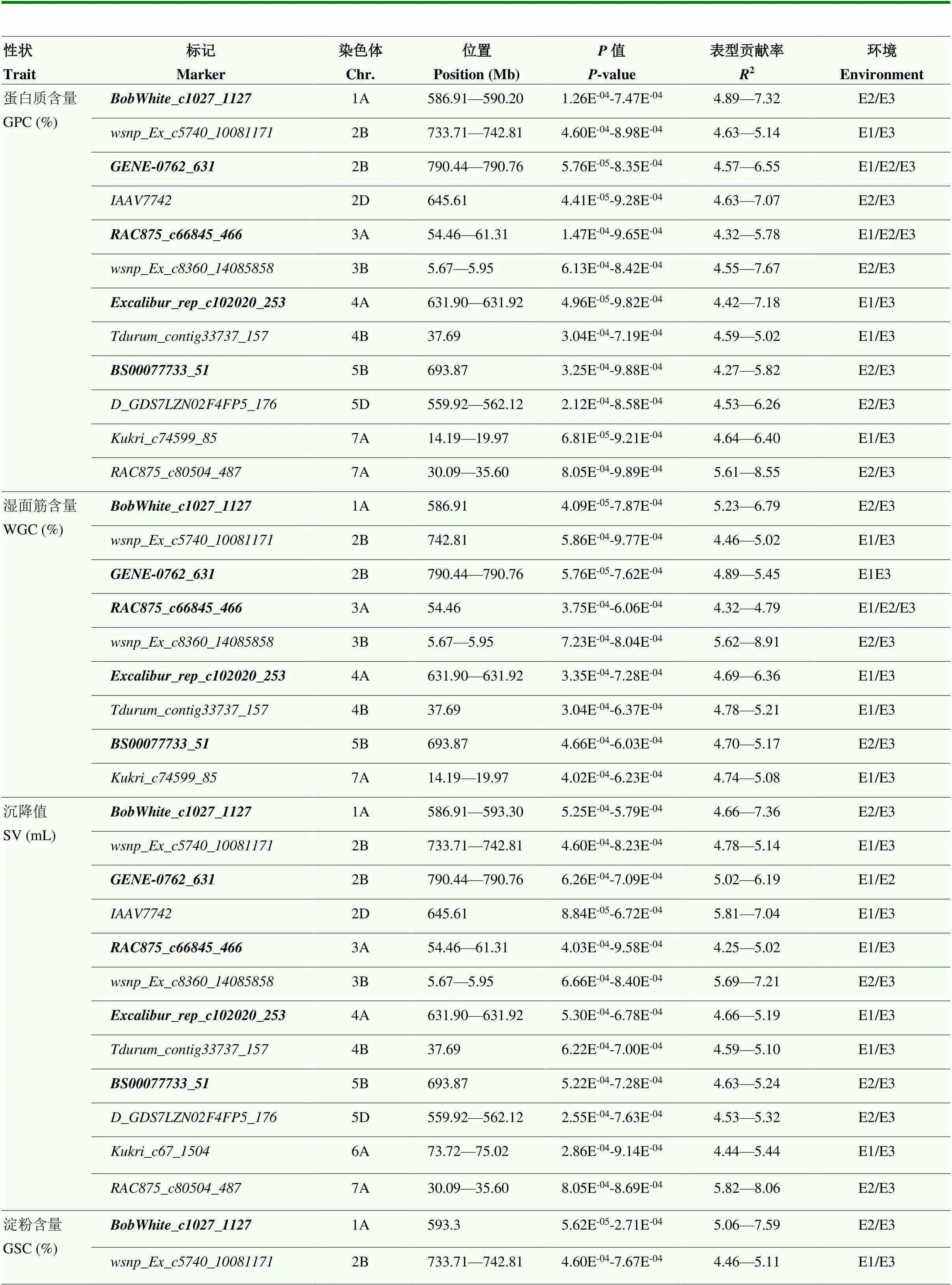
表3 与小麦籽粒品质性状显著关联的稳定位点
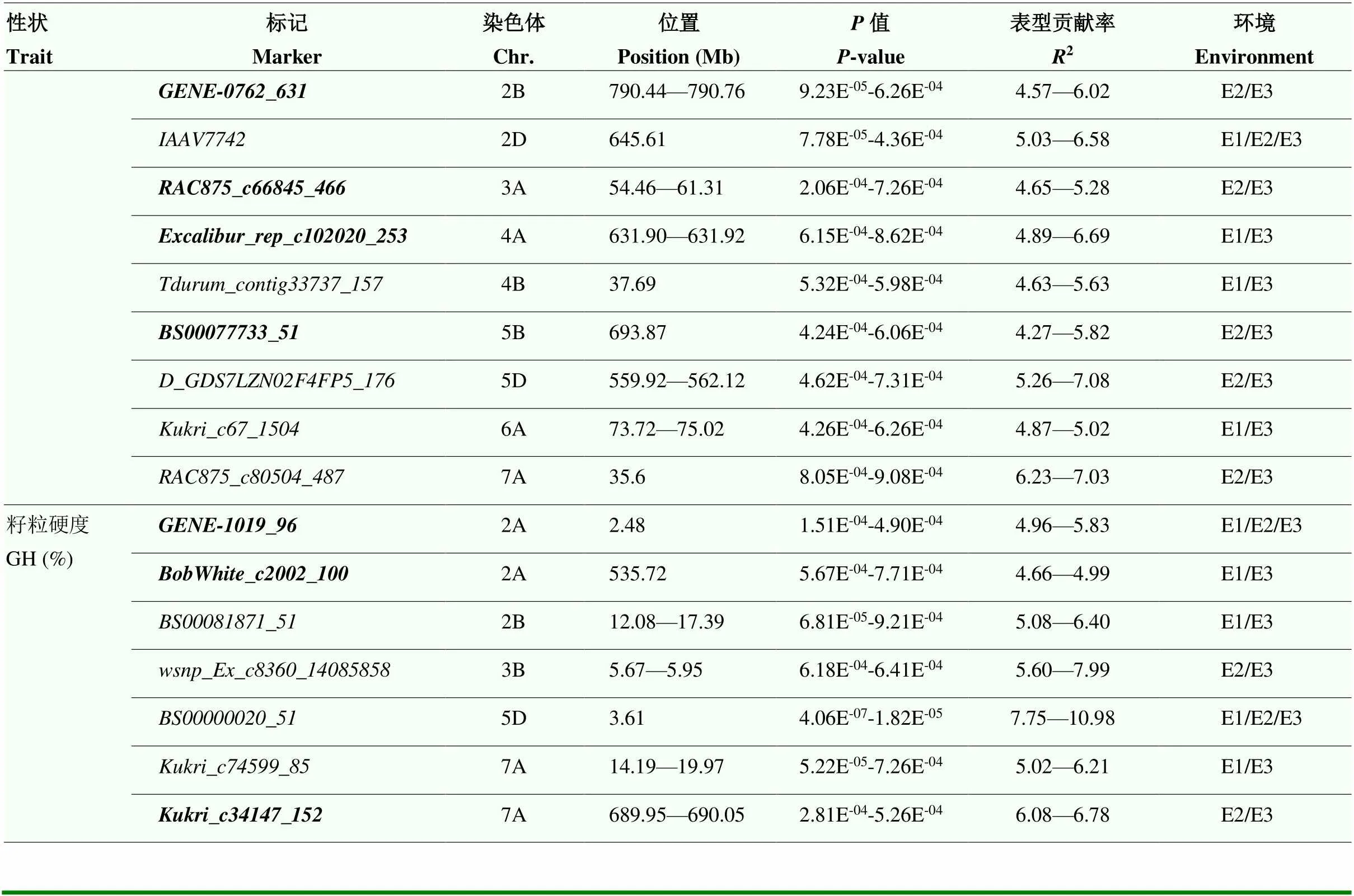
续表3 Continued table 3
E3:联合环境下的BLUP值,加粗表示新发现的位点。下同 E3: BLUP value in joint environment, bolded are newly discovered loci. the same as below
2.4 单倍型分析
通过对定位获得的表型贡献率高的多效应位点进行单倍型分析,SNP位点所在的区域LD值较高,能形成LD Block,位于5D染色体559.92—562.12 Mb区段的与左翼5个SNP标记形成一个跨度为477 kb的LD Block(图3-A),该Block存在4个单倍型(Hap1、Hap2、Hap3和Hap4),供试材料中包含Hap1、Hap2、Hap3和Hap4的材料分别有174、30、15和4份(图3-B)。对含有单倍型的品种(系)进行分析,蛋白质含量、沉降值和淀粉含量的均值表现分别为Hap1(15.87%、43.34 mL和61.74%)、Hap2(16.37%、48.43 mL和61.22%)、Hap3(16.47%、49.25 mL和61.18%)和Hap4(15.61%、41.60 mL和61.78%)。具有单倍型Hap2和Hap3的品种(系)的蛋白质含量和沉降值显著(<0.05)高于具有单倍型Hap1的品种(系);具有单倍型Hap1的品种(系)的淀粉含量极显著(<0.001)高于具有单倍型Hap2和Hap3的品种(系);在蛋白质含量、沉降值和淀粉等性状上,具有单倍型Hap3的品种(系)均比具有单倍型Hap2的品种(系)高,但差异不显著。具有单倍型Hap4的品种(系)在各性状间跟具有单倍型Hap1、Hap2和Hap3的品种(系)无显著性差异(图3-C),可能由于材料数量较少的原因,对此不进行分布频率的鉴定。
具有单倍型Hap1、Hap2和Hap3的品种(系)的分布频率表现为Hap1(74.22%)>Hap2(16.21%)>Hap3(6.92%)(图3-B);西南冬麦区品种(系)全部为单倍型Hap1,没有其他3种单倍型,单倍型Hap2和Hap3分布频率最高的麦区分别是黄淮冬麦区(18.75%)和国外品种(18.75%)。单倍型Hap1的分布频率在不同麦区的表现为西南冬麦区(100.00%)>长江中下游冬麦区(91.67%)>黄淮冬麦区(79.17%)>北部冬麦区(76.47%)>国外品种(68.75%);单倍型Hap2的分布频率表现为黄淮冬麦区(18.75%)>北部冬麦区(14.71%)>国外品种(12.50%)>长江中下游冬麦区(4.17%);单倍型Hap3的分布频率表现为国外品种(18.75%)>北部冬麦区(8.82%)>长江中下游冬麦区(4.17%)>黄淮冬麦区(2.08%)(图4)。
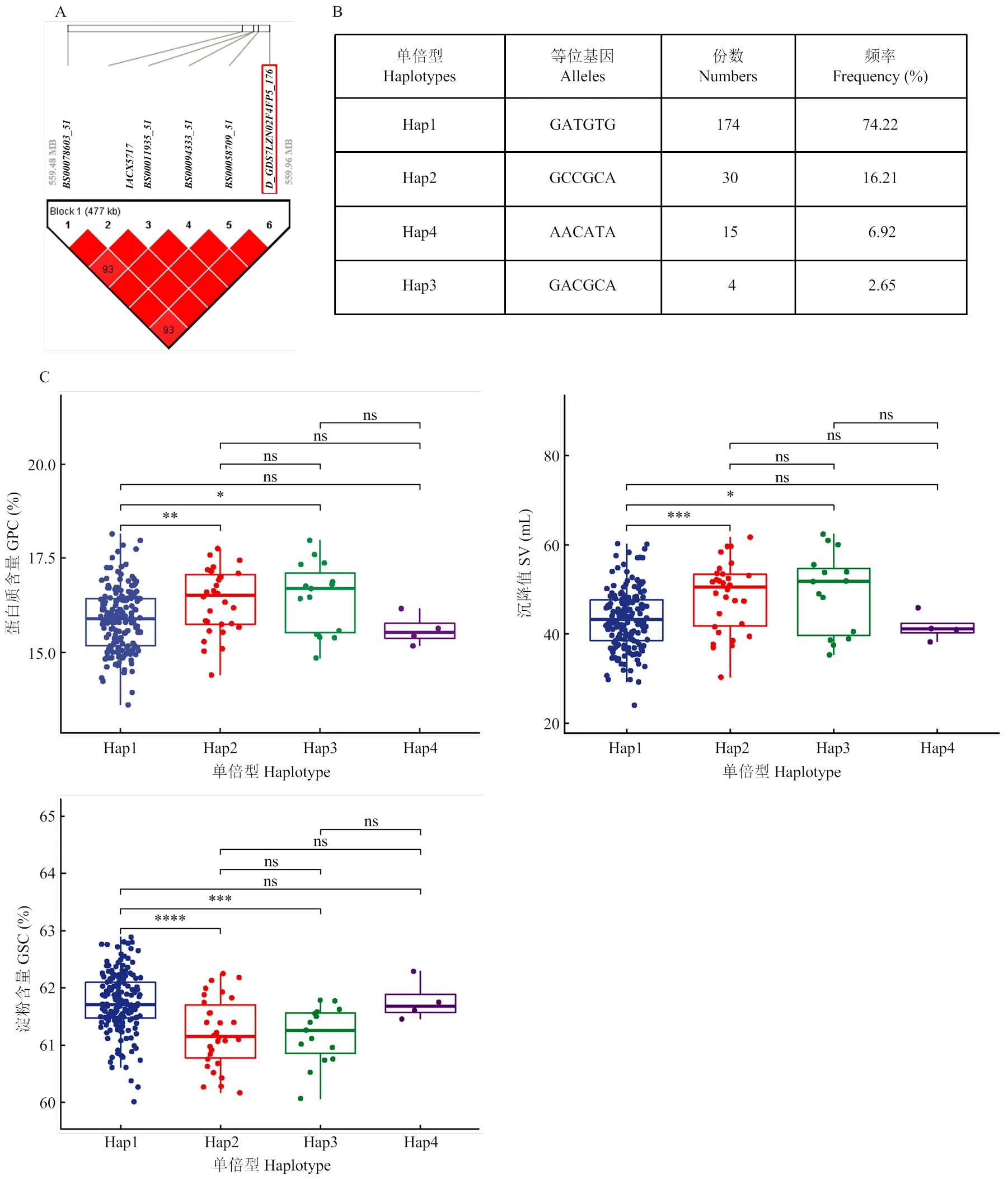
A:位点的LD Block分析;B:不同等位基因的4种单倍型;C:不同单倍型品种(系)的品质表型差异
A: LD Block analysis of the6 locus; B: four haplotypes with different alleles; C: quality phenotypic differences of different haplotype varieties (lines)
图3的单倍型分析
Fig. 3 Haplotype analysis of thelocus
2.5 小麦籽粒品质候选基因预测
将定位到表型贡献率高且稳定关联的位点在普通小麦中国春基因组数据库进行BLAST比对,并在Wheat Omics 1.0数据库中进行基因功能注释,筛选到10个与小麦籽粒品质相关的候选基因(表5)。这些候选基因主要与糖的转运和转化、蛋白质的合成和分解、植物生长发育、逆境应答有关。其中,和均编码细胞色素P450家族蛋白;编码锌指蛋白;编码激酶家族蛋白;编码糖基转移酶;编码LRR受体样激酶家族蛋白;编码磷酸转运蛋白;编码糖转运蛋白;编码F-box家族蛋白;编码天冬氨酸蛋白酶。
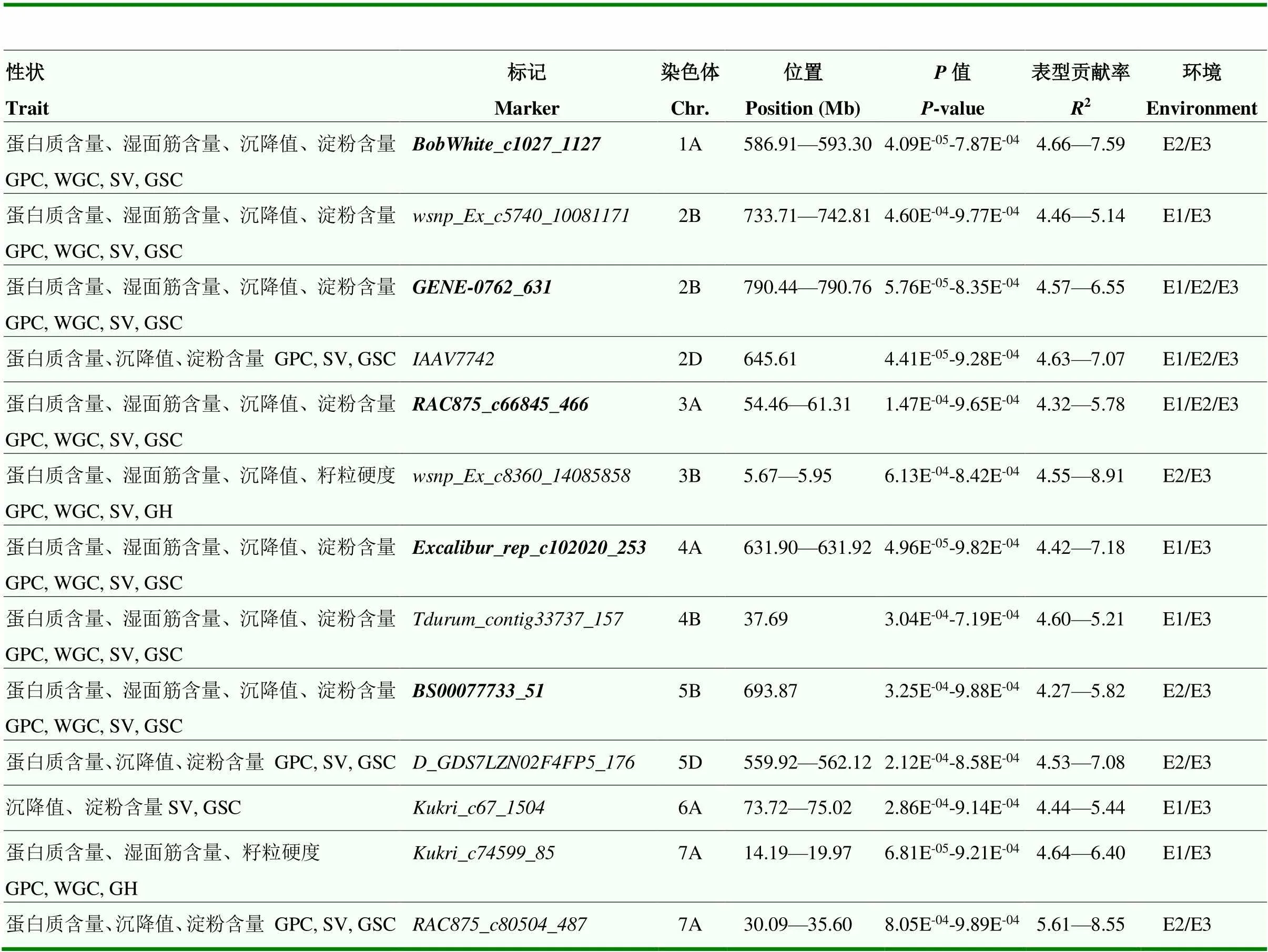
表4 与2个及2个以上籽粒品质性状显著关联的稳定位点
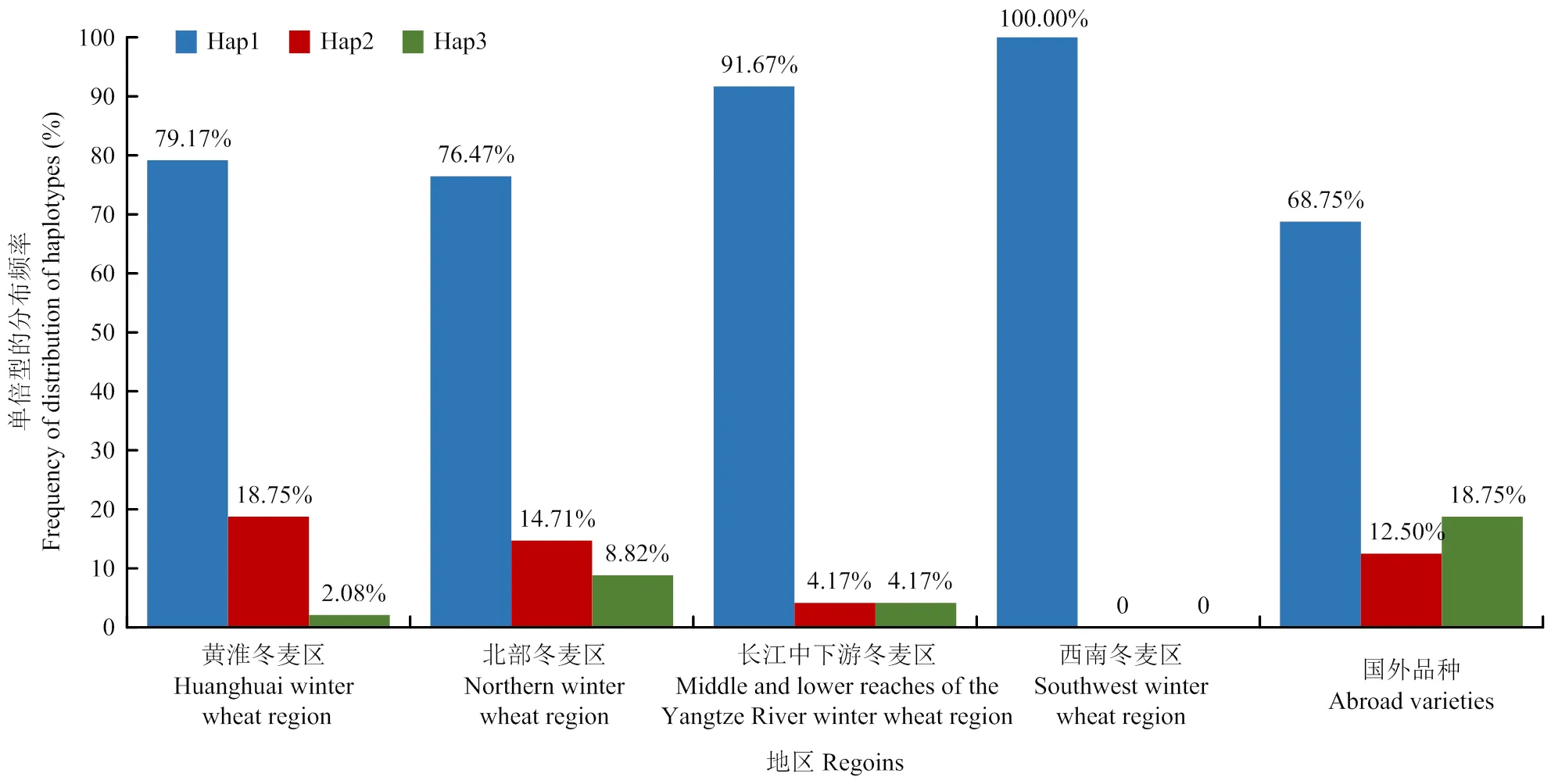
图4 不同来源冬小麦D_GDS7LZN02F4FP5_176位点单倍型的分布频率

表5 筛选获得的候选基因信息
3 讨论
3.1 优质种质资源的筛选和不同麦区间小麦资源品质的分析
我国是小麦生产大国,但每年仍需大量进口优质小麦[19],发展优质小麦和改良小麦品质势在必行[3]。发掘优质种质资源对小麦品质的遗传改良具有重要作用。本研究通过对来自我国主要冬麦区和部分国外的冬小麦品种(系)进行品质综合鉴定,筛选出一些品种综合性状突出和单一品质指标优异的种质资源,其中,最为优质的强筋品种有小偃54、中优9507、京冬22、Mantol(意大利)和周麦32,最为优质的弱筋品种有皖麦29、百农3217、Fr03724(法国)、陕354和Fr03717(法国),可作构建品质遗传改良基础研究的遗传群体,也可作为品质改良繁育的优良骨干亲本。
小麦籽粒品质是受多基因调控的数量性状,其遗传机制较为复杂,不仅受到遗传的调控,还受生态条件、栽培技术和储存条件的影响[11, 20-21]。对我国主要冬麦区的小麦品种(系)的品质性状进行综合分析,有利于了解不同麦区间种质资源的品质状况。本研究结果表明,不同麦区的籽粒品质表现出较大差异,除淀粉含量外,蛋白质含量、湿面筋含量、沉降值和籽粒硬度等性状的均值由高到低为黄淮冬麦区>北部冬麦区>长江中下游冬麦区>西南冬麦区。前人研究表明,蛋白质含量、湿面筋含量和沉降值会随纬度的增加而趋高[22-23],这与本研究对上述性状区域间比较后得到北部冬麦区>长江中下游冬麦区>西南冬麦区的结果相一致。不同麦区间黄淮冬麦区的品质表现最为优异,这可能与黄淮冬麦区作为我国最大优质强筋小麦产区[24]、育种工作者对其小麦品质改良的研究起步较早有关[25],也可能与当地热衷面食、对面制品筋道要求较高、育种工作者在品种选育上更注重筋强的选择有关。
3.2 小麦籽粒品质性状的关联分析
GWAS是定位和挖掘数量性状位点的有效途径之一,目前已经被广泛应用于小麦育种研究[13, 17-18]。小麦品质相关性状的基因挖掘也取得了较大进展,考虑到籽粒品质性状的复杂性、前人定位到的位点不尽相同等因素[10, 18]。本研究采用MLM(Q+K)模型进行关联分析,检测到18个与籽粒品质性状显著关联的稳定位点,与前人研究结果相对比,发现10个相似位点。本研究在2B(12.08—17.39 Mb,733.71—742.81 Mb)、2D(645.61 Mb)、3B(5.67—5.95 Mb)、4B(37.69 Mb)和5D(559.92—562.12 Mb)染色体定位到6个位点与CHEN等[26](2B,8.08 Mb)、HAO等[27](2B,723.96—731.60 Mb;5D,547.50—550.44 Mb)、RATHAN等[28](2D,640.21 Mb)和严勇亮等[10](3B,7.08 Mb;4B,43.56 Mb)定位到的与品质相关的位点物理位置相距均在10 Mb以内,根据LD衰减距离(10 Mb),判断可能为相同位点。同时在5D染色体定位到的与籽粒硬度相关的标记附近存在控制籽粒硬度的主效基因[16, 29],其他学者在这一位置上也有类似的发现[18, 26, 30]。6A染色体73.72—75.02 Mb区域定位到的与沉降值和淀粉含量相关的位点与LOU等[18]定位的与淀粉、湿面筋和蛋白质含量相关的位点(73.58—75.91 Mb)物理位置相吻合,可以判断在6A染色体的73.72—75.02 Mb处可能存在控制不同籽粒品质的基因。7A染色体的14.20—19.97 Mb区域定位到与蛋白质、湿面筋含量和籽粒硬度相关的位点,与RATHAN等[28]定位的与蛋白质含量相关的位点和LOU等[18]定位的与吸水率和面团稳定时间相关的位点物理位置相近;30.09—35.60 Mb区域定位到与蛋白质、沉降值、淀粉含量相关的位点和严勇亮等[10]定位到与沉降值,淀粉含量,蛋白质含量和湿面筋含量相关的位点物理位置吻合。说明7A染色体这两个区域内存在与多个品质性状相关联的位点,该区域内可能存在控制多个品质性状的基因,可作为今后研究的重点区域。由于籽粒品质性状间具有高度的相关性,本研究定位到的稳定位点中有超过70%(13/18)的位点同时与多个籽粒品质性状相关联,与品质性状相关的多效应位点被大量定位,这一结果与前人研究报道相一致[10, 18, 30-32]。定位到的位点大多为多效应位点,说明了籽粒品质性状的复杂性,选择多效应位点区域进行研究,可以同时改善多个品质性状。以上多效应位点区域的发现可以作为今后小麦籽粒品质研究的重点区域。
本研究在1A、2A(2)、2B、3A、4A、5B和7A染色体定位到的8个位点与已报道的相同染色体的与品质性状相关的位点物理位置距离较远[30, 33],可能是品质相关性状的新位点。其中2B()和3A()位点在2个环境和BLUP值下被共同检测到,且与蛋白质含量、湿面筋含量、沉降值和淀粉含量等性状相关联。接下来项目组将对2B和3A染色体的多效应且稳定的位点进行精细定位和分子标记开发的研究,这些位点的发现为进一步解析小麦品质的遗传机理提供了依据。
3.3 不同来源冬小麦的优异单倍型分布规律
单倍型是指位于单条染色体上的一组SNP位点,已成为分子标记辅助育种应用的重要手段之一[34-35]。JIN等[36]对发掘了2个与蛋白质含量相关的单倍型,其中TaAAP6-3B-Ⅰ拥有着更高的蛋白含量。本研究发掘了能够提高蛋白质含量和沉降值的单倍型Hap2和Hap3,而单倍型Hap2(16.21%)和Hap3(6.92%)在供试材料中的占比较低,可能与我国早期小麦育种目标主要以高产为主,品质性状较产量等农艺性状不易被直接观测到,导致育种家早期对品质的关注度较少、研究起步较晚[37-38]。后期可利用含有蛋白质含量和沉降值高的单倍型Hap2和Hap3的品种(系)进行品种的选育和改良。另外,本研究发掘到的具有单倍型Hap4的品种(系)在各性状间跟具单倍型Hap1、Hap2和Hap3的品种(系)无显著性差异,可能与供试品种(系)未能在各麦区间均匀取样、样本数量有限有关,因此,后续研究中可以进一步扩大样本量,以便获得更为准确的结果。
对不同来源的小麦优异单倍型的分布进行鉴定,结果表明,西南冬麦区的冬小麦品种(系)均为含有淀粉含量高的单倍型Hap1,这表明西南冬小麦品种(系)具有较高的淀粉含量。黄淮冬小麦品种(系)含有单倍型Hap2的分布频率高于其他地区,这表明黄淮冬小麦品种(系)具有较高的蛋白质含量和沉降值,这可能与黄淮冬麦区作为我国主要冬小麦产区和最大强筋小麦生产基地有关[24]。单倍型Hap3的分布频率表现为国外冬小麦品种(系)远高于国内冬麦区的冬小麦品种(系),这可能与国外小麦育种家对小麦品质重视度较高、品质性状研究起步较早有关。含单倍型Hap3的国外材料可作为高蛋白质含量和高沉降值的优质种质资源。
3.4 候选基因预测
本研究获得10个可能与小麦籽粒品质性状相关的候选基因。位于2A染色体的基因编码锌指蛋白,该蛋白是一种重要的转录因子,对植物的生长发育具有重要调控作用,参与种子的萌发及成熟、根系的发育和花器官的发育等过程[39]。推测该基因可能通过参与植物的发育调控进而影响植物的物质积累。位于3A、7A、2B和2D染色体的基因、、和分别编码细胞色素P450、LRR类受体蛋白激酶、F-box家族蛋白和激酶家族蛋白,这些基因在调控小麦生长发育、逆境应答方面起到重要作用[40-43],可能通过对小麦的生长发育及非生物胁迫的调节影响到小麦的品质。此外,还在4A染色体发现了编码磷酸转运蛋白,该基因在光合产物的转运中执行单糖的转运[44]。推测该基因在有机物质的积累中起到重要作用,从而影响小麦籽粒品质的形成。位于7A染色体的编码天冬氨酸蛋白酶,天冬氨酸蛋白酶是一类重要的蛋白水解酶,广泛存在于各类生物中,参与了蛋白质的加工和降解,被认为影响了小麦籽粒品质的形成[31]。位于2B染色体的编码产生糖基转移酶的基因,糖基转移酶可以将光合作用的产物转化为双糖、寡糖和多糖[45],该基因可能与淀粉的积累有关,从而影响淀粉含量水平。位于5D染色体的编码糖转运蛋白,该基因对谷物贮藏物质的积累和分布具有重要的调控作用,对小麦品质的形成也至关重要[46]。
4 结论
使用90K SNP基因芯片结合259份国内外冬小麦品种(系)的蛋白质含量、湿面筋含量、沉降值、淀粉含量和籽粒硬度进行全基因组关联分析,获得18个显著关联的稳定SNP标记位点,其中,有10个位点与前人结果一致,有8个位点是新的遗传位点,有13个位点为多效应位点。单倍型分析鉴定到Hap1、Hap2、Hap3和Hap4等4个不同单倍型,其中Hap1为能提高淀粉含量的单倍型,Hap2和Hap3为能提高蛋白质含量和沉降值的单倍型。获得10个可能与小麦籽粒品质相关的候选基因,主要与糖的转运和转化、蛋白质的合成和分解、植物生长发育、逆境应答相关。
[1] 贾光锋, 范丽霞, 王金水. 小麦面筋蛋白结构、功能性及应用. 粮食加工, 2004, 29(2): 11-13, 22.
JIA G F, FAN L X, WANG J S. The structure, functional properties and using of wheat gluten protein. Grain Processing, 2004, 29(2): 11-13, 22. (in Chinese)
[2] 王一杰, 辛岭, 胡志全, 安晓宁. 我国小麦生产、消费和贸易的现状分析. 中国农业资源与区划, 2018, 39(5): 36-45.
WANG Y J, XIN L, HU Z Q, AN X N. Current sittuation of production, consumption and trade of wheat in China. Chinese Journal of Agricultural Resources and Regional Planning, 2018, 39(5): 36-45. (in Chinese)
[3] 张爱民, 李欣, 刘冬成, 孙家柱, 阳文龙. 品质支撑农作物产业与未来发展. 中国农业科学, 2016, 49(22): 4265-4266.
ZHANG A M, LI X, LIU D C, SUN J Z, YANG W L. Quality-The future of crop production. Scientia Agricultura Sinica, 2016, 49(22): 4265-4266. (in Chinese)
[4] 赵新, 王步军. 小麦蛋白质和淀粉性状与面包品质关系研究进展. 中国农学通报, 2008, 24(12): 124-127.
ZHAO X, WANG B J. Advances in relationship of bread quality and characteristics of protein and starch of wheat. Chinese Agricultural Science Bulletin, 2008, 24(12): 124-127. (in Chinese)
[5] 刘建军, 何中虎, 赵振东, 宋建民, 刘爱峰. 小麦面条加工品质研究进展. 麦类作物学报, 2001, 21(2): 81-84.
LIU J J, HE Z H, ZHAO Z D, SONG J M, LIU A F. Review of noodle industrial quality of wheat. Journal of Triticeae Crops, 2001, 21(2): 81-84. (in Chinese)
[6] 杜巍, 魏益民, 张国权, 欧阳韶辉, 胡新中. 小麦品质与面条品质关系的研究. 西北农林科技大学学报(自然科学版), 2001, 29(3): 24-28.
DU W, WEI Y M, ZHANG G Q, OUYANG S H, HU X Z. Study on the relation of wheat property and noodle quality. Journal of Northwest A&F University (Natural Science Edition), 2001, 29(3): 24-28. (in Chinese)
[7] 陈锋, 陈东升, 钱森和, 张艳, 夏先春, 何中虎.基因对春小麦磨粉及馒头、面条品质的影响. 作物学报, 2006, 32(7): 980-986.
CHEN F, CHEN D S, QIAN S H, ZHANG Y, XIA X C, HE Z H. Influence ofgene on milling performance steamed bread and noodle qualities in spring wheat. Acta Agronomica Sinica, 2006, 32(7): 980-986. (in Chinese)
[8] 周艳华, 何中虎, 阎俊, 张艳, 王德森. 中国小麦品种磨粉品质研究. 中国农业科学, 2003, 36(6): 615-621.
ZHOU Y H, HE Z H, YAN J, ZHANG Y, WANG D S. Characterization of milling quality in Chinese common wheat. Scientia Agricultura Sinica, 2003, 36(6): 615-621. (in Chinese)
[9] WANG D W, ZHANG K P, DONG L L, DONG Z Y, LI Y W, HUSSAIN A, ZHAI H J. Molecular genetic and genomic analysis of wheat milling and end-use traits in China: Progress and perspectives. The Crop Journal, 2018, 6(1): 68-81.
[10] 严勇亮, 时晓磊, 张金波, 耿洪伟, 肖菁, 路子峰, 倪中福, 丛花. 春小麦籽粒主要品质性状的全基因组关联分析. 中国农业科学, 2021, 54(19): 4033-4047.
YAN Y L, SHI X L, ZHANG J B, GENG H W, XIAO J, LU Z F, NI Z F, CONG H. Genome-wide association study of grain quality related characteristics of spring wheat. Scientia Agricultura Sinica, 2021, 54(19): 4033-4047. (in Chinese)
[11] 关二旗, 魏益民, 张波. 小麦籽粒品质与基因型及环境条件的关系. 麦类作物学报, 2010, 30(5): 963-969.
GUAN E Q, WEI Y M, ZHANG B. Relationships between wheat kernel quality and genotype as well as environmental conditions. Journal of Triticeae Crops, 2010, 30(5): 963-969. (in Chinese)
[12] ROZBICKI J, CEGLIŃSKA A, GOZDOWSKI D, JAKUBCZAK M, CACAK-PIETRZAK G, MĄDRY W, GOLBA J, PIECHOCIŃSKI M, SOBCZYŃSKI G, STUDNICKI M, DRZAZGA T. Influence of the cultivar, environment and management on the grain yield and bread-making quality in winter wheat. Journal of Cereal Science, 2015, 61: 126-132.
[13] PU Z E, YE X L, LI Y, SHI B X, GUO Z, DAI S F, MA J, LIU Z H, JIANG Y F, LI W, JIANG Q T, CHEN G Y, WEI Y M, ZHENG Y L. Identification and validation of novel loci associated with wheat quality through a genome-wide association study. Journal of Integrative Agriculture, 2022, 21(11): 3131-3147.
[14] CHEN F, ZHANG F Y, LI H H, MORRIS C F, CAO Y Y, SHANG X L, CUI D Q. Allelic variation and distribution independence ofvariants and their association with grain texture in wheat. Molecular Breeding, 2013, 32(2): 399-409.
[15] GIROUX M J, MORRIS C F. Wheat grain hardness results from highly conserved mutations in the friabilin componentsand. Proceedings of the National Academy of Sciences of the United States of America, 1998, 95(11): 6262-6266.
[16] MORRIS C F.: the molecular genetic basis of wheat grain hardness. Plant Molecular Biology, 2002, 48(5): 633-647.
[17] 胡文静, 张晓, 刘巧, 方正武, 高德荣. 普通小麦籽粒硬度的全基因组关联分析. 麦类作物学报, 2021, 41(2): 157-163.
HU W J, ZHANG X, LIU Q, FANG Z W, GAO D R. Genome-wide association study of grain hardness in common wheat. Journal of Triticeae Crops, 2021, 41(2): 157-163. (in Chinese)
[18] LOU H Y, ZHANG R Q, LIU Y T, GUO D D, ZHAI S S, CHEN A Y, ZHANG Y F, XIE C J, YOU M S, PENG H R, LIANG R Q, NI Z F, SUN Q X, LI B Y. Genome-wide association study of six quality-related traits in common wheat (L.) under two sowing conditions. Theoretical and Applied Genetics, 2021, 134(1): 399-418.
[19] 黄奇鹏, 武文斌, 李聪, 孟乐, 林冬华. 中国小麦供需形势分析与对策. 现代面粉工业, 2018, 32(5): 39-42.
HUANG Q P, WU W B, LI C, MENG L, LIN D H. analysis and countermeasures of wheat supply and demand situation in China. Modern Flour Milling Industry, 2018, 32(5): 39-42. (in Chinese)
[20] 马冬云, 朱云集, 郭天财, 王晨阳. 基因型和环境及其互作对河南省小麦品质的影响及品质稳定性分析. 麦类作物学报, 2002, 22(4): 13-18.
MA D Y, ZHU Y J, GUO T C, WANG C Y, Effects of genotype, environment and G×E interaction on wheat quality of Henan province and the stability analysis. Journal of Triticeae Crops, 2002, 22(4): 13-18. (in Chinese)
[21] 张萮, 张海涛, 王伟. 不同储藏方式对小麦品质的影响. 粮食科技与经济, 2017, 42(2): 68-70.
ZHANG Y, ZHANG H T, WANG W. Effects of different storage methods on wheat quality. Grain Science and Technology and Economy, 2017, 42(2): 68-70. (in Chinese)
[22] 吴新元, 芦静, 张新忠, 黄天荣, 李建疆, 周安定, 梁晓东, 曹俊梅, 高永红, 曾潮武. 新疆小麦品质生态区划研究. 新疆农业科学, 2017, 54(8): 1373-1383.
WU X Y, LU J, ZHANG X Z, HUANG T R, LI J J, ZHOU A D, LIANG X D, CAO J M, GAO Y H, ZENG C W. Study of ecological division for wheat quality in Xinjiang. Xinjiang Agricultural Sciences, 2017, 54(8): 1373-1383. (in Chinese)
[23] 李鸿恩, 张玉良, 吴秀琴, 李宗智. 我国小麦种质资源主要品质特性鉴定结果及评价. 中国农业科学, 1995, 28(5): 29-37.
LI H E, ZHANG Y L, WU X Q, LI Z Z. Determination and evaluation on the main quality characters of wheat germplasm resources in China. Scientia Agricultura Sinica, 1995, 28(5): 29-37. (in Chinese)
[24] 孟智鹏, 张靖卓. 优质专用强筋和弱筋小麦生产现状、问题和对策: 基于河南等省调研分析. 农学学报, 2019, 9(3): 89-94.
MENG Z P, ZHANG J Z. Current situation, problems and countermeasures of high-gluten and low-gluten wheat with premium quality for special purposes: an investigation in Henan and other provinces. Journal of Agriculture, 2019, 9(3): 89-94. (in Chinese)
[25] 关二旗, 魏益民, 张波, 郭进考, 张国权, 刘彦军, 罗勤贵, 班进福. 黄淮冬麦区部分区域小麦品种构成及品质性状分析. 中国农业科学, 2012, 45(6): 1159-1168.
GUAN E Q, WEI Y M, ZHANG B, GUO J K, ZHANG G Q, LIU Y J, LUO Q G, BAN J F. Analysis of the variety composition and quality properties of wheat in a part of the Yellow-Huai river zone. Scientia Agricultura Sinica, 2012, 45(6): 1159-1168. (in Chinese)
[26] CHEN J H, ZHANG F Y, ZHAO C J, LÜ G G, SUN C W, PAN Y B, GUO X Y, CHEN F. Genome-wide association study of six quality traits reveals the association of thegene with flour colour in Chinese bread wheat. Plant Biotechnology Journal, 2019, 17(11): 2106-2122.
[27] HAO S Y, LOU H Y, WANG H W, SHI J H, LIU D, BAOGERILE, TAO J G, MIAO S M, PEI Q C, YU L L, WU M, GAO M, ZHAO N H, DONG J C, YOU M S, XIN M M. Genome-wide association study reveals the genetic basis of five quality traits in Chinese wheat. Frontiers in Plant Science, 2022, 13: 835306.
[28] RATHAN N D, KRISHNA H, ELLUR R K, SEHGAL D, GOVINDAN V, AHLAWAT A K, KRISHNAPPA G, JAISWAL J P, SINGH J B, SV S, AMBATI D, SINGH S K, BAJPAI K, MAHENDRU-SINGH A. Genome-wide association study identifies loci and candidate genes for grain micronutrients and quality traits in wheat (L.). Scientific Reports, 2022, 12(1): 1-15.
[29] MASSA A N, MORRIS C F. Molecular evolution of the,, and grain softness protein-1 genes in the tribe triticeae. Journal of Molecular Evolution, 2006, 63(5): 718.
[30] MUQADDASI Q H, BRASSAC J, EBMEYER E, KOLLERS S, KORZUN V, ARGILLIER O, STIEWE G, PLIESKE J, GANAL M W, RÖDER M S. Prospects of GWAS and predictive breeding for European winter wheat's grain protein content, grain starch content, and grain hardness. Scientific Reports, 2020, 10(1): 12541.
[31] YANG Y, CHAI Y M, ZHANG X, LU S, ZHAO Z C, WEI D, CHEN L, HU Y G. Multi-locus GWAS of quality traits in bread wheat: Mining more candidate genes and possible regulatory network. Frontiers in Plant Science, 2020, 11: 1091.
[32] LI C L, BAI G H, CHAO S, CARVER B, WANG Z H. Single nucleotide polymorphisms linked to quantitative trait loci for grain quality traits in wheat. The Crop Journal, 2016, 4(1): 1-11.
[33] WANG J Y, YANG C K, ZHAO W J, WANG Y, QIAO L, WU B B, ZHAO J J, ZHENG X W, WANG J L, ZHENG J. Genome-wide association study of grain hardness and novelalleles in common wheat. Molecular Breeding, 2022, 42(7): 40.
[34] 陈玲玲, 刘亭萱, 谷勇哲, 宋健, 王俊, 邱丽娟. 大豆叶柄夹角相关基因单倍型分析. 植物遗传资源学报, 2021, 22(6): 1698-1707.
CHEN L L, LIU T X, GU Y Z, SONG J, WANG J, QIU L J. Haplotype analysis of petiole angle related gene
[35] 刘国圣, 张大乐. 功能性分子标记在小麦育种中的应用. 生物技术通报, 2016, 32(11): 18-29.
LIU G S, ZHANG D L. The application of the functional molecular marker in wheat breeding. Biotechnology Bulletin, 2016, 32(11): 18-29. (in Chinese)
[36] JIN X F, FENG B, XU Z B, FAN X L, LIU J, LIU Q, ZHU P, WANG T., a regulator of grain protein content selected during wheat improvement. BMC Plant Biology, 2018, 18(1): 71.
[37] 何中虎, 庄巧生, 程顺和, 于振文, 赵振东, 刘旭. 中国小麦产业发展与科技进步. 农学学报, 2018, 8(1): 99-106.
HE Z H, ZHUANG Q S, CHENG S H, YU Z W, ZHAO Z D, LIU X. Wheat production and technology improvement in China. Journal of Agriculture, 2018, 8(1): 99-106. (in Chinese)
[38] 何中虎, 夏先春, 陈新民, 庄巧生. 中国小麦育种进展与展望. 作物学报, 2011, 37(2): 202-215.
HE Z H, XIA X C, CHEN X M, ZHUANG Q S. Progress of wheat breeding in China and the future perspective. Acta Agronomica Sinica, 2011, 37(2): 202-215. (in Chinese)
[39] 李琳, 丁峰, 潘介春, 张树伟, 黄幸, 王金英, 王颖, 李浩然, 徐炯志, 彭宏祥, 何新华.植物锌指蛋白转录因子家族研究进展. 热带农业科学, 2020, 40(2): 65-75.
LI L, DING F, PAN J C, ZHANG S W, HUANG X, WANG J Y, WANG Y, LI H R, XU J Z, PENG H X, HE X H. Research progress on family of plant zinc-finger protein transcription factors. Chinese Journal of Tropical Agriculture, 2020, 40(2): 65-75. (in Chinese)
[40] MIZUTANI M, SATO F. Unusual P450 reactions in plant secondary metabolism. Archives of Biochemistry and Biophysics, 2011, 507(1): 194-203.
[41] 冯蕾, 张海文, 黄荣峰. 植物LRR类受体蛋白激酶的研究进展. 中国农业科技导报, 2012, 14(6): 43-48.
FENG L, ZHANG H W, HUANG R F. Research progress on LRR receptor-like protein kinase in plant. Journal of Agricultural Science and Technology, 2012, 14(6): 43-48. (in Chinese)
[42] JIA Q, XIAO Z X, WONG F L, SUN S, LIANG K J, LAM H M. Genome-wide analyses of the soybean F-box gene family in response to salt stress. International Journal of Molecular Sciences, 2017, 18(4): 818.
[43] 杨乐, 齐妍, 刘生祥, 张双喜, 李连城, 陈明, 徐兆师, 马有志. 植物抗逆相关蛋白激酶的结构与功能. 植物遗传资源学报, 2013, 14(4): 659-667.
YANG L, QI Y, LIU S X, ZHANG S X, LI L C, CHEN M, XU Z S, MA Y Z. Structure and function of stress-related protein kinases in plants. Journal of Plant Genetic Resources, 2013, 14(4): 659-667. (in Chinese)
[44] 胡梦芸, 张正斌, 徐萍. 植物光合产物转运蛋白及其生物学功能. 植物生理学通讯, 2008, 44(1): 1-6.
HU M Y, ZHANG Z B, XU P. Photoassimilate transport proteins and biology function in plant. Plant Physiology Communications, 2008, 44(1): 1-6. (in Chinese)
[45] KEEGSTRA K, RAIKHEL N. Plant glycosyltransferases. Current Opinion in Plant Biology, 2001, 4(3): 219-224.
[46] SOSSO D, LUO D P, LI Q B, SASSE J, YANG J L, GENDROT G, SUZUKI M, KOCH K E, MCCARTY D R, CHOUREY P S, ROGOWSKY P M, ROSS-IBARRA J, YANG B, FROMMER W B. Seed filling in domesticated maize and rice depends on-mediated hexose transport. Nature Genetics, 2015, 47(12): 1489-1493.
Genome-wide association study of grain main quality related traits in winter wheat
DONG YiFan1, REN Yi1, CHENG YuKun1, WANG Rui1, ZHANG ZhiHui1, SHI XiaoLei2, GENG HongWei
1College of Agronomy, Xinjiang Agricultural University/Special High Quality Triticeae Crops Engineering and Technology Research Center, Xinjiang Agricultural University/Xinjiang Wheat Industry System Innovation Team, Urumqi 830052;2Institute of Crop Germplasm Resources, Xinjiang Academy of Agricultural Sciences, Urumqi 830091
【Objective】The quality of wheat grain was an important factor affecting the processing quality and nutritional. Mining loci and candidate genes significantly associated with wheat grain quality traits provided a basis for broadening the understanding of the genetic mechanism of quality traits and molecular marker-assisted quality. 【Method】By measuring five quality traits, including protein content (GPC), wet gluten content (WGC), starch content (GSC), settling value (SV) and grain hardness (GH), in 259 winter wheat varieties (lines) from domestic and abroad, and conducting genome-wide association analysis in combination with 90K SNP chip, the significant association loci located were subjected to haplotype analysis. 【Result】All five traits conformed to normal distribution and showed rich variation among different environments, and the coefficient of variation of sedimentation value was the largest (20.11%-24.42%). All traits have shown highly significant differences (<0.001) among genotype, environment, and genotype×environment, with a broad-sense heritability of 0.77-0.84. A total of 44 loci significantly associated (<0.001) with five traits were detected by genome-wide association analysis, distributed in 19 linkage groups other than chromosomes 1D and 3D. Eighteen loci were stable in two or more environments, involving all five traits including protein content (12), wet gluten content (9), starch content (11), sedimentation value (12) and grain hardness (7), explaining 4.27%-10.98% of the genetic variation. Thirteen of them were multi-effect loci, with the largest number of multi-effect loci (7) associated with traits such as protein content, wet gluten content, settling value and starch content. The,andloci located on 2B, 2D and 3A chromosomes were detected simultaneously at two environmental and BLUP values with a range of 4.32%-7.07% phenotypic contribution. Through haplotype analysis of multi-effect loci present in multiple environments with high phenotypic contribution, four different haplotypes, Hap1, Hap2, Hap3 and Hap4, which were significantly associated with traits such as protein content, sedimentation value and starch content, were uncovered at thelocus of chromosome 5D, among them Hap1 was a high starch content haplotype (<0.001), while Hap2 and Hap3 were both haplotypes with high protein content and sedimentation value (<0.05), and the four haplotypes accounted for 74.22%, 16.21%, 6.92% and 2.65%, respectively. The distribution frequencies of haplotypes from different sources of winter wheat were analyzed, in which the distribution frequencies of haplotype Hap2 with high protein content and sedimentation value were from high to low in the Huanghuai winter wheat regions>northern winter wheat region>abroad varieties>middle and lower reaches of the Yangtze River winter wheat region>southwest winter wheat region. Candidate genes were mined for stable genetic loci, and 10 candidate genes that might be related to wheat grain quality were screened. 【Conclusion】In the study, 18 stable loci significantly associated with grain quality traits were detected, 4 different haplotypes were identified, and 10 candidate genes related to grain quality were screened.
winter wheat; quality; SNP marker; GWAS; haplotype; candidate genes
2022-12-25;
2023-02-17
新疆维吾尔自治区重大科技专项(2021A02001-1)、新疆农业大学作物学重点学科发展基金(XNCDKY2021018)
董一帆,E-mail:f1468989265@qq.com。通信作者耿洪伟,E-mail:hw-geng@163.com
10.3864/j.issn.0578-1752.2023.11.002
(责任编辑 李莉)
