连续光照条件下LED红蓝光供光模式对紫叶生菜生长和品质的影响
2023-06-27邵明杰陈艳琦刘文科
邵明杰, 陈艳琦, 刘文科
(中国农业科学院农业环境与可持续发展研究所,农业农村部设施农业节能与废弃物处理重点实验室,北京 100081)
植物工厂作为一种新兴的农业生产模式,可实现工厂内光照、温度、湿度和二氧化碳含量等环境因素的人为调控,使作物生长不受外界自然条件的影响,被认为是21世纪解决人口、资源和环境问题的重要途径[1]。近年来,随着具有窄波段、高能效、光谱光量任意可调等优势的发光二极管(light emitting diode,LED)产业的发展,针对提高植物工厂生产率的新型LED供光模式的研究也日益深入[2]。区别于传统设施农业生产中常规的红蓝光连续、同时供光模式,在人工光植物工厂中应用LED光源系统可以按照植物生理或生产目标实现光强和光质周期内的自动化调控,例如交替光照、间歇光照以及交错光照等,在不同方面优化栽培模式,提高光源的能量利用率,为植物工厂提高经济效益、降低能耗提供了可能的途径。但是由于传统光源的局限性,对新型光照模式的研究还处于起步阶段。
连续光照(continuous light,CL)是指区别于自然界原有的24 h光周期内昼夜交替的光环境,给植物提供无间断光照的供光模式[3]。CL延长了植物进行光合作用的时间,也是植物工厂中除强光照射之外另一种增加光量子投入、促进植物生长的有效手段。一般来说,生菜对连续光照有一定的耐受能力,常规光强的连续光照会增加生菜叶片活性氧和抗氧化物质的积累,也会提高植株的生物量[4]。但是也有研究表明,连续光照会使植物叶片失绿、叶片衰老、光合受损等[5-6]。这些相互矛盾的结果可能是由于品种的差异和环境因素,如CL的持续时间、光照强度、光谱组成以及环境温度和湿度等[3]。因此供光模式的制定应因植物种类甚至品种而异。
在自然环境中,植物暴露在光强和光质频繁变化的太阳辐射下,这种动态光照可能会成为植物的应激源[7]。受限于传统光源光强和光质的不可控性,早期研究大多都是在固定的光谱光子通量密度分布(spectral photon flux density distribution,SPD)下研究光照强度、光谱组成和光周期对植物生长和生理变化的影响,关于SPD随时间变化的辐照模式影响的研究较少。LED技术的发展使SPD随时间变化成为可能,一些研究通过探索新型LED供光模式来提高植物的生产效率。Hanyu等[8]在生长室中研究了菠菜生长过程中暗期补光光质和补光时间对菠菜生长的影响,发现在光照开始前,蓝光对菠菜生长有着更强的促进作用。Jishi等[9]测定了LED红蓝光交错照射对生菜生长的影响,发现日累积光照量(daily light integral,DLI)相同的条件下,随着单色蓝光照射时间的增加,生菜叶片变长、产量增加。Lanoue等[10]发现,红蓝光交替连续光照可以削减连续光照对番茄的伤害。研究表明,红蓝光交替照射可显著增加生菜产量,并且蓝光对蛋白质和抗坏血酸合成有促进作用[11-13]。
本研究以常规光周期(16 h /8 h)为对照,设置了SPD恒定不变的CL处理,以及4个SPD在24 h周期内发生规律性变化的CL处理,通过分析光环境对紫叶生菜生长和抗氧化系统的影响,研究新型供光模式能否提高植物对CL的耐受能力,从而减少CL对植物的伤害。本研究旨在为植物光配方的研究探索新的思路,促进新型LED供光模式在植物工厂中的应用。
1 材料与方法
1.1 试验材料及栽培环境
试验选取‘紫珊’生菜为试验材料,在中国农业科学院农业环境与可持续发展研究所试验用人工光植物工厂中以水培方式进行栽培。植物工厂内温度(23±3) ℃,相对湿度40%~50%,CO2水平同外界大气。
育苗时首先将生菜种子播种于用蒸馏水浸湿的海绵块(2.5 cm×2.5 cm×2.5 cm)中,并置于黑暗环境至种子发芽;然后将发芽的种子转移至白光LED灯(200 μmol·m-2·s-1,16 h /8 h)下进行培育,每2 d向育苗盘中补充1次营养液;育苗15 d后将生菜苗移栽至装有10 L营养液的水培槽(50 cm×50 cm×5 cm)中,每个栽培槽中种植生菜13株,种植期间每10 d更换1次营养液。营养液配方(mmol·L-1):0.75 K2SO4, 0.5 KH2PO4, 0.1 KCl, 0.65 MgSO4·7H2O, 1.0×10-3H3BO3, 1.0×10-3MnSO4·H2O,1.0×10-4CuSO4·5H2O, 1.0×10-3ZnSO4·7H2O, 0.1 EDTAFe, 5×10-6(NH4)6Mo7O24·4H2O和3.0 Ca(NO3)2·4H2O,pH 6.3,电导率(electrical conductivity,EC)1.3 mS·cm-1。幼苗定植后选用红光波峰为655 nm、蓝光波峰为456 nm的红蓝组合LED光源(50 cm×50 cm)进行光照处理。
1.2 光照处理及取样
幼苗定植后在统一的光照条件下适应7 d后进行不同的光照处理。适应期间光照参数为200 μmol·m-2·s-1、16 h /8 h、4R:1B。适应7 d后,以同一个水培槽的生菜为1组进行不同的光处理。试验设置2个SPD恒定的4R:1B常规光照处理组,其中1组维持适应期的光周期(RB,16 h /8 h);另1组在第7天暗期结束时开始进行CL(RB’,24 h/0 h)处理。另外设置4个24 h光期内SPD发生规律性变化的CL处理,其中2个交错光照处理,24 h周期内分别以蓝光、红蓝光(4R:1B)、红光的顺序交替照射1次和2次,分别记作S1和S2;2个交替光照处理,24 h周期内蓝光和红光分别交替照射1次和2次,分别记为A1和A2。6个处理的光照处理详见表1,光强均为200 μmol·m-2·s-1,1个周期内5个连续光照处理间的红蓝光量子数相同。在光照处理后的第14天RB处理光期结束时(21∶00)取样。每个处理随机取8株生菜,其中4株取中间的4~5片完全展开的叶片,剪去主叶脉迅速用液氮冻实后碾碎摇匀并保存在-80 ℃的超低温冰箱中用于生理指标的测定;另外4株用于生长参数的测定。

表1 光照处理Table 1 Experimental design of light
1.3 生长参数测定
将生菜从茎基部剪开,用分析天平分别称取地上部鲜重(shoot fresh weight,SFW)和地下部鲜重(root fresh weight,RFW)。称重后将生菜地上部主叶脉剪去,分别采用Li-3100C叶面积仪和分析天平测定叶面积(leaf area,LA)和叶鲜重(fresh leaves weight,FLW),通过叶鲜重和叶面积的比值计算比叶重(specific leaf weight,SLW)。然后将生菜的叶片和根部分别用牛皮纸包好放入烘箱,在80 ℃下烘干至恒重,测定地上部干重(shoot dry weight,SDW)和地下部干重(root fresh weight,RFW),计算地上部含水量(shoot water content,SWC)。
1.4 生理指标测定
准确称取0.1 g混匀后的冷冻鲜样于2 mL离心管中,并使用高通量组织研磨器在低温的条件下使用液氮将管内样品磨至粉末状待测。
可溶性糖(soluble sugar,SS)含量测定采用苯酚-硫酸法[14];淀粉含量测定采用酸水解法[15];硝酸盐含量参考Cataldo等[16]的方法测定;花青素含量采用pH示差法[17]测定;类黄酮和总酚(total phenol,TP)含量根据Khanam等[18]的方法进行测定;抗坏血酸(ascorbic acid,AsA)含量参考Spínola等[19]的方法进行测定;苯丙氨酸解氨酶(phenylalanine ammonia-lyase,PAL)活性根据Koukol等[20]的方法测定;丙二醛(malondialdehyde,MDA)含量采用Hodges等[21]的方法测定;超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)和过氧化物酶(peroxidase,POD)活性及过氧化氢(H2O2)和超氧阴离子含量均使用试剂盒(索莱宝,北京)测定。
1.5 数据处理
采用SPSS 23软件进行数据的统计和分析,使用Graphpad prism软件进行数据绘图。
2 结果与分析
2.1 CL条件下红蓝光供光模式对生菜生长及营养品质的影响
与常规光照(RB)相比,5个红蓝光CL处理均显著提高了生菜的地上部干重(表2),增幅为24%~65%,其中交替光处理(A1和A2)下生菜地上部干重最高,且显著高于其他处理。5个CL处理的生菜地上部和地下部鲜重无显著差异。S1、A1和A2处理的生菜地上部鲜重、地下部干重较RB处理显著提高,其中地上部鲜重的增幅分别为38%、34%和45%。RB’、S1、A1和A2处理下生菜地下部鲜重较RB处理显著提高43%~50%。与RB和RB’处理相比,S1、A1和A2处理下生菜叶面积显著增加26%~39%。RB’处理生菜的比叶重显著大于其他处理。由此可见,CL条件下非连续红蓝光照射通过生菜生物量的分配影响叶面积,进而影响生菜冠层的光截获对生菜生物量的积累起作用。CL对生菜地上部干物质的积累有显著的促进作用,其中红蓝光交替处理(A1和A2)和红蓝光交错1次照射处理(S1)对增加生菜产量的效果更显著,A2处理下生菜地上部干、鲜重和叶面积均最大。A1和A2处理显著降低了生菜地上部的含水量。

表2 不同处理模式下生菜的生长Table 2 Growth of lettuce under different treatments
S1处理下生菜可溶性糖含量最高,且显著高于其他处理,较RB和RB’处理分别提高18%和14%;其他处理间可溶性糖含量无显著差异(图1)。与常规光照(RB)相比,CL处理下淀粉含量均显著提高;与RB’处理相比,交替和交错光处理下淀粉含量显著提高10%~21%(图1)。与RB处理相比,常规CL处理(RB’)对硝酸盐含量无显著影响(图1);交替和交错光处理下硝酸盐含量显著提高,其中S1处理较S2处理叶片中硝酸盐含量显著提高39%,A1处理较A2处理显著提高30%。由此可见红蓝光照射模式及其交错照射、交替照射次数均显著影响叶片中硝酸盐的累积。

图1 不同处理模式下生菜的可溶性糖、淀粉和硝酸盐含量Fig. 1 SS, starch, and nitrate contents of lettuce under different treatments
2.2 连续光照条件下红蓝光供光模式对生菜抗氧化物质及其相关酶活性的影响
与RB处理相比,常规CL处理(RB’)下生菜花青素含量显著增加42%(图2)。与RB’处理相比,交替和交错光处理下叶片中花青素含量显著增加75%~129%。RB和RB’处理下类黄酮和总酚含量差异不显著(图2)。CL处理间类黄酮含量差异不显著,但S1、S2和A1处理下类黄酮含量显著高于RB处理。交替和交错光照处理下总酚含量较RB’处理显著提高9%~13%。

图2 不同处理模式下生菜的花青素、类黄酮和总酚含量Fig. 2 Anthocyanin, flavonoids, and TP contents of lettuce under different treatments
RB和RB’处理间生菜叶片中PAL活性差异不显著(图3)。与RB’处理相比,交替和交错光处理下生菜叶片中PAL活性显著提高28%~95%,其中,A1处理下生菜叶片中PAL酶活性最高,且显著高于其他处理。

图3 不同处理模式下生菜的PAL活性Fig. 3 PAL activity of lettuce under different treatments
由图4可知,与常规光照RB处理相比,CL处理下生菜抗坏血酸含量显著增加,其中,RB’处理下抗坏血酸含量较RB处理显著增加20%;S2处理下抗坏血酸含量显著高于其他处理,且比S1处理显著增加12%;A2处理下抗坏血酸含量与A1相比显著增加6%。由此可见,CL条件下红蓝光交替和交错照射可在一定程度上增加生菜叶片中抗氧化物质含量。

图4 不同处理模式下生菜的AsA含量Fig. 4 AsA content of lettuce under different treatments
2.3 连续光照条件下红蓝光供光模式对生菜抗氧化酶活性的影响
CL处理下生菜叶片中POD和SOD活性均显著高于RB处理,交替和交错光处理下生菜CAT酶活性均显著高于RB’处理(图5)。与RB处理相比,RB’处理下POD和SOD活性分别显著提高37%和16%,CAT活性显著降低52%。S1处理下POD活性最高,且显著高于其他处理;A1处理次之,显著高于其他4个处理。S1、S2和A1处理下CAT活性显著高于其他处理。S2和A1处理下SOD酶活性显著高于RB、RB’和S1处理。

图5 不同处理模式下生菜的抗氧化酶活性Fig. 5 Antioxidant enzymes activities of lettuce under different treatments
2.4 连续光照条件下红蓝光供光模式对生菜活性氧和MDA含量的影响
交替和交错光处理间生菜H2O2含量和含量差异不显著,但均显著高于RB和RB’处理;RB和RB’处理之间H2O2含量差异不显著(图6)。与RB’处理相比,交替和交错光处理下H2O2含量显著提高38%~48%。RB’处理下含量较RB处理显著提高81%。与RB’处理相比,交替和交错光处理下含量显著提高56%~58%。由此可见,连续光照条件下红蓝光交替和交错照射可显著增加生菜叶片中活性氧含量的积累。
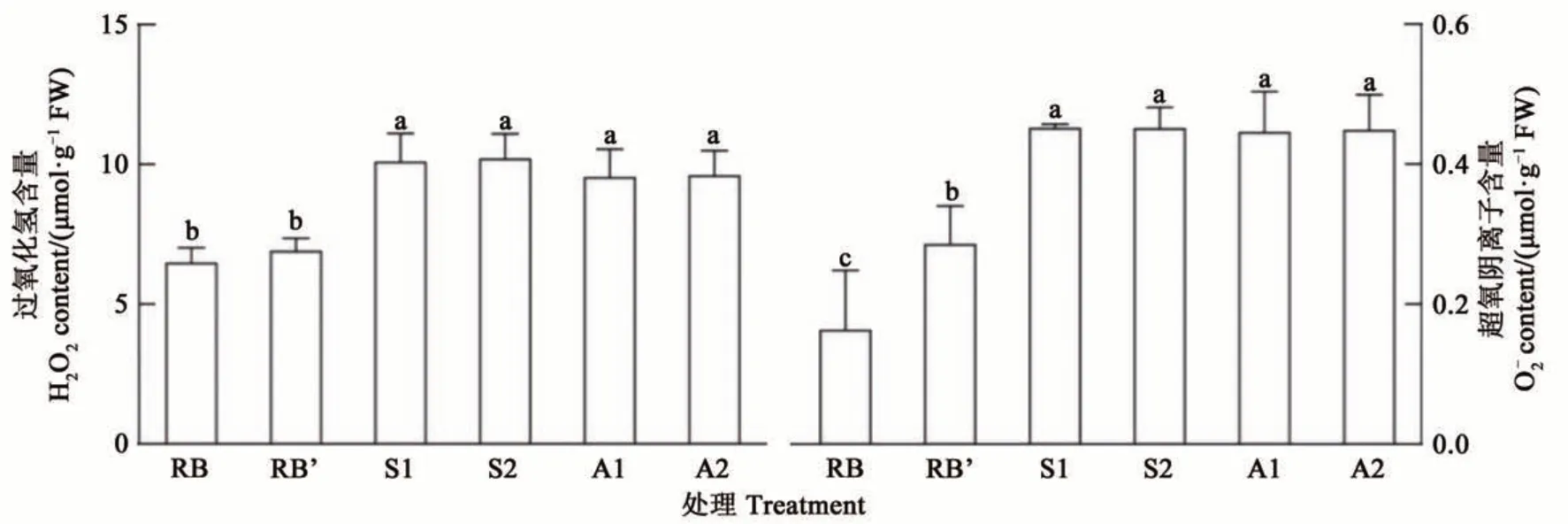
图6 不同处理模式下生菜的H2O2和含量Fig. 6 H2O2 and contents of lettuce under differen treatmentst
由图7可知,RB’处理下生菜叶片中MDA含量较RB处理显著增加105%;与RB’处理相比,交替和交错光处理下MDA含量显著增加50%~97%;交替光处理(A1和A2)下MDA含量显著高于S1处理。

图7 不同处理模式下生菜的MDA含量Fig. 7 MDA content of lettuce under different treatments
3 讨论
CL是一种促进植物生长和营养品质积累的潜在途径,它能增加光合作用的持续时间和DLI。研究表明,延长光周期比增加光照强度更能有效地提高植物的生物量。在相同的DLI条件下,与短光周期的强光照射相比,长光周期的弱光照射更有利于生菜[22-23]、萝卜[24]、玫瑰[25]等植物生物量的积累。本研究表明,不改变光强的条件下延长光照时间可有效促进生菜地上部干物质量的累积,这可能得益于生菜比叶重的增加。和常规光照相比,交替光处理对生菜地上部生物量的促进作用最为显著,同时交替光处理下生菜叶面积显著增加,地上部含水量显著降低。研究表明,黑暗期对植物气孔发育起重要作用,因此CL可能会降低植物的保水能力[26]。气孔在光照下开放,在黑暗中关闭,以此来调节植物的气体交换和水分损失。单色蓝光可通过激活保卫细胞的渗透势诱导气孔开放[27-28]。Hanyu等[8]研究表明,在明期开始前进行30 min的单色蓝光照射处理可有效增加菠菜的气孔孔径,促进植株生长,这可能也是交替光照射促进植物生长的原因。在本研究中,交错光照射虽然促进了生菜地上部生物量的增加,但是对其含水量无显著影响,这可能是因为不同植物种类对单色蓝光照射调节气孔开放的敏感度存在差别。Jishi等[9]研究表明,长时间(约7 h)的单色红光和单色蓝光照射可以促进植物叶片伸展,从而提高植株的光截获能力促进植物生长,与本研究结果一致。
在植物碳氮代谢的复杂过程中,光环境起着决定性的作用。光能被绿色植物叶片吸收后,通过光系统Ⅱ和光系统Ⅰ中的一系列能量转换和电子传递过程转化为化学能,并储存在ATP和NADPH中用于碳固定和氮还原[29]。植物中的碳水化合物可以刺激硝酸还原酶基因的表达,从而加速硝酸盐代谢[30]。在弱光条件下,光合产物的减少将导致大量硝酸盐作为渗透调节物质进入植物叶片,进一步加剧硝酸盐在植物中的积累[31]。Zhou等[32]研究表明,采收前的短期CL可以有效降低生菜硝酸盐含量,提高可溶性糖含量。然而本研究表明,红蓝光交错和交替照射并未降低生菜碳水化合物含量,却显著增加了生菜叶片中硝酸盐含量。有研究发现,在红光和蓝光的共同作用下,植物光合产物显著增加,硝酸盐含量显著降低[33]。红光可以提高植物叶片中硝酸还原酶活性,加速植物的硝酸盐代谢,促进无机氮向有机氮的转化[34]。红蓝光交错和交替照射处理下生菜硝酸盐含量增加可能是因为红光照射时间的减少。增加交替光或交错光照射频率可有效减少硝酸盐的累积,这也可能是得益于红光对硝酸还原酶的调控作用。
CL和长时间的单色光照射都可能成为植物的应激源,使植株产生更多的活性氧[29,35]。在本研究中,与SPD恒定的RB和RB’处理相比,红蓝光交错和交替照射处理均显著提高了生菜叶片中和MDA含量;而与RB处理相比,RB’也显著提高了生菜叶片中和MDA含量。这表明红蓝光交错和交替照射的连续光照处理下生菜活性氧含量的增加不仅与连续光照的时间有关,还和其SPD的变化有关。另外,本研究中CL处理均显著降低了生菜的Fv/Fm,但其值均未低于0.8,说明连续光照处理下生菜叶片中活性氧的产生过程和清除过程处于动态平衡,植株未遭受到光氧化胁迫。
抗氧化酶系统是植物体内清除活性氧的第一道防线,在本研究中活性氧含量对生菜抗氧化酶活性有明显的调控作用。CL处理均显著提高了生菜叶片POD和SOD活性,但是RB’处理显著降低了生菜CAT活性,这可能是因为RB’处理下生菜H2O2含量未出现明显累积。CL处理在一定程度上提高了生菜叶片中花青素和类黄酮含量,尤其是红蓝光交错和交替照射的CL处理对花青素含量的提高作用更加显著,红蓝光交错和交替照射的CL处理下生菜总酚含量较RB’处理显著提高,但是与RB处理相比无显著性变化,这可能和PAL活性有关,其中,A1处理下生菜酚类物质含量最高,PAL活性也最高。另外,连续光照处理对生菜抗坏血酸含量的提高同样有显著的促进作用,活性氧含量的提高促进了生菜抗氧化物质的累积。
本研究表明,不改变光强(200 μmol·m-2·s-1)的条件下延长光照时间可有效促进生菜地上部干物质量的累积,其中交替光处理对促进生菜地上部生物量的效果最佳。相比于CL,交错和交替光处理下由于红光照射时间缩,短硝酸盐含量显著增加。但交替照射促进了淀粉、抗坏血酸和抗氧化物质的积累,提高了抗氧化酶的活性和H2O2、的含量。综上所述,在环境可控的人工光植物工厂内,光强为200 μmol·m-2·s-1时红蓝光交替连续照射有助于获得高产优质的生菜产品。
