内蒙古草原革蜱的鉴定、人工饲养及生活史观察
2023-06-26马懿敏周文凯韩文雄贺泓凯赵维宏张占胜柴海亮王利峰刘永宏
马懿敏,周文凯,杨 波,韩文雄,贺泓凯,王 扬,孙 晶,张 媛,赵维宏,张占胜,柴海亮,王利峰,刘永宏,赵 丽
(1.内蒙古农业大学 兽医学院家畜病理学实验室,呼和浩特 010018;2.农业农村部动物疾病临床诊疗技术重点实验室,呼和浩特 010018;3.鄂尔多斯市动物疫病预防控制中心,内蒙古鄂尔多斯 017000;4.内蒙古赛科星繁育生物技术(集团)股份有限公司,呼和浩特 011517)
蜱(Tick)是哺乳类、鸟类、爬行类和两栖类等动物体表常见的以吸血为生的体外寄生虫,世界已知蜱包括硬蜱科(Ixodidae)、软蜱科(Argasidae)、纳蜱科(Nuttalliellidae)和恐蜱科(Deinocrotonidae)4科21属960种[1],中国记录的蜱有2科10属121种[2],其中占多数、危害最大的为硬蜱科蜱[3]。经蜱叮咬,宿主局部组织破损、水肿、溃疡或因继发感染引起化脓、疼痛、皮炎、贫血、消瘦、麻痹等;更重要的是,蜱作为世界第二大病原传播媒介,在叮咬、吸血时传播病毒、螺旋体、立克次氏体、细菌或原虫等病原,具有把野生动物或家畜疾病传播给人的风险,危害人类健康[4-7]。
草原革蜱(Dermacentornuttalli),属硬蜱科(Ixodinae)、革蜱属(Dermacentor)[1],其宿主范围广泛,成蜱主要寄生于大型哺乳类动物,如牛、犬、马、骆驼、绵羊和山羊等,有时也侵袭人;幼蜱和若蜱寄生于各种小型啮齿类动物[7]。该蜱广泛分布于北京、黑龙江、吉林、河北、辽宁、内蒙古和新疆等中国北方地区[8],且为内蒙古地区优势蜱种[9-11]。D.nuttalli成蜱主要在春季活动,幼蜱、若蜱出现于夏、秋两季,一年发育一个世代,以成虫阶段越冬[12]。已报道D.nuttalli可传播绵羊无浆体(Anaplasmaovis)、绵羊泰勒虫(Theilerialuwenshuni)、布鲁氏杆菌(Brucella)、饶氏立克次体(Rickettsiaraoultii)、埃氏立克次体(R.aeschlimannii)、嗜吞噬细胞无形体(Anaplasmaphagocytophilum)[13]、马泰勒虫(Theileriaequi)[14]、伯氏疏螺旋体(Borreliaburgdorferi)[15]、土拉弗朗西斯菌(Francisellatularensis)[16]、巴贝斯原虫(Babesia)[17]等病原。
实验室人工饲养蜱不仅能够掌握蜱的发育生活史、生物学特性等,还可为蜱及蜱传疾病的研究提供充足、可控发育阶段的材料。但有关D.nuttalli的实验室人工饲养报道较少,只有努尔·库尔曼艾力等[18]和巴音查汗等[19]在20世纪报道了新疆D.nuttalli的实验室饲养。本研究针对内蒙古地区优势蜱种D.nuttalli进行实验室人工饲养和生活史观察,以期建立一套详细规范的D.nuttalli实验室饲养方法,为D.nuttalli的生物学研究和综合防控奠定基础。
1 材料与方法
1.1 材 料
1.1.1 蜱 于2021-04-17采集自内蒙古呼伦贝尔市新巴尔虎左旗新宝利格苏木羊体表。
1.1.2 实验动物 昆明小鼠(6周龄,体质量 25~27 g),为唯一供血动物。
1.1.3 试剂和主要仪器 TaKaRa MiniBEST Universal Genomic DNA Extraction KitVer.5.0(Code No.9765),PremixTaqTM(TakaRaTaqVersion 2.0 plusdye)(Code No.RR901A),4S Green Plus无毒核酸染料(Code No.A616696)、DNA分子量标准(Code No.B600021),购自宝日医生物工程(北京)有限公司。高速冷冻离心机(Cat No.75004250,ThermoFisher)、PCR仪(Part No.4359659,Gene Company Limited)、电泳仪(Model No.PowerPacTM Universal Power Supply,BIO RAD)、凝胶成像仪(BDA Box 2,Biometra GmbH)、体视显微镜(PXS-1040)等。
1.2 方 法
1.2.1 蜱种鉴定 形态学鉴定。对采集的饱血雌成蜱及同一批未饱血成蜱进行清洗处理,用75%乙醇固定后,参照邓国藩等[20]和巴音查汗等[21]的蜱形态学分类依据,借助体视显微镜观察假头基、须肢、盾板、肛沟和气门板等的形态特征,进行形态学初步鉴定。
分子生物学鉴定。饱血雌成蜱产卵后,对其研磨并采用TaKaRa MiniBEST Universal Genomic DNA Extraction KitVer.5.0试剂盒提取核酸,利用16S rDNA基因特异性引物,采用PremixTaqTM(TakaRaTaqVersion 2.0)试剂盒对16S rDNA基因片段进行PCR扩增和琼脂糖凝胶电泳鉴定。引物、PCR反应体系及反应条件参照文献[22-23],引物由生工生物工程(上海)股份有限公司合成。
1.2.2 序列测定及分析 将PCR阳性产物送至生工生物工程(上海)股份有限公司测序,序列应用美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)BLAST在线平台和DNAstar等软件,进行序列分析和系统发育进化树构建。
1.2.3 人工饲养 羊体表叮咬的、饱血将要脱落的雌蜱单只置于含有潮湿脱脂棉的50 mL无菌离心管中,用纱布封口后带回实验室。雌蜱开始产卵后,观察并记录每日产卵数量、停止产卵时间、形态变化及卵孵化为幼蜱的时间。
以昆明小鼠为唯一供血动物饲养幼蜱和若蜱。首先选取健康昆明小鼠,剃除背毛后将小鼠颈部及后肢用医用胶布固定,置于2 000 mL烧杯内[24],将幼蜱(若蜱)用医用棉签沾取后置于小鼠体表,烧杯壁四周上沿涂抹一层医用凡士林[18,25],以防小鼠及幼蜱(若蜱)逃逸。吸血完毕后,饱血幼蜱自行从宿主体表脱落,用金属尖头镊或沾水棉签轻轻将其取出,置于含有潮湿脱脂棉的2.5 mL离心管内,管盖作好标记,管口扎洞保持空气畅通,每2~3 d用无菌注射器从管口注水,防止湿度下降。观察到若蜱饱血后,及时用金属尖头镊,垂直于小鼠体表方向夹饱血若蜱的躯体或假头,轻轻摇动,顺势取下,谨防小鼠误食。为了采到完整饱血若蜱,采集前,可用煤油、氯仿或乙醚等药物涂于叮咬部位[26]。利用体视显微镜观察人工饲养条件下卵孵化到幼蜱,幼蜱到若蜱以及若蜱到成蜱的各期虫体形态特征,并拍照记录。
饲养期间,室内自然温度为20~30 ℃,相对湿度为30%~75%,饲养过程中除自然光照外,不加其他灯光照射,并避免虫体直接暴露于自然强光下。
2 结果与分析
2.1 草原革蜱鉴定
2.1.1 形态学鉴定 雌蜱:整体为卵圆形;假头基位于躯体前端呈矩状;几丁质盾板覆盖虫体背部前1/3处,呈长卵圆形;盾板有银白色珐琅斑,后缘似微波状;颈沟短且深陷,侧沟细窄;气门板呈椭圆形;腹面后部有肛门,肛沟围绕肛门之后;须肢粗短(图1-A,1-B)。

A.雌蜱背部;B.雌蜱腹部;C.雄蜱背部;D.雄蜱腹部
雄蜱:虫体窄长,呈卵圆形;假头短,假头基位于躯体前端呈矩形;盾板大且有混杂不均一的银白色珐琅斑;气门板呈逗点状;肛沟呈半月形,须肢粗短,外缘呈弧形;各足基节顺序增大,4对足粗短(图1-C,1-D)。
基于蜱上述形态结构特征,确定本次试验采集蜱为革蜱属蜱。
2.1.2 分子生物学鉴定 蜱样本DNA经PCR扩增16S rDNA基因,凝胶电泳显示扩增产物(图2)与预计大小一致。

M.DNA分子质量标准;N.阴性对照;1~6.蜱16S rDNA基因PCR扩增产物M.DNA Marker;N.Negative control;1-6.PCR amplification products of tick 16S rDNA gene图2 蜱16S rDNA基因PCR扩增结果Fig.2 PCR analysis of 16S rDNA gene amplification in ticks
测得的2个16S rDNA基因片段长度均为416 bp,BLAST在线分析显示,与序列1和序列2同源性最高的序列(GenBank登录号为MH324407.1和JX051114.1)均为D.nuttalli,同源性分别为98.77%和99.26%。2个16S rDNA序列与GenBank中D.nuttalli及其他革蜱属蜱的16S rDNA序列,运用DNAstar软件绘制系统发育进化树(图3)显示,序列与已知的D.nuttalli序列聚在同一分支上。

图3 革蜱属16S rDNA基因的系统发育树Fig.3 Phylogenetic tree based on partial 16S rDNA gene sequences of Dermacentor
2.2 草原革蜱人工饲养
2.2.1 饱血雌成蜱产卵期 饱血雌成蜱饱满呈豆状,灰褐色,短暂活动1~3 d,然后进入静止状态,藏匿于潮湿棉花下,待产卵。其产卵量与饱血程度呈正比,饱血程度越高,产卵量越多。产卵时雌蜱仅肢体微弱活动,通过分泌的黏性物质将卵粘在一起,卵呈堆状或葡萄串状聚集于假头处。产卵期持续13~18 d,平均为15.5 d,产卵总量约2 680~4 050枚,平均约3 393枚,日均产卵量约219枚;产卵期1~6 d为产卵增长期,每日产卵量约为160~300枚,产卵期7~10 d为产卵平衡期,每日产卵量约为320~370枚,随后产卵量逐渐下降,至最后1、2 d每日产卵量为10~30枚。随着产卵天数的增加和产卵量的增大,饱血雌蜱体积逐渐变小,表面失去光泽出现花纹,颜色逐渐变为土黄色,后期雌蜱体表干瘪、皱缩(图4),并于产卵结束后3~6 d死亡,颜色变为黑色。

图4 产卵中的饱血雌成蜱Fig.4 Full blood of female adult tick laying eggs
2.2.2 卵孵化期D.nuttalli的卵为棕黄色,呈椭圆形,半透明状(图5)。卵在孵化初期没有任何明显变化,随后卵的颜色变浅,开始由棕黄色逐渐变成透明的乳白色,破壳前卵壳内可见有呈黄褐色的幼蜱。在室温(内蒙古自治区4~5月)下孵化期为25~29 d,平均为27.38 d。

图5 体视显微镜下的卵Fig.5 Eggs analyzed under stereomicroscope
从饱血雌蜱所产卵中随机取300枚卵,每30枚卵为一组分别放置于10个2.5 mL离心管中,管中放有浸水的脱脂棉花以维持湿度,卵孵化情况见表1,孵化率为75%~100%,总体孵化率为93.33%(280/300)。

表1 卵孵化情况Table 1 Egg hatching
幼蜱刚孵出时为浅黄色,具3对黄白色足,可缓慢爬动,活动不活跃。经2~3 d后聚集在一起活动,呈堆状;随后3~4 d幼蜱体色变深,呈黄褐色(图6),活动增强且爬行速度加快,具备叮咬侵袭力,积极寻找宿主。幼蜱耐饥饿能力较强,2到3个月未找到宿主寄生仍能保持较强的活力。释放到供血小鼠体表的幼蜱,经1~2 h开始叮咬寄生,2~3 d时可见体积明显增大,逐渐变为暗红色或黑紫色,并有黑色粉末状物体,幼蜱在小鼠体表吸血至饱血脱落需4~6 d,平均为5.23 d。

图6 体视显微镜下的幼蜱Fig.6 Larva analyzed under stereomicroscope
2.2.3 幼蜱蜕化期D.nuttalli幼蜱饱血后自行脱落,呈芝麻状,黑红色,表面光滑,虫体较吸血前明显增大(图7)。在室温(内蒙古自治区5~6月)条件下,离开宿主后活动2~3 d,准备蜕皮。经人工饲养后收集到饱血幼蜱2 974只,75%乙醇保存92只,-80 ℃冻存1 255只,1 627只进行幼蜱蜕化。蜕化期为4~15 d,主要集中于7~ 11 d,平均约为8.83 d,在此期间成功蜕化为饥饿若蜱的有1 316只,蜕化率为80.89%(1 316/ 1 627),具体蜕化时间及蜕化数量见表2。

表2 幼蜱蜕化时间及蜕化数量Table 2 Degeneration days and number of larva

图7 体视显微镜下的饱血幼蜱Fig.7 Full blood of larva under stereomicroscope
刚蜕变完成的若蜱较幼蜱大,颜色为浅棕色,与成蜱一样有4对足(图8),四肢尚未完全伸展,行动迟缓,一般经1~2 d静伏期后开始活动,活动逐渐增强且爬行速度加快,经蜕皮5~10 d后,排出白色液滴状物体,即可叮咬寄生。若蜱在吸血过程中也会有黑色粉样物体排出,随着吸血时间增加,其体积也逐渐增大,颜色转为青灰色。若蜱在小鼠体表吸血期为4~8 d,平均约为5.41 d。

图8 体视显微镜下的若蜱Fig.8 Nymph under stereomicroscope
本阶段有293只若蜱成功叮咬寄生,逐渐成功收集154只饱血若蜱(表3),75%乙醇保存5只,-80 ℃冻存33只,其余116只饱血若蜱进入下一阶段生长发育。
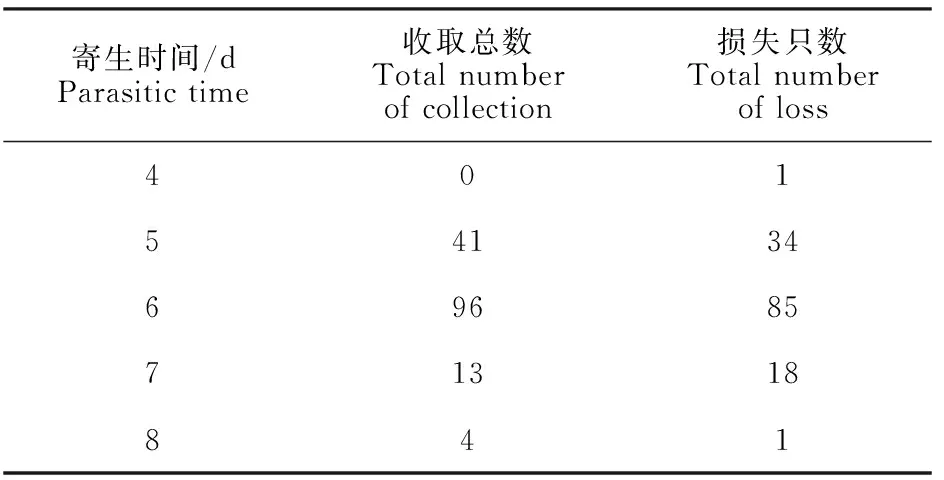
表3 饱血若蜱寄生情况Table 3 Parasitism of bloody nymphs
2.2.4 若蜱蜕化期D.nuttalli若蜱饱血后呈小豆状,青灰色(图9),自行离开宿主经1~2 d活动期,进入休止期准备蜕皮。脱落后1~5 d内形态无明显变化,第10天起表皮开始变白,其体色逐渐由青灰色变为乳白色。在室温(内蒙古自治区6~8月)条件下,经12~21 d的蜕变期后蜕化为成蜱(图10、图11),其中主要集中在12~17 d,平均蜕化时间约为14.81 d。116只饱血若蜱中有79只成功蜕化为成蜱,其蜕化率为68.10%(79/116),包括49只雌蜱和30只雄蜱,成蜱的雌雄比例为1.63∶1。具体蜕化时间、蜕化数量及雌雄比例见表4。

图9 体视显微镜下的饱血若蜱Fig.9 Bloody nymphs under stereomicroscope

图10 体视显微镜下的雌性成蜱Fig.10 Female ticks under stereomicroscope

表4 饱血若蜱蜕化时间、蜕化数量及雌雄比例Table 4 Degeneration number of time and proportion of male and female of bloody nymphs
刚蜕化的成蜱静卧不动,在离心管内可见一层蜕下的透明薄皮,经1~2 d后在管内缓慢爬行,离心管底部有白色小球状物体堆积,渐渐活动频繁。
3 讨论及结论
D.nuttalli为三宿主蜱,发育过程包括卵、幼蜱、若蜱和成蜱4个阶段,需饱血3次才能完成整个发育过程。硬蜱的生殖和发育受多种因素的影响,如地域分布、环境及宿主等因素[27]。人工饲养条件下,不同种蜱的生活史周期不同,同种蜱在不同宿主表现的生活史周期也不同,在不同温、湿度条件下同种蜱在同种宿主上的生活史周期也存在差异[28]。
本研究中,D.nuttalli在室内条件(20 ℃~30 ℃)下,饱血雌蜱的产卵期约13~18 d,平均15.5 d,单雌产卵量为2 680~4 050枚,产卵期长于巴音查汗等[19]报道的7~13 d,但远短于吕洪昌等[29]报道的27~35 d和努尔·库尔曼艾力等[18]的35~40 d;产卵量少于努尔·库尔曼艾力等[18]报道的8 000~9 200枚及吕洪昌等[29]的 4 628~8 653枚,但与巴音查汗等[19]报道的 3 606枚大体一致,可能与雌蜱饱血程度及体质量等相关。此外,在本研究中的卵经过25~29 d,平均27.38 d孵化成为幼蜱,与巴音查汗等[19]报道的18~28 d大体一致,但长于努尔·库尔曼艾力等[18]报道的18~20 d,更与吕洪昌等[29]报道的29~42 d相距甚远,究其原因可能与温度、湿度、种群自身状态、不同地域环境来源的蜱等有关。饥饿幼蜱的吸血期平均为5.23 d;饱血幼蜱到饥饿若蜱的蜕皮期平均为8.83 d,与巴音查汗等[19]报道的5.5 d和8 d研究结果基本一致。饥饿若蜱吸血期平均为5.41 d,饱血若蜱到成蜱的蜕皮期平均为14.81 d,均短于巴音查汗等[19]报道的平均8.5 d和21.5 d,这些差异可能与宿主和自身饱血程度等相关。文献报道在实验室条件下,D.nuttalli从雌蜱吸血到下一代成蜱共需 62~121 d[12]。本研究发现内蒙地区D.nuttalli从雌蜱产卵到下一代成蜱共需72~114 d,平均需 90.66 d。综上所述,这些差异可能体现了内蒙D.nuttalli种群地域特性和遗传多样性。本次D.nuttalli人工饲养还较详细地研究了D.nuttalli卵孵化率及其各阶段蜕化率,卵孵化率高达93.33%,饱血幼蜱蜕化率为80.89%,饱血若蜱蜕化率为 68.10%,初步推算显示实验室条件下一批卵发育到成蜱的概率为51.41%。
蜱类的繁殖、生长与发育所需要的营养物质,必须通过在宿主身上吸血才能获得。幼蜱、若蜱均需在宿主身上摄取营养,才能发育蜕变进入下一生长阶段。D.nuttalli成功叮咬宿主后一般不改变其吸血部位,直至饱血才离开宿主。人工饲养条件下,D.nuttalli幼蜱和若蜱在鼠体叮咬吸血情况良好,饱血后个体差异较小,能正常发育为成蜱。努尔·库尔曼艾力等[18]曾报道蜕化成功的若蜱不在同一宿主体表吸血寄生,另择其他宿主;但在本次D.nuttalli人工饲养中,将饱血幼蜱蜕皮完成后的饥饿若蜱继续接种到同一宿主时仍表现嗜血,且饱血后可正常发育为成蜱。
本研究成功建立了内蒙古D.nuttalli人工饲养方法,明确了从饱血雌蜱产卵至下一代成蜱共需72~114 d,平均需90.66 d。试验结果初步表明,用昆明小鼠作为内蒙D.nuttalli幼蜱和若蜱的供血动物是可行的,虽然利用供血鼠体大量繁殖有困难,但仍可用于实验室初期饲养,从而为今后在实验室扩繁D.nuttalli奠定基础。
