RASGRF1基因多态性与先天性白内障合并高度近视的关系*
2023-06-26克里木江阿不拉麦迪娜那毕江甫拉提阿布都热衣木秦艳莉
克里木江·阿不拉,麦迪娜·那毕江,甫拉提·阿布都热衣木,秦艳莉
新疆维吾尔自治区人民医院眼科,新疆乌鲁木齐 830001
先天性白内障(CC)是指胎儿发育时由于多种因素导致晶状体形态或功能异常,是影响小儿视功能的常见疾病。一项研究显示,2010-2012年法国儿童CC发病率约在0.01%~0.03%,其中76.49%的患儿接受了白内障手术联合人工晶状体植入术[1]。对造成瞳孔区遮挡的白内障,应尽早通过手术摘除,但合并近视的患儿手术难度较高,且术后易出现视力下降,甚至进展为高度近视,故评估CC患儿出现高度近视的风险对临床制订干预方案有一定指导作用。有研究认为,近视的发生是遗传、环境因素共同作用的结果,尤其小儿高度近视受遗传因素影响更加明显,遗传学方法表明,单核苷酸多态性(SNP)与高度近视相关,这对揭示高度近视发生机制有重要意义[2]。Ras特异性鸟嘌呤核苷酸释放因子(RASGRF1)与近视的关系在相关研究中得到证实[3-4],但其SNP分型与高度近视的关系仍需进一步验证。本研究选取本院的CC患儿为研究对象,通过对是否合并高度近视的CC患儿进行对照分析,旨在探究RASGRF1基因多态性与CC患儿合并高度近视的关系,以揭示可能影响高度近视发生风险的相关机制。现报道如下。
1 资料与方法
1.1一般资料 本研究经医学伦理委员会审批通过(批号:KY20200325082)。选取2020年4月至2022年3月本院的CC患儿186例为研究对象,其中男102例,女84例;年龄6~14岁,平均(10.31±1.53)岁。根据是否合并高度近视分为两组,其中合并高度近视(经裂隙灯检查、眼压测定、眼底检查、视力检查确诊为高度近视,屈光度为-6D或以上)的105例患儿为A组,未合并高度近视的81例患儿为B组。纳入标准:符合《中华眼科学》中CC诊断标准[5],白内障遮盖视轴,均为单眼发病;所有患儿均无亲属关系;患儿家属知情本研究,签署同意书。排除标准:合并代谢性疾病,心、肾、肝等脏器功能障碍;既往有眼部手术史;有眼部外伤史;眼部畸形。另选取同期本院的体检健康者93例为对照组,其中男53例,女40例;年龄5~14岁,平均(10.07±1.62)岁。CC患儿与体检健康者性别、年龄比较,差异无统计学意义(P>0.05),具有可比性。
1.2方法 EDTA抗凝真空采血管采集外周静脉血5 mL,4 ℃保存待测。从外周血白细胞中提取全基因组DNA,纯化后进行试验,全血提取试剂盒由德国Qiagen公司提供;采用聚合酶链式反应进行基因测序,仪器选择赛默飞SeqStudio Flex基因分析仪;采用多重连接酶检测反应技术进行SNP分型,以GeneMapper4.1软件进行分型数据分析。具体分型见表1,聚合酶链式反应引物见表2。

表1 RASGRF1基因SNP分型

表2 聚合酶链式反应引物
1.3观察指标 (1)比较CC患儿与体检健康者RASGRF1基因的SNP分型与基因型频率。(2)比较A、B两组RASGRF1基因的SNP分型与基因型频率。(3)比较A、B两组一般资料,包括性别、年龄、父母近视情况、看电视距离、近距离用眼休息时间、每天是否做眼保健操、睡眠时间、居住地、眼轴长度、屈光度、黄斑区视网膜厚度(中心凹、上方、下方、鼻侧、颞侧)。(4)分析RASGRF1基因rs8033417分型对CC合并高度近视患儿的独立作用。

2 结 果
2.1CC患儿与体检健康者RASGRF1基因的SNP分型与基因型频率比较 CC患儿与体检健康者RASGRF1基因SNP分型rs2870087、rs8033417、rs939658、rs4778879、rs12902831的基因型频率比较,差异有统计学意义(P<0.05)。见表3。

表3 CC患儿与体检健康者RASGRF1基因的SNP分型与基因型频率比较[n(%)]
2.2A、B两组RASGRF1基因的SNP分型与基因型频率比较 A组与B组RASGRF1基因的SNP分型rs8033417的基因型频率比较,差异有统计学意义(P<0.05)。见表4。
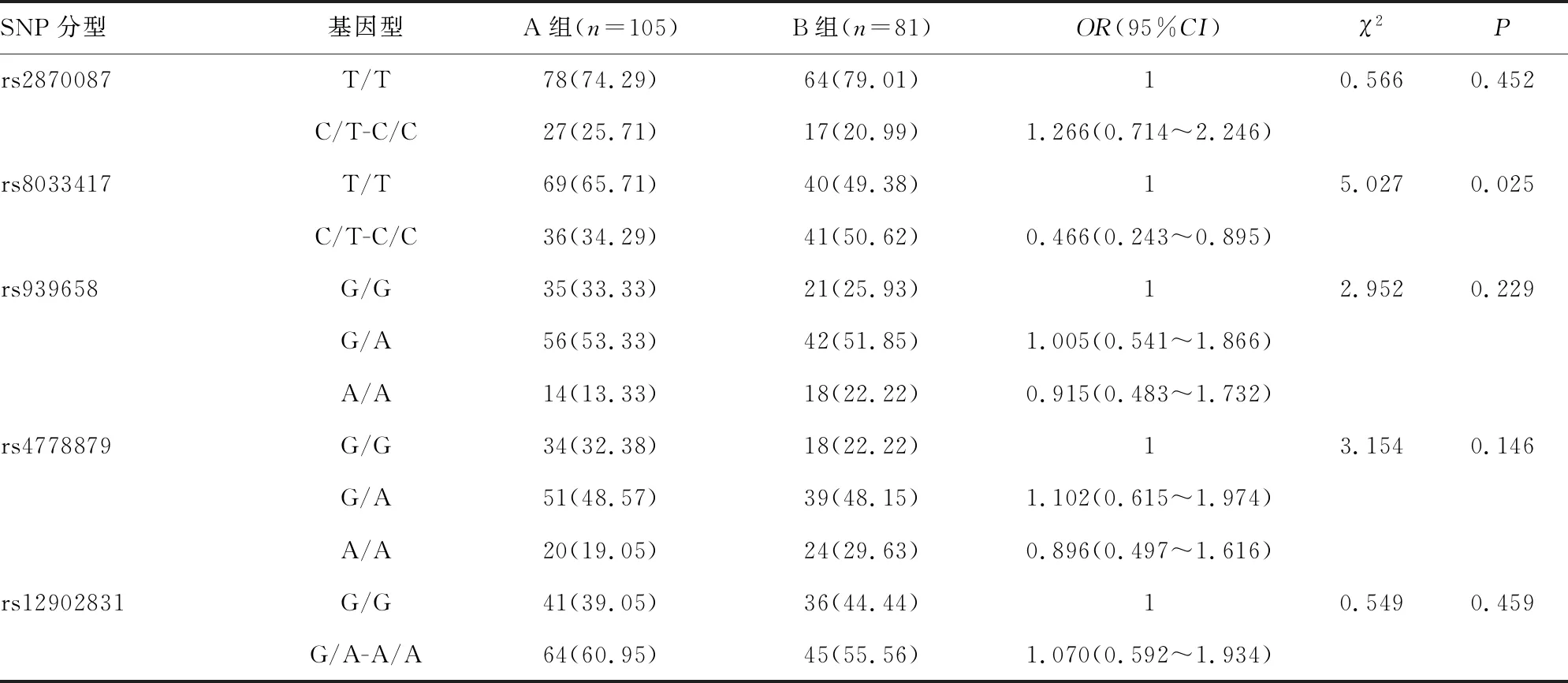
表4 A、B两组RASGRF1基因的SNP分型与基因型频率比较[n(%)]
2.3A、B两组一般资料比较 两组父母近视情况、看电视距离、近距离用眼休息时间、每天是否做眼保健操、睡眠时间、居住地比较差异无统计学意义(P>0.05)。A组女性、年龄>12~14岁人数多于B组,眼轴长度、屈光度、黄斑区中心凹视网膜厚度大于B组,黄斑区上方、下方、鼻侧、颞侧视网膜厚度小于B组(P<0.05)。见表5。
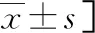
表5 A、B两组一般资料比较[n(%)或
2.4RASGRF1基因rs8033417分型对CC合并高度近视患儿的独立作用 Logistic回归分析结果显示,在未校正因素时,RASGRF1基因rs8033417分型为C/T-C/C的CC患儿发生高度近视的风险是T/T基因型患儿的0.476倍;在模型2、模型3中,RASGRF1基因rs8033417分型为C/T-C/C的CC患儿发生高度近视的风险分别是T/T基因型患儿的0.441倍、0.426倍(P<0.05)。见表6。

表6 RASGRF1基因rs8033417分型对CC合并高度近视的独立作用
3 讨 论
CC是影响儿童视功能的常见疾病,在胎儿发育过程中形成不同形式、不同程度的晶状体浑浊,具有发病时间早、对视力影响大等特点,是儿童致盲的重要原因[6]。CC可导致患儿视力下降,尤其合并轻中度近视的患儿易进展为高度近视。CC合并高度近视患儿眼部结构改变较明显,增加手术难度,且术后视力恢复不佳,不利于患儿的健康成长。因此,筛选CC合并高度近视的高风险患儿,有助于指导临床针对性采取干预措施。
RASGRF1基因是核交换因子,可促进Ras家族GTP酶上的GDP/GTP交换,参与光感受器反应的突触传递[7]。相关研究表明,敲除RASGRF1基因的小鼠会表现出视网膜感光缺陷[8]。RASGRF1基因在视网膜中高度表达,对光感受过程的神经传递具有重要作用,RASGRF1基因缺陷可造成晶状体异常、视觉感觉过程受损,临床有研究证实,RASGRF1是近视发生的易感基因[9-10]。本研究发现,CC患儿与体检健康者RASGRF1基因SNP分型基因型频率比较,差异有统计学意义(P<0.05),提示RASGRF1基因或与CC有关。RASGRF1基因编码的RASGRF1蛋白可从Ras-GDP复合体中解离Ras蛋白,并与GTP结合形成Ras-GTP复合体,激活N-Ras、H-Ras、K-Ras等特定的Ras信号通路,在表观遗传学调控机制中有重要作用[11]。DNA甲基化是表观遗传学修饰的主要方式,RASGRF1基因异常甲基化与编码蛋白有直接关系,对晶状体发育过程有一定影响[12-13]。遗传因素是CC发生的主要因素,约1/3的患儿为染色体显性遗传,此类患儿易出现视力下降,高度近视的发生率更高[14]。为进一步寻找RASGRF1基因中与高度近视发生有关的具有功能性的SNP,本研究通过对是否合并高度近视的CC患儿进行对照研究,发现A、B两组RASGRF1基因分型rs8033417的基因型频率存在明显差异;通过Logistic回归模型分析发现,在校正及未校正其他变量时,RASGRF1基因rs8033417分型为C/T-C/C时均可明显降低高度近视发生率,表明RASGRF1基因rs8033417分型与CC患儿发生高度近视密切相关。RASGRF1基因对近视的发展具有明显影响,有研究显示,RASGRF1基因的遗传变异可造成近视及屈光不正,其机制与RASGRF1基因对视觉信号的传递与处理有关[15]。RASGRF1基因参与维持视网膜的正常功能,且参与导致近视的信号通路,若RASGRF1基因缺乏可导致下游基因发生变化,其中包括视觉障碍基因[16-17]。RASGRF1基因中的rs8033417及其周围序列具有基因增强特征,其与RASGRF1 mRNA水平无明显相关性,而与RASGRF1的长链非编码RNA基因RP11-16K12.1密切相关[18]。RP11-16K12.1与RASGRF1转录方向相反,位于RASGRF1基因的反义链,可通过介导转录因子的相互作用参与基因转录调控,且在诱导染色质重构、细胞分化、细胞维持等活动中有重要作用[19-20]。RP11-16K12.1可通过调控视网膜细胞生长分化,促进眼部疾病发生,这可能是RASGRF1基因与高度近视密切相关的主要机制之一。因此,通过检测RASGRF1基因分型可一定程度上分析CC患儿发生高度近视的风险,具有一定临床应用价值。
综上所述,RASGRF1基因的SNP对CC患儿是否发生高度近视具有直接影响,且主要与rs8033417分型有关,若rs8033417分型为C/T-C/C,则CC患儿发生高度近视的风险较低。本研究仅选取了我国人群分布频率较高的RASGRF1基因SNP分型,对于其他SNP分型是否对CC合并高度近视患儿存在影响,仍需临床进一步深入研究。
