NSCLC患者血清中PTBP1、CDCP1的表达及临床预后意义*
2023-06-26熊云刚成克伦顾延会
熊云刚,成克伦,赵 露,姜 森,顾延会
1.贵州航天医院病理科,贵州遵义 563000;2.遵义医科大学附属医院呼吸一科,贵州遵义 563000
肺癌是人类癌症死亡的最常见原因,全球范围内每年新发病例达180万例,每年死亡病例达160万例[1]。非小细胞肺癌(NSCLC)是肺癌最常见的类型,占全部肺癌类型的80%以上。NSCLC的治疗方式主要包括手术、放化疗及靶向治疗等,但术后复发、转移是NSCLC治疗失败的主要原因[2]。因此,寻找新的有效预测NSCLC患者临床预后的血清肿瘤标志物,对于改善患者临床预后具有重要临床意义。多聚嘧啶束结合蛋白1(PTBP1)属于异质核糖核蛋白亚家族成员,其作为一种RNA结合蛋白,与异质核RNA结合,影响mRNA前体的加工、代谢和转运的过程。近年来有研究发现,PTBP1能够与参与前mRNA剪接的内含子多嘧啶束结合,促进结直肠癌[3]、肺癌[4]等肿瘤的恶性进展及转移。含CUB结构域的蛋白质1(CDCP1)是含有3个细胞外CUB结构域的跨膜蛋白,其作为Src家族激酶的底物,磷酸化激活后上调下游癌基因的表达,促进肿瘤侵袭和转移[5-6]。本研究通过检测NSCLC患者血清PTBP1、CDCP1水平,探讨二者与NSCLC患者临床病理特征及预后的关系。
1 资料与方法
1.1一般资料 选取2019年1月至2020年1月于贵州航天医院就诊的NSCLC患者90例为NSCLC组。纳入标准:(1)经组织病理学检查明确为NSCLC;(2)初次诊治;(3)一般身体状况良好,卡氏功能状态评分>90分;(4)患者及家属对本研究知情同意并签字。排除标准:(1)既往有肿瘤放化疗、靶向治疗史;(2)合并其他部位恶性肿瘤;(3)妊娠、哺乳期女性;(4)临床随访资料不完整。NSCLC组男62例,28例;年龄34~78岁,平均(62.54±6.98)岁;有吸烟史30例;肺腺癌59例,肺鳞癌31例;肿瘤分期:Ⅰ~Ⅱ期57例,Ⅲ~Ⅳ期33例;肿瘤分化程度:中高分化53例,低分化37例;肿瘤最大径:≤5 cm 58例,>5 cm 32例;合并淋巴结转移29例。选取同期诊治的40例肺部良性疾病患者为良性疾病组,其中男26例,女14例;年龄32~78岁,平均(61.72±7.51)岁;肺错构瘤18例,肺炎症病变22例。选取同期体检的40例体检健康者为对照组,其中男25例,女15例;年龄34~79岁,平均(61.80±7.39)岁。3组在性别、年龄上比较,差异无统计学意义(P>0.05),具有可比性。本研究经贵州航天医院伦理委员会审核通过。
1.2方法
1.2.1检测方法 留取NSCLC患者入院后第2天术前,良性疾病组和对照组清晨空腹静脉血5 mL,3 000 r/min离心10 min,离心半径为10 cm,分离上层血清。采用酶联免疫吸附试验(ELISA)检测各组血清PTBP1、CDCP1水平。人PTBP1 ELISA试剂盒购自上海江莱生物科技有限公司。人CDCP1 ELISA试剂盒购自上海科博瑞生物科技公司。实验步骤根据试剂盒使用说明书进行。根据血清PTBP1、CDCP1水平均值将NSCLC组患者分为PTBP1高表达组和低表达组,CDCP1高表达组和低表达组。
1.2.2随访方法 所有NSCLC组患者自确诊之日起开始,以门诊复查或电话的方式进行随访。术后1年内每3个月随访1次,术后第2年起每半年随访1次,随访截止时间2022年2月1日。随访内容包括患者生存状态及肿瘤复发转移情况。随访终点为随访结束或患者死亡。

2 结 果
2.1各组血清PTBP1、CDCP1水平比较 NSCLC组血清PTBP1、CDCP1水平明显高于良性疾病组和对照组,差异均有统计学意义(P<0.05);良性疾病组和对照组血清PTBP1、CDCP1水平差异无统计学意义(P>0.05)。见表1。

表1 各组血清PTBP1、CDCP1水平比较
2.2NSCLC组血清PTBP1与CDCP1水平的相关性 Pearson相关分析结果显示,NSCLC组血清PTBP1与CDCP1水平呈正相关(r=0.721,P<0.001)。
2.3血清PTBP1、CDCP1水平与NSCLC患者临床病理特征的关系 不同肿瘤分期、淋巴结转移患者血清PTBP1、CDCP1水平比较,差异有统计学意义(P<0.05);不同年龄、性别、吸烟史、病理类型、病理分化程度、肿瘤最大径患者血清PTBP1、CDCP1水平比较,差异无统计学意义(P>0.05)。见表2。

表2 血清PTBP1、CDCP1水平与NSCLC患者临床病理特征的关系
2.4血清PTBP1、CDCP1水平与NSCLC患者生存预后的关系 90例NSCLC患者随访6~36个月,平均随访时间(29.42±3.61)个月,死亡36例,失访2例。PTBP1高表达组(44例)和低表达组(46例)NSCLC患者的平均生存时间分别为(27.59±3.32)个月、(31.47±3.68)个月。Kaplan-Meier生存曲线分析结果显示,PTBP1高表达组患者累积生存率低于PTBP1低表达组患者(χ2=5.910,P=0.015)。CDCP1高表达组(47例)和低表达组(43例)平均生存时间分别为(27.34±3.29)个月、(32.27±3.54)个月。CDCP1高表达组患者累积生存率低于CDCP1低表达组患者(χ2=7.544,P=0.006)。见图1。
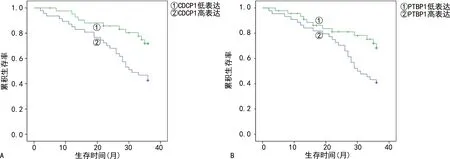
注:A、B分为血清CDCP1、PTBP1水平与NSCLC患者生存预后的生存曲线图。
2.5影响NSCLC患者生存预后的单因素及多因素Cox回归分析 以NSCLC患者的生存预后为因变量(死亡=1,存活=0,生存时间=t),纳入年龄(≥60岁=1,<60岁=0)、性别(男=1,女=0)、吸烟史(有=1,无=0)、肿瘤最大径(>5 cm=1,≤5 cm=0)、病理类型(肺鳞癌=1,肺腺癌=0)、淋巴结转移(有=1,无=0)、肿瘤分期(Ⅲ~Ⅳ期=1,Ⅰ~Ⅱ期=0)、病理分化程度(低分化=1,中高分化=0)、PTBP1(高表达=1,低表达=0)、CDCP1(高表达=1,低表达=0)为自变量,单因素及多因素Cox回归分析结果显示,肿瘤分期Ⅲ~Ⅳ期、有淋巴结转移、PTBP1高表达、CDCP1高表达是影响NSCLC患者生存预后的独立危险因素。见表3、4。

表3 影响NSCLC患者生存预后的单因素Cox回归分析

表4 影响NSCLC患者生存预后的多因素Cox回归分析
3 讨 论
2019年中国肺癌的发病率为58.56/100 000,死亡率为53.23/100 000,并且发病率、死亡率均呈明显上升趋势[7]。NSCLC是最常见的肺癌类型,早期症状不明显,多数患者就诊时已处于晚期,已出现肿瘤血行或淋巴结转移。NSCLC的治疗包括手术及放化疗等,但对于晚期患者,即使经积极综合治疗后患者远期预后仍然较差[8]。NSCLC诊断的金标准是病理活检,但具有一定的有创性及肿瘤播散的风险。血清肿瘤标志物是理想的诊断方式,具有方便、经济等优点。目前NSCLC的血清肿瘤标志物包括癌胚抗原、鳞状上皮癌抗原等,但上述指标在其他疾病中水平也会升高,限制了临床应用[9]。深入研究NSCLC疾病机制,寻找能够有效反映NSCLC患者生存预后的血清标志物,具有重要临床意义。
PTBP1蛋白相对分子质量为58×103,是异质核糖核蛋白亚家族成员,其通过与RNA序列中的嘧啶富集区结合,影响mRNA成熟、定位和翻译等过程。有研究发现,PTBP1能够通过调节肿瘤细胞代谢和T/B淋巴细胞的免疫反应,促进肿瘤的侵袭转移,导致患者不良预后[10]。本研究中,NSCLC患者血清PTBP1水平升高,提示PTBP1可能参与NSCLC的发生过程。有学者证实,NSCLC中CircGLIS4作为分子海绵结合并抑制miR-644a的表达,miR-644a的表达降低导致其直接作用靶点PTBP1 mRNA稳定性增加,进而促进PTBP1的表达[11]。本研究中,NSCLC患者血清PTBP1水平与肿瘤分期及淋巴结转移有关,表明PTBP1的水平升高促进NSCLC的进展。有学者发现,肿瘤细胞中PTBP1水平升高可通过激活磷酸酶张力蛋白同源物/磷脂酰肌醇-4,5-二磷酸3-激酶/蛋白激酶B通路,诱导肿瘤细胞自噬的发生,促进肿瘤细胞的增殖、迁移和侵袭[12]。有研究报道,细胞PTBP1水平升高能够上调细胞周期素依赖激酶D1及B细胞淋巴瘤2的表达,促进诱导细胞周期G1/S期的转化,进而促进肿瘤细胞增殖,并抑制肿瘤细胞凋亡[13]。本研究中,血清PTBP1高表达的NSCLC患者生存预后较差,并且是影响患者生存预后的独立危险因素,提示通过检测血清PTBP1水平有助于评估NSCLC患者的生存预后。分析其原因,可能是PTBP1的水平升高促进肿瘤化疗耐药性形成。有研究发现,肿瘤微环境处于缺氧状态,缺氧条件能够诱导PTBP1的表达,导致DNA损伤修复相关基因的选择性剪接发生改变,促进肿瘤细胞耐药性的形成,导致患者不良预后[14]。
CDCP1也称为CD318,是相对分子质量为135×103的蛋白,结构上有3个CUB样结构域结构域、1个跨膜结构域和1个短的细胞内结构域,多表达于胃肠道、呼吸道等上皮组织中。近年来有研究发现,CDCP1在前列腺癌[6]、乳腺癌[15]等多种恶性肿瘤中水平升高,CDCP1可以从细胞表面脱落,分泌到细胞外及外周血中从而被检测到,是一种新的肿瘤标志物。本研究中,NSCLC患者血清CDCP1水平明显升高,提示CDCP1可能参与NSCLC的肿瘤发生。CDCP1水平升高的机制与NSCLC中RAS通路的激活有关[16]。有研究发现,具有RAS基因突变患者的人肺癌细胞中的CDCP1的水平明显高于没有RAS基因突变的患者,体外细胞实验证实,Ras的过度激活能够明显诱导CDCP1的表达及磷酸化激活,促进肿瘤的迁移和侵袭[17]。本研究中,血清CDCP1水平与肿瘤分期及淋巴结转移有关,提示CDCP1水平促进NSCLC的肿瘤进展。有研究表明,肿瘤中CDCP1的水平升高能够激活Wnt/β-连环蛋白信号通路,促进β-连环蛋白进入细胞核,诱导N-钙黏蛋白的水平升高,E-钙黏蛋白水平降低,增强肿瘤细胞的侵袭和转移能力[18]。此外,有研究发现,肿瘤中CDCP1的水平升高能够促进肿瘤细胞干性形成,促使肿瘤细胞的上皮间质转化的发生,增强肿瘤的侵袭转移能力,导致肿瘤进展[19]。本研究发现,血清CDCP1高表达的NSCLC患者生存预后较差,是影响患者生存预后的独立危险因素,表明血清CDCP1是新的NSCLC肿瘤标志物,检测NSCLC患者血清CDCP1表达有助于评估NSCLC患者的临床预后。有研究表明,在T790M突变的肺癌细胞系中存在AXL/CDCP1/SRC通路过度激活的现象,导致肿瘤细胞对化疗药物耐药性的形成,而沉默CDCP1或AXL的表达后,恢复了对化疗药的敏感性[20]。因此,临床医生可根据血清CDCP1水平,对NSCLC患者的预后进行评估,对于高危患者予以积极治疗和随访,以改善患者生存预后。
本研究通过相关性分析发现,NSCLC患者血清PTBP1与CDCP1水平呈正相关,表明二者可能共同参与NSCLC的发生发展过程。分析其原因是肿瘤中PTBP1水平升高能够稳定CDCP1 mRNA,促进CDCP1蛋白表达,导致肿瘤恶性进展。有研究表明,肿瘤中hsa_circ_0005358作为一种抑癌因子,通过其215-224序列与PTBP1相互作用,阻止PTBP1稳定CDCP1 mRNA,减少CDCP1蛋白翻译,进而抑制肿瘤的转移[21]。
综上所述,NSCLC患者血清PTBP1与CDCP1水平升高,二者与肿瘤分期及淋巴结转移有关,共同促进NSCLC的发生发展。血清PTBP1与CDCP1高表达是影响NSCLC患者生存预后的独立危险因素,是潜在的NSCLC预后相关肿瘤标志物。但本研究也存在一定的不足,本研究样本量有限,随访时间较短,未对不同临床病理特征的NSCLC患者进行分层分析,结果可能存在一定的偏倚,有待今后开展多中心、前瞻性随机对照研究,深入探索二者的临床应用价值。
