先天性肾上腺皮质增生症伴睾丸残余瘤1例
2023-06-26田晓娜叶建红杨嘉欣唐盂晋
田晓娜,叶建红,杨嘉欣,唐盂晋
(1.广州中医药大学第八临床医学院,广东 佛山528000;2.佛山市中医院,广东 佛山528000)
先天性肾上腺皮质增生症又称肾上腺皮质综合症(CAH),是一组以皮质醇合成障碍为特征的常染色体隐性遗传疾病。90%以上的CAH由21-羟化酶(CYP21)缺乏引起[1],此酶缺乏导致皮质醇和(或)醛固酮生成受损,皮质醇减少可负反馈调节垂体促肾上腺皮质激素(ACTH)分泌增加,导致肾上腺和睾丸等其他部位ACTH敏感组织增生,形成肾上腺肿瘤和肾上腺残余肿瘤。睾丸肾上腺残余肿瘤(TARTs)是一种罕见的发生于CAH患者中的良性结节性病变,肿瘤位于睾丸网内,可能阻塞曲精小管,进而导致性腺功能障碍和不育。目前更多学者[2]倾向于此病变来源于肾上腺皮质残余细胞,这些细胞来源于胚胎发育过程中随着睾丸一起下降的异常肾上腺组织,并且部分病灶会在出生后的第1年内自发退化[3]。本文报道1例CAH伴TARTs病例并进行文献复习,旨在加强对此类疾病的认识,提高临床诊疗水平,以免漏诊误诊。
1 临床资料
患者,男,32岁,身材矮小,因“发现双侧睾丸肿块1月余”于2021年10月收入佛山市中医院泌尿外科。既往体健,8岁时身高明显超同龄人,已婚已育。查体:牙龈黏膜和腋窝部有色素沉着,无男性乳房发育,阴茎成年型,阴毛分布正常,尿道外口正常,阴囊皮肤未见异常。双侧睾丸增大,均可触及硬结节,质中稍硬,右侧更为突出,表面光滑,无压痛,无放射痛。实验室检查:肿瘤标志物、人绒毛膜促性腺激素、甲胎蛋白、乳酸脱氢酶均在正常范围内,ACTH 52.68 ng/mL(8am)、15.97 ng/mL(4pm)(参考值1.60~13.90 ng/mL),17-羟孕酮(17-OHP)>300 ng/mL(参考值0.31~2.01 ng/mL),孕酮(P)14.42 μg/L(参考值0.28~1.22 μg/L),雄烯二酮(AD)76.27 nmol/L(参考值1.40~6.63 nmol/L),尿17-类固醇(17-KS)31.3 mg/24 h(参考值6.0~25.0 mg/24 h),黄体生成素/卵泡刺激素(LH/FSH) 0.47(参考值1.00~2.00),精液常规提示精子数量少,浓度低。阴囊超声(US):双侧睾丸明显增大,内见实性低回声肿块,左侧肿块约3.8 cm×2.2 cm×1.9 cm、右侧肿块约4.3 cm×3.2 cm×2.6 cm,境界尚清,边缘不规整,内部回声不均匀,见点状强回声,血供呈散在型,提示双侧睾丸实性肿块。肾上腺US:右肾上腺见一大小4.0 cm×2.8 cm实性低回声结节,包膜清,规整,回声均匀,考虑右肾上腺实性占位。睾丸磁共振成像(MRI):双侧睾丸增大,内见一结节块影,形态规则,呈分叶状,压脂T2WI呈略低、等及略高信号,TIWI呈略高信号,提示双侧睾丸占位性病变,生殖细胞瘤待除外。肾上腺与肾脏CT平扫+增强:双侧肾上腺体积普遍性增大,局部结节样增粗,右肾上腺内外支汇合部见类圆形结节,强化不均匀,考虑先天性肾上腺皮质增生症。双侧睾丸穿刺切片检查,病理结果:镜下肿瘤细胞呈弥漫片状或条索状分布,瘤细胞胞浆丰富嗜酸性,形态相对一致(见图1)。免疫组化:瘤细胞S100(+/-)、a-Inhibin(+)、VIM(+)、SF-1(+)、β-catenin浆(+)、Melan-A(-)、AE1/AE3(-)、CD68(-)、CD163(-)。符合睾丸间质细胞瘤(LCT)。

图1 睾丸活检组织(A:10×20;B:10×10)
患者由泌尿外科转内分泌科治疗,因患者为双侧睾丸病变,且基础17-OHP浓度远远超过正常范围,加上穿刺组织范围局限,所以病理诊断LCT并不能完全解释患者的病情,应排查肾上腺性腺综合征引起的睾丸结节可能。为明确诊断,遂行基因检测,由广州金域医学检验中心进行目标基因的Sanger测序+多重连接依赖性探针扩增(MLPA),发现患者CYP21A2 基因4号外显子杂合突变 c.518 T>A,p.(I1e173Asn),该变异为错义突变[翻译蛋白质中第173位氨基酸残基由异亮氨酸(Ile)变为天冬酰胺(Asn)],会显著削弱蛋白质的活性,其致病性被反复报道[4]。另1号外显子上游调控区以及3、4、6、7号外显子杂合缺失,该变异为缺失突变,预计会使所编码的蛋白质发生大片段缺失突变,进而丧失其正常功能而致病。最终确诊为21-羟化酶缺陷型(21-OHD)CAH伴TARTs。
患者出院后门诊接受激素替代治疗,由于患者的血压、血钠和血钾均正常,替代治疗不需要盐皮质激素,给予糖皮质激素(醋酸泼尼松5~10 mg/d口服),规律复诊5月,睾丸结节与肾上腺增生均有不同程度的缩小(见图2)。目前仍在随访中。
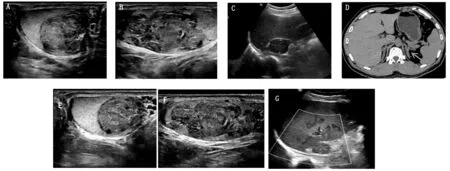
图2 治疗前后睾丸结节、肾上腺结节比较
2 讨论
21-OHD CAH分为经典型(失盐型和单纯男性化型)和非经典型(NCAH)。全球范围内,典型的CAH发病率为1/20 000~1/10 000[5],发病率随年龄的增长而增加。CYP21可将17-OHP转化为11-脱氧皮质醇,将孕酮转化为11-脱氧皮质酮,分别是皮质醇和醛固酮的前体,此酶缺乏导致肾上腺皮质功能减退,进而造成ACTH分泌增加,刺激肾上腺皮质增生并分泌过多的皮质醇前体,使雄激素分泌增加,导致CAH患者性早熟。CYP21A2基因突变所致的21-OHD的严重程度与临床表型高度吻合[6]。其中最严重的为失盐型,由CYP21完全缺乏所致,患者皮质醇和醛固酮生物合成均存在障碍,出生不久即可出现拒乳、呕吐、脱水、低钠高钾血症及代谢性酸中毒等,若治疗不及时,可因循环衰竭而休克。单纯男性化型中CYP21不完全缺乏,能少量合成皮质醇和醛固酮,男性患者6月龄后逐渐出现体格生长加速,阴茎、阴囊增大及色素沉着,女性患者出现外生殖器假两性畸形,故易致性别错判。NCAH是CYP21轻微缺乏所致的一种变异型,发病年龄不一,临床表现各异,男孩出现胡须、痤疮及骨龄超前,女性出现月经紊乱、多囊卵巢及不孕症等。血清17-OHP升高是21-OHD的特异性诊断指标,超过300 nmol/L考虑典型21-OHD,6~300 nmol/L时考虑非典型21-OHD。本例患者在早晨8:00前空腹采血,测17-OHP>300 ng/mL(约936 nmol/L),结合患者病史,诊断符合CAH单纯男性化型。
TARTs是CAH男性患者不育最常见的原因[2],其肿瘤生物学性质为良性肿瘤,肿瘤形态和生物学行为与肾上腺皮质细胞相似。具有纤维间隔、核异型性、低核分裂活性等特征。CAH中TARTs患病率介于0~94%之间[7],在儿童期或青少年期其患病率为21%~33%[8]。患病风险随年龄的增长而增加,通常在20~40岁之间出现[9]。超过2 cm的肿瘤可以通过触诊检测到,US和MRI能够检测到几毫米的病灶[3]。US比MRI更经济、安全、便捷,但无法检测到4岁以下患儿的TARTs[8]。当病变的位置和范围必须精准定位时,如在实施睾丸切除术的情况下,首选MRI 用于术前评估。US所见这些肿瘤位于睾丸网内或睾丸纵隔旁,以低回声为主,边界清晰,形态多样,血供丰富。在MRI中,这些病灶为T1高信号或等信号,T2低信号,边缘清晰[10]。本例患者影像学特征与其大致相符。
TARTs按组织学、临床特征及进程分为5个阶段[11]:Ⅰ期,睾丸网内有肾上腺残余细胞,US难以发现;Ⅱ期,结节较小,不易触诊,US可见睾丸内单个或多个低回声病灶;Ⅲ期,肿物增大可触及,曲精小管梗阻,出现少精子症或无精子症,预计在降低糖皮质激素剂量后,此阶段肿瘤将重新开始生长;Ⅳ期,肿物明显易触及,睾丸网进行性梗阻,肿瘤内纤维化和局部淋巴细胞浸润,可出现曲精小管管周透明样变,此时高剂量糖皮质激素可能不再有效地降低肿瘤大小;Ⅴ期,长期慢性梗阻、压迫致睾丸功能不可逆损害,导致阻塞性无精子症和不育症。由于睾丸实质受压,长期TARTs可导致严重疼痛。TARTs分期对临床标准化治疗具有重要的指导意义。
临床上TARTs易被误认为其他类型的肿瘤而切除睾丸[10,12-13],因此鉴别诊断非常重要。尤其要与LCT相鉴别,此为最常见的睾丸间质细胞肿瘤[13]。两者的治疗方法截然不同,前者口服糖皮质激素,后者行睾丸切除术。TARTs除非因体积大而疼痛不适[8]或激素治疗无效,则可行睾丸肿物剔除术,且应最大限度保留正常睾丸组织。两者相同点:①免疫组化相似,如:a-Inhibin(+)、VIM(+)、Melan-A(-)。②病理特点相似:都为片状多形性胞质嗜酸性细胞,部分细胞含有脂褐素。③均有性早熟和睾丸肿块的表现。两者不同点:①TARTs中可见ACTH和血管紧张素Ⅱ受体,ACTH明显增高,LCT中无ACTH的增高。TARTs是CAH患者的典型表现,但在非CAH患者中也发现TARTs[14],它们通常不位于睾丸,而位于骨盆、腹膜、卵巢、肾脏或脊髓[15]。②TARTs肿块常呈双侧生长,LCT则常为单侧孤立性病灶,超过80%的CAH患者双侧睾丸发生TARTs,而双侧睾丸发生LCT的概率为3%[9]。③约有10%的LCT发生恶变,而在TARTs患者中从未发生恶变[16]。④LCT患者常有男性乳房发育,肿瘤标本在镜下可见特征性的Reinke结晶和胰岛素3样因子[3],此结晶见于约25%~40%的病例[13],而在TARTs中从未出现。⑤TARTs对雄激素受体呈阴性反应,LCT对雄激素受体呈阳性反应,突触体素染色在TARTs中的强度由弱到强;在LCT的染色强度由弱到中[3]。⑥TARTs病灶强化糖皮质激素治疗后肿瘤缩小,而LCT表现为对ACTH抑制治疗无反应的无痛性肿块,首选手术治疗。本例患者行睾丸穿刺活检考虑为LCT,但经糖皮质激素治疗后,睾丸肿块及双侧肾上腺增生均有不同程度的缩小,睾丸疼痛减轻,也印证了TARTs的诊断。
TARTs主要见于激素控制不良的CAH患者,本例患者确诊TARTs前就有肾上腺增生、身材矮小、性早熟、色素沉着等表现,超生理剂量的糖皮质激素可减少过度的ACTH分泌和高雄激素血症,但糖皮质激素的过度应用又可导致糖尿病、胰岛素抵抗、骨质疏松症、肥胖、代谢性疾病的风险及影响生长发育[7],因此治疗应遵循个体化原则。
临床上此类病人往往因睾丸、肾上腺占位或不育前来就诊,明确诊断比较困难。总之,CAH患者双侧睾丸占位性病变应高度怀疑TARTs,因肾上腺或睾丸肿块就诊的患者应警惕CAH的可能,而基础17-OHP水平明显升高可考虑CAH,同时,21-OHD的基因诊断十分重要,是确诊CAH的金标准,并且能诊断杂合子携带者,对遗传咨询也非常重要。CAH患者的内分泌学会指南建议从青春期开始筛查TARTs,并定期监测以评估其发展。诊断和治疗需要多学科参与,避免误诊误治。
