肠黏膜紧密连接蛋白变化与结肠癌合并肠梗阻患者发生细菌移位的相关性研究
2023-06-26邓文胜荣军胡侃肖本萍张裕桂唐和春李晓文
邓文胜 荣军 胡侃 肖本萍 张裕桂 唐和春 李晓文


【摘要】 目的:分析肠黏膜紧密连接(tight junction, TJ)蛋白变化与结肠癌合并肠梗阻发生细菌移位(bacterial translocation, BT)的相关性。方法:回顾性分析2020年10月-2022年6月萍乡市人民医院80例行结肠癌治疗的患者的临床资料,根据患者是否合并肠梗阻分为肠梗阻组(n=30)和非肠梗阻组(n=50),比较两组BT发生率。将肠梗阻组BT患者分为BT阳性组与BT阴性组,比较两组TJ蛋白[咬合蛋白(Occludin)、闭合蛋白-1(Claudin-1)、闭合蛋白-4(Claudin-4)及胞质紧密黏连蛋白-1(ZO-1)]的表达。结果:肠梗阻组BT发生率为56.67%(17/30),高于非肠梗阻组BT发生率18.00%(9/50),差异有统计学意义(P<0.05)。BT阳性组肠黏膜组织中Occludin、ZO-1蛋白表达量均低于BT阴性组,Claudin-1、Claudin-4蛋白表达量均高于BT阴性组,差异均有统计学意义(P<0.05)。结论:肠黏膜TJ蛋白表达的变化与结肠癌合并肠梗阻患者BT紧密相关,发生BT的患者Occludin、ZO-1蛋白较低,Claudin-1、Claudin-4较高。
【关键词】 肠黏膜 结肠癌 肠梗阻 紧密连接蛋白 细菌移位
[Abstract] Objective: To analyze the correlation between the change of intestinal mucosal tight junction (TJ) protein and bacterial translocation (BT) in colon cancer with intestinal obstruction. Method: The clinical data of 80 patients underwent colon cancer treatment in Pingxiang People's Hospital from October 2020 to June 2022 were retrospectively analyzed, according to whether the patients were complicated with intestinal obstruction, they were divided into intestinal obstruction group (n=30) and non-intestinal obstruction group (n=50), and the incidence of BT in the two groups was compared. BT patients in the intestinal obstruction group were divided into BT positive group and BT negative group, and the expression of TJ proteins (Occludin, occludin-1, Claudin-4 and ZO-1) in the two groups were compared. Result: The incidence of BT in the intestinal obstruction group was 56.67% (17/30), which was higher than 18.00% (9/50) in the non-intestinal obstruction group, the difference was statistically significant (P<0.05). The Occludin and ZO-1 protein expression in BT positive group were lower than those in BT negative group, and the Claudin-1 and Claudin-4 protein expression were higher than those in BT negative group, the differences were statistically significant (P<0.05). Conclusion: The changes of TJ protein expression in intestinal mucosa were closely related to BT in patients with colon cancer and intestinal obstruction, in patients with BT, Occludin and ZO-1 proteins are lower, while Claudin-1 and Claudin-4 proteins are higher.
[Key words] Intestinal mucosa Colon cancer Intestinal obstruction Tight junction protein Bacterial translocation
First-author's address: Pingxiang People's Hospital, Jiangxi Province, Pingxiang 337000, China
doi:10.3969/j.issn.1674-4985.2023.14.036
結肠癌属于胃肠道疾病中较为常见的恶性肿瘤疾病,在胃肠道恶性肿瘤疾病中位居第三[1]。当结肠癌患者出现腹胀、无法正常排便、腹痛、肠鸣音及肠腔内狭窄等情况时,则提示患者可能出现肠梗阻。肠梗阻在结肠癌中为常见并发症之一,对患者日常生活造成严重影响[2]。当患者罹患癌症时,自身基础代谢水平会升高,并提升对常规营养支持干预的抵抗[3]。而这时,患者肠道极易遭受细菌侵袭,对肠黏膜造成损伤,通透性增强,增加细菌移位(bacterial translocation, BT)的发生概率[4]。BT指原本处于肠腔内的细菌,通过肠黏膜屏障进入肠黏膜淋巴结及门静脉系统中,最终到达肝、肺及机体循环系统的全过程[5]。相关研究表明,多数重症患者发生感染均是由肠源性微生物造成,以此加速疾病进一步发展,降低生存率[6]。肠黏膜屏障的存在是保护肠道处于正常环境及状态,自身由相关连接蛋白组成,而肠黏膜紧密连接(tight junction, TJ)蛋白是各种连接中最为常见的存在手段,由咬合蛋白(Occludin)、闭合蛋白(Claudin)及胞质紧密粘连蛋白-1(ZO-1)构成,以蛋白复合体的形态存在于机体内[7]。在结肠癌合并肠梗阻患者中,容易发生BT,引起炎症反应,但其具体机制不详。本课题通过收集术中结肠癌合并肠梗阻患者回肠系膜淋巴和肠黏膜组织,检测其肠黏膜TJ蛋白的表达情况,通过对比分析,探讨肠黏膜TJ蛋白的表达变化与结肠癌合并肠梗阻患者中发生BT的关系,丰富结肠癌合并肠梗阻患者的发生感染机制,为临床治疗结肠癌合并肠梗阻提供理论依据。
1 资料与方法
1.1 一般资料 回顾性分析2020年10月-2022年6月萍乡市人民医院80例结肠癌患者的临床资料。(1)纳入标准:①符合文献[8]《中国结直肠癌诊疗规范(2020年版)》中对结肠癌的诊断标准;②临床表现为肠鸣音亢进、肠道停止排气、腹部胀痛明显;③均无腹部手术史;④入院前2周内未行其他外科治疗和抗感染治疗;⑤无消化道穿孔或肠坏死;⑥生命体征均处于平稳状态。(2)排除标准:①年龄<18岁;②进行过相关急诊手术;③合并严重心血管、脏器性等基础疾病;④糖尿病;⑤重度肥胖(BMI>30 kg/m2)或重度营养不良(BMI<15 kg/m2);⑥確诊患有其他内分泌或者代谢性疾病(如甲亢、库欣综合征、系统性红斑狼疮、甲减等);⑦患者临床病例资料不齐全。根据患者是否合并肠梗阻分为肠梗阻组(n=30)和非肠梗阻组(n=50)。将肠梗阻组患者分为BT阳性组与BT阴性组。本研究经医院医学伦理委员会批准。
1.2 方法 (1)细菌培养:于腹腔镜下结肠癌根治术前及使用抗生素前,取距离肿瘤上段(近心端)10 cm结肠黏膜组织中2枚回盲部淋巴结进行有氧和无氧细菌培养,37 ℃左右温度控制下持续培养48 h。将结肠切除并剖肠腔获取粪便,制作组织匀浆,置于麦康凯琼脂37 ℃左右温度控制下持续培养24 h。(2)细菌形态鉴定:随机选取粪便标本中4种大肠埃希菌,大肠埃希菌和淋巴结来源的相应大肠埃希菌采用API 20E试条证实。(注:99%概率与淋巴结之内易位细菌为同源)。(3)确定BT情况:淋巴结内部细菌采用DNA指纹图谱确定是否属肠道移位细菌。并采用肠杆菌基因间保守重复序列(ERIC)-PCR法和基因外重复回文序列(REP)-PCR法证实肠系膜淋巴结之中细菌源于肠道。(4)肠黏膜组织中TJ蛋白表达及细菌结果:用免疫组织化学染色法(Elivision法)检测,取结肠癌上段10 cm结肠黏膜组织1 cm石蜡包埋切片,厚度为3 μm。进行脱蜡后使用纯净水洗涤,将其放置于PBS缓冲液中,进行10 min的95 ℃微波加热修复。封闭标本中的内源性过氧化物酶,滴加抗Occludin、闭合蛋白-1(Claudin-1)、闭合蛋白-4(Claudin-4)和ZO-1一抗180 μL,进行2 h的室温孵育。随后加入二抗,在室温中进行30 min的反应,通过DAB显色,常规脱水透明,封片。由本院3名病理科相关高资历医师通过双盲法在电子显微镜(青岛菲优特检测有限公司,型号:JEM-2100)×400下随机选取3个视野观察Claudin-1、Claudin-4、ZO-1阳性表达情况。四者阳性表达的呈现情况,均以细胞膜、细胞质出现黄色颗粒为标准,观察肠黏膜TJ蛋白(Occludin、Claudin-1、Claudin-4、ZO-1)的染色强度及细胞染色的比例进行阳性情况评定。(5)肠黏膜组织中TJ蛋白检测:用免疫印迹分析法Western blot检测,取结肠癌上段10 cm结肠黏膜组织110 mg,将其解冻后粉碎,加入裂解液,提取总蛋白。随后将含总蛋白的裂解液取出35 μL,将PBS缓冲液加入至其中,在100 ℃高温中煮沸6 min,进行变性。采用5%~20%的十二烷基硫酸钠一聚丙烯酰胺凝胶电泳对变性后的蛋白进行分离,接着进行封膜处理,进行1 h孵育,随后加入Arpin、OC、CL、ZO-1及β-actin单克隆抗体(1︰750和1︰1 500稀释),滴加二抗及HRP-亲和素反应,电化学发光(ECL)显色,摄X线片,并用Quantityone(Rio-Rad)软件分析肠黏膜TJ蛋白(Occludin、Claudin-1、Claudin-4和ZO-1)的相对表达量。
1.3 统计学处理 数据采用SPSS 19.0统计软件处理,计量资料用(x±s)表示,组间比较采用独立样本t检验;计数资料以率(%)表示,比较采用字2检验。P<0.05为差异有统计学意义。
2 结果
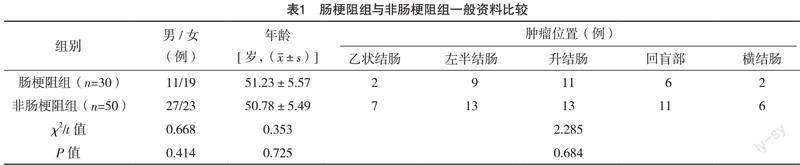
2.1 肠梗阻组与非肠梗阻组一般资料比较 两组一般资料比较,差异均无统计学意义(P>0.05),见表1。
2.2 肠梗阻组与非肠梗阻组BT发生率比较 肠梗阻组30例患者中有17例发生BT,BT发生率56.67%,非肠梗阻组50例患者中有9例发生BT,BT发生率18.00%,肠梗阻组BT发生率高于非肠梗阻组,差异有统计学意义(字2=11.077,P=0.001)。
2.3 肠黏膜TJ蛋白组织BT阳性、BT阴性免疫组化图 BT阳性肠黏膜组织整体结构受到破坏,细胞膜、细胞质出现严重的颗粒现象,且细胞整体形态出现严重变形,呈现椭圆及不规则形态,见图1。BT阴性肠黏膜组织整体趋于正常状态,细胞排列较为整齐,形态为规则圆形和椭圆形,见图2。
2.4 BT阳性组与BT阴性组肠黏膜组织中TJ蛋白表达量比较 BT阳性组肠黏膜组织中Occludin、ZO-1蛋白表达量均低于BT阴性组,Claudin-1、Claudin-4蛋白表达量均高于BT阴性组,差异均有统计学意义(P<0.05)。见表2、图3。
3 讨论
结肠癌在我国乃至全世界的发病率均相对较高,属于胃肠道常见的恶性肿瘤疾病之一。而结肠癌发病病因多与高脂肪及低/无纤维素的饮食摄入有关[9-10]。结肠癌在早期无明显症状,待转入中晚期,则会出现消化不良、腹痛、便血、下肢浮肿等症状,并且将近25%的患者会并发肠梗阻[11]。结肠癌患者合并肠梗阻后,自身免疫力降低,水电解质、酸碱平衡出现紊乱、失调,极易出现全身炎症反应[12]。目前临床相关研究表明,结肠癌合并肠梗阻患者机体内肠黏膜屏障功能出现损伤,提高肠黏膜通透性,增加BT的发生率,引起感染已成为结肠癌术后最常见并发症,甚至还会出现脓毒血症或感染性休克,从而直接威胁患者生命安全[13]。又有研究显示,肠黏膜屏障功能是否处于正常状态,取决于肠黏膜TJ蛋白活性程度是否正常,肠黏膜TJ蛋白能够对机体内细胞外离子及溶质转运过程进行参与和调节,以此保证肠道屏障完整性[14-15]。因此,早期、有效地评估肠黏膜TJ蛋白表达的变化对肠黏膜屏障功能受损导致结肠癌合并肠梗阻患者发生BT及改善危重患者的预后具有重要意义。
本研究纳入本院治疗的80例结肠癌患者进行分析,结果显示,肠梗阻组BT发生率为56.67%(17/30),高于非肠梗阻组BT发生率18.00%(9/50),说明肠梗阻患者比非肠梗阻患者更容易出现BT。相关研究表明,在结肠癌等恶性肿瘤疾病中,患者自身免疫功能呈现降低状态,机体会出现免疫抑制代偿性抗炎反应综合征,表现为患者机体内T淋巴细胞活性及反应性程度降低、Th1/Th2型细胞因子群出现失衡情况等,T淋巴细胞自身功能会向Th2细胞偏移,使Th2细胞的抗炎作用发挥到极致[16-17]。因此,Th1/Th2细胞情况是否处于正常状态,不仅反映免疫功能,还能对炎症发展情况起到决定性作用。而免疫功能降低会导致肠黏膜屏障功能受损,极易发生BT[18]。BT的发生,最直接表现就是炎症反应提升,由此可推测,BT可能直接诱导炎症反应,促进炎症进一步发展。机体炎症反应加重,会使机体代谢等机体多种情况出现障碍,并且BT与炎症反应之间形成恶性循环,加重疾病恶化,出现感染性休克等情况,危及生命安全,机体炎症的加重造成肠黏膜通透性的提高[19]。故BT与肠黏膜屏障功能之间具有相关性,并与机体炎症之间彼此相互影响。
肠黏膜TJ蛋白在机体内位于肠道上皮细胞外膜顶端位置,对肠上皮细胞进行连接的关键性细胞间连接蛋白,自身由跨膜蛋白及细胞脂蛋白合成,涵盖Occludin、Claudin-1、Claudin-4、ZO-1蛋白[19]。结肠癌合并肠梗阻患者中,肠黏膜TJ蛋白处于缺失状态,导致患者肠黏膜屏障功能受损,增加肠上皮自身通透性,还会对血管内皮稳定性产生影响。在结肠癌伴肠梗阻患者机体内,相关炎症因子分泌情况与BT互为因果关系[20]。本研究结果显示,BT阳性肠黏膜组织整体结构受到破坏,细胞膜、细胞质出现严重的进入颗粒现象,且细胞整体形态出现严重变形,呈现椭圆及不规则形态,BT阴性肠黏膜组织整体趋于正常状态,细胞排列较为整齐,形态为规则圆形和椭圆形;BT阳性组肠黏膜组织中Occludin、ZO-1蛋白表达量均低于BT阴性组,Claudin-1、Claudin-4蛋白表达量均高于BT阴性组,说明肠黏膜TJ蛋白表达变化与结肠癌合并肠梗阻患者发生BT密切相关。分析原因,肠黏膜TJ蛋白缺失导致肠黏膜屏障受损,最终造成BT发生,而BT的出现会造成机体出现炎症反应,破坏肠道微生态,造成肠道菌群紊乱、机体免疫力下降,使致病菌过度繁殖,增加BT的进一步发展[13,21]。另外,肠道属于机体内重度感染病原菌主要储库,正常情况下,各菌群内会有少量细菌在其周围进行横向、纵向转移,但数量相对较小,并不会出现转移成功情况,而在肠道感染后,则会使细菌急速繁殖,转移增多,造成BT发生率骤增[22]。也因此进一步引发炎症反应,而炎症的出现,对肠黏膜屏障及肠道微生态产生刺激,彼此之间具有直接紧密的相关性,相互影响、相互作用。加上结肠癌患者较弱的机体免疫力,容易发生菌群失衡现象,从而增加肠黏膜屏障受损程度,提高BT的发生风险。
综上所述,肠黏膜TJ蛋白表达的变化与结肠癌合并肠梗阻患者BT紧密相关,发生BT的患者,其Occludin、ZO-1蛋白水平较低,Claudin-1、Claudin-4蛋白水平较高。
参考文献
[1]孙中,艾江.肠道菌群失调与结直肠癌关系的研究进展[J].现代消化及介入诊疗,2021,26(4):530-533.
[2]张汉松,周健.Ⅰ期肠切除术和吻合术治疗结肠癌合并肠梗阻的临床研究[J].中国医学创新,2017,14(35):17-21.
[3] DAVIS M,HUI D,DAVIES A,et al.Medical management of malignant bowel obstruction in patients with advanced cancer: 2021 MASCC guideline update[J].Support Care Cancer,2021,29(12):8089-8096.
[4] LIU J,HUANG L,LUO M,et al.Bacterial translocation in acute pancreatitis[J].Crit Rev Microbiol,2019,45(5-6):539-547.
[5]辛天宇,刘树元,赵金宝.重症急性胰腺炎继发脓毒症与肠道细菌易位及炎症特征观察[J].现代消化及介入诊疗,2021,26(4):471-473.
[6]葛耀植,黄红兰.肠黏膜屏障功能障碍与细菌易位研究进展[J].医学综述,2018,24(6):1072-1076.
[7]谷佰健,陈碧心,周建华.千金消澼液对肠黏膜上皮屏障紧密连接蛋白的影响[J].长春中医药大学学报,2022,38(4):398-401.
[8]中华人民共和国国家卫生健康委员会.中国结直肠癌诊疗规范(2020年版)[J].中华外科杂志,2020,58(8):561-585.
[9]韩震,王靖,李卉,等.双歧杆菌联合辅助化疗对结直肠癌患者肠道菌群及免疫功能的影响[J].中国医学创新,2022,19(1):29-33.
[10] GUPTA R,BHATT L K,JOHNSTON T P,et al.Colon cancer stem cells: Potential target for the treatment of colorectal cancer[J].Cancer Biol Ther,2019,20(8):1068-1082.
[11]李明东,谢红强,陶涛,等.结直肠癌患者术后肠梗阻发生风险列线图预测模型的构建及评估[J/OL].中华消化病与影像杂志:电子版,2021,11(4):158-163.http://qikan.cqvip.com/Qikan/Article/Detail?id=7105205724.
[12]严平雄,王正文.腹腔镜手术对结肠癌肠梗阻患者的手术效果及炎症指标的影响[J].中国普通外科杂志,2018,27(4):514-518.
[13]莫佳丽,解基良,张楠.肠道菌群与肠梗阻关系的研究进展[J].中国中西医结合外科杂志,2020,26(4):783-787.
[14]穆韵浓,赵百孝,任俊逸,等.艾灸神阙穴对溃疡性结肠炎小鼠血清促炎性因子及肠黏膜紧密连接蛋白的影响[J].中国中医急症,2020,29(6):952-956.
[15]马军宏,于向阳,张楠,等.紧密连接蛋白与肠黏膜屏障损伤研究进展[J].中国中西医结合外科杂志,2015,21(1):104-105.
[16]陈宓,贾霖,蘇州.肠癌根治性术后化疗对患者Th1/Th2、T细胞亚群影响[J].海南医学院学报,2016,22(14):1587-1590.
[17]李秀娟,范焕芳,闫娇娇,等.胃癌患者Th1/Th2细胞因子含量变化及其相关性分析研究[J].现代中西医结合杂志,2021,30(9):991-995.
[18]朱云祥,韩波,李昊晋,等.重症急性胰腺炎继发脓毒症与肠道细菌易位、炎症及免疫抑制的关系[J].中国病原生物学杂志,2017,12(10):1010-1013.
[19]望小杰,李峰,谢勤文,等.肠黏膜紧密连接蛋白变化与癌性恶病质患者细菌易位相关性研究[J].现代消化及介入诊疗,2019,24(9):977-979.
[20]蔺旺君,贾利丽.结直肠癌患者肠道菌群失调与血清炎性因子的相关性[J].中国微生态学杂志,2022,34(7):803-807.
[21]孙中,艾江.肠道菌群失调与结直肠癌关系的研究进展[J].现代消化及介入诊疗,2021,26(4):530-533.
[22]黄路桥,姜英健,李畅,等.肠黏膜屏障损伤与结肠癌患者恶病质的关系[J].中华普通外科杂志,2018,33(3):235-239.
(收稿日期:2022-12-05) (本文编辑:张明澜)
