阿立哌唑改善帕金森病伴发抑郁模型大鼠行为学及能量代谢*
2023-06-25仲照希岳凌峰王瑜璞
马 敬, 仲照希△, 岳凌峰, 王瑜璞, 李 炎
新乡医学院第二附属医院 1心境障碍一科 2精神四科,新乡 453000
帕金森病(Parkinson’s disease,PD)是老年人群中常见的神经系统变性疾病,主要病理表现为中脑黑质多巴胺能神经元变性死亡引起的纹状体多巴胺减少,临床表现出静止性震颤、肌强直、运动迟缓等运动症状,同时部分患者还伴有抑郁、睡眠障碍、痴呆等非运动症状,其中以抑郁最为常见[1-2]。临床统计发现,帕金森病发病过程中,约有一半以上的患者会出现抑郁症状,不仅增加患者精神痛苦,还会加重患者认知功能和身体运动损伤,进一步加重帕金森病情,严重影响患者生活质量[3]。目前,帕金森病抑郁症(Parkinson’s disease depression,PDD)的发病机制尚未完全清楚,其治疗也以抗抑郁药物治疗为主。阿立哌唑(Aripiprazole)是一类新型的抗精神分裂症药物,可双向调节多巴胺能神经系统[4]。Luan等[5]研究显示,辅助应用Aripiprazole治疗难治性抑郁症有较好的疗效和安全性。但Aripiprazole对PDD症状是否有缓解作用尚未可知。本研究通过构建PDD大鼠模型,观察Aripiprazole对PDD大鼠行为学的作用,并初步分析其相关机制,旨在为Aripiprazole应用于PDD治疗提供实验依据。
1 材料与方法
1.1 动物来源
60只SD大鼠,SPF级,雄性,体质量180~220 g,6~8周龄,购于北京维通利华实验动物技术有限公司,动物合格证编号为SCXK(京)2019-0125,饲养于室温20~25 ℃、相对湿度60%~70%、12 h昼夜交替的动物房中,自由摄食饮水,实验前大鼠适应性饲养7 d。
1.2 药品与主要试剂
Aripiprazole(江苏恩华药业股份有限公司,国药准字H20140121,规格10 mg/片);6-羟基多巴胺(6-hydroxydopamine,6-OHDA)、5-羟色胺(5-hydroxytryptamine,5-HT)、5-羟吲哚乙酸(5-hydroxyindoleacetic acid,5-HIAA)试剂盒(美国Sigma);TUNEL试剂盒(美国Promega);乳酸脱氢酶(lactate dehydrogenase,LDH)、Na+-K+-ATP酶、Ca2+-Mg2+-ATP酶检测试剂盒(南京建成生物工程研究所);蛋白一抗(美国Abcam)。
1.3 PDD模型的构建
采用6-OHDA纹状体双靶点注射法及慢性不可预见性温和应激法(chronic unpredictable mild stress,CUMS)制备PDD大鼠模型[6],具体操作如下:腹腔注射3%戊巴比妥钠麻醉大鼠,并将大鼠头颅固定于脑立体定位仪,去毛备皮,沿正中矢状线剪开头皮,暴露前囟,确定右侧纹状体注射点,于相应位点处颅骨钻孔,再缓慢注入15 μg 6-OHDA,术后以医用明胶海绵填塞颅骨孔,缝合头皮消毒,腹腔注射80000 U青霉素钠抗感染,并注意保暖。术后6周时,背部皮下注射0.5 mg/kg阿扑吗啡,诱导大鼠向健侧旋转,注射10 min后观察并记录大鼠60 min内自然旋转圈数,若旋转≥6圈/min提示PD模型构建成功。取PD大鼠进行21 d CUMS,包括24 h禁食、24 h禁水、5 min水平摇晃、2 h闪光刺激、6 h潮湿鼠笼、5 min 50 ℃环境、5 min 4 ℃冷水游泳、24 h昼夜颠倒、1 min夹尾、10 s足底电击,上述10种刺激随机分配到21 d中,每天1种刺激,并避免同种刺激连续使用,通过行为学实验评估PDD模型。
1.4 动物分组与处理
60只SD大鼠随机分为5组:健康对照组、模型组(PDD组)、低、中、高剂量Aripiprazole处理组,每组12只。除健康对照组外,其余大鼠均构建PDD模型,健康对照组大鼠以生理盐水进行外纹状体双靶点注射,不予以应激刺激。低、中、高剂量Aripiprazole处理组于建模后分别灌胃1.25、2.5、5 mg/kg Aripiprazole,1次/d,连续灌胃21 d[7]。健康对照组和PDD组以生理盐水替代药物灌胃。
1.5 大鼠行为学观察
1.5.1 旷场实验 将大鼠置于旷场反应箱正中心方格内,记录5 min内大鼠的总移动路程及中心区域活动时间。
1.5.2 蔗糖溶液偏好实验 实验前3 d,除给予大鼠正常饮食外,予以1%糖水饲喂,且装有糖水瓶和普通饮水瓶随机调换位置,以便大鼠自由选择饮用。适应性训练结束后,禁水不禁食1 d,同时给予1%糖水和纯水,12 h后更换水瓶位置,观察并记录大鼠24 h内两种水的饮用量,计算蔗糖偏好指数(蔗糖水饮用量/总饮用水量×100%)。
1.5.3 Y迷宫实验 将Y迷宫的3个臂随机标记为A、B、C,将大鼠从交叉中心位放入,记录大鼠5 min内自由探索进入3个臂的次序和进入臂总次数,若大鼠每次进入的臂与前两次进入的不同则认定为正确选择,统计犯错次数和新异臂进入次数。
1.6 神经功能损伤评价
处理完成后,采用Longa法评价大鼠神经功能损伤情况,其中无神经功能缺失症状、活动正常为0分;提尾时健侧不能完全伸展为1分;爬行时向健侧转圈行走为2分;行走时身体向健侧倾倒为3分;无法自行行走、丧失意识、昏迷为4分。
1.7 脑组织5-HT和5-HIAA含量检测
处理完成后,断头处死大鼠,冰上快速剥离脑组织,加入0.1 mol/L高氯酸匀浆,10000 r/min离心10 min,取上清检测单胺类神经递质及其代谢产物(5-HT、5-HIAA)的含量,具体操作参照试剂盒说明书。
1.8 大鼠脑组织损伤观察
处理完成后,断头处死大鼠,冰上快速剥离脑组织,行常规石蜡切片,苏木精-伊红(HE)染色后光镜下观察脑组织病理损伤。
1.9 大鼠脑组织细胞凋亡观察
处理完成后,断头处死大鼠,冰上快速剥离脑组织,行常规石蜡切片,置于二甲苯中脱蜡,经磷酸盐缓冲液洗涤后,添加TUNEL检测试剂,避光条件下反应45 min,加入DAPI染剂孵育5 min,光镜下观察并拍照,计数染色阳性(凋亡)细胞数,计算凋亡阳性细胞数占比(凋亡指数)。
1.10 外周血代谢相关酶活性检测
处理完成后,收集腹主动脉血,7500 r/min离心10 min,取上清采用比色法,测定血清LDH、Na+-K+-ATP酶、Ca2+-Mg2+-ATP酶活性。
1.11 蛋白印迹法检测凋亡和代谢相关蛋白的表达
处理完成后,断头处死大鼠,冰上快速剥离脑组织,加入适量液氮研磨,经蛋白裂解液提取总蛋白,各组取等量蛋白进行凝胶电泳,待蛋白完全分离后进行转膜,再将转以后的膜放入5%的脱脂奶粉中,摇床上室温反应2 h,然后置于1∶1000一抗工作液中,4℃摇床反应过夜,次日置于1∶10000二抗工作液中,摇床上室温反应1 h,最后添加化学发光剂,经凝胶成像及分析系统,检测生存素(Survivin)、B淋巴细胞瘤-2基因(B-cell lymphoma-2,Bcl-2)、Bcl-2相关X蛋白(Bcl-2 associated X,Bax)、腺苷酸活化蛋白激酶α1(adenosine activated protein kinase α1,AMPKα1)、过氧化物酶体增殖物激活受体γ辅激活因子1α(peroxisome proliferator-activated receptor γ coactivator-1α,PGC-1α)及葡萄糖转运蛋白4(glucose transporter 4,GLUT4)的相对表达量。
1.12 统计学方法

2 结果
2.1 Aripiprazole对PDD大鼠抑郁样行为的影响
与健康对照组比较,PDD组大鼠旷场移动路程、蔗糖偏好指数及新异臂进入次数均减少,犯错次数增加(均P<0.05),表现出明显抑郁样行为;与PDD组比较,中、高剂量Aripiprazole处理可显著提高旷场移动路程、蔗糖偏好指数及新异臂进入次数,降低犯错次数(均P<0.05),见表1。
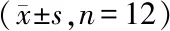
表1 Aripiprazole对PDD大鼠抑郁样行为学的影响Table 1 Effects of Aripiprazole on depression-like behaviors in PDD
2.2 Aripiprazole对PDD大鼠脑神经损伤和脑内单胺类神经递质的影响
如图1,与健康对照组比较,PDD组大鼠脑神经功能损伤评分升高,脑组织5-HT、5-HIAA含量降低(均P<0.05);与PDD组比较,中、高剂量Aripiprazole处理可显著降低脑神经功能缺损评分,并提高5-HT、5-HIAA含量(均P<0.05)。
A:脑神经功能评分,B:脑组织5-HT含量,C:脑组织5-HIAA含量;1:健康对照组,2:PDD组,3~5:低、中、高剂量Aripiprazole处理组;与健康对照组比较,*P<0.05;与PDD组比较,#P<0.05;n=6图1 Aripiprazole改善PDD大鼠脑神经损伤和升高单胺类神经递质水平Fig.1 Aripiprazole improves brain nerve damage and increases monoamine neurotransmitter level in PDD rats
2.3 Aripiprazole对PDD大鼠脑组织病理损伤的影响
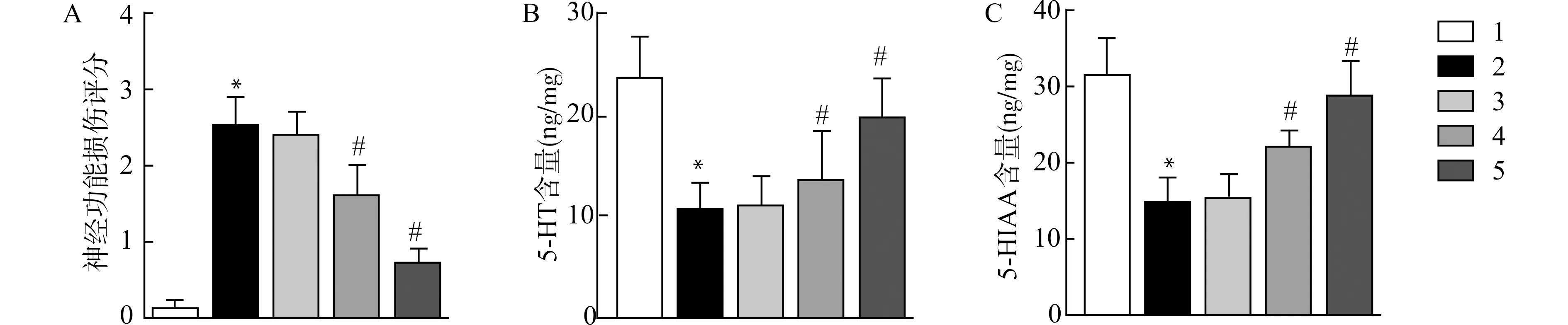
如图2,健康对照组大鼠脑组织细胞结构完整、分布均匀,且无坏死细胞;模型组脑组织结构缺损、分布紊乱,且存在大量的坏死细胞;Aripiprazole处理后PDD大鼠脑组织病理损伤明显减轻,其中以中、高剂量Aripiprazole处理组改善更为显著。
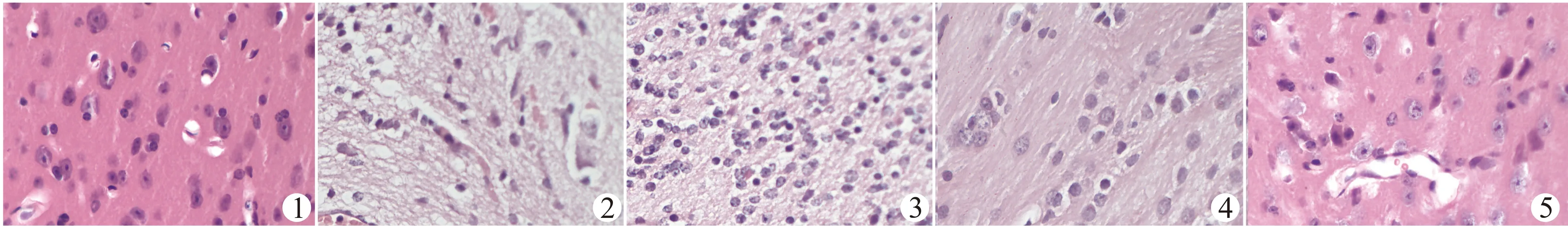
1:健康对照组;2:PDD组;3~5:低(3)、中(4)、高(5)剂量Aripiprazole处理组图2 Aripiprazole改善PDD大鼠脑组织病理损伤(HE染色,×400)Fig.2 Aripiprazole improves pathological damage in brain tissues of PDD rats(HE staining,×400)
2.4 Aripiprazole对PDD大鼠脑组织细胞凋亡的影响
如图3,健康对照组、模型组(PDD组)、低、中、高剂量Aripiprazole处理组脑组织细胞凋亡指数分别为(6.21±1.35)%、(52.37±9.51)%、(48.64±11.27)%、(36.72±6.57)%、(19.37±5.24)%。各组比较,差异有统计学意义(F=33.127,P<0.01);与健康对照组比较,PDD组大鼠脑组织细胞凋亡指数升高(P<0.05);与PDD组比较,中、高剂量Aripiprazole处理可显著降低脑组织细胞凋亡指数(均P<0.05)。
2.5 Aripiprazole对PDD大鼠脑组织中凋亡相关蛋白表达的影响
如图4,与健康对照组比较,PDD组大鼠脑组织中Survivin表达降低,Bax/Bcl-2水平升高(均P<0.05);与PDD组比较,中、高剂量Aripiprazole处理组可显著升高Survivin表达,并降低Bax/Bcl-2水平(均P<0.05)。
2.6 Aripiprazole对PDD大鼠血清代谢相关酶活性的影响
与健康对照组比较,PDD组大鼠血清LDH含量升高,Na+-K+-ATP酶和Ca2+-Mg2+-ATP酶活性降低(均P<0.05)。
与PDD组比较,中、高剂量Aripiprazole处理可显著降低血清LDH水平,并升高Na+-K+-ATP酶和Ca2+-Mg2+-ATP酶活性(均P<0.05),见表2。

表2 Aripiprazole对PDD大鼠血清代谢相关酶活性的影响Table 2 Effects of Aripiprazole on activities of serum metabolism-related enzymes in PDD
2.7 Aripiprazole对PDD大鼠脑组织中代谢相关通路的影响
如图5,与健康对照组比较,PDD组大鼠脑组织中p-AMPKα1、PGC-1α及GLUT4表达降低(均P<0.05);与PDD组比较,中、高剂量Aripiprazole处理可显著提高AMPKα1磷酸化水平以及PGC-1α和GLUT4的表达(均P<0.05)。

A:蛋白电泳条带图;B:各组p-AMPKα1/AMPKα1、PGC-1α及GLUT4表达的统计比较;1:健康对照组;2:PDD组;3~5:低、中、高剂量Aripiprazole处理组;与健康对照组比较,*P<0.05;与PDD组比较,#P<0.05;n=6图5 Aripiprazole对PDD大鼠脑组织中代谢相关通路的影响Fig.5 Effects of Aripiprazole on metabolism-related pathways in brain tissues of PDD rats
3 讨论
本研究应用旷场实验、蔗糖溶液偏好实验及Y迷宫实验,反映大鼠情绪,发现PDD大鼠表现出明显的抑郁样行为学改变,且存在运动障碍;经中、高浓度Aripiprazole处理后,蔗糖偏好指数及新异臂进入次数的增加和犯错次数的减少,说明Aripiprazole可改善PDD大鼠模型的抑郁情绪,这与Yoon等[8]临床研究结果基本相符。
单胺类递质假说是研究最多最深入的抑郁症发病机制之一,脑内多巴胺、5-HT、去甲肾上腺素等神经递质及受体失调,引起海马、皮层等调节情绪脑区结构和功能的改变,最终导致抑郁症的发生[9]。而PD由于黑质内多巴胺能神经元缺失,降低多巴胺释放,从而引起多巴胺递质系统与乙酰胆碱系统失调,不仅引起肌张力增高、运动减少等运动症状,还会出现抑郁症。单胺类神经递质5-HT主要参与情绪、体温、认知等功能的调节,其脑内含量与抑郁症的病情密切相关,多数临床一线抗抑郁药物主要靶向5-HT系统,从而达到抗抑郁的作用[10]。本研究显示,遭受应激刺激的大鼠脑组织神经功能出现明显损伤,脑内5-HT及其代谢产物5-HIAA含量明显降低,经中、高剂量Aripiprazole治疗后,脑神经功能损伤明显减轻,5-HT和5-HIAA含量明显增加,提示Aripiprazole对PDD大鼠的抗抑郁作用机制可能与影响脑内5-HT能神经系统,增加5-HT和5-HIAA含量有关。
既往对PD患者的临床病理学研究、基础研究均表明,脑内细胞凋亡与PD密切相关[11-12]。当脑组织结构和功能发生改变时,往往伴随着神经细胞损伤,这与抑郁症状、认知功能障碍的发生也存在联系[13]。TUNEL染色发现,PDD大鼠脑组织细胞凋亡指数显著上升,提示脑组织细胞凋亡是PDD大鼠脑功能损伤的重要表现。体内细胞凋亡过程受多种途径的共同调控,其中线粒体途径主要通过调节Bcl-2家族中抗凋亡蛋白Bcl-2和促凋亡蛋白Bax比例,影响线粒体通透性,最终激活下游半胱天冬酶家族级联反应[14]。Survivin是一种强效的抗凋亡因子,可介导半胱天冬酶家族抑制细胞凋亡过程,并增强细胞增殖的潜能[15]。本研究中,Aripiprazole治疗可提高PDD大鼠脑组织中Survivin表达,并降低Bax/Bcl-2水平,表明Aripiprazole可能通过抑制脑组织细胞的凋亡,保护PDD大鼠的脑损伤,这与kim等[16]研究报道Aripiprazole在缺血性卒中后抑郁小鼠中的抗凋亡作用一致。
脑能量代谢异常常见于PD、脑缺血、脑挫裂伤等。研究证实,抑郁症患者脑内可出现明显的能量代谢紊乱,提示能量代谢损伤可能是抑郁症临床症状的神经生物学基础[17]。LDH是机体糖无氧酵解的重要指标,可敏感反映体内能量代谢情况[18]。ATP作为主要的能量物质,Na+-K+-ATP酶和Ca2+-Mg2+-ATP酶是参与主动转运离子泵的核心成分,可维持细胞内外的离子交换,也是代谢紊乱及组织损伤的标记物[19]。AMPK/PGC-1α是重要的能量代谢信号调控通路,AMPK亚基AMPKα1活化状态可启动PGC-1α,增加GLUT4表达,促进葡萄糖的摄取[20]。本研究结果显示,血清LDH含量升高,Na+-K+-ATP酶、Ca2+-Mg2+-ATP酶活力及脑组织p-AMPKα1/AMPKα1、PGC-1α及GLUT4表达降低可能与PDD大鼠抑郁行为变化有关,Aripiprazole可降低LDH水平,提高Na+-K+-ATP酶、Ca2+-Mg2+-ATP酶活力,p-AMPKα1/AMPKα1、PGC-1α及GLUT4的表达,改善模型大鼠脑内能量代谢,这可能是Aripiprazole在PDD大鼠中抗抑郁作用的重要分子机制。
综上所述,阿立哌唑可改善帕金森病抑郁症大鼠抑郁样行为,其机制可能与增加单胺类神经递质、抑制脑组织细胞凋亡、改善能量代谢有关。但阿立哌唑是否存在其他的作用途径改善PDD症状,仍有待进一步研究明确。
