基于网络药理学及实验验证分析西黄丸治疗胃癌血瘀证的潜在活性成分及作用机制
2023-06-23贺忠宁陈鸿郭秋均花宝金李丛煌
贺忠宁 陈鸿 郭秋均 花宝金 李丛煌


摘要 目的:应用中医药整合药理学研究平台(TCMIP V2.0)预测西黄丸治疗胃癌血瘀证的潜在活性成分,并初步探讨其分子机制。方法:利用TCMIP V2.0平台中药材数据库及中药分子机制模型数据库(BATMAN-TCM),收集西黄丸已报道的化学成分信息;利用中药(含方剂)靶标预测功能,收集西黄丸的候选靶标谱;利用疾病数据库,收集胃癌疾病及血瘀证证候基因集;利用病证方关联分析模块,构建“病-证-方”关联网络,由网络拓扑特征值确定核心网络;利用David 6.8平台对“病-证-方”的核心网络进行生物学功能分析,包括基因本体(GO)富集分析和京都基因和基因组百科全书(KEGG)通路富集分析;根據化学成分对应的靶点个数和频次,圈定西黄丸治疗胃癌血瘀证的潜在核心成分及其对应的靶点和通路信息;利用Cytoscape 3.8.0软件绘制“核心成分-核心靶点-核心通路”图;再利用Autodock 4.2对主要成分和核心靶点进行分子对接验证。结果:西黄丸主要通过4味中药、13个核心化学成分、19个核心靶标、33条核心通路发挥其治疗胃癌血瘀证的药理作用。其治疗的机制可能主要集中麝香、乳香等两味中药,涉及的通路主要包括肿瘤通路、致癌相关通路、免疫系统通路、内分泌与代谢相关通路等; 磷酸肌醇3激酶(PIK3CG)、磷脂酰肌醇3(PIK3R1)、核因子B1(NFKB1)、肿瘤蛋白P53(TP53)、细胞周期蛋白42(CDC42)等靶点可能在其治疗胃癌血瘀证中发挥了重要的作用。分子对接结果显示核心成分与靶点之间有较强的结合力。体外实验发现:西黄丸可以显著抑制胃癌(MGC-803)细胞拟态管道的形成(P<0.01),且抑制作用等同于低氧诱导因子-1α(Hypoxia Inducible Factor-1,HIF-1α)抑制剂2-甲氧基雌二醇(2-ME)。体内实验发现:西黄丸及2-ME均可以显著降低小鼠胃癌组织中拟态管道的形成数目,二者的作用相似。结论:西黄丸的潜在化学成分可以治疗胃癌血瘀证患者,还能抑制胃癌小鼠血管生成拟态的形成。
关键词 中医药整合药理学;TCMIP V2.0;西黄丸;胃癌;血瘀证;调气解毒;分子对接;病-证-方
Active Components and Mechanism of Xihuang Pills against Gastric Cancer with Blood Stasis Syndrome:Based on Network Pharmacology and Experimental Verification
HE Zhongning1,CHEN Hong2,GUO Qiujun1,HUA Baojin1,LI Conghuang1
(1 Guang′anmen Hospital,China Academy of Chinese Medical Sciences,Beijing 10053,China; 2 School of Traditional Chinese Medicine,Shenyang Pharmaceutical University,Shenyang 110016,China)
Abstract Objective:To predict the potential active components of Xihuang Pills against gastric cancer with blood stasis syndrome based on Integrative Pharmacology-based Research Platform of Traditional Chinese Medicine (TCMIP V2.0) and to explore the molecular mechanism.Methods:The chemical constituents of Xihuang Pills were retrieved from TCMIP V2.0 and a Bioinformatics Analysis Tool for Molecular mechANism of Traditional Chinese Medicine (BATMAN-TCM), and the candidate targets of Xihuang Pills were predicted.Genes related to the gastric cancer and blood stasis syndrome were screened out and the disease-syndrome-prescription network was constructed.The core network was determined based on the network topology eigenvalue and David 6.8 was employed for the Gene Ontology (GO) term enrichment and Kyoto Encyclopedia of Genes and Genomes (KEGG) pathway enrichment of the core network.According to the number and frequency of the chemical components, the potential core components of Xihuang Pills against gastric cancer with the blood stasis syndrome and the corresponding targets and pathways were determined.Cytoscape 3.8.0 was used to plot the “core component-core target-core pathway” network, and Autodock 4.2 was applied for the docking of major components and core targets.Results:Xihuang Pills exerts therapeutic effect on gastric cancer with blood stasis syndrome through 4 medicinals, 13 core chemical components, 19 core targets, and 33 core pathways.The main medicinals were Moschus and Olibanum, and the pathways involved mainly included tumor pathway, carcinogenesis-related pathway, immune system pathway, and endocrine and metabolism-related pathway.Phosphatidylinositol-4, 5-bisphosphate 3-kinase, catalytic subunit gamma (PIK3CG), phosphoinositide-3-kinase regulatory subunit 1 (PIK3R1), nuclear factor kappa B subunit 1 (NFKB1), tumor protein p53 (TP53), and cell division cycle 42 (CDC42) may play an important role in the treatment of blood stasis syndrome of gastric cancer.Molecular docking showed high binding affinity between the core components and the targets.In vitro experiments showed that Xihuang pills significantly inhibited the formation of mimicry channels in gastric cancer (MGC-803) cells (P<0.01), and the inhibitory effect was equivalent to 2-methoxy-estradiol (2-ME), an inhibitor of Hypoxia Inducible Faction-1 (HIF-1α).In vivo experiments showed that both Xihuang Pills and 2-ME could significantly reduce the number of mimicry channels in mouse gastric cancer tissue, and their effects were similar.Conclusion:The potential chemical components of Xihuang pills can treat the patients with blood stasis syndrome of gastric cancer and inhibit the formation of angiogenic mimicry in mice with gastric cancer.
Keywords Integrative Pharmacology of traditional Chinese medicine; TCMIP V2.0; Xihuang Pills; Gastric cancer; Blood stasis; Regulating qi and detoxifying; Molecular docking; Disease-syndrome-prescription
中图分类号:R273文献标识码:Adoi:10.3969/j.issn.1673-7202.2023.02.003
胃癌是常见的消化系统恶性肿瘤,据全球癌症统计数据显示,2018年胃癌新发病例超过100万例,死亡病例达78万例,使其成为最常诊断的第五大癌症和癌症死亡的第3大原因[1]。尽管目前手术、放化疗、靶向治疗等治疗手段不断进步,但胃癌的总体预后仍然很差,晚期胃癌患者的生存率小于5%[2]。
胃癌可归属于中医癓瘕、积聚等范畴,《医林改错》言:“肚腹结块,必有形之血。”中医学认为“久病必瘀”“久病入络”,童克家等[3]的临床研究显示:血瘀证素在晚期胃癌患者中占比较高,约占48.23%。血瘀证与现代医学血液高凝状态、血管生成、乏氧状态等病理状态密切相关[4],且贯穿于肿瘤发生发展的始终;有研究表明,血瘀证是导致肿瘤发生发展及复发转移的重要原因[5]。
调气解毒法在肿瘤患者的治疗过程中起到了关键作用,气行则血行,气滞则血凝,胃癌患者多气血运行不畅,癌毒内蕴于中焦,故临床治疗可以调气解毒,活血散结为法。而西黄丸可作为调气解毒法的代表方剂,西黄丸出自《外科证治全生集》,方由牛黄、麝香、乳香、没药等四味药构成,组方以麝香破血化瘀;牛黄清热解毒;乳香、没药活血行气,消肿止痛;全方共奏活血散结,调气解毒之效。郭秋均的研究显示:西黄丸可通过调控乏氧微环境抑制胃癌细胞的生长及转移[6]。
中医药整合药理学研究平台(Integrative Pharmacology-based Research Platform of Traditional Chinese Medicine,TCMIP)主要包括来自《中医药百科全书》(ETCM)的5个数据库资源,提供了中医药包括化学成分、作用靶点等方面的基本信息,同时,采用人工智能、数据挖掘、网络计算及可视化等方法和技术,形成7大整合药理学分析模块,可用于查询和挖掘疾病、证候和方剂的生物学基础和机制,进而有效揭示中药治疗疾病的药效物质基础及分子作用机制[7-8]。本研究借助中医药整合药理学研究平台,探讨西黄丸治疗胃癌血瘀证的药效物质基础及分子作用机制网络,为进一步深入研究西黄丸的有效成分、分子作用机制及临床应用提供一定的数据基础[9]。
1 材料与方法
1.1 材料
1.1.1 数据库 中医药整合药理学研究平台(TCMIP V2.0),中医药分子机制模型数据库(a Bioinformatics Analysis Tool for Molecular mechANism of Traditional Chinese Medicine,BATMAN-TCM)(http://bionet.ncpsb.org.cn/batman-tcm/)生物信息注释可视化和集成发现数据库(The Database for Annotation,Visualization and Integrated Discovery,DAVID)(https://david.ncifcrf.gov),有机小分子活性数据库(Pubchem)(https://pubchem.ncbi.nlm.nih.gov),RCSB蛋白质数据库(RCSB Protein Data Bank)(http://www.rcsb.org/),蛋白质相互作用分析数据库(STRING)(https://cn.string-db.org),分子在线对接平台(Cavity-detection guided Blind Docking,CB-DOCK)(http://clab.labshare.cn)。
1.1.2 细胞 人胃癌MGC-803细胞系购自中国医学科学院基础医学研究所细胞资源中心,编号:1101HUM-PUMC000660。
1.1.3 動物 4~6周龄无特定病原体(Specific Pathogen Free,SPF)级BALB/c裸鼠,购自北京维通利华实验动物技术有限公司,动物许可证号:SYXK(京)2017-0033。伦理审批号:IACUC-GAmH-2022-012。饲养于北京大学医学部实验动物中心SPF级动物房饲养于北京大学温度20~26 ℃,相对湿度40%~70%,自由饮食。
1.1.4 药物 西黄丸(北京同仁堂药店,批号:13043355),2-ME(国家标准物质中心,批号:138019)。
1.1.5 试剂与仪器 低氧工作站(RUSKINN公司,英国,型号:INVIVO2 200),光学倒置显微镜(Nikon公司,日本,型号:TS100)。
1.2 方法
1.2.1 网络药理学实验
1.2.1.1 疾病靶点来源 TCMIP V2.0中“疾病相关分子库”来源于基因相关性数据库(DisGeNET),人类表型本体数据库(HPO),Drugbank数据库,治疗靶点数据库(TTD)等数据库[10]。在TCMIP V2.0“疾病相关分子库”中,以“Gastric cancer”“Stomach cancer”“Neoplasms of the Stomach”“Stomach Neoplasms”作为疾病关键词进行检索,检索出的所有靶点,作为胃癌的候选靶点集。
1.2.1.2 证候靶点来源 在TCMIP V2.0“疾病相关分子库”中,以“不同的临床表现”为切入点,通过血瘀证候相关临床表现的英文词条进行检索,相关基因集取并集,得出血瘀证的候选靶点谱。具体检索词见表1。
1.2.1.3 方剂靶点来源 利用TCMIP V2.0中“中药材数据库”收集“麝香”“牛黄”“乳香”“没药”等4味药材的化学成分信息,并结合BATMAN-TCM模型数据库的化学成分及既往文献研究加以补充,最终构建方剂的化学成分库。设置Tanimoto Score为0.8(高准确度)预测化学成分的候选靶点谱。TCMIP V2.0采用二维结构进行相似性搜索,并采用Tanimoto Score定义的相似度计量方法,通过与已经上市,或FDA已经批准的药物进行化学结构相似性比对,以Tanimoto Score定义的相似度计量方法进行相似性打分[10]。
1.2.1.4 网络构建与分析 利用TCMIP V2.0“中医药关联网络挖掘”模块,根据胃癌疾病基因集、证候(血瘀证)基因集和方剂(西黄丸)候选靶点之间的相互作用信息,构建“疾病-证候-方剂”关联网络。TCMIP V2.0可针对疾病、证候、方剂、中药成分,构建可视化的中药多维关联网络;平台镶嵌了HAPPI,Reactome,OPHID,InAct,HPRD,PDZBase,MINT,DIP等数据库中PPI数据,设置了连接度(Degree),介度(Betweenness),紧密度(Closeness)3种网络拓扑特征值,通过相关计算来预测中药治疗疾病发挥药效的关键靶点;通过关键靶点的富集分析,确定关键靶点的生物学功能及其所参与的生物学通路[10],分析方剂治疗疾病的机制。
1.2.1.5 靶点富集分析与分子网络图构建 利用David 6.8平台对关键靶点进行生物通路富集分析,分析西黄丸治疗胃癌血瘀证主要参与的生物通路,探讨其治疗的可能作用机制。利用Cytoscape 3.8.0软件构建“中药-成分-靶点-通路”分子网络图。
1.2.1.6 分子对接验证关键靶点蛋白 在Pubchem数据库下载西黄丸关键成分的sdf格式结构文件,并利用Openbabel软件将其转化为pdb格式。借助RCSB PDB数据库下载核心靶点蛋白的晶体结构,对接采用AutoDock 4.2软件进行。在对接过程中,采用软件中Autogrid模块设置蛋白对接盒子,盒子大小根据蛋白质与其已知配体的结合区域进行设定,对接采用拉马克遗传算法(LGA),并借助Pymol软件对对接结果进行优化制图[11]。将出现频次较多的主要成分和靶点中,选择有实验构型且有相互作用关系的4对成分-靶点采用AutoDock 4.2软件进行分子对接,结合能见图5。一般认为,分子对接时化合物与蛋白的结合能<-5 kcal/mol(1 cal=4.184 J)时表示有一定结合能力,<-7 kcal/mol时表示结合活性较强,结合能越小说明对接效果越好[11]。
1.2.2 体内外试验
1.2.2.1 分组与模型制备 体外实验制备常氧和乏氧2种细胞培养条件,分别分为空白组、西黄丸组、2-ME组、2-ME联合西黄丸组。常氧条件将细胞置于细胞培养箱20%常氧培养24 h,乏氧条件则将细胞置于5%低氧工作站中培养24 h,体内实验分为空白组、西黄丸组、2-ME组、2-ME+西黄丸组。其中包含西黄丸组灌胃给药,包含2-ME组腹腔注射2-ME給药。
1.2.2.2 干预方法 建立体外模型,西黄丸干预24 h,倒置显微镜下观察各组MGC-803细胞成管情况并计数;建立体内模型后,待小鼠7 d成瘤,药物干预14 d后脱颈处死小鼠,将小鼠肿瘤组织固定包埋切片,镜下观察随机5个视野内的拟态血管数量。
1.2.2.3 统计学方法 采用SPSS 20.0统计软件和Graphpad Prism 5软件分析上述统计结果并绘图,采用独立样本t检验进行组间比较,以P<0.05为差异有统计学意义。
2 结果与分析
2.1 网络药理学实验结果
2.1.1 病-证-方关联核心靶点网络分析 共获得疾病靶点67个,证候靶点473个,药物靶点1 204个,利用平台中“中医药关联网络”中的“疾病-证候-方剂”关联分析模块,选择疾病,证候,方剂的靶点集后提交,经过网络分析计算,结果显示,与胃癌、血瘀证、西黄丸相关的核心网络靶点共226个;疾病、证候、方剂、核心网络靶点的韦恩图如图1。其中胃癌与血瘀证之间有11个共同靶点,血瘀证与西黄丸之间有73个共同靶点,胃癌与西黄丸之间有16个共同靶点。可以看出核心网络靶点中其中属于疾病的靶点有31个,属于证候的靶点有76个,属于方剂的靶点有164个,属于病证方共有的有5个。为了再一次缩小核心网络靶点的范围,提高分析结果的精确性,将平台富集的226个核心网络靶点依次按Degree、Closeness、Betweenness由高至低依次排序,并利用David对排名前100位的核心网络靶点进行富集分析,共富集到KEGG通路(P≤0.05)共133条,针对胃癌相关机制对通路进行筛选,共选出来60条通路,排名前20位的通路见表2。对这些通路涉及到的属于西黄丸的方剂靶点与方剂靶点对应的成分进行靶点数量、靶点频次、成分频次的统计,选取靶点数量在5以上,靶点频次在30以上的成分作为核心成分,共13个核心成分。13个核心成分有4个核心成分属于牛黄,7个核心成分属于麝香,乳香,没药各含有1个核心成分。见表3。
2.1.2 核心成分的验证 核心成分中共涉及74个靶点,选取在通路中出现5次以上的21个靶点进行富集分析,共富集出65条通路(P≤0.05),其中与胃癌相关的有33条,占50.8%,此33条核心通路可分为肿瘤通路、致癌相关通路、免疫系统通路、内分泌与代谢通路等4个通路模块。见表4。
核心通路中涉及的靶点为19个,与从核心成分中统计出来的21个差2个,占比90.5%。故最终确定的核心靶点为19个,这19个靶点在核心通路出现的频次统计见图2。对这13个核心成分,19个核心靶点,33条核心通路利用Cytoscape进行作图,将分析结果进行可视化。13个核心成分有4个核心成分属于牛黄,7个核心成分属于麝香,乳香,没药各含有1个核心成分,19个核心靶点富集的核心通路主要分为肿瘤通路、致癌相关通路、免疫系统通路、内分泌与代谢通路等4个模块,具体见图3。
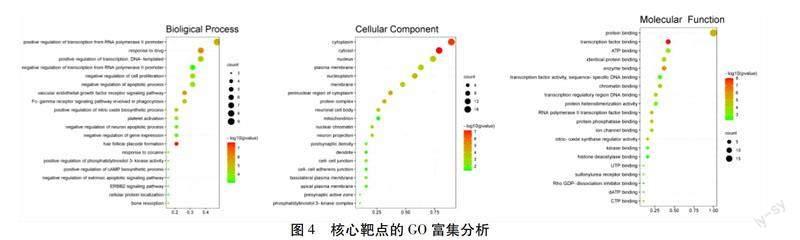
2.1.3 靶点GO生物过程富集分析 对19个核心靶点进行GO富集分析,可以看出:在生物过程中,主要涉及基因表达、药物反应、细胞增殖、细胞吞噬、血小板活化、细胞凋亡、调节物质合成等过程;在细胞组分中,以细胞核、细胞膜、细胞质等细胞内成分为主;在分子功能中,主要参与蛋白质结合、离子通道结合通路;蛋白磷酸酶、一氧化氮合酶等多种酶活性通路。见图4。
2.1.4 分子对接验证结果 大部分化合物与核心靶点的结合能力较强。特别是雌二醇和PIK3CG,结合能为-9.1 kcal/mol。见图5。为了更加直观地体现关键化合物和核心靶点的相互作用模式,图6中展示了这9对化合物对接后复合物的结构示意图。
2.2 实验验证
2.2.1 西黄丸及2-ME体外干预MGC-803细胞成管的情况 西黄丸在常氧和乏氧环境下均可以显著抑制胃癌MGC-803细胞拟态血管的形成(P<0.01),乏氧状态下抑制作用更为明显,且与HIF-1α抑制剂2-ME的作用相似。同时,2-ME联合西黄丸可以更好的抑制肿瘤细胞拟态血管形成数目,但差异无统计学意义。
2.2.2 西黄丸及2-ME干预荷MGC-803细胞裸鼠移植瘤拟态血管形成的情况 西黄丸可降低小鼠胃癌肿瘤组织中管道的形成数,作用与2-ME相似,二者联合可以更好的抑制管道形成。见图8。
3 讨论
通过TCMIP V2.0平台基于3个网络拓扑特征值的运算,在病证方的总靶点中挑出了226个初步核心网络靶点,方便高效地缩小了范围,为进一步深入研究西黄丸的有效成分、分子作用机制及临床应用提供科学依据。再通过David 6.8进行富集分析以及筛选,最终确定了13个核心成分,19个核心靶点,33条核心通路。这些核心靶点在功能上显著参与了多种胃癌相关通路,包括VEGF信号通路、PI3K-AKT信号通路、Ras信号通路、ErbB信号通路、血小板活化、細胞凋亡、免疫系统通路等多个信号通路。
花宝金团队近期提出以“调气解毒”为恶性肿瘤的主要治疗原则,而西黄丸可作为调气解毒的代表方剂,既往临床研究证实其治疗胃癌血瘀证有一定的临床作用。网络药理学研究发现西黄丸治疗胃癌血瘀证的已报道核心成分主要包括雌二醇、麝香酮类化合物、尿囊素、乳香酸类化合物、麦角胺等。雌二醇作为一种常见类固醇化合物,具有一定的抗微管蛋白作用,还能诱导细胞凋亡和自噬[12]。麝香酮是麝香的重要成分和生理活性物质,能通过阻断肿瘤新生血管的形成以发挥其抑制肿瘤生长、侵袭及转移[13]。既往研究证实:尿囊素可以减少铂类药物的神经毒性,还能改善血液高凝状态,可作为癌症治疗的辅助药物[14]。乳香酸类化合物已被证实可以抑制肿瘤细胞侵袭和转移、参与肿瘤细胞分化及免疫调节[15]。刘建平[16]研究发现麦角胺可促进骨肉瘤细胞凋亡,并能进抑制其增殖与侵袭。
本研究中,PIK3CG、PIK3R1、NFKB1、TP53、CDC42等靶点出现频率高,以上靶点参与了多种信号通路,是西黄丸治疗胃癌血瘀证的关键靶点。磷酸肌醇-3激酶催化亚单位γ(Phosphoinositide-3 Kinase Catalytic Subunit-gamma,PIK3CG)是磷酸肌醇-3激酶家族的成员,可参与细胞的增殖、分化、凋亡等多种功能的调节,既往研究发现靶向抑制PIK3CG基因的表达可能诱导肿瘤细胞凋亡和迁移抑制[17],发挥其抑制胃癌发生发展的作用[18]。磷脂酰肌醇3激酶调节亚基1(Phosphoinositide-3-kinase Regulatory Subunit 1,PIK3R1)在多种类型恶性肿瘤的形成中起着关键作用,参与多种细胞功能的调节,PIK3R1基因的下调对胃癌细胞的增殖和侵袭均具有抑制作用[19]。NFKB1基因的表达与细胞增殖、转化和凋亡等病理生理过程相关,敲除胃癌小鼠的NFKB1基因会导致小鼠胃中肿瘤坏死因子的表达增加,从而促进炎症免疫反应和胃癌的发展[20]。TP53基因编码的蛋白可参与诱导细胞周期停滞、细胞凋亡、衰老、DNA修复、代谢等改变[21-22]。ANDO等[23]研究发现TP53基因表达阳性的患者肿瘤浸润更深,淋巴结和肝转移发生的更多。细胞分裂周期蛋白42(Cell Division Cycle42,CDC42是Rho GTP酶家族的成员,可调控肿瘤细胞的转移,有研究表明CDC42的下调可能通过诱导细胞周期停滞在G1/S期来抑制胃癌细胞的增殖[24]。
核心通路中基本涵盖了胃癌的病理生理过程,与我们的预测结果一致,如肿瘤相关通路、致癌相关通路、免疫系统通路、内分泌与代谢相关通路等信号通路。提示我们的药理学策略具有很高的准确性。其中VEGF信号通路是常见的血管新生和肿瘤转移通路[25],PI3K-AKT信号通路是一种常见的自噬相关信号通路,它的异常激活会调节细胞自噬、上皮间质转化、细胞凋亡、转移等多种生理病理过程[26]。RAS蛋白位于细胞膜内,参与调控细胞的生长、增殖、运动、迁移及血管生成,有研究表明RAS信号通路的激活可以抑制BGC-823胃癌细胞的增殖、侵袭和迁移[27]。ErbB信号通路的异常激活可能引起肿瘤细胞增值分化,浸润转移[28]。其他信号通路大多作用于免疫系统来发挥其抗肿瘤作用。
本研究利用中医药整合药理学研究平台TCMIP v2.0及BATMAN-TCM模型数据库收集西黄丸所含化学成分的候选靶点谱、胃癌的疾病基因集和血瘀证证候基因集,构建“病-证-方”关联网络,并根据靶点数量和频次圈定治疗胃癌的核心成分、核心靶点,进而对核心靶点进行生物功能富集分析,明确核心成分发挥疗效的作用机制。结果表明,西黄丸可通过4味中药、13个核心化学成分、19个核心靶点、33条核心通路发挥其治疗胃癌血瘀证的药理作用。其干预治疗的机制可能主要集中麝香、乳香等2味中药,涉及的通路主要包括肿瘤相关通路、致癌相关通路、免疫系统通路、内分泌与代谢通路等;PIK3CG、PIK3R1、NFKB1、TP53、CDC42等靶点可能在其中发挥了重要的作用。
本研究团队既往体内、体外实验研究均证实:西黄丸可以有效抑制胃癌血管生成拟态的形成[6]。体外实验发现:西黄丸可以显著抑制胃癌(MGC-803)细胞拟态管道的形成(P<0.01),且抑制作用等同于低氧诱导因子-1α(Hypoxia Inducible Factor-1,HIF-1α)抑制剂2-甲氧基雌二醇(2-ME)。体内实验发现:西黄丸及2-ME均可以显著降低小鼠胃癌组织中拟态管道的形成数目,二者的作用相似。体内外试验也进一步证实西黄丸对于胃癌血管生成有一定的抑制作用。本研究为中药复方作用机制的初步探索提供了一种经济、高效的方法,可以为未来实体实验提供方向性的参考,有助于推进中药复方的研究进展。
利益冲突声明:无。
参考文献
[1]BRAY F,FERLAY J,SOERJOMATARAM I,et al.Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J].CA Cancer J Clin,2018,68(6):394-424.
[2]Mattiuzzi C,Lippi G.Current Cancer Epidemiology[J].J Epidemiol Glob Health,2019,9(4):217-222.
[3]童克家,汪志成,唐珂.进展期胃癌的证素、证型分布情况及与免疫标志物的相关性分析[J].中医药导报,2021,27(3):116-118.
[4]张思奇,胡凯文,周天.脾虚、血瘀及痰饮与乏氧肿瘤微环境研究进展[J].中国中医药信息杂志,2018,25(7):126-129.
[5]罗琴琴,鲁叶云,王立芳,等.基于血瘀证探讨活血化瘀法在恶性肿瘤治疗中的应用[J].中医杂志,2017,58(8):654-656.
[6]郭秋均.西黄丸抑制胃癌细胞增殖及其血管生成拟态形成的机制探讨[D].北京:北京中医药大学,2017.
[7]XU HY,ZHANG YQ,LIU ZM,et al.ETCM:an encyclopaedia of traditional Chinese medicine[J].Nucleic Acids Res,2019,47(D1):D976-D982.
[8]ZHAO C,LI S,ZHANG J,et al.Current state and future perspective of cardiovascular medicines derived from natural products[J].Pharmacol Ther,2020,216:107698.
[9]世界中医药学会联合会.网络药理学评价方法指南[S].世界中医药,2021,16(4):527-532.
[10]许海玉,刘振明,付岩,等.中药整合药理学计算平台的开发与应用[J].中国中药杂志,2017,42(18):3633-3638.
[11]TROTT O,OLSON AJ.AutoDock Vina:improving the speed and accuracy of docking with a new scoring function,efficient optimization,and multithreading[J].J Comput Chem,2010,31(2):455-461.
[12]MINORICS R,ZUPKO I.Steroidal Anticancer Agents:An Overview of Estradiol-related Compounds[J].Anticancer Agents Med Chem,2018,18(5):652-666.
[13]劉永惠,常靖,薛陆军,等.麝香酮对血瘀证乳腺癌生长及对VEGF表达的影响[J].西安交通大学学报:医学版,2014,35(4):547-550.
[14]VINDYA NS,MOHAMAD A,RAZDAN R.Allantoin attenuates deficits of behavioural and motor nerve conduction in an animal model of cisplatin-induced neurotoxicity in rats[J].Animal Model Exp Med,2019,2(2):114-120.
[15]方丽敏.乳香和乳香酸的药理活性及其作用机制[J].心电图杂志(连续型电子期刊),2019,8(4):263-264.
[16]刘建平.麦角胺联合奥沙利铂诱导骨肉瘤细胞增殖和凋亡行为变化[J].解放军预防医学杂志,2018,36(7):918-921,936.
[17]张亮,熊艺琏,任宇亮,等.重楼皂苷A直接靶向ETS-1抑制胃癌细胞增殖并诱导凋亡的作用机制[J].中国中药杂志,2022,47(6):1650-1657.
[18]CHANG J,HONG L,LIU Y,et al.Targeting PIK3CG in Combination with Paclitaxel as a Potential Therapeutic Regimen in Claudin-Low Breast Cancer[J].Cancer Manag Res,2020,12:2641-2651.
[19]QI W,SUN L,LIU N,et al.Tetraspanin family identified as the central genes detected in gastric cancer using bioinformatics analysis[J].Mol Med Rep,2018,18(4):3599-3610.
[20]LOW JT,CHRISTIE M,ERNST M,et al.Loss of NFKB1 Results in Expression of Tumor Necrosis Factor and Activation of Signal Transducer and Activator of Transcription 1 to Promote Gastric Tumorigenesis in Mice[J].Gastroenterology,2020,159(4):1444-1458.
[21]NICOLAI S,ROSSI A,DI DANIELE N,et al.DNA repair and aging:the impact of the p53 family[J].Aging(Albany NY),2015,7(12):1050-1065.
[22]Yuan L,Zhang Y,Xia J,et al.Resveratrol induces cell cycle arrest via a p53-independent pathway in A549 cells[J].Mol Med Rep,2015,11(4):2459-2464.
[23]ANDO K,OKI E,ZHAO Y,et al.Mortalin is a prognostic factor of gastric cancer with normal p53 function[J].Gastric Cancer,2014,17(2):255-262.
[24]DU DS,YANG XZ,WANG Q,et al.Effects of CDC42 on the proliferation and invasion of gastric cancer cells[J].Mol Med Rep,2016,13(1):550-554.
[25]APTE RS,CHEN DS,FERRARA N.VEGF in Signaling and Disease:Beyond Discovery and Development[J].Cell,2019,176(6):1248-1264.
[26]FATTAHI S,AMJADI-MOHEB F,TABARIPOUR R,et al.PI3K/AKT/mTOR signaling in gastric cancer:Epigenetics and beyond[J].Life Sci,2020,262:118513.
[27]CHEN H,CHENG ZY,PAN Y,et al.RASAL1 influences the proliferation and invasion of gastric cancer cells by regulating the RAS/ERK signaling pathway[J].Hum Cell,2014,27(3):103-110.
[28]WANG Z.ErbB Receptors and Cancer[J].Methods Mol Biol,2017,1652:3-35.
(2022-06-11收稿 本文編辑:吴珊)
基金项目:北京市自然科学基金项目(7212189)作者简介:贺忠宁(1996.05—),女,博士研究生在读,研究方向:中医内科(肿瘤学),E-mail:1151593118@qq.com通信作者:李丛煌(1982.07—),男,博士,副主任医师,研究方向:中西医结合(肿瘤学),E-mail:liconghuang@163.com
