PIGM、ATP6V1B2及NANP基因单核苷酸多态性与缺血性脑卒中及其血脂水平的关联研究
2023-06-23钟清清赵直徐冰一朱路路吴旭龙杨佳磊古联苏莉
钟清清 赵直 徐冰一 朱路路 吴旭龙 杨佳磊 古联 苏莉


【摘要】 目的 探討磷脂酰肌醇聚糖锚生物合成M类(PIGM)基因rs2275404、ATP酶H+转运V1亚单位B2(ATP6V1B2)基因rs1042426、N-乙酰神经氨酸磷酸酶(NANP)基因rs11700338多态性与缺血性脑卒中及其血脂水平的关联性。
方法 共纳入1567名研究对象,其中缺血性脑卒中患者774例,健康对照者793例。基因分型采用Massarray SNP技术,应用非条件logistic回归模型分析加性模型、显性模型、隐性模型与疾病的关联。
结果 PIGM基因rs2275404、ATP6V1B2基因rs1042426和NANP基因rs11700338多态性与缺血性脑卒中患者易感性无遗传关联(均P>0.05)。在调整性别年龄后,PIGM基因rs2275404多态性与缺血性脑卒中甘油三酯水平显著相关(隐性模型:βadj=-0.26,95% CI=-0.47~0.05,Padj=0.015);ATP6V1B2基因rs1042426多态性与缺血性脑卒中载脂蛋白B水平显著相关(加性模型:βadj=0.06,95% CI=7.77×10-4 ~0.12,Padj=0.048;显性模型:βadj= 0.07,95% CI=4.28×10-3~0.14,Padj=0.037);NANP基因rs11700338多态性与缺血性脑卒中载脂蛋白A1水平也显著相关(显性模型:βadj=0.05,95% CI=2.86×10-4~0.09,Padj=0.049)。
结论 未发现PIGM基因rs2275404、ATP6V1B2基因rs1042426、NANP基因rs11700338多态性与缺血性脑卒中发生风险相关,但是可影响缺血性脑卒中患者血脂水平。
【关键词】 缺血性脑卒中;基因多态性;血脂;关联研究
中图分类号:R743.3 文献标志码:A DOI:10.3969/j.issn.1003-1383.2023.04.007
Study on association between single nucleotide polymorphisms of PIGM,ATP6V1B2 and NANP genes and ischemic stroke and its blood lipid level
ZHONG Qingqing1, ZHAO Zhi1, XU Bingyi1, ZHU Lulu1, WU Xulong1, YANG Jialei1, GU Lian2, SU Li1
(1. School of Public Health, Guangxi Medical University, Nanning 530021, Guangxi, China;2. Department of Internal Neurology,
the First Affiliated Hospital of Guangxi University of Chinese Medicine, Nanning 530023, Guangxi, China)
【Abstract】 Objective To investigate the associations between the polymorphisms of phosphatidylinositol glycan anchor biosynthesis class M (PIGM) gene rs2275404, ATPase H+ transporting V1 subunit B2 (ATP6V1B2) gene rs1042426, N-acetylneuraminic acid phosphatase (NANP) gene rs11700338 and ischemic stroke (IS) and its blood lipid level.
Methods A total of 1567 subjects were enrolled in the study, including 774 cases of IS and 793 controls. Massarray SNP technique was used for genotyping, and unconditional logistic regression model was used to analyze association between genetic models (additive model, dominant model, and recessive model) and diseases.
Results There was no genetic association between the polymorphisms of PIGM gene rs2275404, ATP6V1B2 gene rs1042426 and NANP gene rs11700338 and the susceptibility of IS (all P>0.05).After adjusting age and gender, PIGM gene rs2275404 was significantly correlated with the triglyceride level of IS (recessive model: βadj=-0.26, 95% CI=-0.47 - 0.05, Padj= 0.015);ATP6V1B2 gene rs1042426 was significantly correlated with the apolipoprotein B level of IS (additive model: βadj= 0.06, 95% CI= 7.77×10-4 - 0.12, Padj=0.048;dominant model: βadj=0.07, 95% CI=4.28×10-3 - 0.14, Padj=0.037);and NANP gene rs11700338 was significantly correlated with apolipoprotein A1 level of IS (dominant model: βadj=0.05, 95% CI=2.86×10 -4 - 0.09, Padj=0.049).
Conclusion The polymorphisms of PIGM gene rs2275404, ATP6V1B2 gene rs1042426, and NANP gene rs11700338 are not associated with the risks of ischemic stroke, but they may affect the blood lipid levels of patients with ischemic stroke.
【Key words】 ischemic stroke(IS); gene polymorphism; blood lipids; relevance research
缺血性脑卒中(ischemic stroke, IS)具有高发病率、高致残率、高病死率和高复发率的特点,严重影响患者的生活质量,给全球带来了沉重的疾病负担[1],同时也是导致我国人口死亡和长期残疾的主要原因[2]。IS是多基因复杂疾病,遗传因素在IS的发展中发挥重要作用,IS的易感基因探索也是研究重点[3]。与代谢途径相关的基因,比如参与同型半胱氨酸代谢的亚甲基四氢叶酸还原酶(MTHFR)基因[4]、脂质代谢的载脂蛋白 E(APOE)基因[5]与IS发生发展有关。研究发现,MTHFR基因C677T与血浆纤溶酶原激活物抑制剂-1(PAI-1)4G/5G基因多态性以及与叶酸代谢途径相关的还原性叶酸载体(SLC19A1)基因rs1131596、rs1051266、rs12659可增加IS的发生风险[6-7]。磷脂酰肌醇聚糖锚生物合成M类(PIGM)基因、ATP酶H+转运V1亚单位B2(ATP6V1B2)基因和N-乙酰神经氨酸磷酸酶(NANP)基因也属于代谢通路基因。此外血脂异常在动脉粥样硬化的发生发展过程中也发挥重要作用[8],是缺血性脑卒中常见的危险因素。为了揭示缺血性脑卒中的遗传因素,识别新的治疗靶点,可以有效地改善患者预后,减轻疾病负担,本研究主要探讨了PIGM、ATP6V1B2和NANP基因单核苷酸多态性(SNP)位点与IS及其血脂水平的相关性。
1 对象与方法
1.1 研究对象
选取2013年9月至2017年6月期间1567名研究对象,其中病例组774例,均来自广西中医药大学第一附属医院脑病科确诊为缺血性脑卒中的患者,诊断标准符合1995年中华医学会第四次全国脑血管病学术会议修订的《各类脑血管病诊断要点》,所有患者均经头颅CT和/或MRI确诊,排除因脑血管畸形、短暂性脑缺血发作、血液病、肿瘤、动脉炎、脑外伤、药物等引起的缺血性脑卒中患者;对照组793例,为上述医院体检中心参加体检的正常人,与病例组的年龄和性别相匹配,排除有肾脏、肝脏、心脏等重大疾病患者以及自身免疫系统疾病患者。所有研究对象无血缘关系,均签署知情同意书。这项研究已获得广西医科大学医学伦理委员会的批准。
1.2 SNP的选择
从HapMap网站中下载PIGM、ATP6V1B2和NANP基因的基因型数据,选出中国汉族人群数据。SNPs位点根据连锁不平衡(LD)r2>0.8,小等位基因频率(MAF)>0.05,哈迪-温伯格平衡(Hardy-Weinberg Equilibrium,HWE)P值>0.05选择功能性位点。见表1。
1.3 基因分型
通过采集每位研究对象清晨空腹血2 mL(乙二胺四乙酸抗凝管),并严格按照DNA提取试剂盒(北京艾德莱生物科技有限公司产品)说明书实验流程来提取血液基因组DNA,质检合格后转移至-80 ℃的低温冰箱冻存备用。使用NanoDrop2000仪器检测DNA吸光度(OD)以及1.25%琼脂糖凝胶电泳来检测提取的DNA质量,OD值260/280在1.6~1.8之间为DNA质检合格。采用 AssayDesigner 3.1 软件设计PCR反应和引物,并交由博淼生物科技(北京)有限公司合成。引物序列见表2。在Agena平台,采用Massarray SNP基因分型实验技术,由生物公司进行基因多态性位点的基因分型检测。
1.4 临床指标测定
用非抗凝真空采血管采集每位研究对象2 mL清晨空腹血,使用HITACHI日立7600全自动生化分析仪,按照标准化实验程序检测以下指标的血清水平:总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)、极低密度脂蛋白(VLDL)、载脂蛋白A1(APO-A1)、载脂蛋白B(APO-B)水平。
1.5 统计学方法
遗传关联分析运用PLINK软件进行分析:用拟合优度χ2检验分析HWE,采用χ2检验对基因型频率分布、等位基因频率分布进行组间比较。应用非条件logistic回归模型,以是否发生脑梗死为应变量,以各遺传模型(A1:小等位基因;A2:大等位基因;加性模型:A1A1 vs A1A2 vs A2A2、显性模型:A1A1+A1A2 vs A2A2;隐性模型:A1A1 vs A1A2+A2A2)下的基因型为自变量,分析与疾病的关联,其中关联强度用比值比(OR)及95%置信区间(CI)表示。使用Linear回归分析多态性位点与缺血性脑卒中患者的血脂水平的关联,其中应变量为患者的具体血脂水平,自变量为各遗传模型下的基因型。此外,运用SPSS 17.0软件进行数据处理,计数资料用频数或百分率表述,组间比较使用χ2检验,符合正态分布的计量资料用(±s)表示,组间比较使用两独立样本t检验。所有统计学的检验均为双侧检验,检验水准:α=0.05。
2 结 果
本研究共纳入1567名研究对象,病例组774例,平均年龄(64.12±10.34)岁,男459例、女315例;对照组793例,平均年龄(63.81±10.36)岁,男437例、女356例。病例组与对照组在性别(χ2=2.815,P=0.093)、年龄(t=-0.582,P=0.561)上比较差异无统计学意义,具有可比性。
2.1 基因型分布频率以及HWE检验
HWE检验显示,PIGM基因rs2275404、ATP6V1B2基因rs1042426、NANP基因rs11700338多态性的基因型分布均符合HWE遗传平衡定律(PHWE >0.05);病例组与对照组间PIGM基因rs2275404、ATP6V1B2基因rs1042426、NANP基因rs11700338多态性的基因型频率分布差异无统计学意义(P>0.05)。见表3。病例组与对照组间PIGM基因rs2275404、ATP6V1B2基因rs1042426、NANP基因rs11700338多态性的等位基因分布差异无统计学意义(均P>0.05)。见表4。
2.2 PIGM基因rs2275404、ATP6V1B2基因rs1042426和NANP基因rs11700338多态性与缺血性脑卒中发生风险关联分析
多因素logistic回归分析结果显示,在加性模型、显性模型、隐性模型三个遗传模型中,PIGM基因rs2275404、ATP6V1B2基因rs1042426和NANP基因rs11700338多态性与缺血性脑卒中发生风险差异无统计学意义(均P>0.05)。见表5。
2.3 PIGM基因rs2275404、ATP6V1B2基因rs1042426和NANP基因rs11700338多态性与缺血性脑卒中患者血脂水平的相关分析
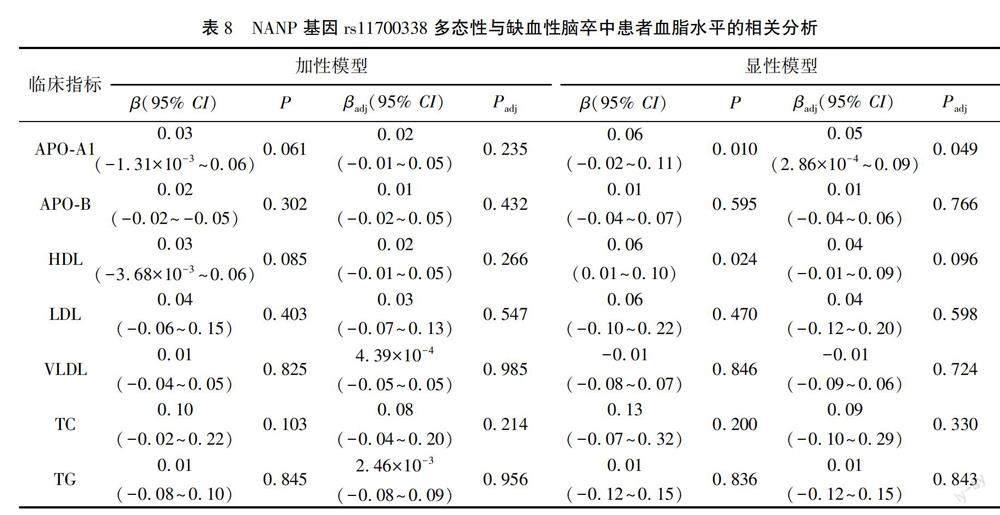
Linear回歸分析结果显示,在校正性别年龄后,PIGM基因rs2275404多态性与缺血性脑卒中TG水平显著相关(隐性模型:βadj=-0.26,95% CI=-0.47~0.05,Padj=0.015)。PIGM基因rs2275404多态性与缺血性脑卒中的APO-A1、APO-B、HDL、LDL、VLDL、TC水平的相关性均无统计学意义(均P>0.05)。见表6。ATP6V1B2基因rs1042426多态性与缺血性脑卒中APO-B水平显著相关(加性模型:βadj=0.06,95%CI =7.77×10-4~0.12,Padj=0.048,显性模型:βadj=0.07,95% CI=4.28×10-3~0.14,Padj=0.037);ATP6V1B2基因rs1042426多态性与缺血性脑卒中的APO-A1、HDL、LDL、VLDL、TC、TG水平的相关性均无统计学意义(P>0.05)。见表7。NANP基因rs11700338多态性与缺血性脑卒中APO-A1水平显著相关(显性模型:βadj=0.05,95% CI=2.86×10-4~0.09,Padj=0.049);NANP基因rs11700338多态性与缺血性脑卒中的APO-B、HDL、LDL、VLDL、TC、TG水平的相关性均无统计学意义(均P>0.05)。见表8。
3 讨 论
本研究未发现PIGM基因rs2275404、ATP6V1B2基因rs1042426、NANP基因rs11700338多态性与缺血性脑卒中的发生风险有关联。目前这3个基因多态性位点尚未有文献报道,本研究首次发现rs2275404、rs1042426、rs11700338与血脂水平显著相关:PIGM基因rs2275404与TG水平显著相关;ATP6V1B2基因rs1042426与APO-B水平显著相关;NANP基因rs11700338多态性与APO-A1水平显著相关。
PIGM基因参与糖基磷脂酰肌醇(GPI)生物合成。GPI结构对于GPI微结构域的形成和某些GPI锚定蛋白的功能是必需的。如果GPI结构被跨膜蛋白取代,那么该蛋白的功能就会丧失[9]。GPI特异性磷脂酶D(GPI-PLD)参与脂质代谢,可影响甘油三酯和血浆脂蛋白代谢。另外,动物实验表明,通过腺病毒介导的基因转移增加C57BL/6小鼠肝脏GPI-PLD的表达,这种变化与空腹(30%)和餐后甘油三酯(50%)水平增加以及富含甘油三酯的脂蛋白分解代谢降低两倍有关,提示GPI-PLD可通过改变富含TG的脂蛋白的分解代谢影响血清TG水平[10]。因此,PIGM基因 rs2275404可能通过影响GPI-PLD的GPI结构来影响体内TG水平。
ATP6V1B2基因编码囊泡型质子泵蛋白(V-ATPase)。V-ATPase依赖的细胞器酸化是细胞内过程(例如蛋白质分类、酶原激活、受体介导的内吞作用和突触小泡质子梯度生成)所必需的。溶酶体膜上的V-ATPase通过将质子中的质子连续泵入溶酶体来维持其内部酸性环境[11]。APO-B脂蛋白被认为是动脉粥样硬化的主要危险因素,也是动脉粥样硬化病变中胆固醇的主要来源。在本研究中,ATP6V1B2基因rs1042426与APO-B水平显著相关。APO-B α1β区是微粒体甘油三酸酯转移蛋白(MTTP)的结合位点,后者将甘油三酸酯转移至APO-B进行组装VLDL,敲除APO-B α1β区或该区域带正电荷的精氨酸和赖氨酸突变为中性氨基酸可消除APO-B与MTTP之间的相互作用,并防止或减少APO-B的分泌[12-14]。因此,ATP6V1B2基因可能通过V-ATPase调节细胞内的酸性环境,从而影响氨基酸的电负性,这种情况会影响体内APO-B的水平。
NANP基因编码的蛋白质是一种参与合成唾液酸(SA)的酶,其中N-乙酰神经氨酸(Neu5Ac)是SA最常见的衍生物[15]。动物实验表明,高脂饮食喂养会导致高脂血症,但在较高剂量下补充Neu5Ac可以减弱高脂饮食诱导的变化,提示Neu5Ac可用于预防高脂血症相关的炎症和氧化应激[16]。另一动物实验表明,与正常饮食的小鼠相比,高脂饮食持续12周可导致肝脏组织中APO-A1基因表达显著增加[17]。APO-A1是HDL的主要组成蛋白,能反映机体的血脂代谢情况,促进脂质代谢和胆固醇分解的酶活性,它也可以起到抗氧化和消炎的作用[18]。本研究发现NANP基因rs11700338与APO-A1的水平显著相关,我们推测Neu5Ac与APO-A1可能存在协同作用,有待进一步实验验证。
综上所述,PIGM基因rs2275404、ATP6V1B2基因rs1042426、NANP基因rs11700338多态性与IS的发生风险无关联,但是与IS患者的血脂水平相关。而血脂水平是缺血性脑卒中的一个重要危险因素,因此缺血性脑卒中相关基因仍需进一步探讨。
参 考 文 献
[1] ROTH G A, MENSAH G A, JOHNSON C O, et al. Global burden of cardiovascular diseases and risk factors, 1990-2019:update from the GBD 2019 study[J]. J Am Coll Cardiol, 2020, 76(25):2982-3021.
[2] ZHOU M G, WANG H D, ZENG X Y, et al. Mortality, morbidity, and risk factors in China and its provinces, 1990-2017:a systematic analysis for the Global Burden of Disease Study 2017[J]. Lancet, 2019, 394(10204):1145-1158.
[3] EKKERT A, LIACHTENKO A, GRIGAITJ, et al. Ischemic stroke genetics:what is new and how to apply it in clinical practice?[J]. Genes (Basel), 2021, 13(1):48.
[4] HUANG L W, LI L L, LI J, et al. Association of the methylenetetrahydrofolate reductase (MTHFR) gene variant C677T with serum homocysteine levels and the severity of ischaemic stroke:a case-control study in the southwest of China[J]. J Int Med Res, 2022, 50(2):3000605221081632.
[5] GANAIE H A, BISWAS A, BHATTACHARYA A P, et al. Association of APOE gene polymorphism with stroke patients from rural eastern India[J]. Ann Indian Acad Neurol, 2020, 23(4):504-509.
[6] CHO Y, KIM J O, LEE J H, et al. Association of reduced folate carrier-1 (RFC-1) polymorphisms with ischemic stroke and silent brain infarction[J]. PLoS One, 2015, 10(2):e0115295.
[7] 許慧芳,李越然,杨魁,等.MTHFR C677T、MTRR A66G和PAI-14G/5G基因多态性与皖南地区人群缺血性脑卒中关联性研究[J]. 牡丹江医学院学报,2022,43(5):19-22,34.
[8] 冯可欣,郑启健,吕康,等.血脂及血尿酸对颈动脉粥样硬化发生风险的交互作用研究[J]. 中国脑血管病杂志,2022,19(10):667-676.
[9] 郑荣儿.褐飞虱PIGM基因的克隆及功能研究[D]. 杭州:中国计量大学,2021.
[10] RAIKWAR N S, CHO W K, BOWEN R F, et al. Glycosylphosphatidylinositol-specific phospholipase D influences triglyceride-rich lipoprotein metabolism[J]. Am J Physiol Endocrinol Metab, 2006, 290(3):E463-E470.
[11] XIA Y, LIU N, XIE X X, et al. The macrophage-specific V-ATPase subunit ATP6V0D2 restricts inflammasome activation and bacterial infection by facilitating autophagosome-lysosome fusion[J]. Autophagy, 2019, 15(6):960-975.
[12] HUSSAIN M M, BAKILLAH A, NAYAK N, et al. Amino acids 430-570 in apolipoprotein B are critical for its binding to microsomal triglyceride transfer protein[J]. J Biol Chem, 1998, 273(40):25612-25615.
[13] IQBAL J, JAHANGIR Z, AL-QARNI A A. Microsomal triglyceride transfer protein:from lipid metabolism to metabolic diseases[J]. Adv Exp Med Biol, 2020, 1276:37-52.
[14] VANHOYE X, JANIN A, CAILLAUD A, et al. APOB CRISPR-Cas9 engineering in hypobetalipoproteinemia:a promising tool for functional studies of novel variants[J]. Int J Mol Sci, 2022, 23(8):4281.
[15] 王梦花,林小仙,琚萌萌,等.唾液酸的制备和生物活性研究进展[J]. 药学研究,2022,41(9):600-604.
[16] ZHANG Y D, IMAM M U, ISMAIL M, et al. High fat diet-induced inflammation and oxidative stress are attenuated by N-acetylneuraminic acid in rats[J]. J Biomed Sci, 2015,22:96.
[17] 丁威,杨剑波,陈军.小鼠肥胖实验模型建立及其对肝脏Apo-A1和Apo-B基因表达的影响[J].畜牧与兽医,2018,50(11):120-123.
[18] 陈磊,刘新灿,王炜,等.急性心肌梗死患者血清N末端脑钠肽前体、载脂蛋白E、载脂蛋白A1、载脂蛋白B水平与冠状动脉病变的关系探究[J].中国临床医生杂志,2022,50(5):550-554.
(收稿日期:2022-09-01 修回日期:2023-02-01)
(编辑:王琳葵 梁明佩)
