刺参双通道自清洁循环水养殖系统构建与饲料中海泥比例确定
2023-06-21朱建新崔正国陈世波
李 浩,周 红,朱建新,刘 洋,崔正国,陈世波
(1.大连海洋大学水产与生命学院,辽宁 大连 116023;2.中国水产科学研究院黄海水产研究所,山东 青岛 266071;3.山东恒兴渔业发展有限公司,山东 潍坊 262714;4.青岛卓越海洋集团有限公司,山东 青岛 266408)
刺参(Apostichopus japonicus)素有“海产八珍”之首的美誉,自然栖息于西太平洋北部,包括俄罗斯远东沿海、日本和韩国等地,在我国主要分布于辽宁半岛和山东半岛沿海海域[1]。近年来我国刺参养殖面积不断增加,刺参养殖已成为渔业经济新的增长点。刺参具有窄温窄盐的生活习性,当水温低于3 ℃时刺参会进入冬眠状态,水温高于24 ℃时,刺参会进入夏眠状态,因此,自然状态下刺参的全年最适生长期一般只有4个半月[2-4]。我国目前刺参增养殖主要以近海底播养殖和池塘养殖为主,此外还有海上浮筏吊笼养殖、网箱养殖、潮间带围堰养殖等多种养殖方式[5-7]。上述几种刺参养殖模式都属于传统的开放式养殖,容易受外界环境干扰,如遇高温、高寒、暴雨、台风等自然灾害都会对刺参养殖造成不同程度损害[8-10]。室内刺参工厂化养殖环境则相对可控,主要用于刺参的苗种繁育和大规格苗种培育。室内工厂化养殖需要投放大量人工附着基,一般采用静水充气和微流水两种养殖模式[11]。但刺参工厂化养殖过程中需要投喂大量海泥和藻粉,池底经常出现大量残饵和粪便堆积的现象,为防止病原菌和敌害生物滋生,需要定期清污,工作强度很大[12-13]。因此,改进刺参养殖模式,发展高效清洁的循环水养殖,对推动刺参养殖产业的健康与可持续发展具有重要意义。
本科研团队自主设计一种具有自动清洗功能的刺参工厂化循环水养殖专用附着装置,在此基础上,首次构建一套由双通道进排水系统和四级生物净化池组成的刺参工厂化循环水养殖系统,并利用该套系统探究不同料泥质量比饲料对刺参养殖效果的影响,可为刺参循环水养殖技术优化及推广普及提供理论指导。
1 刺参工厂化循环水养殖系统设计与构建
1.1 自清洁附着基
刺参工厂化养殖除需要投喂大量的藻粉和海泥外,还需要提供足够的附着物,而刺参摄食后排出的粪便、剩余的残饵常黏附于池底和附着物上难以清理,传统波纹板、网片等附着物需要定期通过“倒池”方式进行清洗,工作强度很大。为保证构建的刺参工厂化循环水养殖系统连续稳定的运行,本研究利用朱建新等[14]设计的一种海参工厂化循环水养殖自清洁附着装置(专利号:ZL202110452222.7),布设于每个循环水养殖池中,既为刺参提供附着物,同时也解决了养殖池的清污难题。
1.2 双通道进排水系统设计
刺参的粪便主要成分是泥沙,为在养殖尾水进入水处理系统前将泥沙和其他有机代谢物分开,并排出系统外,本研究设计适合刺参循环水养殖系统的双通道进排水系统(图1)。
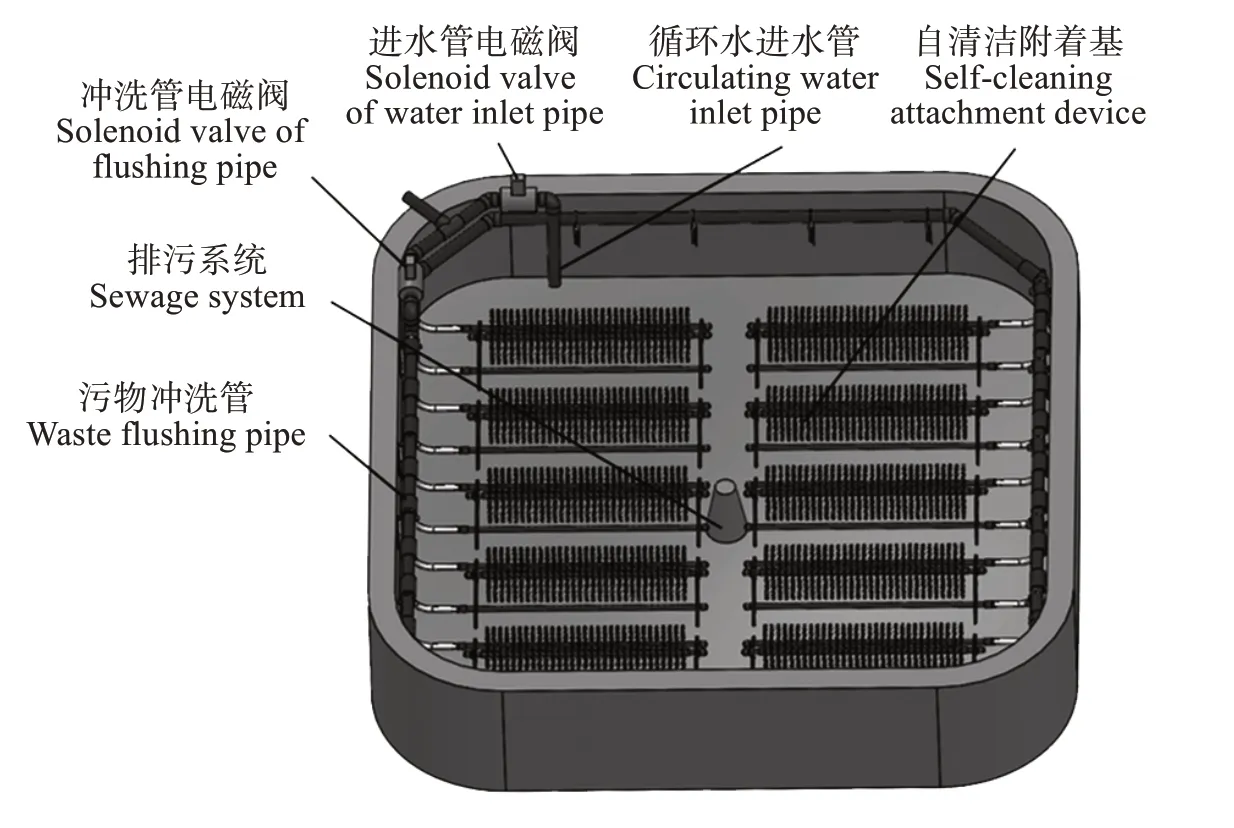
图1 刺参养殖池示意Fig.1 Schematic diagram of Apostichopus japonicus culture pond
进水系统由进水管和污物冲洗管组成,管道上均安装电磁阀,且电磁阀由智控箱控制。进水管负责日常循环水养殖工况下的进水,污物冲洗管用于冲洗池底和附着基。智控箱可控制冲洗时长和流量。
双通道排污装置由沥参网、中心花管、排泥管、集泥槽、回水管组成(图2)。沥参网的主要作用是防止刺参从排污口逃逸,集泥槽用于收集刺参粪便,并通过排泥管定期排出。中心花管、回水管负责日常循环水养殖工况下的排水。

图2 双通道排污装置示意Fig.2 Schematic diagram of dual-channel wastewater discharge device
1.3 刺参循环水养殖系统工艺流程
在实现附着基自清洁和通过双通道进排水系统实现泥污快速分离后,本研究借鉴鱼类循环水养殖工艺,构建刺参工厂化循环水养殖系统。该系统由养殖池、微滤机、四级生物滤池、紫外消毒器、增氧与控温池和提水泵组成(图3)。其水处理工艺流程:养殖池→微滤机→四级生物净化池→紫外消毒→增氧控温→提水泵→养殖池。
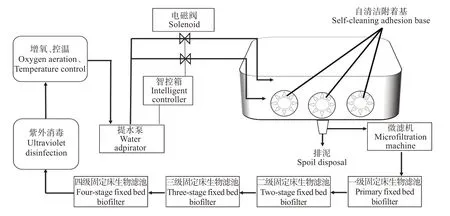
图3 刺参工厂化循环水养殖系统工艺流程Fig.3 Flow chart of industrialized recirculating aquaculture system for Apostichopus japonicus
1.3.1 养殖池 刺参工厂化循环水养殖系统共包括4 个养殖池。养殖池均为内径6.0 m 的方形圆角砖混池,池边深度1.0 m,中心深度1.2 m,有效养殖面积约为35.0 m2。每个养殖池内均布设10 组自清洁附着基,并设置适宜刺参循环水养殖系统的双通道进排水系统。
1.3.2 物理过滤 采用转鼓式微滤机,具有液面智能控制自动间隙反冲洗功能,可以以最快速度“移出”养殖水体中的残饵、粪便等固体颗粒物,处理精度大于60 μm。
1.3.3 生物过滤 生物净化采用4 级固定床生物净化池,固定床生物净化池内布设PⅤC 立体弹性填料的微生物附着基,不但能降解养殖水体中氨氮、亚硝酸盐等有毒有害无机盐,还能有效截污沉淀。生物净化池底部均设计为斗状集污和多孔排污结构,以利于沉积物收集与排出。
1.3.4 紫外消毒 采用敞开型浸没式紫外灯消毒器,具有消毒效果好、造价低、维护方便等优点,可有效杀灭养殖水中的病原微生物,降低刺参发病风险。
1.3.5 增氧及控温装置 为满足刺参高密度养殖对高溶氧要求,采用液氧供氧的方式,以保证刺参养殖池内的水体溶氧始终维持在7 mg·L-1以上。由于刺参每年受夏季高温和冬季低温的影响都会停止生长进入休眠状态,所以为了避休眠对刺参正常生长的影响,本研究在夏季高温期利用地下低温海水降温,在冬季低温期利用环保过滤升温设施对整个养殖车间进行保温处理,以降低环境温度对刺参生长的影响,可为刺参营造一个长期适宜的生长环境。
2 材料与方法
2.1 材料
2.1.1 实验刺参 实验所用刺参均来自于山东省海阳市黄海水产有限公司,刺参的初始体质量约为(40.00±5.25)g。
2.1.2 饲料 实验刺参饲料选用山东升索科技有限公司的成参配合饲料(粗蛋白质量分数≥18.0%、粗脂肪质量分数≤8.0%、粗纤维质量分数≤15.0%、粗灰分质量分数≤32.0%、赖氨酸质量分数≥0.8%、水分质量分数≤11.0%、钙质量分数≤5.0%、总磷质量分数≥0.2%)。海泥来源于养殖场附近滩涂表层泥土,经杀菌、曝晒后制成块状,于密封袋内常温储存备用。使用时,将配合饲料与海泥按比例分别称质量,称量后同时置于白色塑料桶中用海水浸泡4 h以上,投喂时搅拌均匀满池泼洒。
2.1.3 系统运行管理 2021 年6 月30 日,刺参工厂化循环养殖系统构建完成并开始启动运行。每池放养刺参150 kg,初始养殖密度为4.28 kg/m2,水循环频次控制在8~10次/d。每日下午4点进行投喂,投喂后系统停止循环2 h,以保证投喂的饲料和海泥充分沉降至池底和附着基的表面。每2~3 d 启动一次自动清洗系统,每次清洗时间20~30 min,清洗通常于投饵前完成。
2.2 方法
2.2.1 养殖条件 按照海泥在饲料中所占比例设置4 个实验梯度,分别为A 组(料泥质量比1∶1)、B 组(料泥质量比1∶2)、C组(料泥质量比1∶3)、D组(料泥质量比1∶4),4 个实验梯度分别在4 个养殖池中进行。实验共进行120 d,投喂量按刺参体质量的1%~2%进行投喂。
2.2.2 水质指标检测 养殖期间,每7 d 用YSL556 MPS多参数水质测量仪测定养殖池水温、pH、盐度、溶解氧等数据;每3 d 定时定点抽样监测养殖系统的氨氮、亚硝氮等水质指标,抽样时间为早上8:00,抽样点养殖池外侧的回水管管口(所采水样为4 个养殖池出水管汇聚口处)。水质监测方法依据《海洋监测规范》(GB17378.4-2007)标准执行。
2.2.3 刺参样品采集及生化指标检测 养殖期间,每30 d采用“五点采样法”分别从4个养殖池随机捞取50只刺参进行抽样称质量,每次采样称质量重复3 次。将刺参样品置于干滤纸上放置30 s 后快速用电子天平(精确至0.001 g)称量,称量过程尽量减少操作误差。养殖结束后,饥饿24 h,再从4 个养殖池中各随机选取5只刺参,进行解剖并取出其肠道,用液氮快速冷冻保存,随后用干冰保温送样至南京生物工程研究所进行肠道胰蛋白酶、淀粉酶、脂肪酶等生化指标检测。
2.2.4 数据处理 实验数据采用Excel 2019 进行分析处理;采用OriginPro 2018 作图;采用SPSS 25.0进行单因素方差分析(One-way ANOⅤA)和组间多重比较分析(LSD),显著水平α=0.05,结果均以“平均值±标准差”表示。
3 结果与分析
3.1 循环水系统内部氨氮、亚硝氮水质变化情况
实验前期,氨氮与亚硝氮浓度呈持续缓慢升高态势,于80 d达到峰值,其中氨氮质量浓度最高达到0.289 mg/L,亚硝氮质量浓度最高达到0.025 mg/L。后快速下降,并在100 d 左右维持相对稳定,此时,氨氮质量浓度维持在0.20 mg/L左右,亚硝氮质量浓度维持在0.01 mg/L左右(图4)。
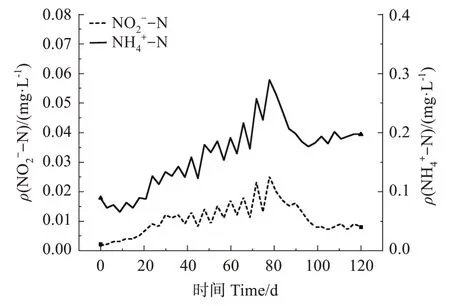
图4 刺参养殖系统氨氮、亚硝氮变化Fig.4 Ⅴariation of ammonia and nitrite concentration in the recirculating aquaculture system of Apostichopus japonicus
3.2 饲料中不同料泥质量比例对刺参生长的影响
在6-10 月的高温期,各实验组刺参并未因环境高温而停止生长进入休眠状态,反而各实验组呈现不同程度的生长趋势,且实验刺参平均增重达43.70%。不同料泥质量比饲料对刺参生长影响:实验60 d 时,C、D 两组刺参体质量显著高于A、B 两组(P<0.05),C、D 组间差异不显著(P>0.05),A 组体质量最低,并与B组差异显著(P<0.05);实验后60 d时,B 组、C 组刺参体质量增长迅速,在养殖结束时B、C 组刺参体质量高于其他各组;而D 组生长相对缓慢,其与C 组的差异显著(P<0.05),而A 组体质量仍然处于最低(图5)。
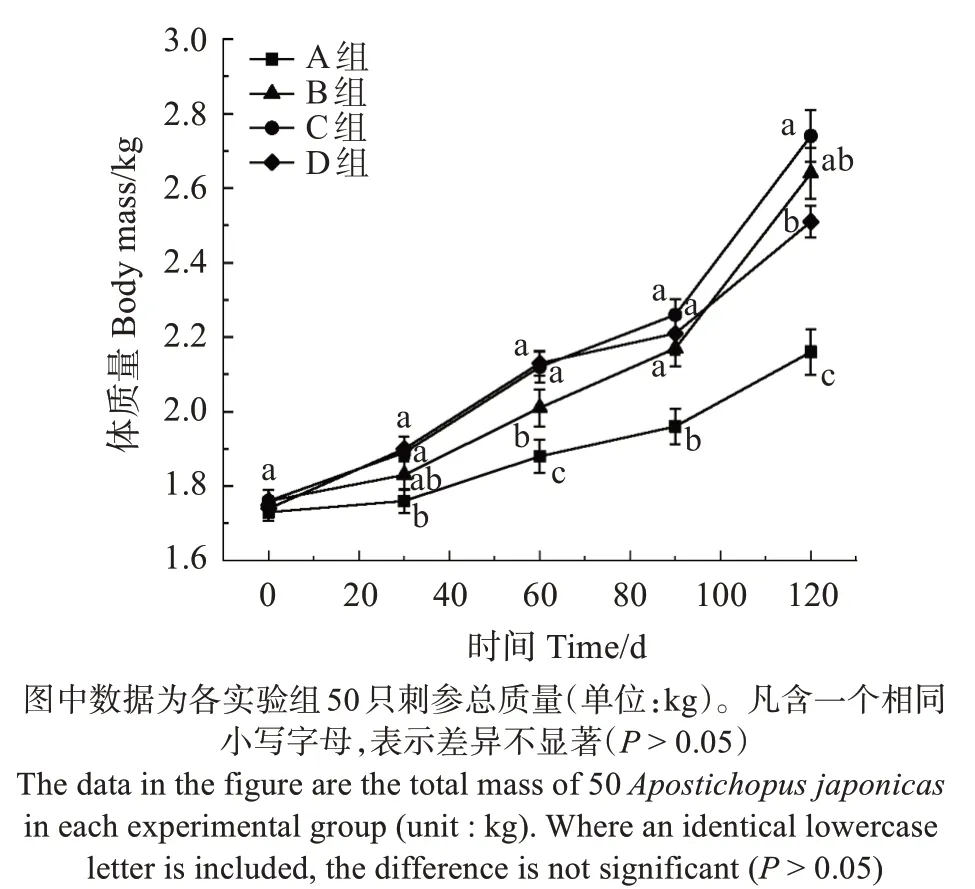
图5 刺参的生长Fig.5 Growth of Apostichopus japonicus
3.3 饲料中不同料泥质量比例对刺参肠道消化酶活性的影响
A 组刺参肠道内淀粉酶活性最低(1.25 U/mg),与B、C、D 组差异显著(P<0.05),C 组淀粉酶活性最高(2.87 U/mg),与D组差异显著(P<0.05)(图6(a))。C组刺参肠道内的胰蛋白酶活性最高(6 007.36 U/mg),A组最低(2 701.84 U/mg),除B组与D组间差异不显著外(P>0.05),其他各组间差异均是显著(P<0.05)(图6(b))。由图6(c)得知,C 组刺参肠道内的脂肪酶活性最高(6.986U/mg),A 组最低(4.349 U/mg)。其中B 组脂肪酶活性与C 组间差异不显著(P>0.05),D 组与A 组差异不显著(P>0.05),而A、D 两组与B组、C 组之间的脂肪酶活性均是呈显著差异(P<0.05)(图6(c))。
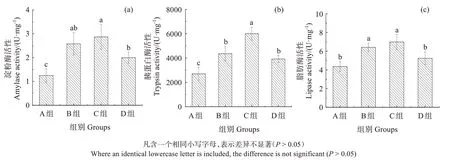
图6 刺参前肠道中各消化酶活性Fig.6 Activities of digestive enzymes in the foregut of Apostichopus japonicus
4 讨论
4.1 刺参工厂化循环养殖的水质特点
生物滤池是循环水养殖系统中的核心单元,培养一个成熟的生物滤池对水质调控至关重要。朱建新等[15]认为,当系统内生物代谢产氮作用与生物滤池的综合消氮作用达到一个相对平衡时,可视为生物膜培养成熟,而未培养成熟的生物膜,其滤池内硝化细菌丰度较低,对水体中氨氮等物质的总体去除能力则较弱。
本研究中氨氮、亚硝态氮的浓度变化呈一致性,均为先升高后下降趋势,且随生物膜的稳定成熟,在系统运行100 d 左右逐渐趋稳,这一实验结果与大多数循环水养殖报道中的水质变化趋势一致[16-17],但最终趋稳的时间略长。以往研究表明,循环水养殖系统内的生物膜成熟时间一般为30~60 d,如在牙鲆(Paralichthys oliνaceus)的封闭式循环水养殖系统中生物膜熟化大约为36 d[18];在斑节对虾(Penaeus monodon)循环水养殖系统中需60 d 左右[19];美国红鱼(Sciaenops ocellatus)的循环水养殖系统中生物膜成熟需48 d左右[20]。而本研究中刺参循环水养殖中生物滤池的生物膜熟化时间为80 d左右,时间明显长于上面所述研究结果。本研究推测这可能与养殖过程中低水温有关。由于刺参喜低温,在养殖过程中水温一直控制在18 ℃左右,而硝化细菌其适宜生长温度约为20~40 ℃,因此低温可能影响硝化细菌的正常生长,从而延长系统建立完整硝化作用的时间。。
然而,乔玮等[21]构建的大菱鲆(Scophthalmus maximus)循环水养殖系统、蒋雯雯等[22]构建的虹鳟(Oncorhynchus mykiss)等冷水性鱼类的循环水养殖系统[养殖水温(16 ± 0.9)℃],其生物膜熟化时间均只要50 d 左右。本研究分析造成刺参循环水养殖系统生物膜成熟时间延迟的原因除低水温以外,可能还与刺参饲料所用的蛋白均为植物蛋白有关,其或许会造成生物膜生长所需的营养不足。因此,刺参循环水养殖系统生物膜培养技术及其影响机制还有待进一步研究。
总之,在4个月的养参过程当中,整个养殖系统的氨氮质量浓度始终≤0.289 mg/L、亚硝氮质量浓度始终≤0.025 mg/L,且养殖池自清洁效果显著,即使在长期高料泥质量比的投喂情况下,各养殖池也从未出现积淤现象,这也就说明所构建的循环水养参系统具有良好的清污功能和水质净化能力。
4.2 不同料泥质量比对刺参生长的影响
本研究经过4个月的养殖实验发现,实验前期,刺参生长速度与饲料中加入的海泥量呈正相关,且料泥质量比较高的D、C 两组的生长速度快于料泥质量比较低的A、B 两组;而在实验后期,料泥质量比最高的D组的生长速度逐渐放缓。史策等[23]用不同料泥质量比的饲料喂养刺参50 d 后,发现刺参生长率随饲料中海泥比例的上升而升高,Shi等[24]也指出增加海泥比例可提升刺参的摄食率和排粪率,这些研究结果均与本研究早期结果一致;而曹学彬等[25]用不同料泥质量比的饲料喂养刺参90 d 后,发现当饲料海泥含量超过75%时,会造成饲料中粗蛋白、粗脂肪等营养物质含量降低,增加刺参的摄食能量消耗,从而导致刺参生长效率下降,其实验结论又与本实验后期结果相同。可见,在本实验条件下,实验各组刺参的生长速率,不仅与饲料中料泥质量比有关,还与摄食不同料泥质量比饵料的周期有关,即较短的摄食周期内适当提高饲料海泥含量可以促进刺参的生长速率,但长期摄食过高料泥质量比例的饵料反而会造成其生长速率下降。结合本实验120 d 的刺参生长和肠道酶活性检测结果,本研究认为过高海泥含量可能会造成刺参肠道内胰蛋白酶、淀粉酶、脂肪酶的活性下降,进而影响刺参生长;但消化酶活性的下降过程并非短时间内造成的,而是刺参肠道长时间高负荷运转累计而成的。本实验得出刺参工厂化循环水养殖饲料的最优料泥质量比为1∶3,为指导刺参工厂化循环水养殖提供理论指导。
5 结语
本研究构建的刺参工厂化循环水养殖系统,实现了对水质的稳定控制,提高了刺参的生长效率,使本该处于夏眠状态的刺参在6-10月的高温期平均增重达43.70%,此外本研究还发现在刺参工厂化循环水养殖过程当中饲喂料泥质量比为1∶3的饵料时刺参生长效果最优。
