农药对蚯蚓的毒理学效应研究进展
2023-06-20陈小军孟志远
包 鑫, 陈小军, 孟志远*,,2
(1.扬州大学 植物保护学院,江苏 扬州 225009;2.扬州大学 广陵学院,江苏 扬州 225009)
农药作为农业生产中重要的生产要素之一,在保障农产品质量安全中发挥着重要的作用。土壤不仅是植物生长的主要依托,还是耕地产能、粮食安全和环境保护的重要支撑[1-2],更是农药施用过程中最容易进入的环境介质之一[3]。已有研究指出了包括有机氯类、有机磷类、新烟碱类等农药在内的诸多农药在土壤中残留的事实[4-6]。同时,大量研究发现,农药可以明显影响土壤的生态功能。比如丙硫菌唑 (prothioconazole) 及其脱硫代谢物可抑制土壤中脱氢酶、过氧化氢酶和脲酶的活性[7];氟醚菌酯 (fluoxastrobin)、乙草胺(acetochlor) 和莠去津 (atrazine) 等农药不仅会影响土壤脱氢酶和脲酶的活性,还可改变土壤微生物的多样性[8-9]。
蚯蚓是土壤环境中生物量最大的动物类群[10],其可以通过挖洞、摄食等活动而疏松土壤、促进养分循环以及改善土壤肥力[11]。此外,蚯蚓在土壤无机物和有机物的分解中也发挥着重要作用[12],是陆生生物与土壤生物之间污染物传递的桥梁。因此,蚯蚓在毒理学研究中常被作为评价土壤污染程度的重要模式生物[13]。其中,赤子爱胜蚓Eisenia fetida和安德爱胜蚓E.andrei因具有较短的生命周期以及较强的行动能力、繁殖能力和降解能力而在生态毒理学研究中被广泛使用,也是农药土壤环境风险评估的标准测试生物[14-16]。近年来,随着社会经济的持续发展,人们对生态环境安全提出了更高的要求,农药对蚯蚓的生态毒性效应及其潜在机制研究备受关注。目前,已有大量研究证实了农药污染会对蚯蚓的生殖生长[17]、组织结构[18]及神经传递[19]等方面造成不利影响。此外,随着科学技术的不断发展,转录组学、代谢组学和微生物组学等组学技术可以在较短时间内检测出生物体内核酸、蛋白质、内源性代谢物及微生物等生物信息的变化,彻底改变了农药毒理学的研究体系,有助于促进人们对农药毒性效应分子机制的理解[20-23]。已有一些研究利用组学技术创新性地从基因、代谢物或微生物水平探究了农药对蚯蚓的致毒机理[24-26]。本文拟就农药进入土壤的途径及其在土壤中的残留现状、农药在蚯蚓体内的富集与消除等研究成果进行回顾,重点归纳总结农药对蚯蚓产生的毒性效应及其作用机制,旨在为农药的土壤生态风险评估提供数据支撑,为农药在农业生产实践中的合理应用以及土壤污染管理提供建议。
1 农药进入土壤的途径及其在土壤中的残留现状
1.1 农药进入土壤的途径
农药对土壤的污染可以分为直接污染和间接污染两种形式。截至2020 年底的统计表明,中国水稻、小麦、玉米三大粮食作物的农药利用率仅为40.6%[26],这意味着大部分农药并未能沉积于靶标而发生了流失损耗。现阶段,农药仍主要以茎叶喷雾的方式施用,因此大量的农药雾滴会以飞溅、漂移、滚落等形式流失到土壤、水体等环境中[27]。此外,拌种法、土壤处理法等施药方式更是直接将土壤作为农药的储存和集散场所[28]。同时,在农药生产过程中,加工机械、运输管道、储存单元等加工流程中的农药泄漏也是土壤环境中残留农药的来源之一[29]。而作为典型社会源危险废物的农药包装废弃物,若未得到妥善的处理,也将是农药进入土壤环境中的潜在形式[30]。还有研究发现,毒氟磷 (dufulin) 进入大羽白肉鸡体内后,主要随着排泄物排出体外[31],由此证明农药还可能通过动物排泄物间接进入土壤环境。此外,Tauchnitz 等[32]在德国的城市环境以及农业环境的地表水中发现了草甘膦 (glyphosate) 及其代谢物氨甲基膦酸 (AMPA)、吡氟草胺 (diflufenican)等农药的残留。也有一些关于在中国的水环境、地表沉积物中发现有机氯类农药残留的相关报道[33-34],因此,被污染的灌溉水源以及地表沉积物等土壤改良物质同样也可能是农药进入土壤的载体之一。总的来说,农药可能通过施药过程的流失、加工储运过程的泄漏、农药废弃包装、生物体排泄、土壤改良物质等多种形式进入土壤环境(图1)。
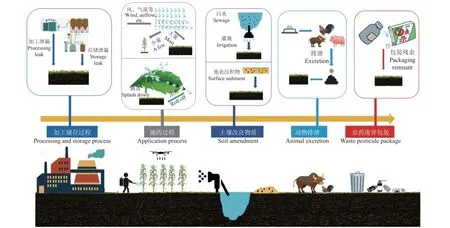
图1 农药进入土壤中的主要途径Fig.1 The main ways of pesticides entering the soil
1.2 农药在土壤中的残留现状
有机氯类农药由于在环境中滞留时间长,降解速度慢以及历史使用量大等原因,其在环境中的检出率一直居高不下[35]。魏雪芬等[36]调查发现,甘肃兰州西固地区土壤中的8 种有机氯农药异构体 (OCPs) 的检出率均达到了100%。梁晓晖等[37]也在雷州半岛土壤中检测出了10 种OCPs 残留,其中六六六 (HCHs) 和七氯 (heptachlor) 是该地区的主要有机氯类污染物,在土壤中的残留量分别为23.83~111.51 和11.01~25.95 ng/g。Tao 等[4]在2018—2020 年间采集的北京麦田土壤中检测出了HCHs、DDTs 等有机氯农药残留,其中DDTs保持了稳定的检出频率,2020 年在土壤样本中检测到了21 种农药残留,其中p,p′-DDE 的检出率达到100%,最高残留量为546.0 μg/kg,吡虫啉(imidacloprid) 则以90%的检出率位居新烟碱类农药第一,最高残留量为532.6 μg/kg。同时,2017—2018 年间韩国的有机氯类农药土壤调查结果显示,在韩国150 个农业土壤样品中,有机氯类农药的检出率为96%,其中DDTs 和硫丹 (endosulfan)的检出浓度水平较高,平均残留量分别为0.31 和0.33 ng/g[38]。
土壤对有机磷类农药具有吸附和结合残留成分的作用,因此该类农药在土壤中也具有较高的残留风险[39-40]。Li 等[5]在调查有机磷类农药在中国的分布特征时发现,有机磷农药在温室土壤和露天土壤中的检出残留量范围分别为22.1~335 和9.93~303 ng/g,平均残留量分别达到了108 和57.9 ng/g,同时该调查结果显示,有机磷类农药在中国东北部、北部和中部地区残留量较高。Pan 等[41]采集并检测了241 份长江三角洲的农业土壤,发现9 种有机磷农药的检出率达到了93%,总检出残留量范围为3.0~521 ng/g,平均残留量为64.7 ng/g,其中,乐果 (dimethoate) 的检出率最高,为80.9%,平均残留量达到50.8 ng/g。
新烟碱类杀虫剂因其独特的作用机理以及广谱、高效的杀虫活性,已在农业生产中广泛使用[42],并逐渐在土壤污染因子中占据了主要地位[43]。在山东省济阳县的设施番茄土壤中,调查人员检测出了较高浓度的噻虫嗪 (thiamethoxam) 和吡虫啉,其残留量均值分别为0.107 和0.233 mg/kg。此外,在设施黄瓜土壤中同样检测出了较高浓度的噻虫嗪和吡虫啉,其残留量均值分别为1.18 和0.126 mg/kg[44]。Wu 等[6]在山东省寿光市的番茄大棚土壤和黄瓜大棚土壤中分别检出了7 种和6 种新烟碱类杀虫剂,总检出残留量范围分别为0.731~11.383 和0.363~19.224 μg/kg,同时发现表层土壤中的新烟碱类杀虫剂残留量高于中下层土壤。Bonmatin 等[45]采集了菲律宾3 个省份的67 份土壤样品,新烟碱类杀虫剂的检出率达到78%,其中吡虫啉检出频率最高,平均残留量为0.56 μg/kg;同时他们指出,柑橘土壤中的新烟碱类农药残留水平是水稻、香蕉、蔬菜土壤的130 倍,平均残留量达到了113.5 μg/kg。
研究人员在中国江苏、重庆、浙江、广东、广西、福建及云南等地的土壤中还检测出了8 种拟除虫菊酯类农药残留,其中氯氰菊酯 (cypermethrin)在上述地区土壤中的检出率最高[46]。为了评估中国长江三角洲地区农业土壤中拟除虫菊酯类农药的残留状况,Deng 等[47]对在上述地区所采集的土壤样品进行了检测,发现了甲氰菊酯 (fenpropathrin)、氯氰菊酯、溴氰菊酯 (deltamethrin) 以及三氟氯氰菊酯 (cyhalothrin) 的残留,4 种农药的平均检出残留量分别为4.92、1.10、0.89 和0.20 ng/g,其中氯氟氰菊酯的检出率最高,达到63.9%。同样,调查人员在江苏省的农业土壤和茶园土壤中也检测出了高效氯氟氰菊酯 (beta-cyfluthrin) 和联苯菊酯(bifenthrin) 等拟除虫菊酯类农药残留,两种土壤中拟除虫菊酯类农药的残留总量分别为27.1~50.7和56.9~97.0 ng/g[48]。此外,手性农药由于其独特的手性结构,在土壤中的降解行为存在较大差异,因此其土壤残留风险也备受关注。Shen 等[49]调查了我国农业土壤中的甲霜灵 (metalaxyl)、敌草胺 (napropamide)、灭菌唑 (triticonazole) 及叶菌唑 (metconazole) 等手性农药的残留情况,发现上述4 种农药的最大检出残留量分别为16.67、32.99、207.39 和71.83 ng/g,其中还观察到了R-甲霜灵、R-灭菌唑、叶菌唑-1 和叶菌唑-4 的特异性残留 (表1)。
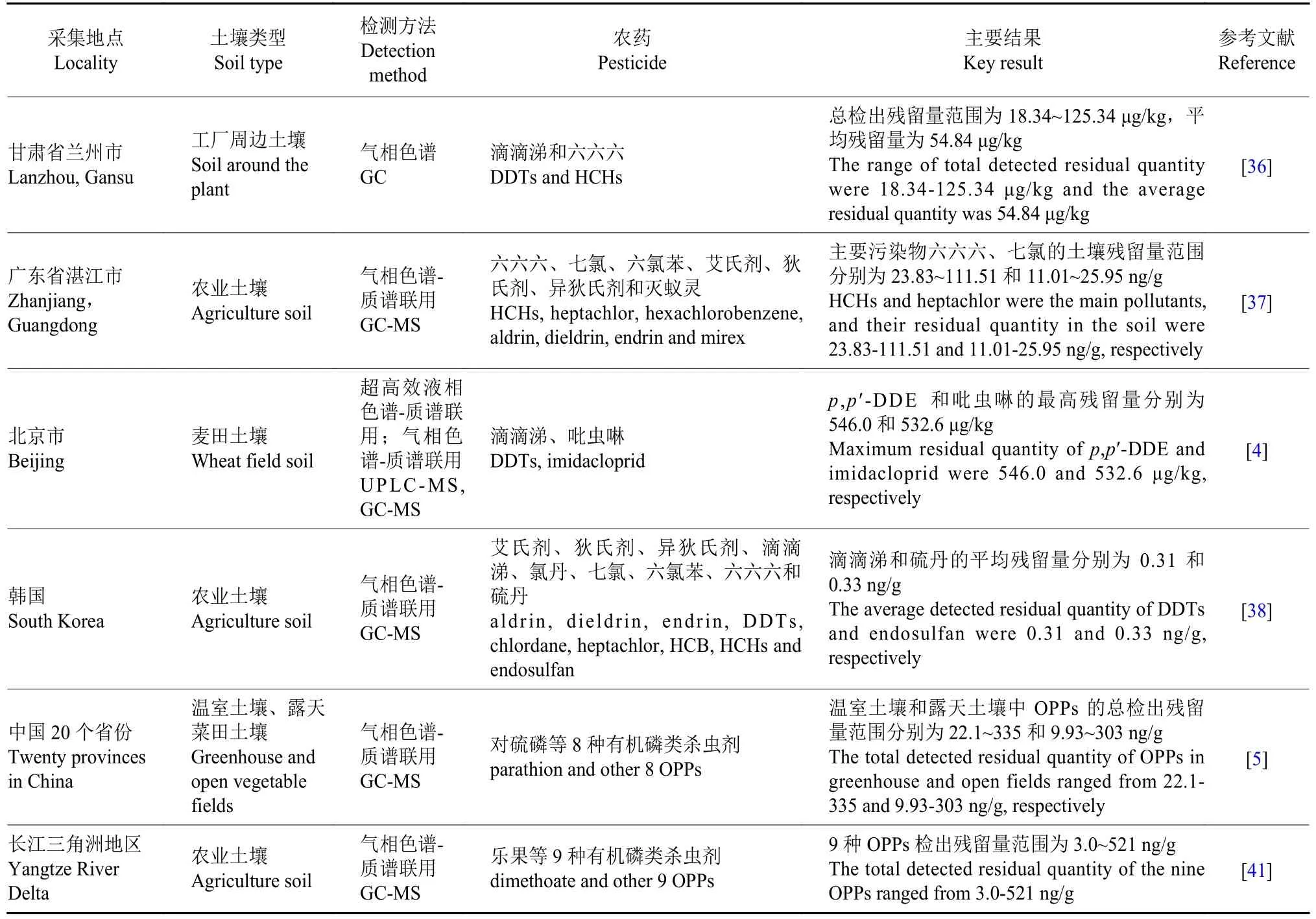
表1 部分地区土壤中的农药残留分布特征Table 1 Distribution characteristics of pesticide residues in soil samples from certain areas
相较于上述对几种农药的检测,Silva 等[50]基于LC-MS 检测了317 个欧洲农业土壤样品中76 种农药的残留水平,在80%的土壤中检测出了农药残留;在所有土壤样品中,最大单个农药残留量为2.05 mg/kg,最大总残留量为2.87 mg/kg;且值得关注的是,上述欧洲农业土壤样品中残留量和检出率较高的农药除了草甘膦、DDTs 及其代谢物外,还包含了啶酰菌胺 (boscalid)、氟环唑(epoxiconazole)、戊唑醇 (tebuconazole) 等常用杀菌剂。
2 农药在蚯蚓体内的富集与消除
2.1 农药在蚯蚓体内的富集行为
蚯蚓暴露于土壤环境中,可通过被动扩散和摄食作用将土壤中的农药吸收并积累于体内,进而通过食物链等途径威胁更高等级生物。被动扩散作用主要是指农药通过土壤溶液穿透蚯蚓体表进入体内,而摄食作用则是土壤中的农药通过蚯蚓的摄食过程进入体内[51]。Belfroid 等[52]基于两种吸收途径,建立了可预测蚯蚓体内疏水性有机化合物吸收、积累的模型,借此模型可以通过化合物的油水分配系数 (logKow) 来预测蚯蚓吸收和积累农药的方式。Jager 等[53]也建立了相关预测模型并进一步指出,随着有机化合物疏水性的增强,当logKow接近5、尤其是大于6 时,蚯蚓通过肠道吸收有机化合物将是其主要的吸收途径。例如在正常环境下,甲霜灵[54]、乙氧呋草黄 (ethofumesate)[55]和α-六氯环己烷[56]的logKow值分别为1.6、2.7 和3.9,因此皮肤暴露可能是这3 种农药进入蚯蚓的主要途径。蚯蚓的内脏分泌物有利于物质的消化且可以提高农药等有机物在其体内的溶解度,从而间接提高农药向蚯蚓组织扩散的能力。与此同时,蚯蚓脏器内液相物质极性降低,更利于农药在蚯蚓脏器脂肪中累积[51]。除此之外,Chevillot 等[57]还提出了农药与蚯蚓体内结构蛋白等蛋白质的结合也是蚯蚓富集农药的一种潜在机制。
生物浓缩因子 (BCF)、生物富集因子 (BAF)及生物-土壤富集因子 (BSAF) 在“OECD 317”[58]中被确定为用于描述污染物在蚯蚓体内富集过程的重要因子,并成为评估农药在蚯蚓体内富集的重要指标。熊康[59]研究发现,随着暴露时间延长,溴敌隆 (bromadiolone) 可在蚯蚓体内富集,其中10 和20 mg/kg 土壤处理组蚯蚓的富集浓度均在暴露第14 天达到最大值,同时其BAF 值随着土壤中药剂暴露浓度的增大而减小,表明溴敌隆在蚯蚓体内的富集与暴露浓度有关。此外,杨广斌等[60]在分别进行叠加污染和一次污染、但控制毒死蜱 (chlorpyrifos) 暴露总浓度均为4、12 和20 mg/kg 的前提下,根据BSAF 值测定结果,证明毒死蜱以多次叠加污染的方式暴露更易在蚯蚓体内富集。Goto 等为了评估二甲戊灵 (pendimethalin)和氟乐灵 (trifluralin) 在Eiseniaspp.和Pheretimaspp.两种亚洲常见蚯蚓中的富集能力,通过吸收和消除试验计算出两种除草剂在蚯蚓体内的动力学生物积累因子 (BAFk),证明了Pheretimaspp.对二甲戊灵和氟乐灵吸收较慢、消除较快,由此认为Pheretimaspp.对该两种除草剂的富集风险较低[61]。Hartnik 等[62]研究发现,在时长50 d 的α-氯氰菊酯暴露试验期间,挪威和丹麦土壤中蚯蚓体内的α-氯氰菊酯浓度一直保持上升趋势;而Diao等[63]的研究显示,α-氯氰菊酯在中国北京土壤中暴露10 天后,蚯蚓体内α-氯氰菊酯浓度就开始下降并达到稳定水平。因此,污染方式、蚯蚓种类、土壤性质等因素的差异也会对农药在蚯蚓中的富集与消除行为产生潜在影响。此外,Wang 等[64]研究发现,手性农药灭菌唑和丙硫菌唑在蚯蚓体内的富集行为存在对映体选择性,其中S-灭菌唑和R-丙硫菌唑在蚯蚓体内优先富集。同时,Chang等[65]根据高效氯氟氰菊酯暴露28 d 期间的对映体分数 (EF) 测定结果发现,(+) -高效氯氟氰菊酯在蚯蚓体内优先富集。
2.2 农药在蚯蚓体内的消除行为
蚯蚓还可进一步通过体内的相关酶系统或肠道菌群降解所富集的农药[66]。李冰等[67]研究发现,敌百虫 (trichlorfon) 对蚯蚓体内的解毒酶羧酸酯酶 (CarE) 有诱导作用,其中0.04 g/L 的敌百虫可诱导蚯蚓体内CarE 活性达到最大。Sanchez-Hernandez 等[68]的研究则表明,蚯蚓体内的Ⅰ相代谢酶细胞色素酶 (CYP450) 和Ⅱ相代谢酶谷胱甘肽硫转移酶 (GST) 在毒死蜱的降解过程中发挥了重要作用。蚯蚓在受到硫丹胁迫后,其肠道中的RhodococcusMTCC 6716 菌株可在15 d 内将97%的硫丹降解为无毒的硫丹二醇和硫丹硫酸酯[69]。研究人员基于16S rRNA 分析结果,提出蚯蚓体内的红球菌和芽孢杆菌可将DDT 降解,使其毒性降低,并通过试验证明了菌株的降解率分别可达到88.36%和85.22%[70]。Owagboriaye 等[71]研究发现,Alma millsoni、Eudrilus eugeniae和Libyodrilus violaceus3 种蚯蚓均可富集草甘膦,其中A.millsoni的BAF 值在整个试验周期均小于1,而E.eugeniae、L.violaceus两种蚯蚓的BAF 值在第8 周均大于1,同时E.eugeniae和L.violaceus两种蚯蚓可加快土壤中草甘膦的消除速度,因此研究者认为这两种蚯蚓可用来治理被草甘膦污染的土壤。Cao 等[72]研究发现,异草酮 (clomazone)在蚯蚓体内富集较快,第3 天即达到富集最大值;同时通过消除试验发现,在1 d 内,3 个浓度处理组 (10、40、160 mg/kg) 分别有74%、75%和80%的异草酮被消除。孙宇涵[73]将富集联苯三唑醇 (bitertanol) 21 d 后的蚯蚓置于空白土壤,发现前3 d 蚯蚓体内的联苯三唑醇浓度迅速下降,3 d 后则与土壤中的联苯三唑醇浓度基本达到平衡。同时,Qu 等[74]的研究还发现,两种氟虫腈(fipronil) 对映体在蚯蚓体内的半衰期分别为3.3和2.5 d,7 d 后分别有76%和85%的氟虫腈被消除。乙氧呋草黄对映体在蚯蚓体内的消解半衰期更短,仅为1.8 d[55]。Zhou 等[56]根据α-六氯环己烷在蚯蚓体内的快速消除特性,指出蚯蚓的肠道排泄是α-六氯环己烷在蚯蚓体内快速消除的原因之一。因此,蚯蚓富集农药后,由于农药性质差异以及蚯蚓自身排泄等的差异,导致农药在蚯蚓体内的降解半衰期存在较大差异。
综上所述,蚯蚓主要通过摄入被污染的土壤及皮肤接触两种途径吸收土壤中的残留农药。在接触农药的初期,蚯蚓体内农药量一般会呈现上升趋势并在某暴露节点达到峰值,随后在蚯蚓体内代谢酶和微生物等的作用下,经过积累、转化和代谢等多个过程,使得农药在蚯蚓和土壤之间的分配达到平衡,最终使蚯蚓体内农药含量趋于稳定。
3 农药对蚯蚓的毒性效应
3.1 生长生殖毒性
大量研究表明,农药会对蚯蚓的生长过程产生影响,其中生长率、体重、行为形态变化等指标常被用来评估农药对蚯蚓的生长毒性[75](表2)。史雅静等[17]研究发现,3 个不同水平 (5、25 和30 mg/kg) 的溴氰菊酯暴露均能显著降低蚯蚓的体重,并且蚯蚓体重降低的程度与溴氰菊酯的暴露浓度和时间呈正相关。为了更全面地评估氟草胺(benfluralin)、嗪草酮 (metribuzin) 及戊炔草胺(propyzamide) 3 种除草剂对蚯蚓的影响,Travlos等[76]通过土壤暴露试验发现,上述3 种除草剂均不同程度地降低了蚯蚓的体重并且可影响蚯蚓的存活率。此外,胡玲[77]的研究表明,呋喃丹(carbofuran) 暴露会导致蚯蚓呈现蜷缩挣扎、环节肿大和糜烂的中毒症状。王喆[78]发现,蚯蚓在杀菌剂甲霜灵和精甲霜灵 (metalaxyl-M) 暴露下,出现了环节肿大、渗液出血的现象。蚯蚓作为寡毛纲雌雄同体生物,其生殖活动主要包括交配、精液交换、茧内受精结茧等[79]。Wang 等[80]研究发现,吡虫啉对蚯蚓具有较高的生殖毒性,可以显著抑制其繁殖。Ge 等[81]通过人工土壤法进行了吡虫啉、噻虫胺 (clothianidin)、烯啶虫胺 (nitenpyram)、啶虫脒 (acetamiprid)、呋虫胺 (dinotefuran) 及噻虫啉 (thiacloprid) 6 种新烟碱类杀虫剂对蚯蚓的暴露试验,发现6 种供试农药均可不同程度地抑制蚯蚓的茧产量、重量以及孵化数。此外,还有研究发现,40 和80 mg/kg 的乙草胺暴露15 d 会引起蚯蚓精子数量的减少[82]。毒死蜱以10 mg/kg 及以上的浓度暴露后,蚯蚓出现精子细胞核浓缩、桑葚胚受损且数量减少的现象[83]。Espinoza-Navarro 等[84]还发现,经马拉硫磷 (malathion) 处理后,赤子爱胜蚓受精卵中的精子分布异常,精囊中细胞增殖加快,精原细胞中DNA 发生断裂。
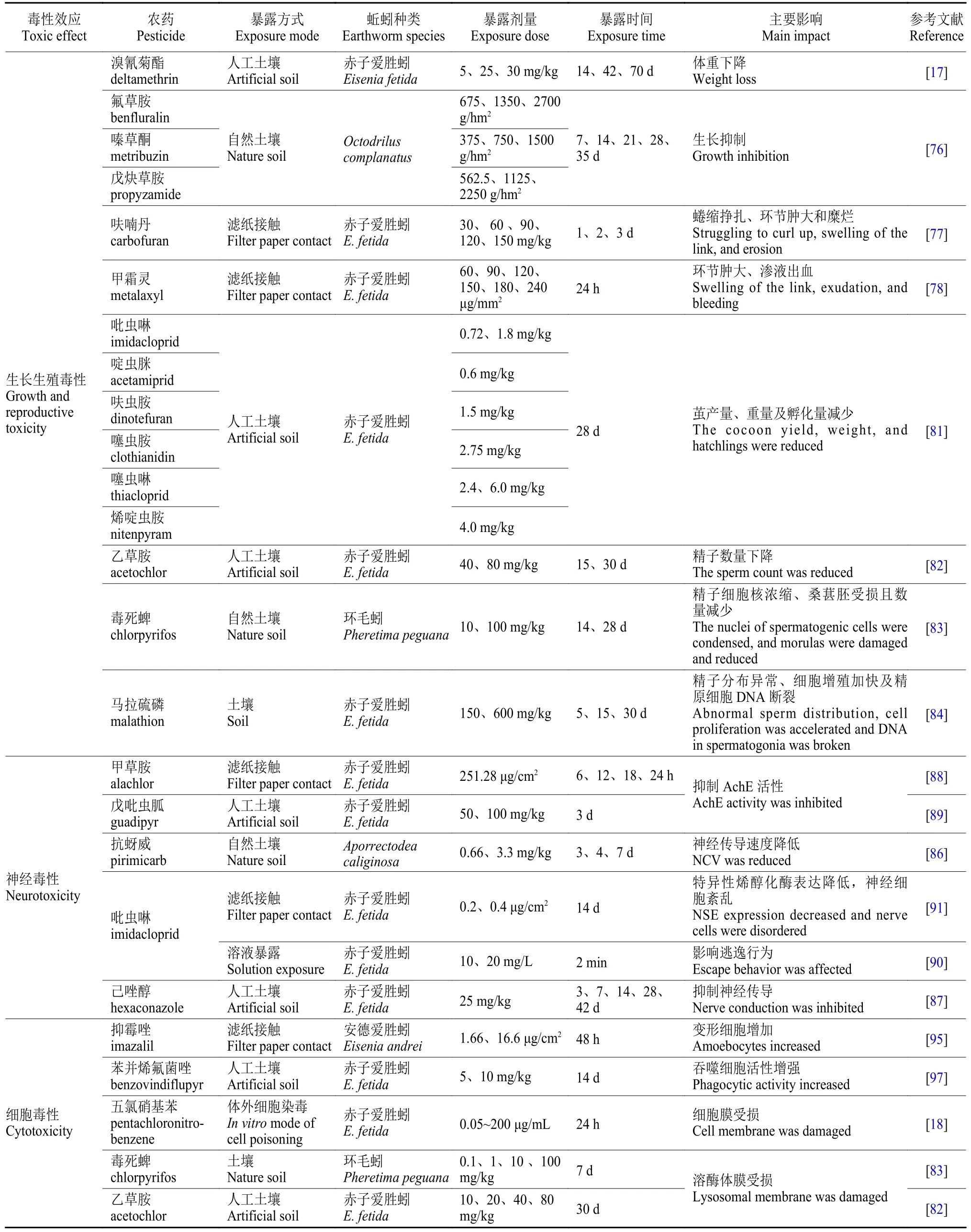
表2 典型农药对蚯蚓的毒理学效应Table 2 Toxicological effects of pesticides on earthworms
3.2 神经毒性
长期以来,农药对蚯蚓神经系统的影响一直受到广泛关注 (表2)。众所周知,有机磷类、氨基甲酸酯类、沙蚕毒素类杀虫剂对蚯蚓的神经系统威胁较大[85-86]。乙酰胆碱酯酶 (AchE) 是生物体神经传导过程中的关键酶,因此也是农药毒理学研究中重要的生物标志物[87]。除草剂甲草胺 (alachlor)暴露会降低蚯蚓AchE 的活性,其中甲草胺暴露24 h 对蚯蚓AchE 活性的抑制率最高,达91.99%[88]。此外,新烟碱类杀虫剂戊吡虫胍 (guadipyr) 以50 和100 mg/kg 的浓度暴露,也导致了蚯蚓的AchE 活性降低[89]。Mazzia 等[86]通过测定蚯蚓的神经传导速度 (NCV) ,评价了氨基甲酸酯类杀虫剂抗蚜威 (pirimicarb) 对蚯蚓的神经毒性,发现抗蚜威以0.66、3.3 mg/kg 的浓度暴露后,在第3、第4 和第7 天可诱导蚯蚓的NCV 显著降低,同时还发现抗蚜威所诱导的蚯蚓N C V 变化与其AchE 活性的改变显著相关。为了研究吡虫啉暴露下蚯蚓的逃逸行为,研究者还记录了蚯蚓在接触吡虫啉后的初始逃逸距离和逃逸速度,发现10 和20 mg/L 的吡虫啉暴露会破坏蚯蚓的神经系统,抑制其逃逸行为[90]。此外,Huslystyi 等[91]还在细胞水平上发现了吡虫啉可导致蚯蚓神经元标志物特异性烯醇化酶 (NSE) 的表达降低,证明吡虫啉造成了蚯蚓神经细胞的紊乱。Liu 等[87]研究发现,25 mg/kg 的己唑醇 (hexaconazole) 暴露可以显著抑制蚯蚓体内AchE 的活性,证明己唑醇对蚯蚓的神经传导过程具有潜在影响。
3.3 细胞毒性
蚯蚓的体腔细胞具有免疫活性,在识别和消除外来物质、免疫反应、吞噬作用等方面具有重要作用[92]。已有研究表明,化学物质可通过真皮影响体腔细胞,并诱导蚯蚓体腔细胞的凋亡[93-94]。作为一种具有系统渗透性的杀菌剂,经抑霉唑(imazalil) 暴露72 h 后,蚯蚓体腔细胞的密度随着抑霉唑浓度的增加而增加,此外,研究人员根据细胞学染色结果还发现,经抑霉唑暴露48 h 后,蚯蚓体腔液中变形细胞的比例显著增加[95]。Correia 等[96]评估了抑霉唑的光催化降解产物对赤子爱胜蚓的毒性作用,发现蚯蚓在分别暴露于光降解18、35 和90 min 的抑霉唑降解产物 (PDT-18、35 和90) 溶液中48 h 后,其体腔细胞中油细胞的比例显著增加。He 等[97]研究发现,经5 和10 mg/kg 的苯并烯氟菌唑 (benzovindiflupyr) 暴露14 d 后,蚯蚓体内吞噬细胞的活性显著提高,且细胞功能受损。Li 等[18]将乳酸脱氢酶 (LDH) 作为反映蚯蚓细胞膜通透性的生物标志物,通过体外细胞毒性试验发现,五氯硝基苯 (pentachloronitrobenzene) 暴露可导致蚯蚓细胞膜通透性受损;同时,五氯硝基苯的暴露浓度和蚯蚓体内的LDH 水平呈线性关系。此外,中性红保留时间(NRRT) 作为溶酶体膜损伤程度的评价指标,可以反映蚯蚓受到农药影响后在亚细胞水平上发生的变化[98]。随着毒死蜱暴露浓度和时间的增加,蚯蚓NRRT 值逐渐下降,证明毒死蜱暴露对蚯蚓的溶酶体膜造成了损伤[83]。Xiao 等[82]在发现乙草胺破坏了蚯蚓溶酶体膜完整性的同时,还提出NRRT 可以作为蚯蚓受到乙草胺胁迫的预警信号,并建立了NRRT 和土壤中乙草胺残留浓度的关系模型。总的来说,农药对蚯蚓的细胞毒性主要包括导致细胞密度和活性变化、细胞膜通透性改变以及溶酶体膜损伤等方面 (表2)。
3.4 遗传毒性
DNA 作为遗传信息的载体,易受到生命体内部或外部因素的影响而产生损伤[99]。单细胞凝胶电泳法 (彗星试验) 是一种能快速地在单细胞水平检测DNA 损伤的测试方法[100],已被广泛应用于农药对蚯蚓遗传毒性的评价 (表2)。Liu 等[101]通过单细胞凝胶电泳法,发现硫丹暴露后蚯蚓的OTM 值 (Olive 尾矩) 增加,认为其诱导了蚯蚓DNA 链的断裂。Yao 等[102]发现,除0.5 mg/kg 处理组外,1.5、5 和50 mg/kg 苯并烯氟菌唑处理组蚯蚓的OTM 值均显著高于对照组,证明苯并烯氟菌唑造成了蚯蚓DNA 的损伤。此外,杀菌剂噻呋酰胺 (thifluzamide) 也可导致蚯蚓细胞核出现大量拖尾,使DNA 呈蓬松状;同时,噻呋酰胺对蚯蚓OTM 值的影响还存在剂量依赖效应[103]。除导致蚯蚓DNA 拖尾长度和OTM 值显著增加外,还有研究发现,当莠去津的质量浓度达到2.5 mg/kg时,蚯蚓体腔细胞的大部分DNA 会迁出细胞核,导致细胞核呈现镂空状,造成DNA 损伤[104]。刘修园等[105]研究发现,蚯蚓经5 和10 mg/kg 的氟苯虫酰胺 (flubendiamide) 暴露7 d 后,其DNA 的OTM值随着染毒剂量的增加和暴露时间的推移而升高,并显著高于对照组。
3.5 氧化应激
氧化应激是由于蚯蚓体内抗氧化防御系统受到抑制以及活性氧 (ROS) 的过量产生并超过了内源性抗氧化能力而引起的毒性效应[106],其进一步会诱导蚯蚓脂质过氧化、蛋白质损伤、DNA 损伤以及细胞凋亡[92]。其中,丙二醛 (MDA) 作为脂质过氧化的最终产物,在破坏细胞膜结构的同时还会进一步导致蛋白质及核酸聚合,诱导细胞毒性[107]。当ROS 积累至一定程度时,还会进攻DNA分子中鸟嘌呤碱基的第8 位碳原子而产生8-羟基脱氧鸟苷 (8-OHdG);与此同时,蚯蚓体内的抗氧化酶系统被激活,从而降低其过氧化氢 (H2O2) 等ROS 的积累,以达到自身防御作用[108](图2)。对于农药暴露造成的氧化损伤,蚯蚓主要通过提高抗氧化酶活性来实现其机体防御,因此超氧化物歧化酶 (SOD)、过氧化物酶 (POD) 及过氧化氢酶(CAT) 等主要抗氧化酶的活性是评价蚯蚓受农药影响后体内氧化应激水平的重要指标[109](表2)。
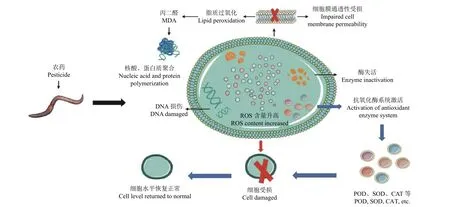
图2 农药诱导蚯蚓产生氧化应激的内在过程Fig.2 The internal process of oxidative stress in earthworms induced by pesticides
张程[110]将蚯蚓暴露于不同浓度的氟嘧菌酯后,发现潮土、红土、黑土3 种不同性质土壤中的氟嘧菌酯均可导致蚯蚓体内的ROS 含量升高,诱导蚯蚓产生氧化应激。Liu 等[87]研究发现,经25 mg/kg 的己唑醇暴露7 和14 d 后,均可以显著提高蚯蚓体内ROS 的水平,证明己唑醇会导致蚯蚓氧化损伤。蚯蚓在受到溴氰虫酰胺 (cyantranilipr)刺激后,其体内ROS 含量改变,产生氧化应激,同时蚯蚓体内8-OHdG 含量的改变表明溴氰虫酰胺还导致了其DNA 损伤[108]。Qiao 等[111]基于蚯蚓在溴氰虫酰胺刺激下蛋白羰基 (PCO) 含量的升高,证明溴氰虫酰胺暴露造成了蚯蚓蛋白质的氧化损伤。肟菌酯 (trifloxystrobin) 的暴露也会导致蚯蚓体内ROS 积累,显著改变SOD 及CAT 等抗氧化酶的活性,同时研究人员通过计算综合生物标志物反应指数 (IBR) 发现,棕色土壤中的肟菌酯对蚯蚓所产生的氧化应激要大于人工土壤[112]。在为期28 d 的三酮类除草剂硝磺草酮 (mesotrione)暴露期内,蚯蚓ROS 含量均显著高于对照组且呈现出先升高后降低的趋势,同时基于SOD、CAT及POD 活性的变化,表明蚯蚓抗氧化酶系统被激活以清除过量的ROS,其中CAT 和POD 的活性在28 d 时接近对照水平,进一步表明二者最终共同清除了蚯蚓体内过多的ROS[113]。研究人员发现,精甲霜灵暴露也会导致蚯蚓体内ROS 含量的升高,在第21 天和第28 天,由于抗氧化酶的作用使ROS 含量较前两周开始下降,以缓解精甲霜灵所诱导的氧化损伤[114]。此外,经0.125、0.25、0.5 及1 μg/cm2的二甲吩草胺-p(dimethenamid-p)暴露48 h 后,蚯蚓体内的ROS 含量并没有发生显著改变,表明蚯蚓自身的抗氧化酶系统仍能及时清除所产生的过量ROS[15]。张榜军等[115]基于实时荧光定量PCR 技术 (RT-qPCR) 发现,除草剂2,4-D 暴露改变了蚯蚓hsp70和crt基因的表达水平,
证明了蚯蚓体内氧化应激的产生。为评估毒死蜱对蚯蚓的生态风险,Farsani 等[116]研究发现,在毒死蜱暴露的第4 和第8 天,19.2 和38.4 mg/kg 处理组蚯蚓的MDA 含量显著升高。Fang 等[117]也发现了蚯蚓在经氟啶虫胺腈 (sulfoxaflor) 暴露 7 d以后,其体内MDA 的含量显著升高。上述研究强调了毒死蜱和氟啶虫胺腈暴露除了可导致蚯蚓发生脂质过氧化作用外,还可以诱发蚯蚓的细胞毒性。此外,作为解毒酶系统中清除过氧化物的关键酶[108],GST 在蚯蚓受到多菌灵 (carbendazim)的干扰后活性显著提高,进而有助于减轻多菌灵对蚯蚓造成的氧化损伤[118]。
4 基于组学技术的农药对蚯蚓致毒机制研究进展
4.1 基于转录组学的农药对蚯蚓致毒机制研究
转录是遗传信息从DNA 转向RNA 的过程,是调控生物体基因表达的重要方式之一。转录组学是一门在整体水平上研究机体细胞中基因转录情况及转录调控规律的学科,其可以从转录水平揭示生物受到胁迫后整个基因组表达情况[119]。转录组学的核心技术是转录组测序,即利用仪器对试验样品的全部转录产物进行测序,以获取遗传序列信息[120]。目前,相关测序技术已发展至第3 代,但在蚯蚓毒理学领域中应用较多且较成熟的则是以Illumina 为主要测序平台的第2 代测序技术。在获得转录组测序结果并筛选出差异表达的基因 (DEGs) 后,研究人员还可基于京都基因和基因组百科全书 (KEGG)、基因本体功能 (GO) 等数据库对DEGs 进行功能注释,进而从基因表达层面阐述试验变量对蚯蚓生物学功能的影响[23]。此外,为了明确差异表达转录产物的表达水平,还有一些研究使用RT-qPCR 技术评估了差异表达基因转录产物的丰度差异[120]。
已有研究表明,农药可以通过影响蚯蚓不同代谢通路中相关基因的表达水平,进而对蚯蚓造成不利影响。Li 等[23]利用转录组测序技术,分析了暴露于嗪草酮和戊唑醇后蚯蚓的基因表达谱,发现2 种农药均导致了Ankyrin-2、Chitinase、Scavenger receptor、Cytochrome P450等与神经系统、免疫系统及氧化应激相关基因的异常表达,证明了嗪草酮和戊唑醇可诱导蚯蚓产生神经毒性、免疫毒性以及氧化应激。张程[110]运用RNAseq 对氟嘧菌酯处理后蚯蚓的基因转录组进行探究,从0、0.1、1 和2.5 mg/kg 4 种质量浓度的氟嘧菌酯处理组共筛选出27 个共同的DEGs,同时基于这27 个DEGs 的KEGG 富集分析结果表明,氟嘧菌酯影响了蚯蚓体内蛋白质的折叠和降解,同时影响了其信号传导、免疫以及细胞生长相关的途径,此外根据其血管生成素基因表达量的下调,还发现蚯蚓的血液循环受到了干扰。Qiao等[111]研究发现,1 和10 mg/kg 的溴氰虫酰胺可分别诱导蚯蚓体内960 和1212 个基因表达异常,其中氨基糖、核苷酸糖相关基因表达上调,而类固醇激素生物合成和蛋白质消化吸收通路的相关基因表达下调,证明溴氰虫酰胺影响了蚯蚓体内糖类、蛋白质和脂质的生物合成及其吸收与转化过程。Liu 等[87]基于转录组分析结果发现,己唑醇(HEX) 暴露可使蚯蚓体内20 多个生物途径发生变化,其中S-(+)-HEX 对蚯蚓类固醇的生物合成、花生四烯酸代谢和细胞周期等过程的影响比R-(-)-HEX 明显。研究人员通过Illumina Novaseq 6000对蚯蚓样品的cDNA 进行测序,发现25 和50 mg/kg的氟吡呋喃酮 (flupyradifurone) 共同显著改变了蚯蚓880 个基因的表达,并通过KEGG 数据库注释了蚯蚓的DEGs 功能,同时针对与热休克蛋白(HSP)、AchE 及细胞色素P450 酶相关的DEGs,通过RT-qPCR 技术进行了验证,发现氟吡呋喃酮暴露后显著影响了蚯蚓的信号传导、物质合成与代谢、细胞进程以及解毒等通路,进一步破坏了蚯蚓的神经系统、糖脂代谢以及诱导蚯蚓细胞损伤与凋亡[121]。Zhang 等[122]根据转录组学分析结果,发现戊唑醇暴露后蚯蚓体内产卵相关基因Annetocin的表达降低,从而干扰其产卵过程,表现出生殖毒性 (表3)。
4.2 基于代谢组学的农药对蚯蚓致毒机制研究
代谢组学作为继基因组学、转录组学和蛋白质组学之后发展起来的一种新的组学方法[10],主要通过研究生物体内源性代谢产物相对含量的变化,从整体水平研究生物体的代谢变化[123],目前已广泛应用于毒理学、医学及食品等领域中[124-126]。现阶段,代谢组学主要依靠核磁共振波谱 (NMR)、气相色谱-串联质谱 (GC-MS/MS)、液相色谱-串联质谱 (LC-MS/MS) 等平台检测生物体氨基酸、脂肪酸、碳水化合物、维生素和脂类等内源性代谢产物[127-129]。代谢组学作为一种高通量、高灵敏度的分析方法,在完成样品检测工作后会产生大量数据,因此,研究人员常通过多元统计分析进行相关的数据处理工作[130]。具体来说,主要是基于主成分分析 (PCA)、偏最小二乘法-判别分析 (PLSDA)、正交偏最小二乘法-判别分析 (OPLS-DA) 等模式识别方法来筛查试验组间的差异代谢物,初步评估试验变量对生物体代谢谱的影响。最后,利用KEGG、人类代谢组学数据库 (HMDB) 等公共数据库解释差异代谢物的生物学功能,以进一步评估试验变量对生物体的分子作用机制[123]。
农药在引起蚯蚓代谢过程发生改变后,基于代谢组学技术可以阐述农药干扰蚯蚓特定代谢途径的具体机制[131]。Dani 等[24]利用1H NMR 分析平台,发现亚致死剂量的莠去津抑制了蚯蚓的整体代谢水平,并可诱导蚯蚓体内麦芽糖、延胡索酸、苹果酸、苏氨酸、谷氨酸、精氨酸、谷氨酰胺及ATP 等物质发生显著变化。同时,他们进一步指出,莠去津通过抑制蚯蚓ATP 的合成而扰乱其能量代谢[24]。Dani 等[130]借助主成分分析结果,发现蚯蚓在接触吡虫啉后代谢水平较对照组发生了显著改变,且该变化与吡虫啉暴露浓度无关;此外,基于谷氨酸、亮氨酸、异亮氨酸、苯丙氨酸及肌苷等代谢物水平的改变,表明吡虫啉影响了蚯蚓的糖异生以及ATP 的合成过程 。Mudiam[132]等利用GC-MS/MS 平台,借助多变量分析,研究了克百威 (carbofuran) 对蚯蚓的代谢扰动,发现经克百威暴露后,蚯蚓体内葡萄糖、半乳糖等糖类代谢物以及酪氨酸、缬氨酸、甘氨酸、丙氨酸、鸟氨酸、丝氨酸及苯丙氨酸等氨基酸类代谢物的相对含量表现出显著波动,证明克百威可以显著干扰蚯蚓的蛋白质和糖类代谢过程。Zhang 等[133]利用非靶向代谢组学,阐释了甲霜灵和精甲霜灵对蚯蚓代谢过程的选择性作用差异主要是由于精甲霜灵对蚯蚓三羧酸循环和尿素循环产生的干扰较甲霜灵大。根据一维和二维NMR 代谢组学研究结果,研究人员发现,硫丹及其代谢物硫丹硫酸盐可诱导蚯蚓体内谷氨酸循环代谢产物以及亚精胺发生显著波动,从而导致蚯蚓产生神经中毒和细胞凋亡[134]。为了明确氯氰菊酯对蚯蚓的代谢扰动,Ch 等[135]基于GC-MS/MS 代谢组学技术,发现氯氰菊酯可影响蚯蚓体内22 种代谢产物,导致蚯蚓神经元代谢发生明显变化,同时增加了糖原和脂肪酸的消耗,进而影响蚯蚓体内正常的生理生化过程以及诱导神经毒性。还有研究发现,氟啶虫胺腈激活了蚯蚓体内的能量代谢和尿素循环,但抑制了核苷酸的代谢,这一作用被认为是造成蚯蚓DNA 损伤的因素[117]。杨晓霞等[136]基于代谢组学研究发现,草甘膦暴露会导致蚯蚓糖酵解及三羧酸循环减弱,氨基酸代谢受损,嘌呤代谢紊乱,细胞渗透功能受损,对蚯蚓的正常生长产生明显毒副作用。总之,代谢组学可揭示农药暴露后蚯蚓体内代谢谱的波动,从而进一步明确了农药暴露对蚯蚓糖类、脂类代谢以及尿素循环等过程的潜在毒性作用机制 (表3)。
4.3 基于微生物组学的农药对蚯蚓致毒机制研究
蚯蚓的肠道是一个接近于厌氧状态的微环境,其中的菌群具有富集碳、氮、磷元素的能力[137],而农药的暴露胁迫与蚯蚓肠道菌群特征之间具有复杂的相互依赖性。宏基因组学是一种通过功能基因筛选或测序分析,研究特定环境中微生物的新方法[138],用于对样本中所包含的微生物基因组进行功能性和序列性的分析,其中,扩增子测序技术正逐渐成为环境微生物组学的主要研究手段[139]。目前,已有大量基于宏基因组学研究农药对蚯蚓肠道微生物结构和丰度影响的报道。Zhu 等[25]通过微生物组分析发现,蚯蚓肠道中变形菌门 (Proteobacteria)、厚壁菌门 (Firmicutes)、放线菌门 (Actinobacteria) 以及泉古菌门 (Crenarchaeota)的相对丰度随着氯丹 (chlordane) 暴露浓度的增大而升高,而浮霉菌门 (Planctomycetes) 和绿弯菌门(Chloroflexi) 的相对丰度则呈相反趋势;同时他们对蚯蚓肠道菌群进行遗传功能注释后,发现氯丹暴露会刺激蚯蚓的免疫功能,并使得蚯蚓体内蛋白质合成、硝酸盐转化以及葡萄糖、脂质和氨基酸的代谢过程发生改变。此外,Chang 等[140]的研究还发现,蚯蚓体内放线菌门下芽生球菌(Blastococcus)、诺卡氏菌 (Nocardioides)、节杆菌(Arthrobacter) 和放线菌 (Gaiella) 丰度的增加对于氟磺胺草醚 (fomesafen) 在蚯蚓体内的生物富集具有推动作用,而芽孢杆菌 (Bacillus)、微枝形杆菌(Microvirga) 及罗尔斯通菌 (Ralstonia) 丰度的减少则证明,蚯蚓在暴露于氟磺胺草醚后其代谢能力有所下降。基于纳米孔测序结果,研究人员发现,毒死蜱暴露后蚯蚓肠道菌群α-多样性和β-多样性发生了显著改变,其中蚯蚓肠道细菌群落受毒死蜱的影响较真菌群落更显著[141]。Astaykina等[142]基于宏基因组学分析,发现嗪草酮、吡虫啉和苯菌灵 (benomyl) 可以显著改变蚯蚓肠道菌群的结构与丰度,主要表现为变形菌门 、酸杆菌门(Acidobacteria)、浮霉状菌 (Planctomyces)、疣微菌门 (Verrucomicrobia) 及蓝菌门 (Cyanobacteria)
的相对丰度增加,而放线菌门的相对丰度降低。同时,该研究表明,放线菌门丰度的降低是蚯蚓代谢能力下降的因素之一,此外他们还鉴定出蚯蚓肠道中蚯蚓状肾杆菌属 (Verminephrobacter)、不动杆菌属 (Acinetobacter)、Candidatus udaeobacter及假苍白杆菌属 (Pseudochrobactum) 等细菌是对嗪草酮、吡虫啉和苯菌灵敏感的菌群[142]。最近的一项研究还发现,多菌灵会富集蚯蚓肠道中放线菌门下的特定菌群,且多菌灵暴露诱导了蚯蚓肠道内四环素类、利福霉素类和糖肽类抗生素抗性基因 (ARGs) 丰度的增加[143]。总体而言,目前从微生物角度阐明农药对蚯蚓毒理学影响的研究大多聚焦于农药暴露前后蚯蚓肠道微生物的组成与丰度变化,然后基于产生丰度差异的微生物类群,并结合现有的研究基础以阐述农药对蚯蚓的作用机理 (表3)。
5 总结与展望
农药进入土壤环境后,会对蚯蚓产生不同程度的影响,部分农药即使在较低浓度下也会对蚯蚓的生长、发育、繁殖等过程产生不同层次的毒性效应,对土壤生态环境具有潜在风险。现阶段,有关农药对蚯蚓的毒性研究主要集中于生长生殖毒性、遗传毒性、细胞毒性、神经毒性及氧化应激等方面 (图3)。依据此类研究数据,对于部分高残留、对蚯蚓高毒性农药的使用需进行严格规范的管理,以期进一步降低农药对蚯蚓的毒性影响。与此同时,目前针对农药对蚯蚓毒理学效应的研究仍然是片面的,迫切需要借助更多新的技术手段进行农药对蚯蚓毒理学效应的评估研究,并根据研究结果科学地评估相关农药的土壤环境风险。此外,组学技术在环境毒理学领域的应用为农药对蚯蚓致毒机制的探究作出了重大贡献,但组学技术在阐明其中相关机制的过程中仍有较大发展空间。转录组学虽然改变了传统的针对单个基因的研究模式,转而从转录水平上揭示部分农药对蚯蚓的毒性作用机制,但仍需进一步完善不同种类蚯蚓的基因组测序以及相关基因注释等工作,同时需要解决蚯蚓中相关蛋白mRNA的丰度与蛋白本身含量或活性的关系不一致等问题,以期为蚯蚓的基因功能分析以及农药对蚯蚓的致毒机制探究提供坚实的工具[144-145]。相较于其他组学技术,代谢组学技术虽然可以完整地反映出蚯蚓代谢水平的变化,但受制于检测技术,目前在研究中并无法真正实现对蚯蚓全部代谢物的检测以及对其代谢通路的精准定位[10]。更重要的是,单一的组学技术并不能完全阐述农药对蚯蚓的致毒机制,因而多组学技术在该领域的应用将是未来相关机制探究的主流手段。正如现阶段微生物组学的发展,便为多组学技术的应用提供了重要的发展思路。事实上,微生物组学囊括了宏基因组学、代谢组学等其他检测手段,可基于多种检测技术对蚯蚓肠道等微生物进行分析[146]。同样,突破单一组学技术的弊端,从代谢水平、转录水平、基因水平、蛋白质水平等其他层面综合进行探究,将组学技术进行有意义的结合,对于全面阐述农药对蚯蚓的致毒机制具有重要的现实意义。
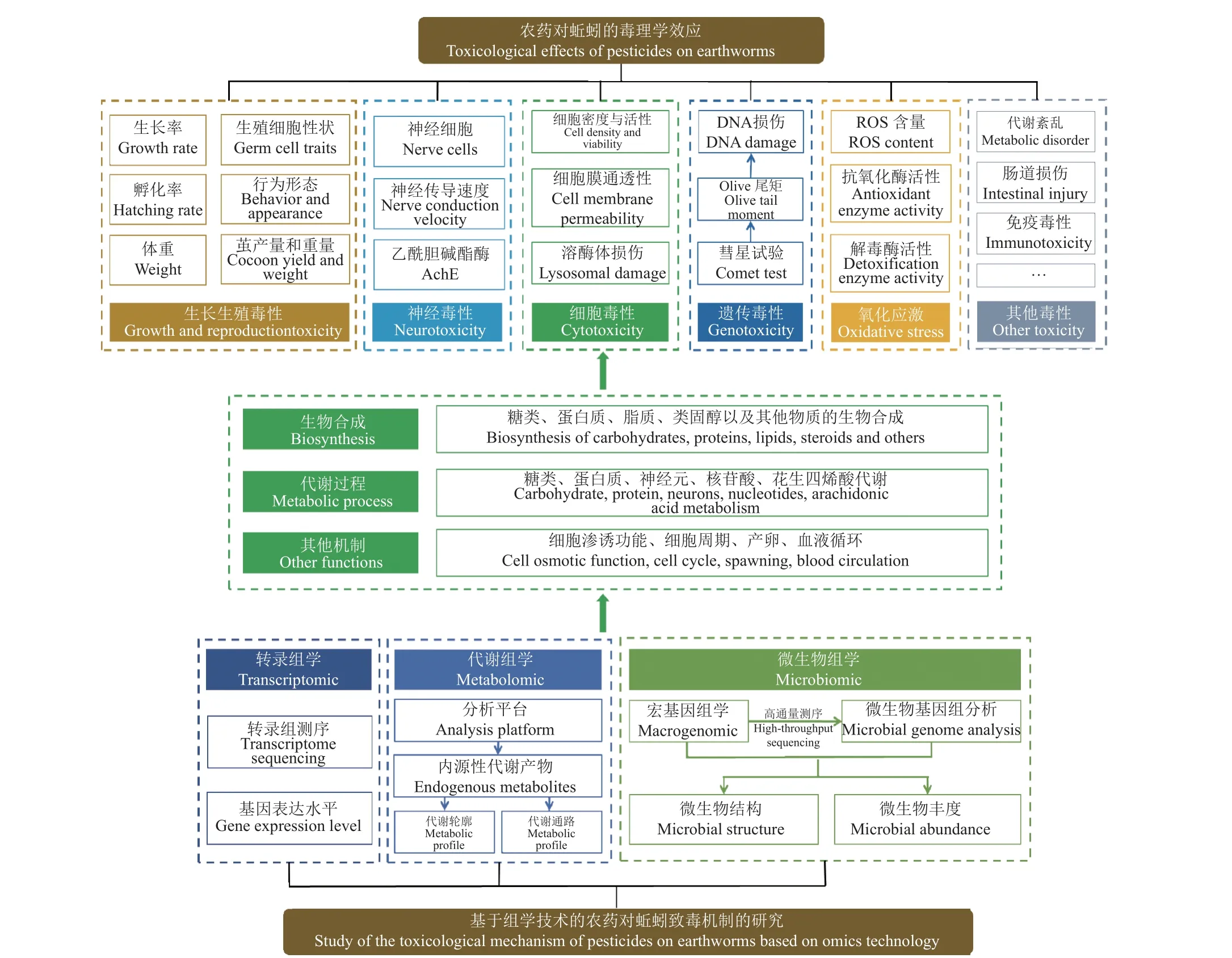
图3 基于组学技术的农药对蚯蚓致毒机制研究Fig.3 Study of the toxicological mechanisms of pesticides on earthworms based on omics technology
除此之外,虽然已有大量研究揭示了农药对蚯蚓的毒性效应,并利用组学技术初步探索了农药对蚯蚓的致毒机制,但现阶段有关农药对蚯蚓的毒理学研究仍集中于对单一农药毒性的评估,忽视了农业生产活动中实际用药的复杂性及其他诸多因素的影响。从农药使用层面而言,大多数研究都是将农药原药 (有效成分) 作为供试药剂来评估其生态环境风险,从而忽视了农药剂型中助剂等成分对蚯蚓的潜在毒性影响。此外,纳米农药具有提高农药利用率及生物活性、延长持效期等优势,成为近年来农药研究的热点[147],但其对蚯蚓的毒性效应等迫切需要进一步探究。从土壤污染层面而言,Shen 等[148]在中国太湖地区的土壤中检测出了Cd、Cr、Cu 等重金属与农药的共同残留;张俊丽等[149]在分析中国陕西省渭南市种植业面源污染现状时发现,2017 年当地农用地膜的回收率仅为47.9%,具有较大的土壤残留风险。因此,探明重金属、残留地膜等其他污染源与农药复合污染对蚯蚓的毒理学影响更具有实际意义[150-151]。现有研究已证实,聚苯乙烯微塑料会破坏蚯蚓肠道细胞,诱导蚯蚓产生氧化应激,并对其繁殖产生不利影响[152-153],除此之外,重金属作为土壤中另一重要污染源也会在蚯蚓体内富集,并对其肠道组织、抗氧化酶系统等产生影响[154-156],但目前关于农药与微塑料、重金属等其他土壤污染物共同暴露对蚯蚓毒性影响的研究仍较少,其对蚯蚓的复合毒性亟待进一步评估。因此,农药与其他土壤污染物的复合毒性评估及其机制探究将是未来农药土壤生态毒理学效应研究的重点及热点之一。
