Karrikins 类天然产物的全合成及其衍生物的生物活性研究进展
2023-06-20欧亚龙宋昌洋王美玲
欧亚龙, 罗 菊, 宋昌洋, 王美玲, 张 锐
(湖北文理学院 食品科学技术学院 • 化学工程学院,湖北 襄阳 441053)
1 背景介绍
20 世纪50 年代,科学家发现原始森林发生火灾后,某些植物的种子会迅速萌发。Brown 等认为森林大火产生的烟雾中可能存在一种或者多种可促进植物种子的萌发的化学物质[1]。2004 年,Flematti 课题组利用质谱 (MS) 和核磁共振波谱(1H NMR、13C NMR 和2D-NMR) 技术研究纤维素的燃烧产物,首次发现了Karrikinolide (KAR1,结构如图式1a 所示)[2],并通过单晶衍射进一步确认其结构[3]。截至目前,该家族共有6 个分子被成功鉴定,即KAR1-KAR6(图式1a),统称为Karrikins[4-5]。
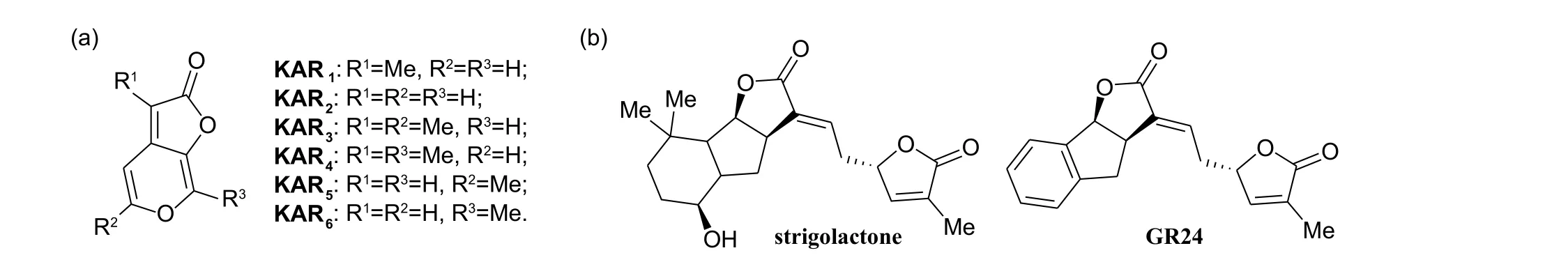
图式1 Karrikins 类天然产物、独脚金内酯及其衍生物GR24 的化学结构Scheme 1 Chemical structures of the Karrikins, strigolactone and its active analogue GR24
Karrikins 类天然产物作为一类植物信号分子,具有多种不同的生物及生理活性[2,6-9]。2004 年,Flematti 课题组首次发现KAR1可在低于10-9mol/L浓度下促进多种植物种子的萌发,比如Syncarpha vestita、Emmenanthe penduliflora、Nicotiana attenuata、C.aculeata和S.affine[2]。2014 年,Meijler 课题组发现Karrikins 类天然产物可调控根癌农杆菌Agrobacterium tumefaciens、绿脓杆菌Pseudomonas aeruginosa及哈维氏弧菌Vibrio harveyi等致病细菌的群体感应 (quorum-sensing,QS)[6],而细菌的群体感应在细菌的致病过程中发挥着重要作用,因此,Karrikins 类天然产物可作为潜在杀细菌剂[7]。此外,2020 年Wu课题组发现,Karrikins 类天然产物可显著提高乌桕Triadica sebifera的抗逆性能 (耐干旱和耐盐碱)[8],Antala等报道Karrikins 类天然产物可作为潜在的植物生长调节剂[9]。
Karrikins 类天然产物具有独特的化学结构和优异的生物活性,其化学全合成及其在植物体内的信号传导通路、作用机制研究已成为有机合成及植物分子生物学领域的研究热点。Karrikins 类天然产物与独脚金内酯 (strigolactone,结构如图式1b) 在化学结构、信号传导通路以及生物学功能方面具有一定的相似性[10]。在拟南芥中,Karrikins 类天然产物与独脚金内酯衍生物GR24(结构如图式1b) 几乎共用同一信号传导途径,即类胡萝卜素衍生的MAX/RMS/D 途径,均可促进植物种子的萌发[11-12]。但在连续红光照射下,只有Karrikins 能够促进幼苗的子叶生长,而GR24却并未表现出该类活性,说明Karrikins 类天然产物与独脚金内酯在光介导的信号转导途径上存在差异[13]。截至目前,已有多个课题组针对独脚金内酯及其类似物和Karrikins 类天然产物的信号传导途径的相同点及不同点进行了研究和综述[14-19]。基于此,本文将主要针对Karrikins 类天然产物及其衍生物的化学全合成和生物活性研究、应用拓展等方面进行综述,以期为Karrikins 类天然产物衍生物的进一步研究及相关农用活性化合物的发现提供参考。
2 Karrikins 天然产物的全合成
Karrikins 类天然产物具有呋喃并吡喃的核心骨架,其新颖的化学结构引起了合成化学工作者的关注。截至目前,已有7 例成功的全合成报道[20-26]。本文将根据合成路线中关环顺序的不同对Karrikins 类天然产物的化学全合成进行综述,以KAR1的合成为例,分别从先构建吡喃环再构建呋喃内酯环[20-22]、先构建呋喃内酯环再构建吡喃环[23-25]、呋喃内酯环和吡喃环同时构建[26]3 方面展开综述,同时对新近报道的产生KAR1的新途径进行总结[27]。
2.1 KAR1 的全合成
2.1.1 先构建吡喃环再构建呋喃内酯环 2005 年,Flematti 课题组以化合物1 为起始原料[28-29],经3 步化学转化,以10.3%的总收率完成了KAR1的首次全合成 (图式2)[20]。该路线中,化合物1 首先与2-氯丙酰氯 (2) 发生酯化反应,得化合物3(产率92%),随后经P2S5处理以51%的收率获得硫代化合物4,最后在Ph3P/AcONa 条件下对呋喃内酯关环,完成KAR1的合成,产率22%;同时,反应过程中也产生了少量thio-KAR1(图式2)。2014 年,Van Staden 课题组利用类似的合成方法制备了KAR1,获得其单晶结构,并测试了KAR1促进种子萌发的活性[30]。
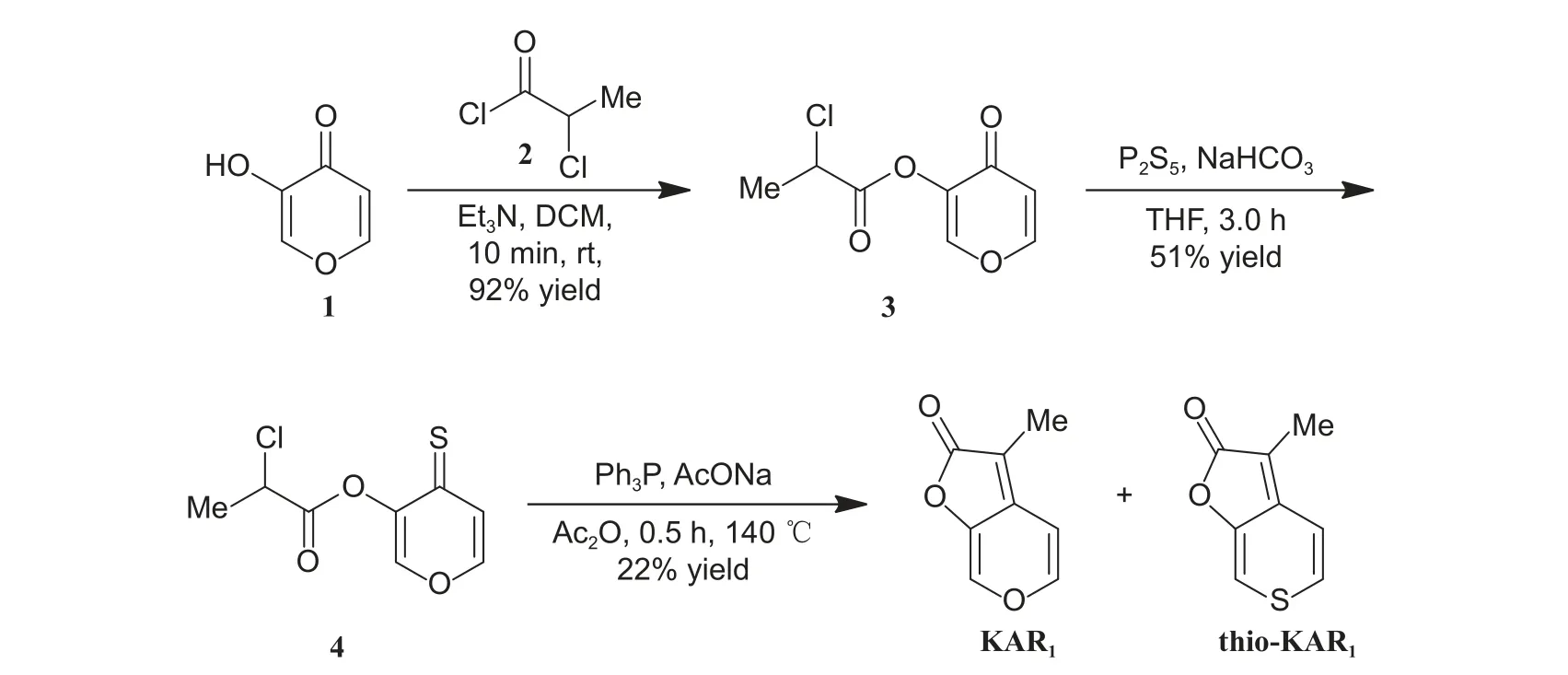
图式2 Flematti 课题组报道的KAR1 合成路线[20]Scheme 2 Synthetic route of KAR1 reported by Flematti group[20]
2008 年,Tanabe 课题组以呋喃-2-甲醇 (5) 为起始原料完成了KAR1的合成(图式3)[21]。首先,化合物5 经间氯过氧苯甲酸 (m-CPBA) 氧化、乙酰化保护,以82%的收率获得化合物6,随后经SnCl4催化的缩醛交换及催化氢化,以68%的收率获得化合物7。随后,化合物7 与甲基丙酮酸在TiCl4存在下经羟醛缩合反应,以47%的收率制备化合物8;再经三氟乙酸酐 (TFAA)/4-二甲氨基吡啶(DMAP)/1,8-二氮杂双环[5.4.0]十一碳-7-烯 (DBU)处理得烯酮中间体9。中间体9 无需分离直接经对甲苯磺酸 (p-TSA) 处理完成KAR1的合成 (收率45%)。整条合成路线最长线性步骤为8 步,总收率14.5%,其中,p-TSA 催化的分子内酯化反应构建呋喃内酯是该路线的关键步骤。

图式3 Tanabe 课题组报道的KAR1 合成路线[21]Scheme 3 Synthetic route of KAR1 reported by Tanabe group[21]
2011 年,Shindo 课题组报道了以D-木糖为起始原料,以Cu(II)催化剂17 催化的内酯化为关键反应的KAR1新合成路线 (图式4)[22]。该路线中作者首先以D-木糖为起始原料,经乙酰保护、溴代及消除反应 (Zn/CuSO4),成功合成化合物12 (3 步总收率65%)。化合物12 经MeONa 处理,脱除乙酰基得化合物13 (产率92%),再经重铬酸吡啶盐(PDC) 氧化羟基得酮14 (产率38%)。化合物14 与苯硫酚发生Michael 加成反应得化合物15。15 无需分离直接在催化剂16 存在下与化合物17 反应,得化合物18 (收率50%,d.r.= 1:1)。最后,化合物18 经N-溴代丁二酰亚胺 (NBS) 和偶氮二异丁腈 (AIBN) 处理,最后在对p-TSA 存在下发生消除反应,成功完成天然产物KAR1的合成,整条合成路线共9 步化学转化,总产率7.3%。

图式4 Shindo 课题组报道的KAR1 的合成路线[22]Scheme 4 Synthetic route of KAR1 reported by Shindo group[22]

图式5 Goddard-Borger 课题组报道的KAR1 和KAR2 合成路线[23]Scheme 5 Synthetic route of KAR1 and KAR2 reported by Goddard-Borger group[23]
2.1.2 先构建呋喃内酯环再构建吡喃环 2007 年,Goddard-Borger 课题组报道了第2 例以D-木糖为起始原料的KAR1及衍生物的合成方法 (图式5),并以合成过程中的关键中间体完成了多个KAR1衍生物的构建[23]。作者以D-木糖为起始原料,首先经缩环/丙酮叉保护得到化合物20 (收率85%),以TrCl 选择性保护伯羟基,以82%的收率获得化合物21[31],再经PDC 氧化得化合物22 (60%收率)。化合物22 发生Horner-Wadsworth-Emmons 反应得不饱和酯23 (产率79%,E/Z=1 : 19),再经三氟乙酸 (TFA) 和H2O 处理得内酯24a (收率83%)。化合物24a 经乙酰基保护及在碱性条件下的消除反应得化合物25 (89%,2 步反应)。化合物25 在Pd(PPh3)4存在下经氧化脱除乙酰氧保护基 (-OAc),以84%的收率得到KAR2。KAR2经甲酰化、硼烷还原转化得到天然产物KAR1(收率76%,两步)。整条合成路线的最长线性步骤为11 步,总收率15.7%。2022 年,Westwood课题组报道了以化合物24b 为起始原料合成KAR1的类似方法[32]。
2008 年,Xu 课题组以化合物27 为起始原料,经5 步化学转化,以15.5%的总产率完成了KAR1的合成新方法 (图式6)[24]。首先,化合物27 与28 反应获得化合物29,无需分离直接用HCl/THF 处理,可以60%的收率得化合物30。随后,化合物30 经TFA 处理关吡喃环,可顺利获得KAR2(产率32%)。KAR2经NBS 溴化得化合物31 (产率90%),最后在正丁基锂 (n-BuLi)/甲基硼酸存在下发生甲基化反应,成功完成KAR1的合成。
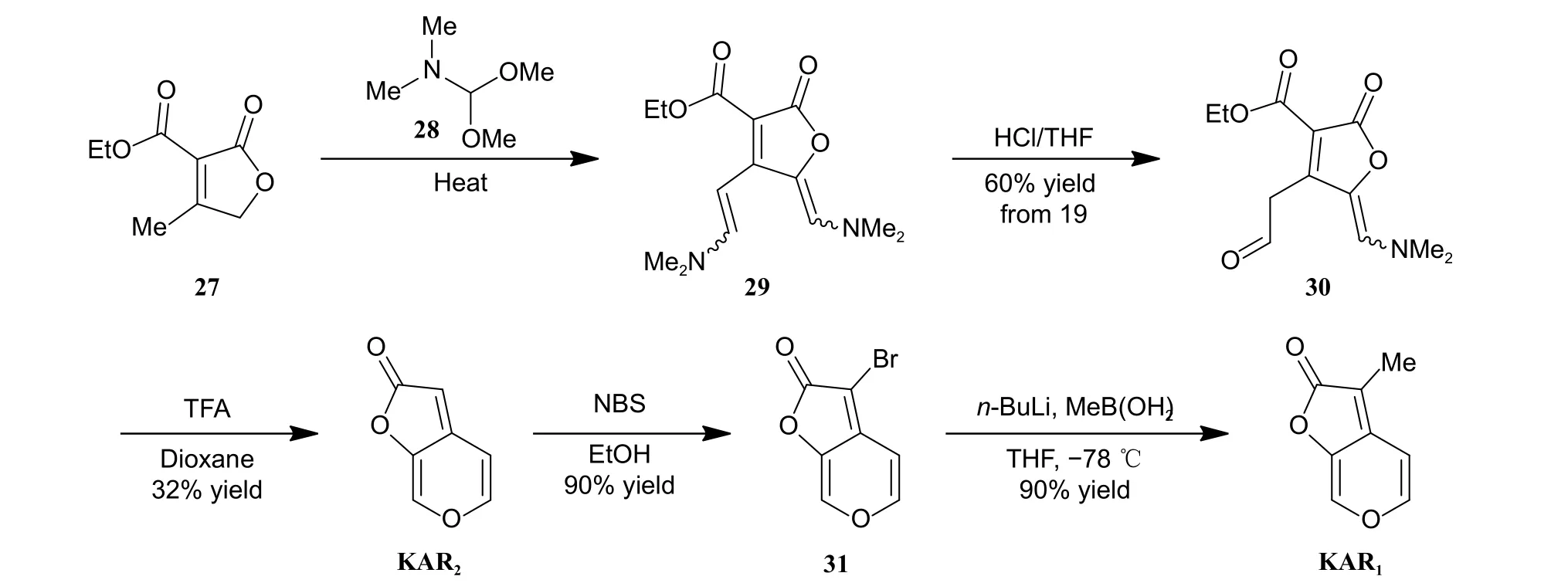
图式6 Xu 课题组报道的KAR1 的合成路线[24]Scheme 6 Synthetic route of KAR1 reported by Xu group[24]
2018 年,Mesmaeker 课题组报道了以金催化的环化异构化反应为关键步骤的KAR1新合成路线 (图式7)[25]。作者以化合物32 为起始原料,经溴化、溴化氢 (HBr) 促进的内酯化反应成功制备化合物33 (产率60%)。化合物33 经三氟甲磺酸酐(Tf2O) 处理,以80%的收率获得磺酸酯34,随后通过Sonogashira 偶联反应成功制备了化合物35(产率89%)。化合物35 与Bredereck 试剂 (36) 反应得化合物37 (收率87%),再经四丁基氟化铵(TBAF) 处理,脱除TBS 保护基,以67%的收率获得化合物38。最后以MeAuPPh3为催化剂,化合物38 发生分子内的烯炔环化异构化反应,以86% 的收率获得KAR1。整条合成路线仅7 步,总产率21.4%。
2.1.3 呋喃内酯环和吡喃环同时构建 2020 年,Hosokawa 课题组报道了一条以Aldol 类型的加成反应为关键步骤的KAR1简洁全合成路线 (图式8)[26]。以化合物39 为起始原料,首先与酰溴40 反应,可以99%的收率制备酯41;随后41 与42 发生两次连续的以硼试剂介导Aldol 类型的加成反应,成功制备了化合物43 (收率57%,2 步);最后,化合物43 分别与亚磷酸三乙酯、NaH 及p-TSA 反应,采用3 步1 锅法以59%的收率获得天然产物KAR1。整条路线仅需6 步反应,且仅中间体41 和43 需纯化,总产率高达33%。此外,作者还完成了KAR1的克级规模合成,证实了该条合成路线具有实用价值。
2.2 KAR1 的产生新途径——糖类化合物的燃烧
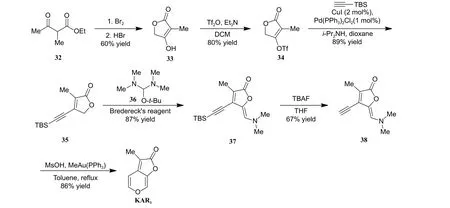
图式7 Mesmaeker 课题组报道的KAR1 合成路线[25]Scheme 7 Synthetic route of KAR1 reported by Mesmaeker group[25]
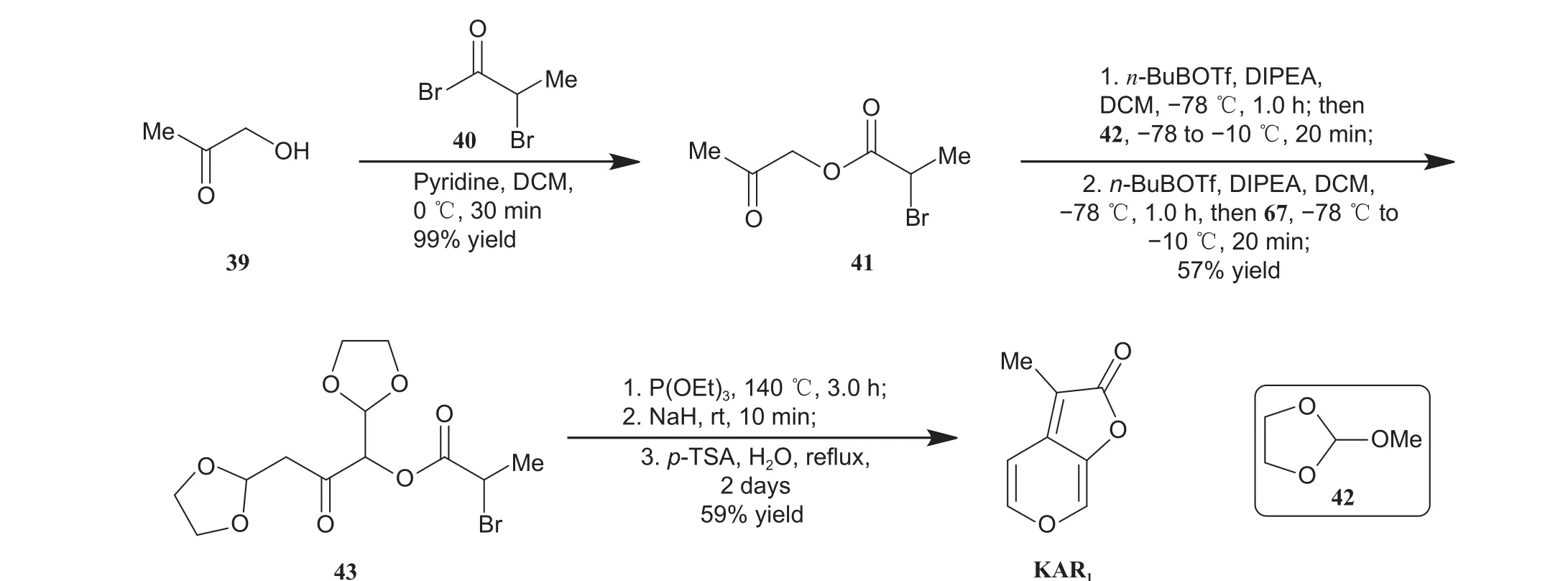
图式8 Hosokawa 课题组报道的KAR1 合成路线[26]Scheme 8 Synthetic route of KAR1 reported by Hosokawa group[26]
2011 年,Flematti 课题组发现,通过简单糖类化合物的燃烧可直接产生KAR1[27]。在该研究中,作者发现纤维素、天然葡萄糖和天然木糖充分燃烧后的提取物中均含有KAR1,其中木糖燃烧产生的KAR1最多为948 ng/2.0 g,而纤维素和D-葡萄糖燃烧可产生的KAR1分别为740 ng/2.0 g和302 ng/2.0 g (图1)。当向木糖中添加甘氨酸(0.6 g/2.0 g) 后,燃烧产物中KAR1的含量可提高至1012 ng/2.0 g。2010 年,Van Staden 课题组研究发现,植物燃烧提取物中存在抑制植物种子萌发的活性成分,可降低KAR1促进植物种子萌发的活性[33]。而Flematti 及其合作的研究发现:与单独的木糖燃烧提取物相比,添加L-甘氨酸后的木糖燃烧提取物抑制植物种子萌发的活性在一定程度上得到了降低[27]。

图1 不同糖类化合物燃烧产生KAR1 的数量分布图[27]Fig.1 KAR1 produced by the combustion of various carbonhydrates[27]
3 Karrikins 衍生物的生物活性
Karrikins 类天然产物具有优异的生物活性,其衍生物的设计、合成及相关生物活性研究引起了众多研究者的注意。截至目前,Karrikins 衍生物已被报道可用作种子萌发促进剂[34-35]、线粒体呼吸链抑制剂等[36]。另外,由于Karrikins 类天然产物在植物体内的作用机制未知,因此,基于Karrikins类天然产物的结构设计、合成探针分子以及用以研究其作用机制也有相关报道[37]。
3.1 KAR1 衍生物的设计合成及其促进植物种子萌发活性
2007 年,Flematti 课题组基于前期报道的KAR1合成路线[20],设计并合成了10 个KAR1衍生物 (图式9),并测试了所合成衍生物对Lactuca sativa Grand Rapids lettuce、E.penduliflora和S.orbiculatum种子萌发的促进活性[34]。测试结果显示:KAR3(5-Me-KAR1) 促进种子萌发的活性与KAR1相当,而KAR2(De-Methyl-KAR1)、KAR4(7-Me-KAR1)、KAR5以及KAR6的活性均出现了不同程度的降低,而化合物46 (6-Br-KAR4) 的生物活性与KAR4相当。最后,当氮原子取代吡喃环中的氧原子时,化合物47 和48 对供试种子均表现出优异的促进萌发活性。综上所述,KAR1结构中C-3 位甲基对其生物活性的保持至关重要,而C-7 位取代基的引入则对生物活性的保持或提升不利。后期,可将C-4 位和C-5 位作为修饰位点,继续进行结构修饰和优化。
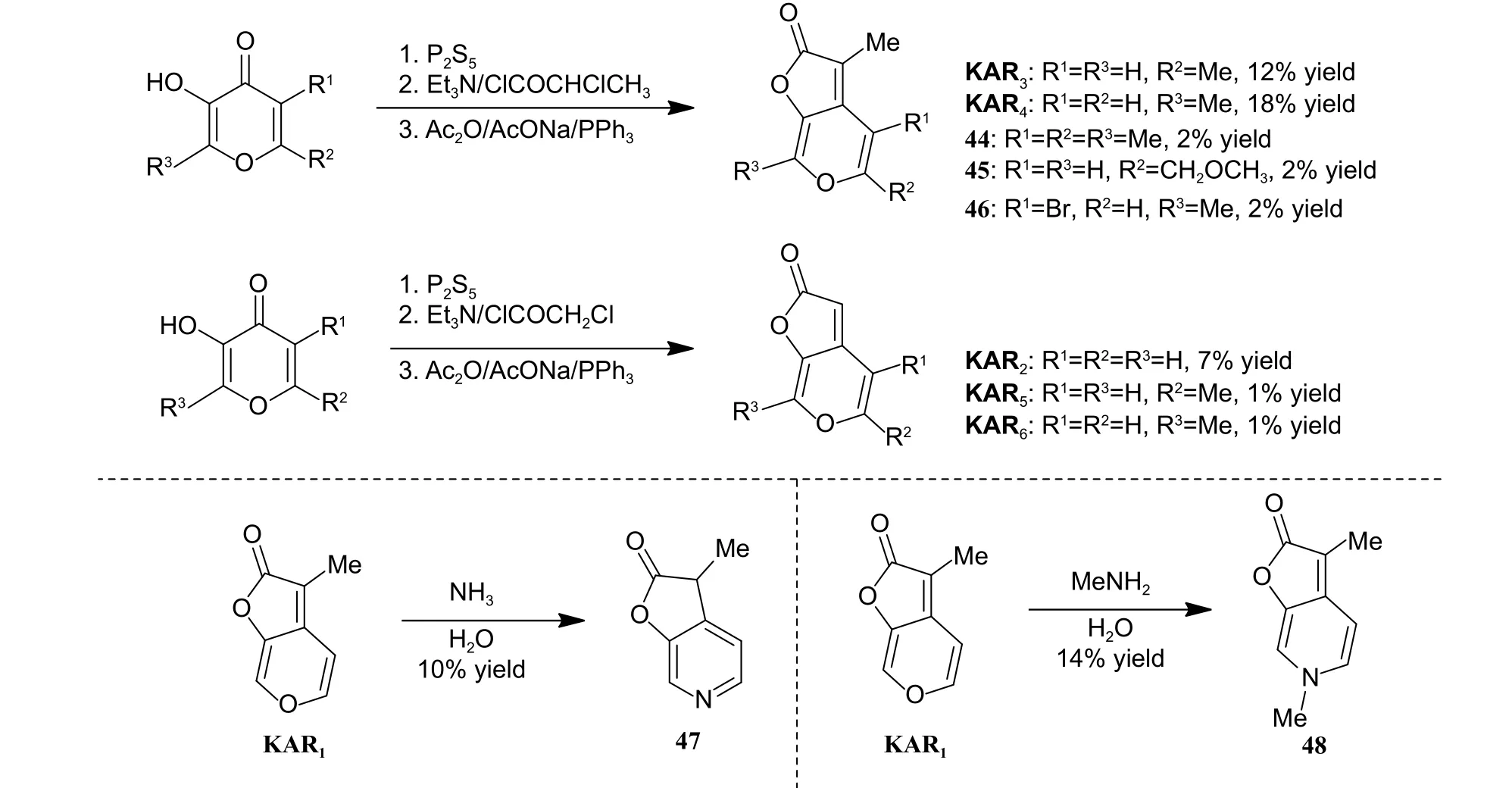
图式9 Flematti 课题组报道的KAR1 衍生物合成路线[20]Scheme 9 Synthetic route of KAR1 analogues reported by Flematti group[20]
2010 年,Flematti 课题组为进一步阐明KAR1的作用机制,对KAR1的C-3 位、C-4 位、C-5 位和C-7 位进行系统结构修饰,完善了KAR1的构效关系研究[35],相关衍生物的结构如图式10所示。
作者在KAR1的C-3 位分别引入烷基 (如Et、Pr)、含氧官能团 (如羟甲基、甲酰基、乙酰基等)、苯环、强吸电子基 (如 -CN、-NO2、-X 等)(图式10a) 时,所合成衍生物的生物活性与KAR1相比均出现大幅度下降,表明C-3 位甲基在后期开展KAR1的结构修饰时应予以保留。C-4 位修饰衍生物 (化合物KAR4、62 和63,图式10b) 的合成参考了Nagase 课题组报道的方法[21]。活性测试发现:化合物62 与KAR4的活性相当,而当C-4 位修饰为乙基时,化合物63 (合成路线如图式11 所示) 的生物活性几乎完全丧失,因此,作者未对C-4 位衍生物继续进行结构修饰和优化。
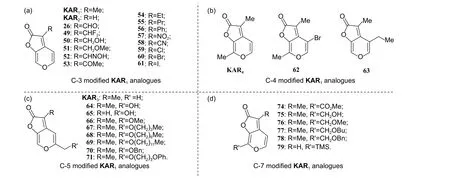
图式10 Flematti 课题组报道的KAR1 衍生物的化学结构[35]Scheme 10 Chemical structures of KAR1 analogues reported by Flematti group[35]
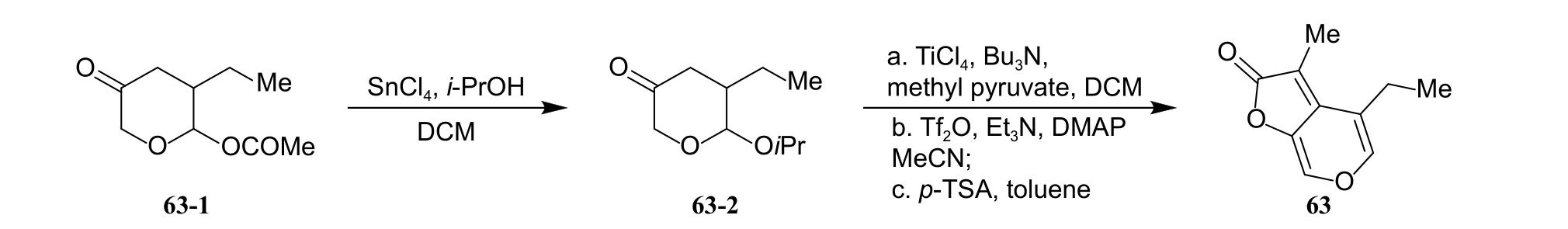
图式11 C-4 位修饰化合物63 的合成路线[35]Scheme 11 Synthetic route of compound 63 modified at C-4 position[35]
作者在KAR1结构的C-5 位主要引入羟甲基和长链烷基醚类结构 (图式10c)。活性测试结果显示:化合物64 和65 的生物活性基本丧失,说明亲水性官能团的引入对活性的保持不利。而醚类化合物66 (R′ = OMe) 活性较为优异,因此,作者后续制备了醚类衍生物67~71 (合成路线如图式12所示),其中仅化合物67 和70 在1 μg/L 的质量浓度下可有效促进种子萌发,而其他衍生物仅在高质量浓度 (> 100 μg/L) 下表现出部分促进种子萌发的活性。
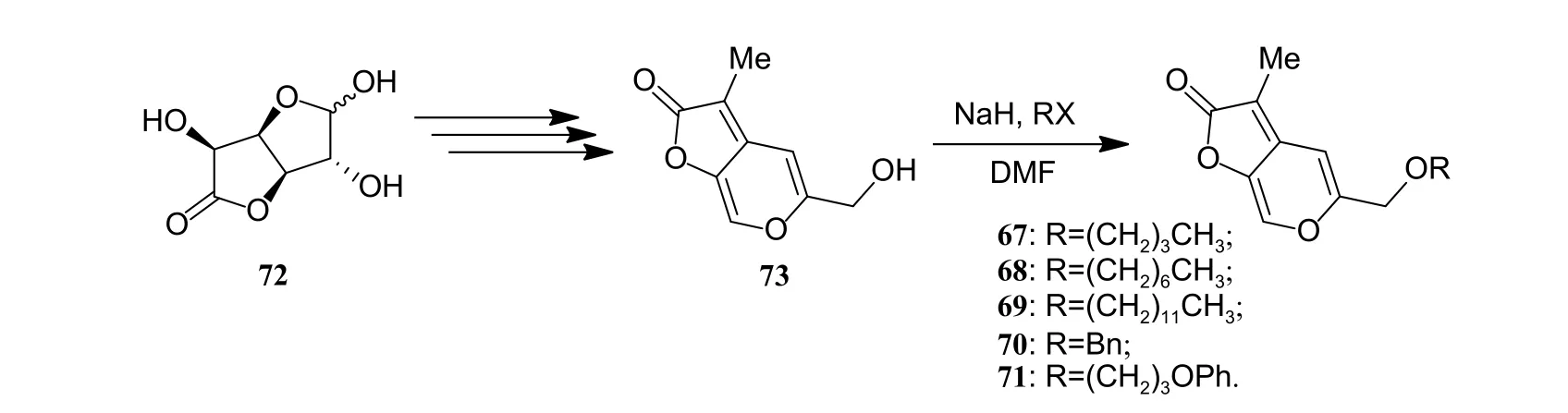
图式12 C-5 位修饰衍生物67~71 的合成路线Scheme 12 Synthetic route of analogues 67-71 modified at C-5 position
作者在对KAR1的C-7 位进行结构修饰时,前期发现化合物74 的生物活性优异[24]。进一步地,作者继续在C-7 位引入含氧和含硅官能团 (结构如图式10d 所示),完成了化合物75~79 的合成(合成路线如图式13 所示)。结果显示:化合物75~78 的生物活性与化合物74 相比出现了大幅度下降;而当C-7 位引入三甲基硅基 (trimethylsilyl,TMS) 时,衍生物79 的生物活性与KAR1相当,可作为先导结构进行继续研究[35]。
3.2 基于KAR1 结构的新型探针分子的设计、合成及相关生物活性
2011 年,Scaffidi 课题组为研究Karrikins 类天然产物的作用机制,设计并合成了5 个基于KAR1衍生物的探针分子80~84,13C-KAR1和3H-KAR1(结构如图式14 所示)[37]。结果显示:所设计的多数探针分子无法有效促进测试物种种子的萌发,仅化合物80 和82 (合成路线见图式15[37]) 在高质量浓度下 (> 100 μg/L) 对所测试植物种子萌发有促进作用。作者基于13C-标记D-xylose 制备的13C-KAR1(图式16a[23]) 和C-7 位3H 标记的3H-KAR1(图式16b)的生物活性与KAR1一致,可作为探针分子进行KAR1作用机制的研究。
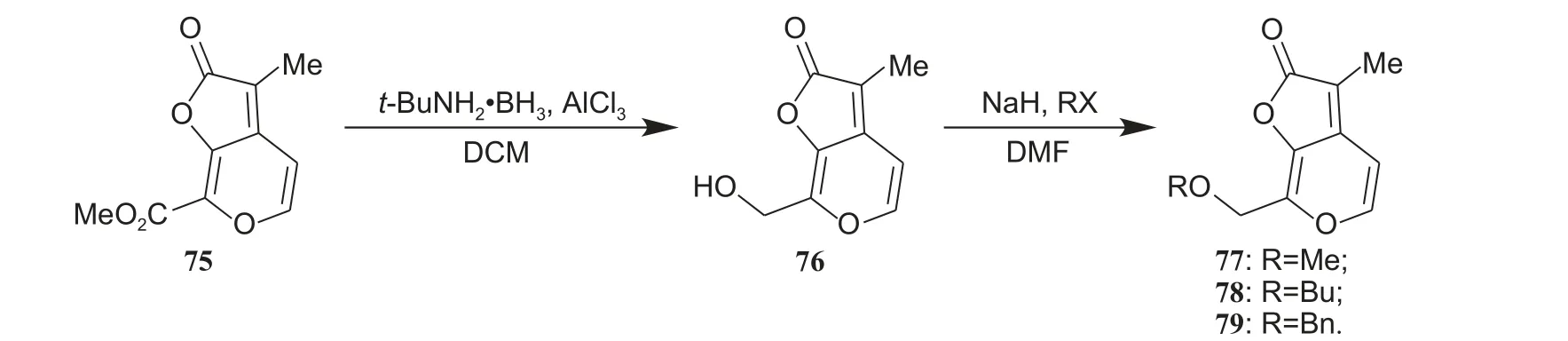
图式13 C-7 位修饰衍生物77~79 的合成[35]Scheme 13 Synthetic route of analogues modified 77-79 at C-7 position[35]
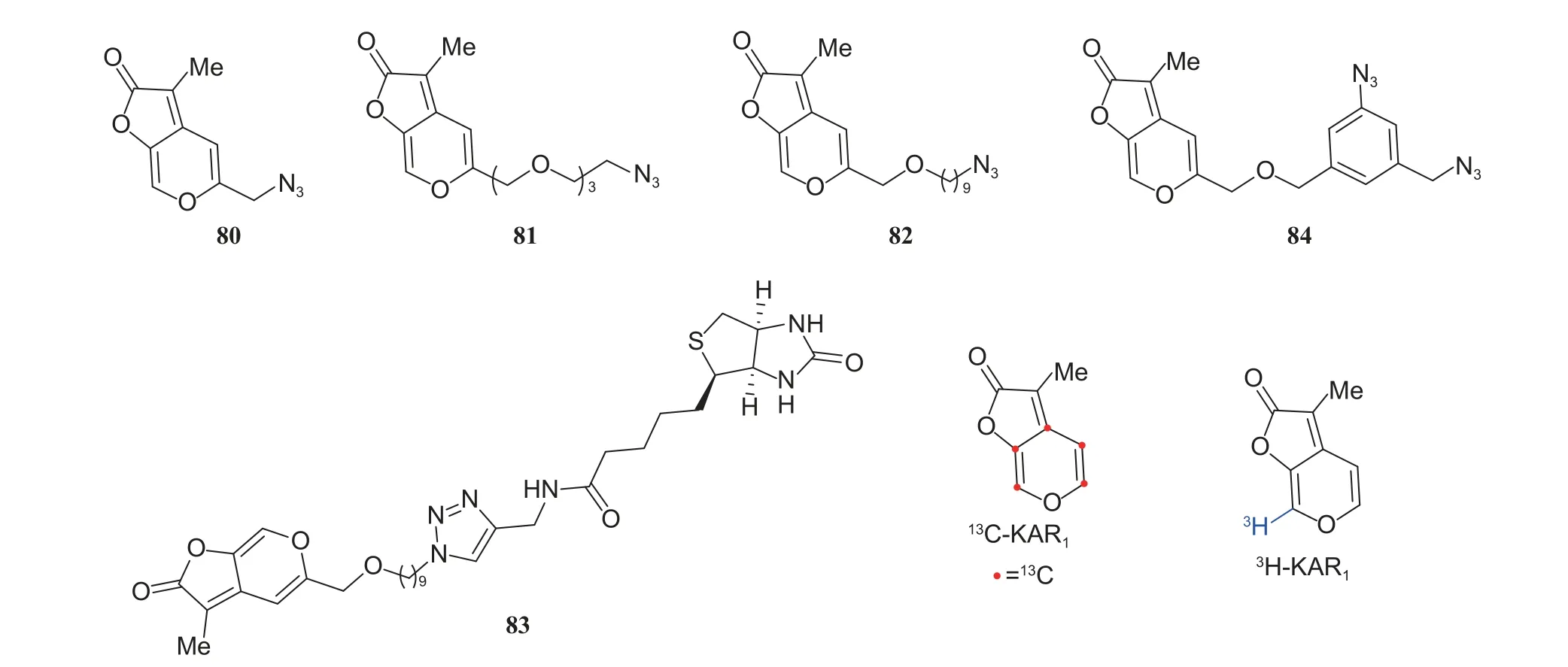
图式14 Scaffidi 课题组报道的KAR1 探针分子化学结构[37]Scheme 14 Chemical structures of the probes based on KAR1 reported by Scaffidi group[37]
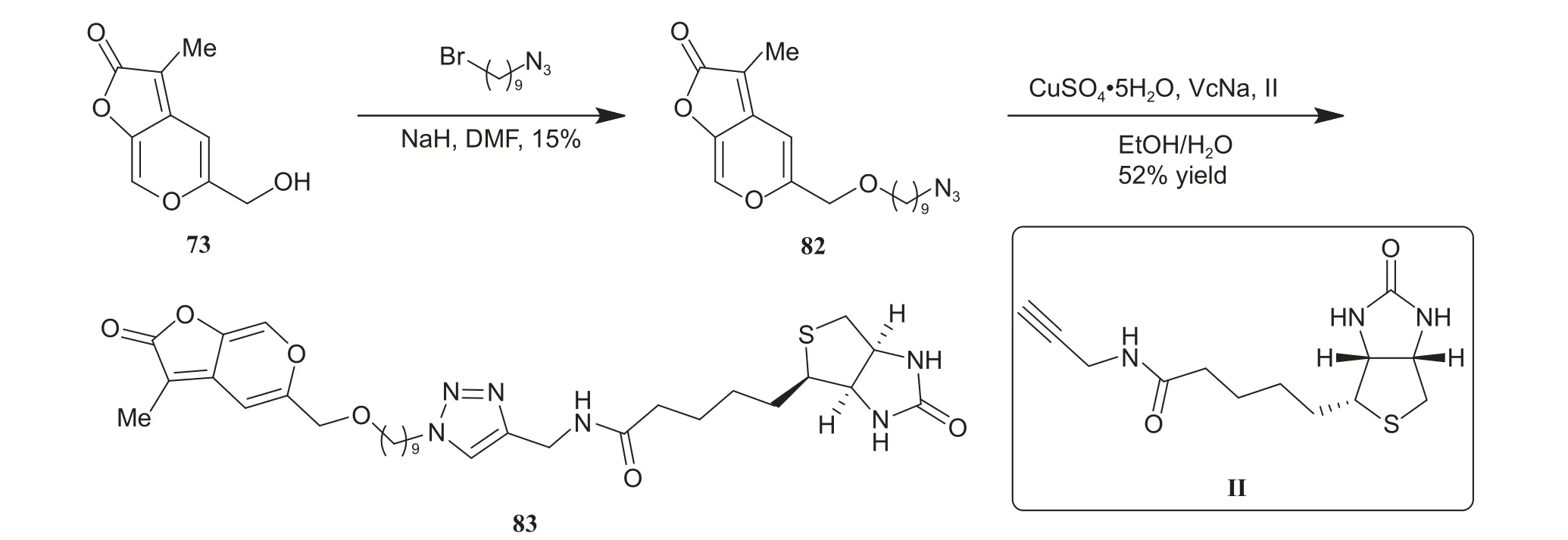
图式15 化合物82 和83 的合成路线[37]Scheme 15 Synthetic route of compounds 82 and 83[37]
3.3 其他生物活性
2016 年,Wu 课题组以天然产物KAR1为先导结构,设计并合成了一系列C-3 位修饰的KAR1衍生物,并测试所合成衍生物对琥珀酸-细胞色素还原酶 (succinate-cytochrome reductase,SCR) 的抑制活性[36]。该研究中,作者首先采用已报道的合成方法完成了KAR2和KAR1的制备[23]。随后,以KAR2为原料,经NBS 溴化,以75%的收率获得化合物85,最后与取代硼酸反应完成了16个KAR1衍生物 (86a~86p,合成路线见图式17[36])的制备。测试结果显示:天然产物KAR1和KAR2对SCR 无明显抑制活性,但当C-3 位引入取代苯环时,所合成衍生物对SCR 的抑制活性大幅提升,其中,化合物86f (R = 4-Bu-Ph) 活性最优,IC50为 (0.737 ± 0.011) μmol/L,优于商品杀菌剂吲唑磺菌胺,有进一步研究的价值 (表1)。
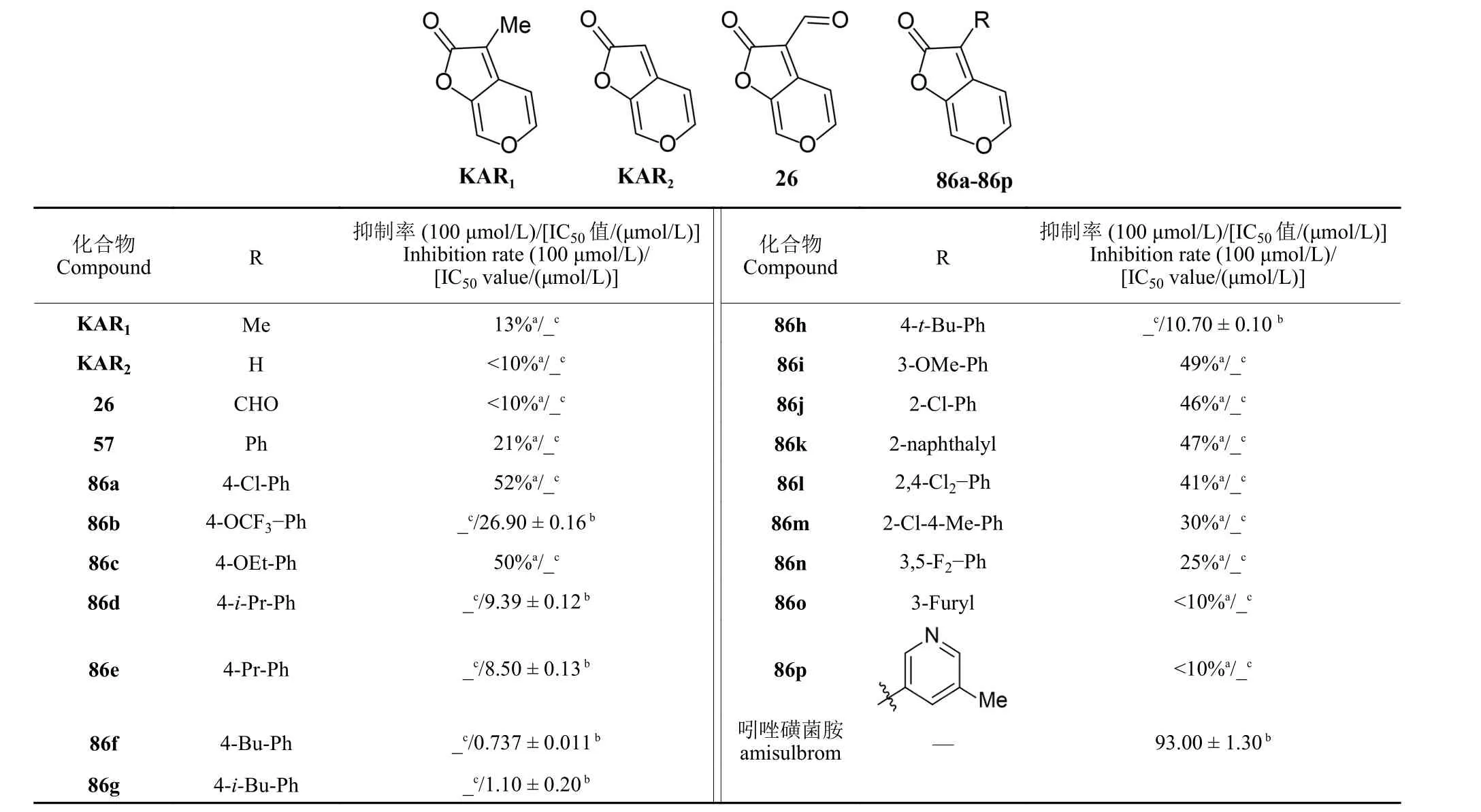
表1 KAR1 衍生物86a~86p 在100 μmol/L 下对SCR 的抑制活性[36]Table 1 Inhibitory activity of 86a-86p against SCR at 100 μmol/L[36]

图式16 13C-KAR1 和 3H-KAR1 的合成路线[37]Scheme 16 Synthetic routes of 13C-KAR1 and 3H-KAR1[37]
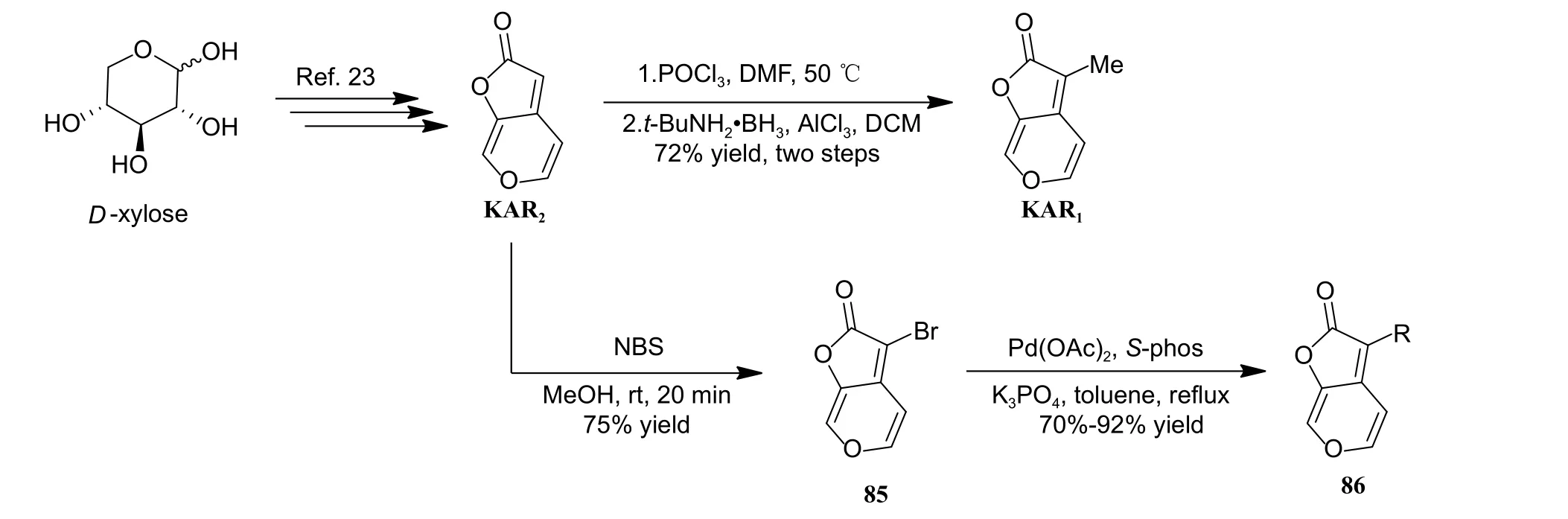
图式17 KAR1、KAR2 及其衍生物86 的合成路线[36]Scheme 17 Synthetic route of KAR1, KAR2 and their analogues 86[36]
2019 年,Van Staden 课题组发现KAR1、KAR3、Thio-KAR1以及衍生物49 对单胺氧化酶(monoamine oxidase, MAO, 包括MAO-A 和MAOB) 和乙酰胆碱酯酶 (acetylcholinesterase, AchE) 表现出中等水平的抑制活性 (表2)[38]。其中,化合物Thio-KAR1对MAO-A 和MAO-B 的抑制活性与阳性对照吗氯贝胺和司来吉兰活性相当;对AchE 的抑制活性优于阳性对照格兰他明,有进一步研究的价值。
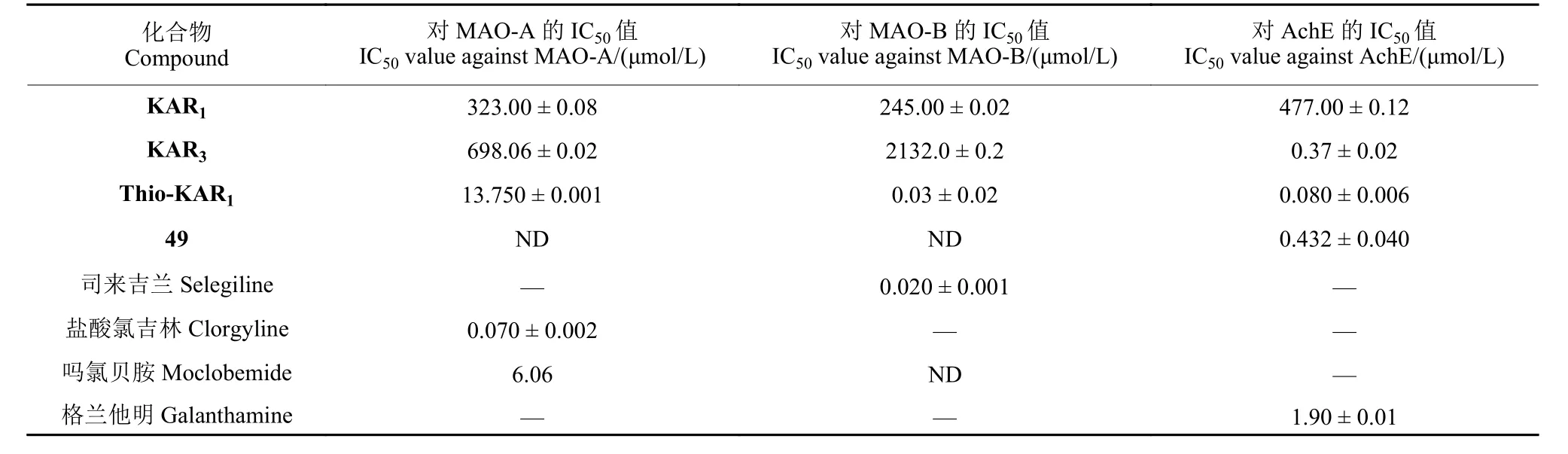
表2 KAR1、KAR3、Thio-KAR1 和化合物49 对单胺氧化酶和乙酰胆碱酯酶的抑制活性[38]Table 2 Inhibitory activity of KAR1, KAR3, Thio-KAR1 and 49 against MAO-A, MAO-B and AchE[38]
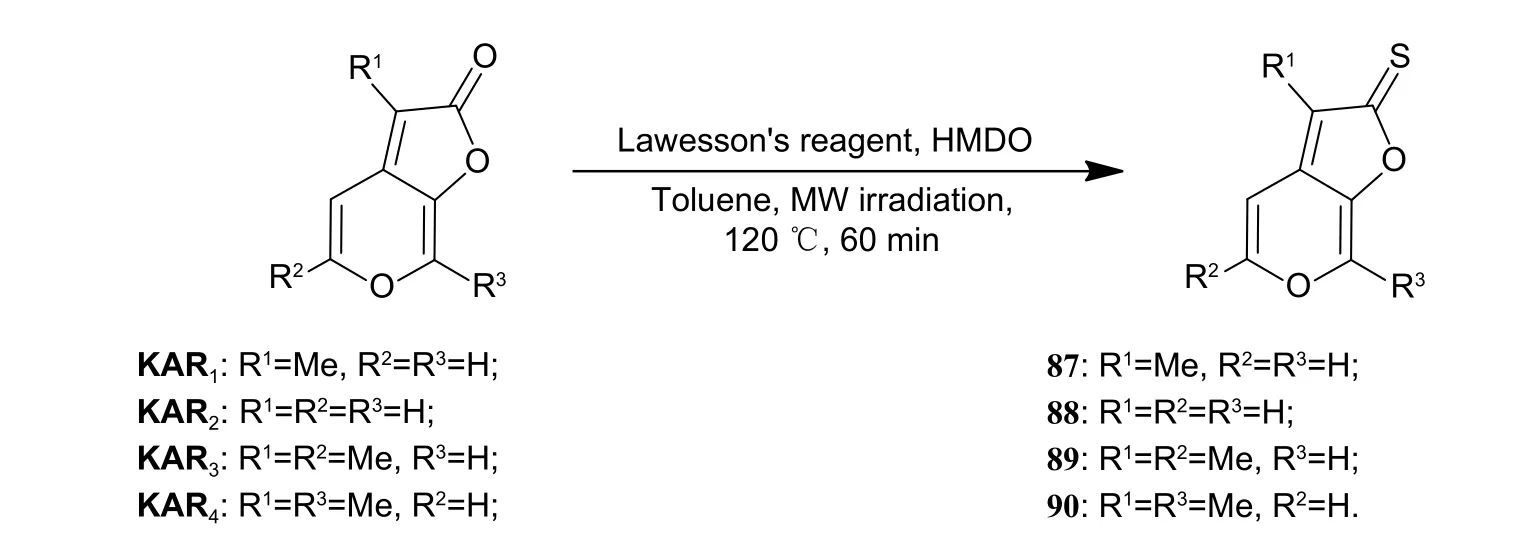
图式18 C-2 位硫代Karrikins 衍生物88~91 的合成[39]Scheme 18 Synthetic route of C-2 thiones of Karrikins 88-91[39]
虽然Van Staden 课题组首先发现Thio-KAR1具有神经保护活性,可对MAO-A/B 和AchE 表现出优异的抑制活性,但样品来源于Karrikins 衍生物合成过程中的副产物,并且并未报道Thio-KAR1的合成方法。因此,2022 年Pošta 课题组以商业可得的原料完成了C-2 位和/或C-6 位硫代Karrikins衍生物的合成,其中包括化合物Thio-KAR1,相关衍生物的合成路线如图式18[39]、图式19[39]和图式20[39]所示。随后,作者用所合成的硫代目标化合物对AchE 的抑制活性进行了测试。结果发现;仅KAR3和Thio-KAR1对AchE表现出中等水平的抑制活性[IC50值为(0.08 ± 0.006) μmol/L],其他硫代Karrikins 衍生物未对AchE 表现出明显生物活性 (表3)[39]。

表3 C-2 和/或C-6 位硫代Karrikins 衍生物对AchE 的抑制活性[39]Table 3 Inhibitory activity of C-2 and/or C-6 thiones of Karrikins analogues against AchE[39]
4 总结及展望
自2004 年Karrikins 类天然产物KAR1的结构被成功解析,该类天然产物的全合成、衍生物的设计制备及相关生物活性研究已取得了重要进展。本文对Karrikins 类天然产物的发现、结构鉴定、化学全合成及相关衍生物的设计制备、生物活性研究进行总结、综述,期望能够对该类天然产物的后续研究提供帮助。
目前,有关Karrikins 类天然产物的研究仍然有许多问题值得进一步研究和阐明:首先,Karrikins类天然产物自发现至今已超过15 年,但其生源合成途径和作用机制依然未知,而生源合成途径的阐明对研究该类天然产物的作用机制至关重要;其次,Karrikins 类天然产物对一些植物种子可表现出促进萌发效应,却对另外一些植物种子的萌发表现出抑制作用,阐明该现象产生的根本原因对拓展Karrikins 类天然产物的应用意义重大;再者,Karrikins 类天然产物新应用的发现及其作用机制的研究。目前已有研究表明Karrikins 可提升特定作物的抗逆性能 (耐干旱和耐盐碱),这对于减弱干旱或高盐碱等胁迫对作物的不利影响、拓宽作物的种植范围、提升作物产量具有重要意义。
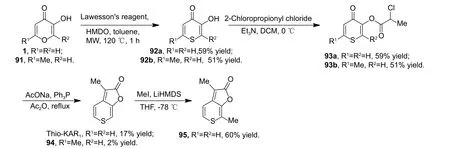
图式19 Karrikins 衍生物Thio-KAR1、94 和95 的合成路线[39]Scheme 19 Synthetic route of Karrikins analogues Thio-KAR1, 94 and 95[39]

图式20 Karrikins 衍生物97~100 的合成路线[39]Scheme 20 Synthetic route of Karrikins analogues 97-100[39]
