不同条件下羊栖菜溶解有机碳(DOC)分泌特征
2023-06-20周庆澔许曹鲁
周庆澔,许曹鲁,权 伟
(1.温州市洞头区农业农村局,浙江 温州 325700;2.浙江安防职业技术学院,温州市自然灾害遥感监测预警重点实验室,浙江 温州 325016;3.温州科技职业学院,温州市农林渔生态系统增汇减排重点实验室,浙江 温州 325006)
大型藻类是海洋生态系统中非常重要的初级生产者,因藻体含有叶绿素a而能进行光合作用,把二氧化碳(CO2)固定在藻类体内[1]。近年来,从海洋产业绿色发展、碳达峰、碳中和、碳汇渔业、碳汇交易、碳汇市场到蓝色粮仓,碳汇理念及相关研究不断深入,近海养殖大型藻类的碳汇能力得到了越来越多的关注和研究[2-5]。在光暗交替的养殖周期内,海藻养殖最终降低了溶解无机碳(Dissolved inorganic carbon,DIC)浓度,能够促进大气CO2向海水转移[6]。作为海洋碳系统的两种主要的存在形态之一,DIC也是海洋碳循环和全球碳循环中极其重要的一部分[7]。海藻通过光合作用,将大气中的CO2转化为海藻藻体中所含的碳及把海洋中的DIC转化为溶解有机碳(Dissolved organic carbon,DOC),同时海藻还会通过复杂的生化过程,将部分固碳量以DOC的形式转移到水体或沉积物中[8],导致在计算大型藻类的固碳能力过程中,此部分DOC常被漏算了,对核算大型藻类的碳汇量造成偏差。许多研究者在研究中得出,大型海藻的DOC释放量跟藻种和水动力场等环境要素有关,而释放量大小不等,最大释放量差值可达30%~40%[9]。此外,大部分研究表明:一般情况下DOC的释放量小于5%[10-11]。在固碳的同时,大型藻类向水体中分泌的DOC未能被准确计算,是目前导致精确核算大藻渔业的碳汇量及全球碳收支结果不确定性的主要原因之一。
大型经济褐藻羊栖菜(Sargassumfusiforme)具有较高的经济、生态、营养、药用等价值[12-13]。我国在大型藻类DOC释放方面的研究较少,仅有少量关于浮游植物分泌DOC的报道[14-18]。徐智广等[19]研究了温度、光照强度和营养史对羊栖菜无机磷吸收的影响以及孙圆圆等[20]研究了温度对羊栖菜生长的影响,结果表明羊栖菜生长的最适温度为 14.0~21.6℃,光合作用的适宜承温约为 15~25℃,以 20℃为最适承温;在饱和光照强度以内,适宜光照强度为(0.4~3.0)×104lx,最适光照强度为(1.0~3.0)×104lx[21]。此外,赵越剑[22]研究了阳光紫外辐射对羊栖菜生长速率的影响;高光等[23]研究了阳光紫外辐射对褐藻羊栖菜生长和光合作用的影响。
有关羊栖菜生长影响因素、营养盐固定能力等方面的相关研究较多,但未见不同水环境因子对羊栖菜分泌DOC的影响报道。因此,通过研究光照强度、盐度、pH、水体中总无机氮浓度、水体中总磷酸盐浓度对羊栖菜小苗分泌DOC的影响,为精确核算大型海藻的渔业碳汇能力、探索浅海“遗漏的碳汇”及深入了解大型海藻养殖的碳汇生态学提供参考。
1 材料与方法
1.1 实验材料
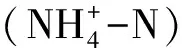
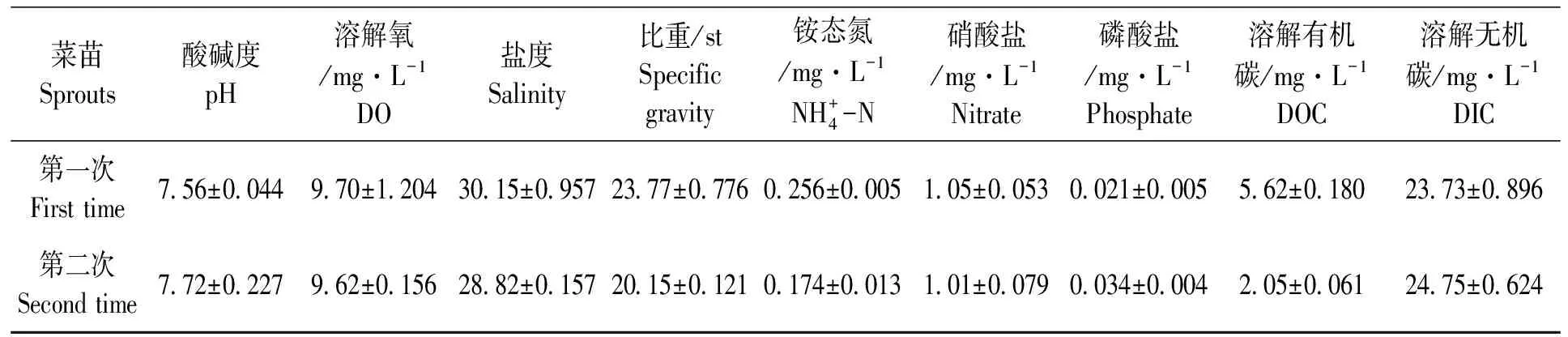
表1 海水基本理化参数背景值
1.2 实验方法
1.2.1 不同生长阶段对羊栖菜DOC分泌的影响实验
养殖实验在温州科技职业学院园林与水利工程学院组培室内进行。实验设置小苗、中苗、大苗3个样品组及空白对照组,每个样品组设置4个重复,空白组设置2个重复。小苗取完整的藻体,中苗、大苗羊栖菜取侧枝,分别将其放入透明广口玻璃瓶,加入250 mL海水,高温高压灭菌;不加羊栖菜只加海水的广口玻璃瓶作为空白对照。
1.2.2 不同光照强度对羊栖菜小苗DOC分泌的影响实验
将羊栖菜小苗放入盛有250 mL海水的透明广口玻璃瓶内养殖。光照强度设置了500、1 700、2 800、4 400 lx四个梯度,光暗交替48 h(光照12 h+黑暗12 h循环)。环境温度为25℃,相对湿度为28.6%。自培养瓶放入光照环境下开始计时,实验结束时立即用0.45 μm玻璃纤维滤膜进行抽滤,利用岛津TOC-LCPH总有机碳分析仪对所得滤液进行DOC、DIC浓度测定。光照养殖实验之后,将养殖的羊栖菜放入烘箱内,在80℃下烘烤24 h至恒重,再称干重(Dry weight,DW)。
1.2.3 不同盐度、pH、营养盐对羊栖菜小苗DOC分泌的影响实验
取完整的羊栖菜小苗,放入透明广口玻璃瓶,加入250 mL海水,光暗交替养殖48 h(光照12 h+黑暗12 h循环),光照养殖光源为日光灯,实验光照强度为2 800 lx,温度为 23.1℃,相对湿度为29%。1)盐度设置了10、20、30(原海水)、40、50共计5个梯度,10、20盐度的调节采用纯水稀释,40、50盐度通过添加分析纯NaCl进行调节。2)pH设置了5、6、7、8(原海水)、9共计5个梯度,分别用1.0 mol/L HCl和1.0 mol/L NaOH调节。盐度、pH均采用英国AQUAread Ap 2000水质分析仪进行测定。3)水体中总无机氮浓度设置了0.5、1.0(原海水)、2.0、5.0、10.0 mg/L共计5个梯度,通过纯水稀释或添加硝酸钾进行调节。4)水体中总磷酸盐浓度设置了0.01、0.02(原海水)、0.06、0.18、0.38 mg/L共计5个梯度,通过纯水稀释或添加磷酸二氢钾进行调节。
1.2.4 指标的测定与计算
DOC分泌速率、DIC固定速率、DOC分泌量占固碳量的比例的计算及指标说明参考文献[24]。
DOC分泌速率指一定质量羊栖菜在一定时间内引起的水体中DOC含量的变化,计算公式:RDOC[mg/(kg·h)]=(Ct-C0)×V/(DW×t),式中Ct是t时加羊栖菜的光合作用瓶内DOC的浓度(mg/L);C0是无羊栖菜的空白对照瓶中DOC的浓度(mg/L);V是水体体积(L);DW是羊栖菜的干重(kg),t是处理时间(h)。
DIC固定速率指一定质量羊栖菜在一定时间内引起的水体DIC含量的变化,计算公式:RDIC[mg/(kg·h)]=(C0’-Ct’)×V/(DW×t),其中Ct’是t时加羊栖菜的养殖瓶内水体DIC的浓度(mg/L);C0’是无羊栖菜的空白对照瓶中DIC的浓度(mg/L);V是水体体积(L);DW是羊栖菜的干重(kg);t是处理时间(h)。
DOC分泌量占固碳量的比例(P)指在一定时间内DOC变化浓度占DIC变化浓度的百分比例,计算公式:P=RDOC/RDIC×100%。
1.3 统计分析
在Excel 2003中对数据进行计算并作图;统计分析使用SPSS 17.0软件;不同品系羊栖菜各指标之间的差异性采用配对样本T检验法进行分析;不同处理时间、光照强度各指标之间的差异性采用单因素方差分析法进行分析。
2 结果与分析
2.1 生长阶段对羊栖菜DOC分泌的影响
实验结果(图1、图2)显示:1)大苗羊栖菜DOC分泌速率为132.58 mg/(kg·h);中苗羊栖菜最高,达141.20 mg/(kg·h);小苗羊栖菜最低,为67.33 mg/(kg·h)。2)小苗羊栖菜DIC固定速率最高,为125.03 mg/(kg·h);其次为大苗羊栖菜100.6 mg/(kg·h);最低为中苗羊栖菜39.39 mg/(kg·h)。3)中苗羊栖菜较高的DOC分泌速率和较低的DIC固定速率,使得中苗羊栖菜DOC分泌量占固碳量的比例最高,依次为中苗(382.54%)>大苗(130.64%)>小苗(45.99%)。分析原因可能是中苗羊栖菜生长迅速,生理活动旺盛,因而DOC分泌量较大。
2.2 光照强度对羊栖菜小苗DOC分泌的影响
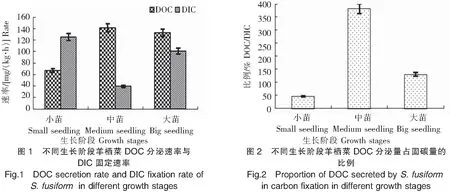
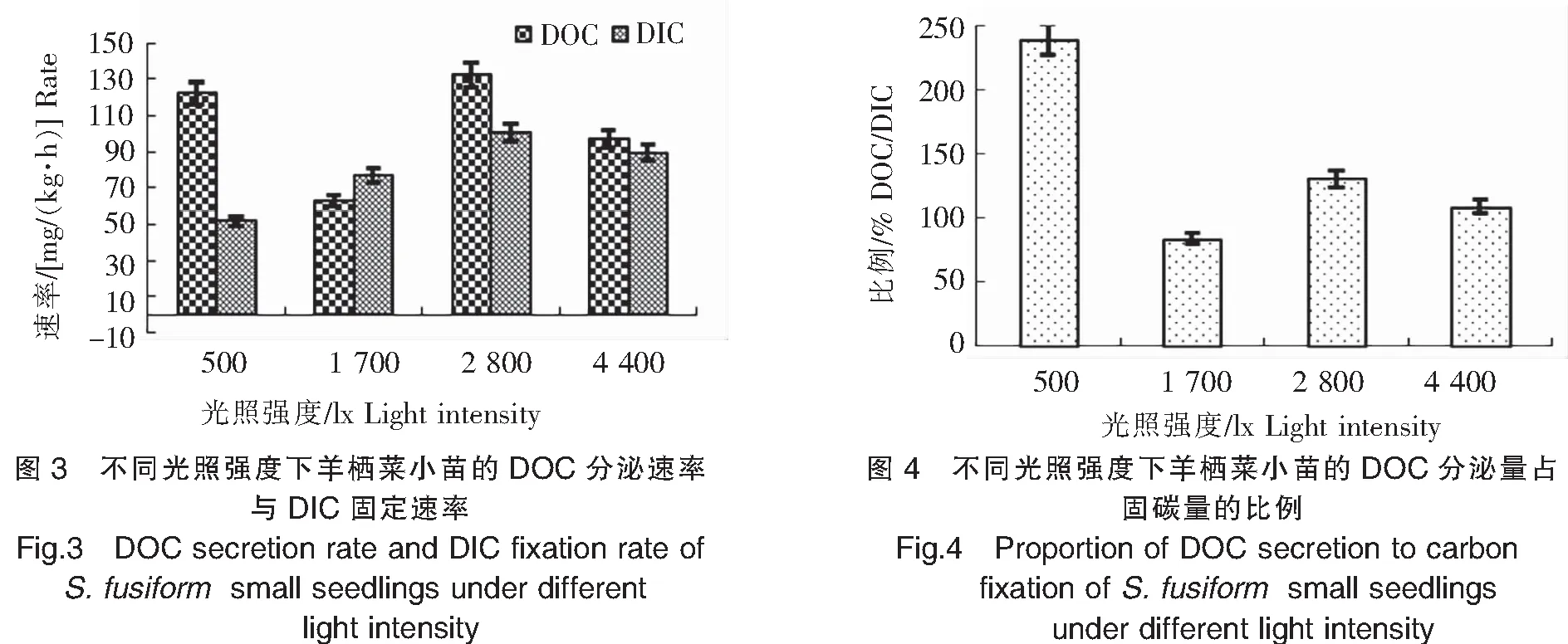
实验结果(图3、图4)显示:1)羊栖菜小苗DOC分泌速率在2 800 lx光照强度下最高,达132.58 mg/(kg·h);1 700 lx光照强度下最低,为62.65 mg/(kg·h);在500 lx低光照强度条件下,仍有较高的DOC分泌速率,为122.76 mg/(kg·h)。2)羊栖菜小苗DIC固定速率在低光照强度500 lx条件下最低,为51.62 mg/(kg·h);随光照强度的增加先升高后下降,在2 800 lx光照强度下最高[100.60 mg/(kg·h)],在4 400 lx光照强度下降低至89.41 mg/(kg·h) 。这可能是4 400 lx光照强度对羊栖菜小苗光合作用产生了抑制,导致其DOC的分泌速率和DIC固定速率均下降。3)在低光照强度500 lx条件下,羊栖菜小苗DOC分泌量占固碳量的比例最高,达239.02%;1 700 lx光照强度下最低,为83.48%。结果表明,2 800 lx光照强度有利于羊栖菜小苗DOC的分泌和DIC的固定。
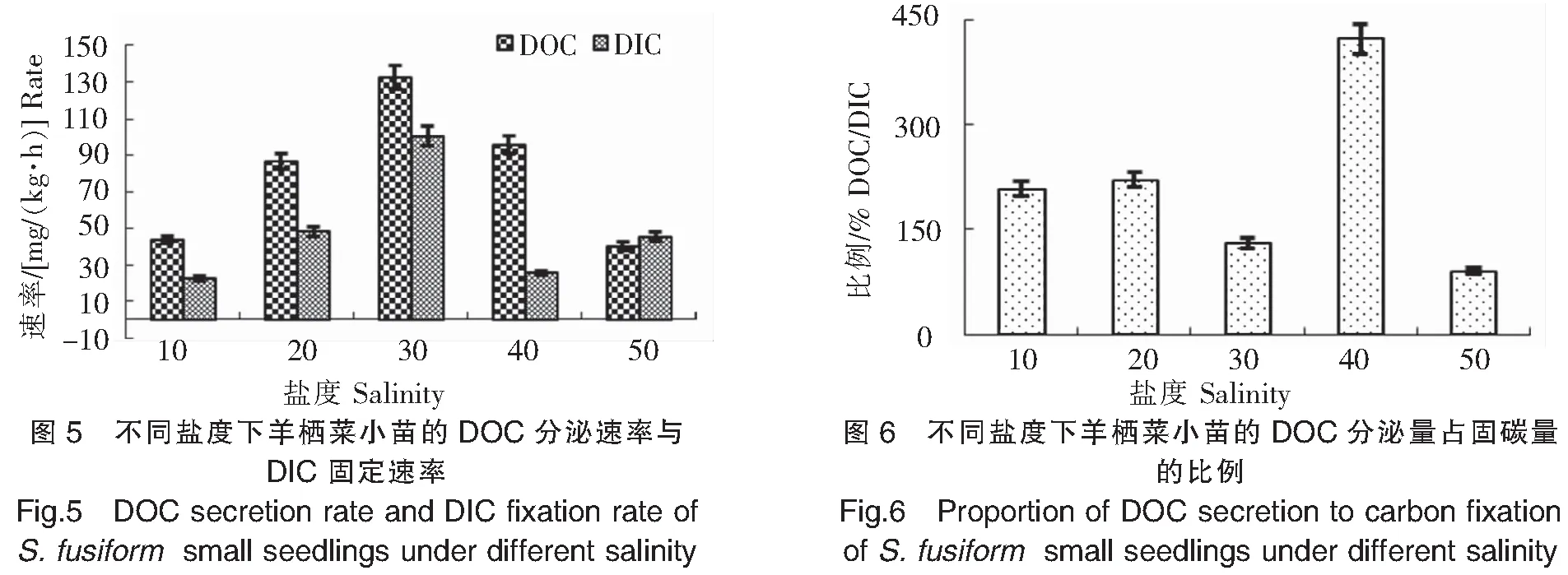
2.3 盐度对羊栖菜小苗DOC分泌的影响
实验结果(图5、图6)显示:1)羊栖菜小苗DOC分泌速率在10盐度下为43.61mg/(kg·h),随盐度增加先升高后下降,在30盐度下最高[132.58 mg/(kg·h)],在50盐度下最低[40.18 mg/(kg·h)]。2)羊栖菜小苗DIC固定速率在低盐度10条件下最低,为22.75 mg/(kg·h);在30盐度下最高,达100.60 mg/(kg·h);在盐度40和50条件下,保持在较低值,分别为25.47 mg/(kg·h)和45.58 mg/(kg·h)。3)在盐度40条件下,较高的DOC分泌速率95.60 mg/(kg·h)和较低的DIC固定速率25.47 mg/(kg·h),使得羊栖菜小苗DOC分泌量占固碳量的比例最高,达423.34%;50盐度最低,为83.48%。结果表明,30左右的盐度最有利于DOC的分泌和DIC的固定。这可能是在长期生存进化过程中,羊栖菜适应了自然海水30左右的盐度,藻体内各种酶在此盐度下活性也最高,因此其正常的新陈代谢也最为旺盛。
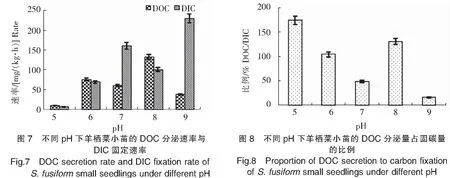
2.4 pH对羊栖菜小苗DOC分泌的影响
实验结果(图7、图8)显示:1)羊栖菜小苗DOC分泌速率在pH 8条件下最高,达132.58 mg/(kg·h);pH 5条件下最低,为9.61 mg/(kg·h)。2)羊栖菜小苗DIC固定速率在pH 9条件下最高,达230.27 mg/(kg·h);pH 5条件下最低,为6.43 mg/(kg·h)。3)在pH 5条件下,羊栖菜小苗DOC分泌量占固碳量的比例最高,达174.03%;其次在pH 8时降至130.64%;pH 9时最低,为15.94%。结果表明,微碱环境有利于DOC的分泌和DIC的固定。
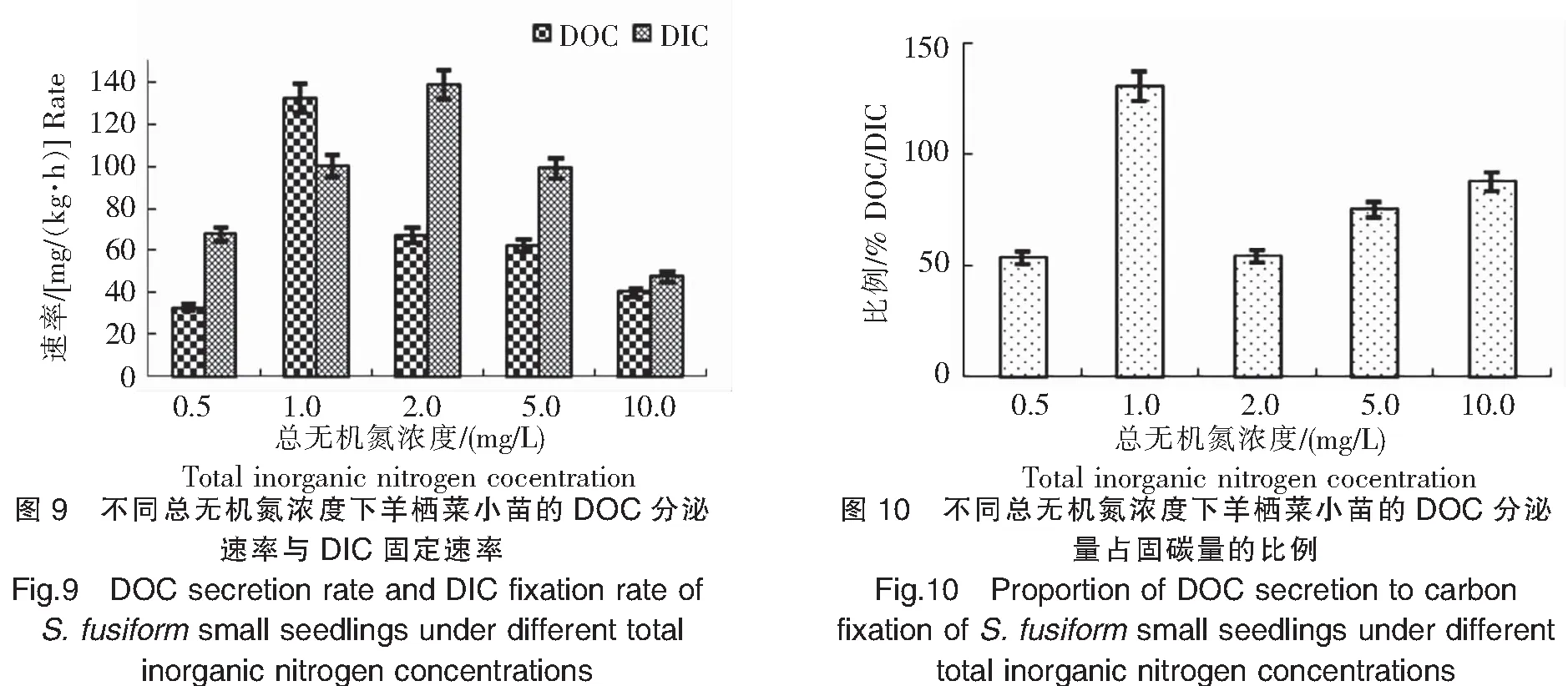
2.5 水体中总无机氮浓度对羊栖菜小苗DOC分泌的影响
实验结果(图9、图10)显示:1)当总无机氮浓度为0.5 mg/L时,羊栖菜小苗DOC分泌速率最低,为33.23 mg/(kg·h);随总无机氮浓度增加,DOC分泌速率先升高后下降,在1.0 mg/L时最高,达132.58 mg/(kg·h),在10.0 mg/L时降至40.61 mg/(kg·h)。2)羊栖菜小苗DIC固定速率的变化趋势呈先升高后下降,在总无机氮浓度为2.0 mg/L时最高,达139.04 mg/(kg·h);在总无机氮浓度为10 mg/L时最低,为47.87 mg/(kg·h)。3)当总无机氮浓度为1.0 mg/L时,羊栖菜小苗DOC分泌量占固碳量的比例最高,达130.64%;在0.5 mg/L时最低,为53.18%。结果表明,1.0 mg/L总无机氮浓度最有利于DOC的分泌,2.0 mg/L总无机氮浓度最有利于DIC的固定。这可能是因为羊栖菜需要一定的无机氮浓度以维持正常新陈代谢,但过高的无机氮浓度又会抑制其DOC的分泌和DIC的固定。
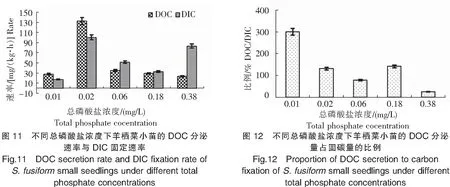
2.6 水体中总磷酸盐浓度对羊栖菜小苗DOC分泌的影响
实验结果(图11、图12)显示:1)羊栖菜小苗DOC分泌速率在总磷酸盐浓度为0.02 mg/L的条件下最高,达132.58 mg/(kg·h);在0.01、0.06、0.18、0.38 mg/L条件下均保持较低值,分泌速率在23.45~35.01 mg/(kg·h)之间。2)羊栖菜小苗DIC固定速率同样在总磷酸盐浓度为0.02 mg/L的条件下最高,达139.04 mg/(kg·h),在0.01 mg/L、0.06 mg/L、0.18 mg/L条件下均保持较低值[17.59~51.49 mg/(kg·h)],但在0.38 mg/L条件下有较高值[83.65 mg/(kg·h)]。3)在0.01 mg/L总磷酸盐浓度条件下,羊栖菜小苗DOC分泌量占固碳量的比例最高,达300.30%;在0.38 mg/L条件下最低,为25.15%。结果表明,0.02 mg/L总磷酸盐浓度最有利于DOC的分泌和DIC的固定。
3 讨论
3.1 DOC分泌速率和DIC固定速率
在海洋中,浮游植物DOC释放渠道包括整个细胞的直接释放、细胞解体后的释放和细胞死亡后原体内颗粒有机物的降解[25]。Wiebe W J等[26]利用光合作用产生的光合溶解有机碳 (Photosynthetically produced dissolved organic carbon,PDOC)来归纳藻类释放的所有溶解态光合作用的有机产物,此后该定义被多数研究者采用。PDOC是浮游植物光合产物之中的一部分,其占所有初级生产力的比例是PDOC研究的关键内容,通常以细胞外释放比例(Percentage of extracellular release,PER)来代表[27]。Mague T H等[28]提出,对PDOC的研究,除了PER之外,还应报道PDOC的绝对释放速度。
1)羊栖菜中苗的生理活动旺盛,生长迅速,因此DOC分泌速率和DIC固定速率均最高。2)羊栖菜小苗DOC分泌速率在2 800 lx光照强度下达到最高,这是因为在较高的光照强度下,羊栖菜会更多地合成小分子代谢物,但过高的光照强度会抑制羊栖菜的生长,易对羊栖菜造成生理伤害。在自然界中,过高的光照强度往往伴随高温,导致羊栖菜烂菜。而坛紫菜DOC分泌速率在2 000 lx光照强度下达到最高[22],表明羊栖菜和坛紫菜对光照强度的需求不同,羊栖菜能适应更高强度的光照。3)羊栖菜小苗DOC分泌速率和DIC的固定速率在30盐度条件下达到最高,表明羊栖菜的生长对盐度较为敏感,过高或过低的盐度均不利于羊栖菜的生长,这可能是过高、过低的盐度均会抑制羊栖菜正常的新陈代谢,降低光合作用过程中各种酶的活性。4)羊栖菜小苗DOC分泌速率和DIC的固定速率在pH 8~9条件下达到最高,说明微碱环境有利于DOC的分泌和DIC的固定,这与刘春光等[29]的pH值对淡水藻类生长影响的研究结果一致。5)羊栖菜小苗DOC分泌速率和DIC的固定速率在1~2 mg/L总无机氮浓度条件下最高,这可能是过低的总无机氮浓度无法提供氮源,而过高的总无机氮浓度导致藻类细胞分裂减缓,对藻类生长具有抑制作用[30]。6)羊栖菜DOC分泌速率和DIC的固定速率在0.02 mg/L总磷酸盐浓度条件下最高,这可能因为磷是藻类生长所必需的营养元素,过低的总磷酸盐浓度无法满足羊栖菜的生长需要,但过高的总磷酸盐浓度会造成水体富营养化,反而限制羊栖菜的生长。
上述影响因子对DOC分泌速率和DIC固定速率的影响未考虑交互作用,为独立单因素实验。今后将进一步开展双因素或多因素的交互实验,以探索不同影响因子之间的交互作用。
3.2 DOC分泌量占固碳量的比例
在实验室条件下,生长期藻类的PER大多数在2%~10%之间,而成熟期的藻类往往有更高的PER,大多在10%~60%[25,28,31-33]。本实验采用的是羊栖菜苗种,PER在2%~10%之间,其中羊栖菜中苗具有较高的DOC分泌速率和较低的DIC固定速率,DOC分泌量超过固碳量。高PER值往往在控制实验的较低光照强度时出现,或在现场培养的真光层底部出现[28,34-36]。本研究中,在低光照强度500 lx条件下,羊栖菜小苗DOC分泌量占固碳量的比例较高,这与上述研究结果相一致。
在盐度40、pH 5、总无机氮浓度为1.0 mg/L、总磷酸盐浓度为0.01 mg/L条件下,羊栖菜具有较高的DOC分泌速率和较低的DIC固定速率,而且DOC分泌量占固碳量的比例较高,均大于1。表明在这些条件下,羊栖菜的DOC分泌量比DIC固定量大,被动扩散机制可能是DOC分泌机制的主要形式,通过释放出细胞内的溶解有机物,特别是小分子代谢产物,被动地经由细胞膜向细胞外扩散[25,37]。羊栖菜发生了自身的消耗,不能净积累碳水化合物以促进自身的生长,这可能是受环境因子的影响,也可能是受实验条件的制约,需进一步开展研究以确定原因。在盐度50、pH 9、总无机氮浓度为0.5 mg/L、总磷酸盐为0.38 mg/L条件下,DOC分泌量占固碳量的比例较低,这是因为DOC的分泌机制可能是溢出形式,在固定碳源速度超过细胞自身成分合成的速度时,多余的光合作用产物才采用溢出形式向细胞外释放[25,38-39],因此DOC分泌速率较低。
4 小结
羊栖菜中苗的DOC分泌速率最高,达141.20 mg/(kg·h);在光照强度2 800 lx下,羊栖菜小苗DOC分泌速率和DIC固定速率均最高,分别为132.58、100.60 mg/(kg·h);在原海水盐度30、pH 8、总无机氮浓度1 mg/L、总磷酸盐浓度0.02 mg/L条件下,羊栖菜小苗DOC分泌速率达到最高。原海水的理化性质有利于羊栖菜DOC分泌,而高盐度、强酸度、低总无机氮浓度、高总磷酸盐浓度均会限制羊栖菜DOC的分泌。DOC分泌量占固碳量的比例大小受DOC分泌速率、DIC固定速率、分泌机制、光合作用、代谢方式等多种因素的影响,难以总结为较简单的条件或原因,需进一步深入研究。
