哈密瓜种植对根际土壤细菌群落组成和多样性的影响
2023-06-20田敬宇高兴旺赵鹏安苏比努尔居来提
田敬宇,高 雁,高兴旺,曾 军,赵鹏安,苏比努尔·居来提
(1.新疆大学生态与环境学院,乌鲁木齐 830046;2.新疆农业科学院微生物应用研究所,乌鲁木齐 830091;3.新疆大学生命科学与技术学院/新疆生物资源基因工程重点实验室,乌鲁木齐 830046)
0 引 言
【研究意义】连作往往导致作物产量和品质下降、土传病害加重等[1]。新疆哈密瓜属于甜瓜种下、长毛亚种下的夏甜瓜变种[2]。目前,在哈密、五家渠等哈密瓜主产区存在不同程度的连作障碍现象。连作障碍发生的根源是连作导致作物根际微生态失衡,研究大田种植哈密瓜后根际微生态的变化规律,对探究哈密瓜连作障碍机理,以及为进一步开展哈密瓜连作障碍的防治有重要意义。【前人研究进展】徐小军等[3]发现随甜瓜种植年限的增加,根际土壤营养元素失衡,土壤有机质、全氮、全磷含量发生显著变化。周艳丽等[4]和唐小付等[5]采用平板培养法发现甜瓜连作导致可培养细菌数量显著变化。郑立伟等[6]研究发现甜瓜连作导致全氮、速效氮、速效钾含量和pH值显著增加,以及假单胞菌、根瘤菌等有益菌属丰度降低。【本研究切入点】根际微生态失衡是连作障碍发生的根本原因,现有研究主要探究了甜瓜多年连作根际土壤的微生态变化规律,但瓜农多采用休耕和轮作的短期种植方式缓解甜瓜连作障碍,关于甜瓜短期种植情况下根际土壤微生态变化规律的相关研究鲜见报道。需研究哈密瓜种植对根际土壤细菌群落组成和多样性的影响。【拟解决的关键问题】研究在新疆五家渠市103团选取3个哈密瓜种植大田,采集哈密瓜根际土和非根际土,通过细菌扩增子测序技术,分析不同样本细菌群落结构,检测土壤理化性质,并对土壤理化性质与细菌群落结构进行相关性分析,从土壤理化性质和细菌群落结构视角解析该区种植哈密瓜后根际微生态变化规律,为开展哈密瓜连作障碍的防控研究提供参考。
1 材料与方法
1.1 材 料
2022年7月在新疆五家渠市103团选取3片哈密瓜结实初期大田,分别标记为W1(87°31′52″E, 40°23′27″ N)、W2(87°31′33″E, 44°20′33″N)和 W3(87°31′51″E, 44°19′29″N)。在每个样地用土钻随机采集35个行间土壤[7]混作非根际土(采样深度为0~20 cm),分别记为W10、W20和W30。随机选取35株健康哈密瓜植株,采用抖根法采集哈密瓜根际土壤[8],分别记为W11、W21和W31。每个样地采集5个土样,装入无菌袋后低温运回实验室。每个土样分成两部分,一部分储存于-80℃用于细菌扩增子测序,另一部分自然风干、研磨、过筛后用于理化性质的测定。
1.2 方 法
1.2.1 土壤理化因子测定
土壤pH值采用PHS-3C型精密酸度计测定,EC值采用FE30电导率仪测定,全氮(TN)采用凯氏定氮法测定,全磷(TP)采用NaOH熔融-钼锑抗比色法测定,全钾(TK)采用NaOH熔融-火焰光度法测定,碱解氮(AN)采用碱解扩散法测定,速效磷(AP)采用碳酸氢钠浸提-钼锑抗比色法测定,速效钾(AK)采用乙酸铵浸提-火焰光度法测定,土壤有机质(SOM)采用重铬酸钾滴定法测定,方法参照《土壤农化分析》[9]。
1.2.2 土壤DNA提取
采用磁珠法土壤和粪便基因组DNA提取试剂盒提取土壤样本中的基因组DNA。经琼脂糖凝胶电泳检测DNA纯度和完整性后扩增子测序分析。
1.2.3 PCR扩增及扩增子测序
细菌16S rDNA基因的V3-V4区扩增和测序,上游引物序列为341F:5′-CCTAYGGGRBGCASCAG-3,下游引物序列为806R:5′-GGACTACNNGGGTATCTAAT-3[10-11]。根据PCR产物浓度进行等量混样,充分混匀后经2%琼脂糖凝胶电泳纯化PCR产物,Universal DNA纯化回收试剂盒回收目的条带。纯化样本使用NEB Next®Ultra DNA Library Prep Kit建库试剂盒进行文库构建,检测合格后上机测序(北京诺禾致源科技有限公司)。测序数据上传至NCBI数据库(PRJNA898128)。
1.2.4 土壤细菌群落结构
根据Barcode序列和PCR扩增引物序列对下机数据进行拆分,截去Barcode和引物序列后用FLASH[12]软件拼接,获得原始数据。用Vsearch[13]软件将测序数据与物种注释数据库比对检测,去除嵌合体序列,获得有效数据。利用QIIME2软件中的DADA2模块过滤掉有效数据中丰度小于5的序列,获得ASVs(Amplicon Sequence Variants,即扩增子序列变异)数据集及特征表。用QIIME2软件中的classify-sklearn模块将ASVs与数据库silva138.1比对进行物种注释,得到门纲目科属种各分类水平上物种及丰度信息。
1.3 数据处理
经细菌16S rDNA扩增子测序,每个样本获得原始数据8×104条左右,剔除古菌ASVs,抽平后进行后续分析。绘制门和属水平百分比堆积图;基于bray_curtis距离进行PCoA (Principal Co-ordinates Analysis) 分析;使用LEfSe(LDA Effect Size)进行LEfSe分析以阐释各样地标志性差异物种(Biomarker);通过db-RDA(distance based redundancy analysis)分析环境因子与细菌群落结构的关系。除LEfSe分析外,所有数据分析和图片绘制均利用R语言完成。
2 结果与分析
2.1 土壤理化性质
研究表明,与非根际土壤比较,3个哈密瓜样地的根际土壤理化性质均发生了不同程度的变化,总体均表现出甜瓜种植后土壤pH显著增加,而SOM、TP、TK、AN总体呈下降变化(P<0.05)。W1样地:根际土的pH、EC和AP显著增加(P<0.05),SOM、TK和AK显著下降(P<0.05),AN无变化。W2样地:根际土的pH和AK显著增加(P<0.05),EC、SOM、TP、AN显著下降(P<0.05),TN、TK无变化。W3样地:根际土的pH和AK显著增加(P<0.05),EC、TP、TK、AN和AP均显著下降(P<0.05),SOM、TN无变化。表1
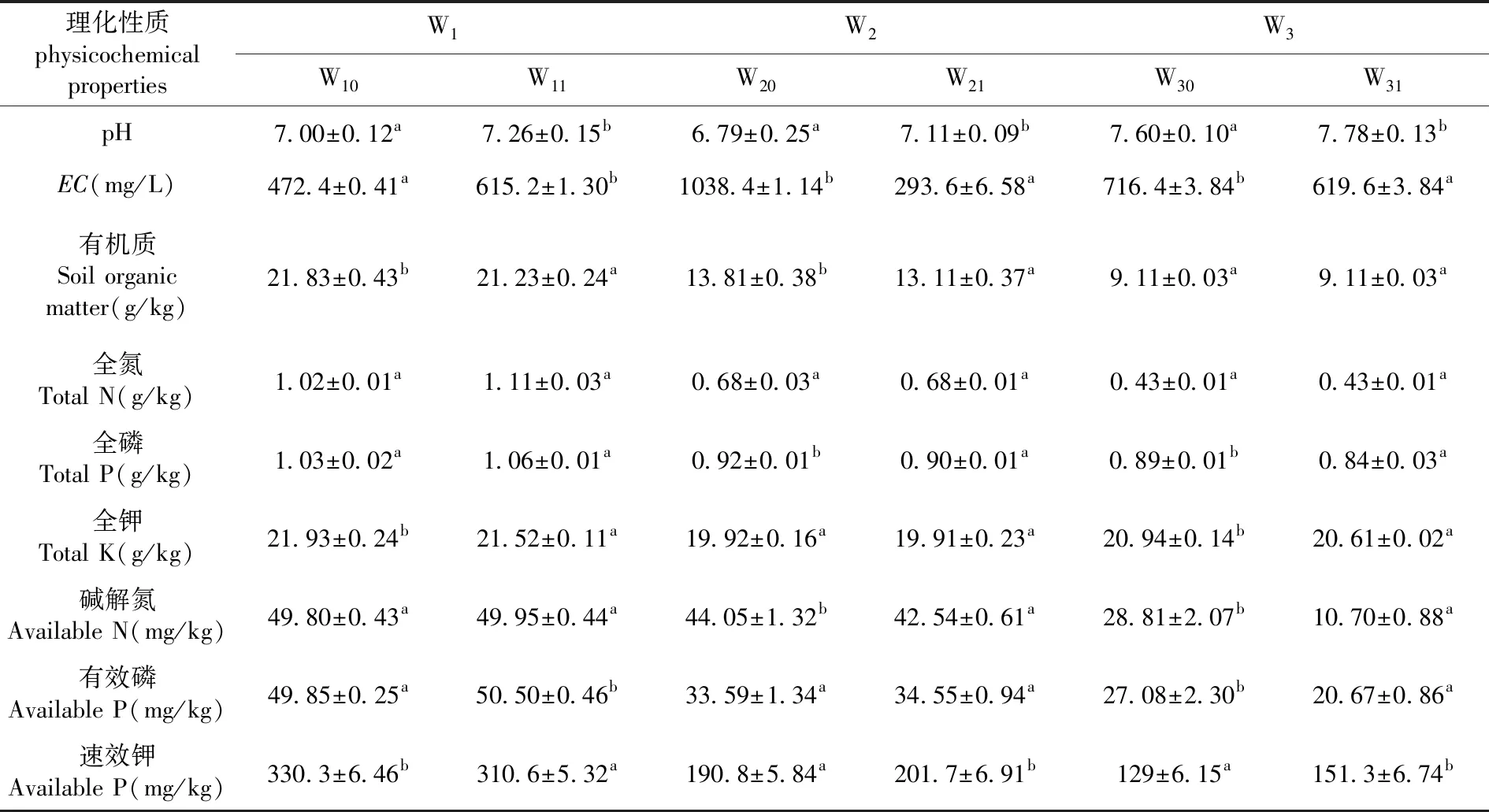
表1 3个哈密瓜样地根际土/非根际土的土壤理化性质
2.2 土壤细菌群落结构
2.2.1 哈密瓜根际土和非根际土壤细菌α多样性
研究表明,W1样地中,根际土W11的细菌丰富度指数、Chao1指数和Shannon指数均低于非根际土W10;W2和W3样地与W1样地总体变化趋势相反,但均无显著性差异。表2
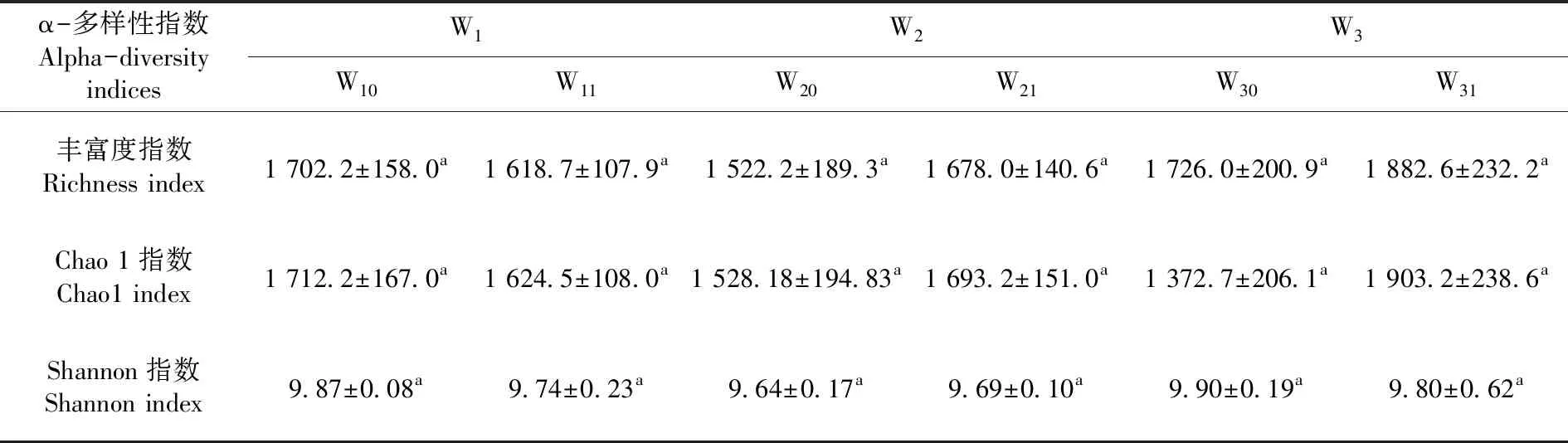
表2 3个哈密瓜样地根际土/非根际土细菌群落α多样性指数
2.2.2 哈密瓜根际土和非根际土细菌β多样性
研究表明,根据3个样地中非根际土(W10、W20和W30)和根际土(W11、W21和W31)样本所获ASVs的丰度信息,进行PCoA分析。3个样地中哈密瓜种植根际土和非根际土细菌β多样性,哈密瓜种植显著改变了原有土壤微生物群落结构。图1
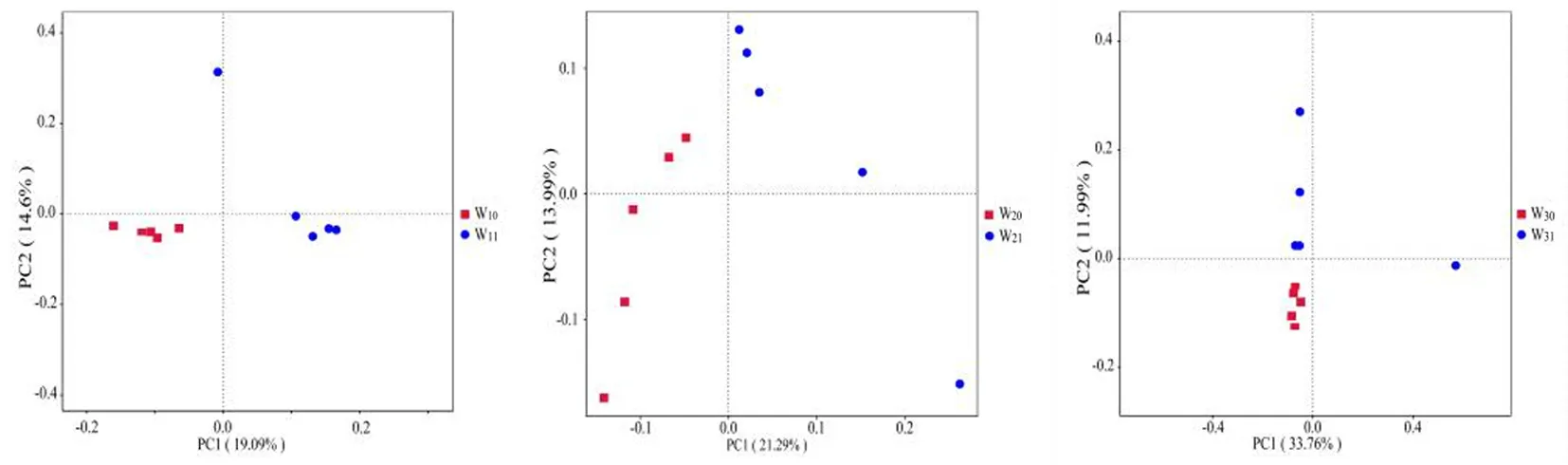
图1 3个哈密瓜样地根际土/非根际土细菌群落主坐标(PCoA)
2.2.3 土壤细菌群落结构
研究表明,共检测到细菌43门、103纲、271目、440科、820属。3个样地细菌丰度排名前10的细菌门中,共有的优势细菌门有9个:变形菌门(Proteobacteria)、放线菌门(Actinobacteriota)、酸杆菌门(Acidobacteriota)、芽单胞菌门(Gemmatimonadota)、拟杆菌门(Bacteroidota)、绿弯菌门(Chloroflexi)、厚壁菌门(Firmicutes)、疣微菌门(Verrucomicrobiota)和粘球菌门(Myxococcota);W1和W2样地还有Entotheonellaeota,W3样地还有蓝细菌门(Cyanobacteria)。图2

图2 3个哈密瓜样地根际土/非根际土细菌群落相对丰度
对于W1样地,种植后,厚壁菌门和粘球菌门相对丰度分别增加62.32%、10.27%,拟杆菌门和疣微菌门的相对丰度分别降低38.19%、23.05%。对于W2样地,种植后,厚壁菌门和变形菌门相对丰度分别增加27.46%、7.21%,芽单胞菌门、拟杆菌门和酸杆菌门的相对丰度分别降低18.24%、19.79%和4.91%。W3样地,种植后,蓝细菌门和厚壁菌门相对丰度分别增加176.12%、70.56%;芽单胞菌门和酸杆菌门的相对丰度分别降低27.37%、16.93%。3个样地的厚壁菌门相对丰度随哈密瓜的种植而增加,酸杆菌门和绿弯菌门相对丰度随哈密瓜的种植而下降。在属水平上,W1样地中,种植后假单胞菌属(Pseudomonas)、芽孢杆菌属(Bacillus)和假红杆菌属(Pseudarthrobacter)相对丰度分别增加444.74%、69.13%和34.65%,Vicinamibacteraceae属的相对丰度降低22.59%。W2样地中,种植后芽孢杆菌属、假红杆菌属和假单胞菌属相对丰度分别增加27.76%、18.75%和4.17%,Candidatus_Entotheonella属和RB41属相对丰度分别降低16.71%、12.85%。W3样地中,种植后假单胞菌属相对丰度增加665.56%,Vicinamibacteraceae属、假红杆菌属、Skermanella属和RB41属相对丰度分别降低23.34%、21.32%、11.33%和3.83%。3个样地的Pedosphaeraceae属、Vicinamibacteraceae属、Acidibacter属、JG30-KF-CM45属和Skermanella属相对丰度随哈密瓜的种植而下降,假单胞菌属、芽孢杆菌属相对丰度随哈密瓜种植呈上升趋势。另外, 3个样地均发现在哈密瓜种植后特有的葡萄球菌属(Staphylococcus)。图2,表3
2.2.4 哈密瓜根际土和非根际土细菌差异标志物种分析
研究表明,筛选出各样地中的标志性差异物种(Biomarker)。W1样地中,W10中具有显著性差异的生物标志物主要包括拟杆菌门、拟杆菌纲(Bacteroidia)、Vicinamibacteria纲、噬纤维菌目(Cytophagales)、Vicinamibacterales目、Microscillaceae科、Vicinamibacteraceae属;而W11中具有显著性差异的生物标志物主要包括厚壁菌门、芽孢杆菌纲(Bacilli)、芽孢杆菌目(Bacillales)、芽孢杆菌科(Bacillaceae)、芽孢杆菌属。W2样地中,W20中具有显著性差异的生物标志物主要包括芽单胞菌门、拟杆菌门、拟杆菌纲、芽单胞菌纲、噬纤维菌目、芽单胞菌目、Hymenobacteraceae科、芽单胞菌科、Pontibacter属;W21中具有显著性差异的生物标志物主要包括γ-变形菌纲(Gammaproteobacteria)、伯克氏菌目(Burkholderiales)、芽孢杆菌目、芽孢杆菌科、芽孢杆菌属。W3样地中,W30中具有显著性差异的生物标志物主要包括芽单胞菌门、芽单胞菌纲、Vicinamibacteria纲、芽单胞菌目、Vicinamibacterales目、芽单胞菌科、Vicinamibacterales科、Vicinamibacteraceae属;W31中具有显著性差异的生物标志物为厚壁菌门。图3
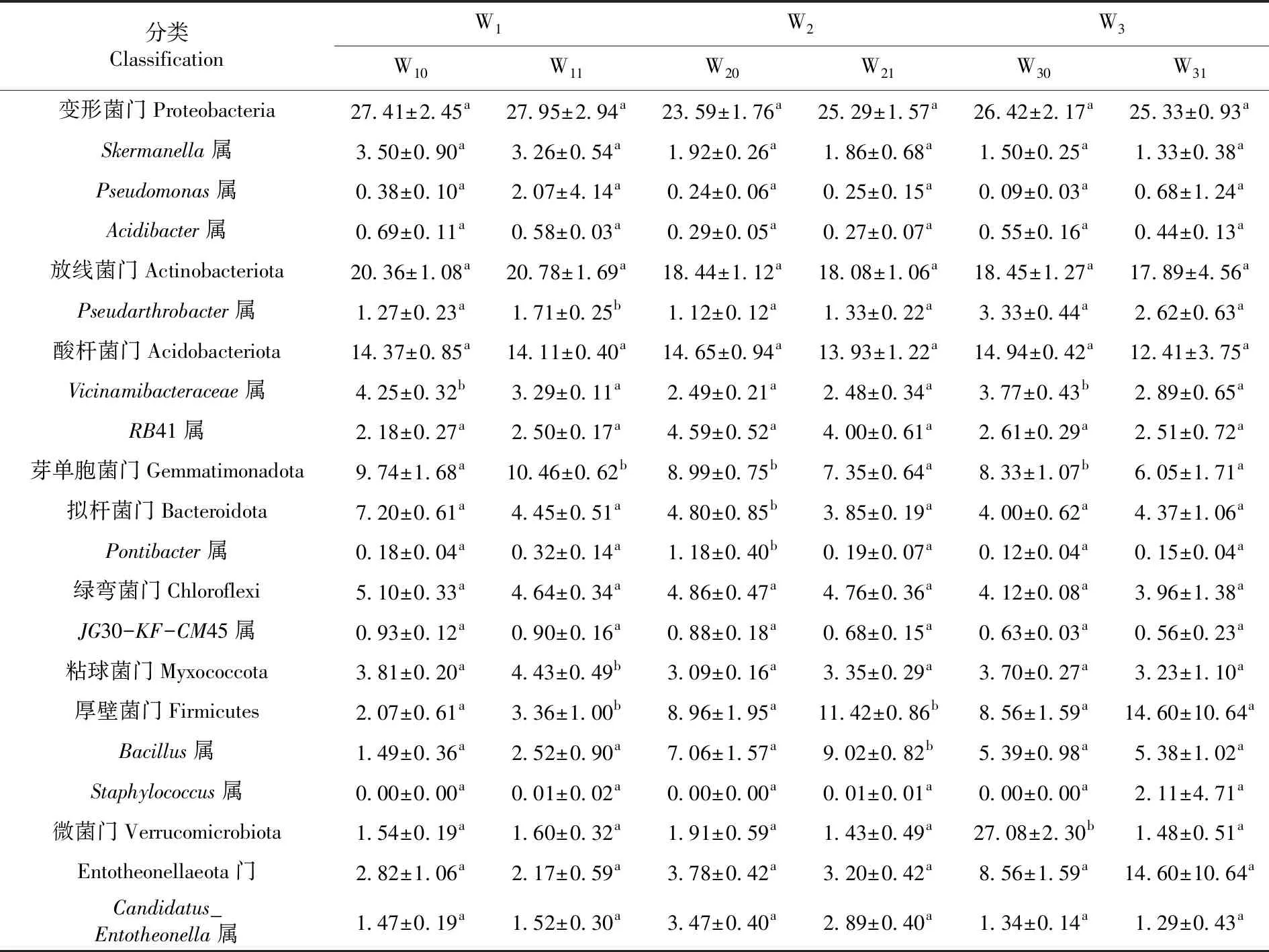
表3 3个样地哈密瓜根际土/非根际土细菌在门、属水平上的相对丰度
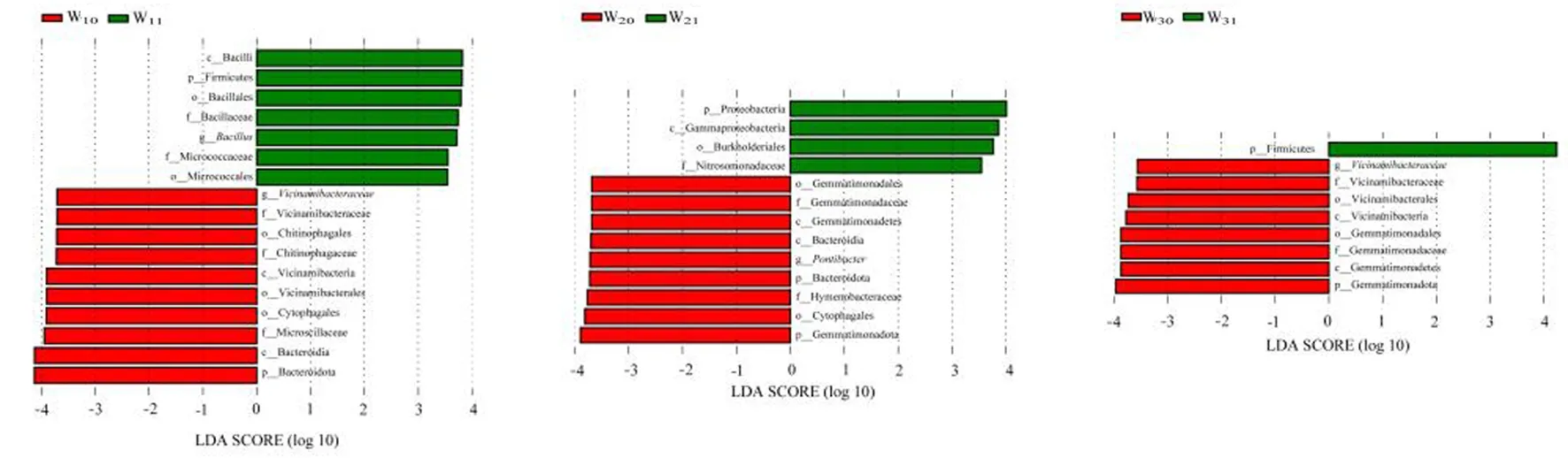
注:设定LDA阈值为3.5。红色和绿色分类分别代表每个样地根际土和非根际土中起重要作用的生物标志物
2.3 土壤理化性质与土壤细菌多样性相关性
研究表明,db-RDA分析解释了土壤细菌群落73.5%的总方差,土壤理化性质会对土壤细菌群落组成造成不同影响,其中TP(R2=0.44)和pH(R2=0.21)是影响土壤细菌群落组成最主要的土壤环境因子。图4
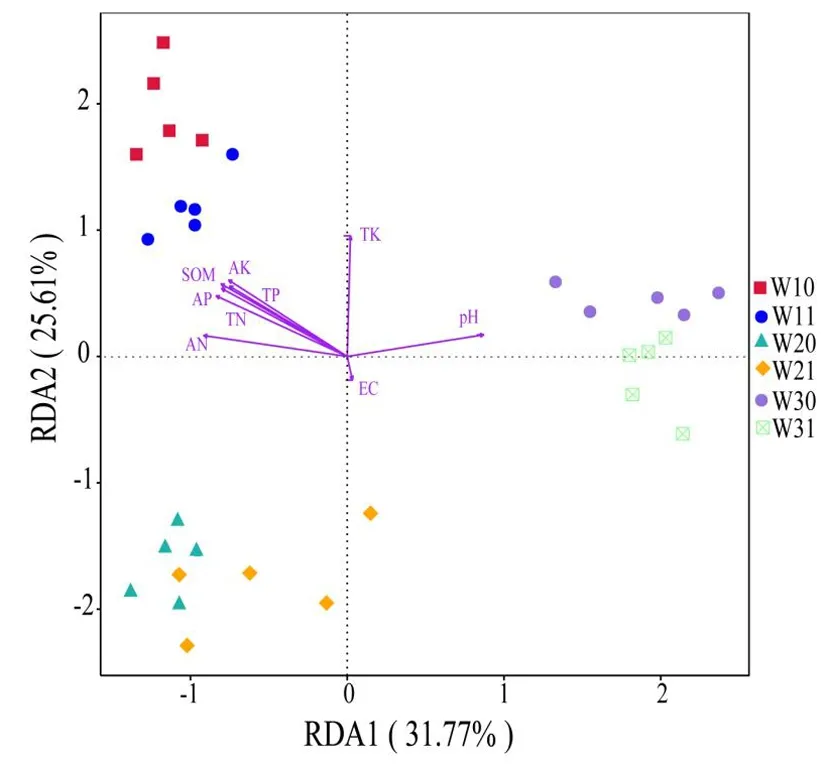
图4 3个哈密瓜样地根际土/非根际土 细菌门水平种类与理化因子基于 距离的冗余分析(db-RDA)
“TP+pH+TK+AK+TN+AP+AN”的组合对土壤中细菌群落的变化的影响最为明显,相关系数为0.742 7,该组合对土壤细菌群落变化的影响具有极显著性(P=0.001)。表4
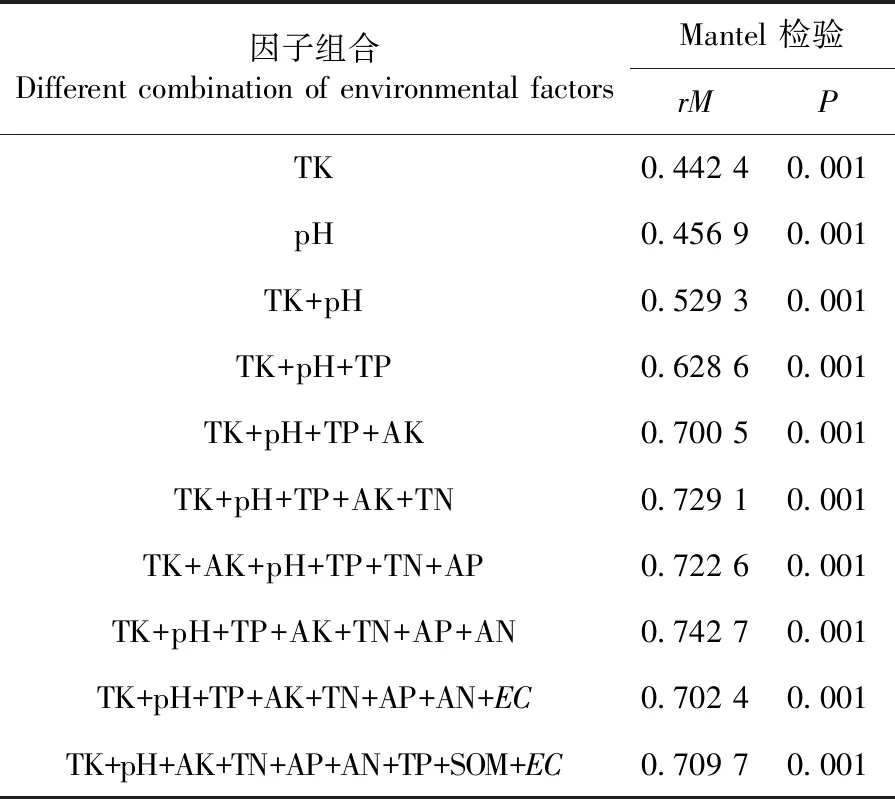
表4 3个样地哈密瓜根际土/非根际土中不同 环境因子组合与细菌群落的相关关系
3 讨 论
3.1 大田种植哈密瓜后土壤理化性质变化规律
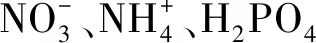
3.2 大田种植哈密瓜后土壤细菌群落结构变化规律
土壤细菌群落结构与土壤理化性质及植株健康状况密切相关。作物种植往往引起土壤微生物群落结构发生变化。研究主要从门和属水平分析哈密瓜种植后土壤细菌群落结构的变化规律。
在门水平上,变形菌门、放线菌门和酸杆菌门是各样本中细菌群落的优势门,郑立伟等[6]发现甜瓜根际土壤中的优势细菌门变形菌门、拟杆菌门、酸杆菌门,土壤优势物种种类和丰度的差异可能是由于土壤类型、管理模式等诸多因素导致。3个样地中,厚壁菌门相对丰度均随哈密瓜种植平均增加了53.5%,酸杆菌门和绿弯菌门相对丰度均随哈密瓜种植呈下降趋势,分别降低7.88%和5.06%。厚壁菌门能促进作物生长发育,ZHU等[21]发现厚壁菌门是苎麻种植根际土壤中优势门,并且与连作苎麻的茎长、茎粗和纤维产量呈正相关,这可以被视为是一种环境处于恶劣时期的自我调节过程[22]。酸杆菌门被列为潜在益生菌,具有降解复杂碳水化合物和促进氮代谢的基因,在碳循环和氮循环中发挥重要作用[23]。绿弯菌门包含可利用光照的菌种[24],哈密瓜种植一定程度降低根际土壤光照强度,从而使绿弯菌门的相对丰度降低。与非根际土壤相比,哈密瓜种植后导致根际土壤细菌群落结构失衡,其中优势细菌门厚壁菌门相对丰度增加,酸杆菌门和绿弯菌门相对丰度降低,可能对下一茬哈密瓜的正常生长发育产生不利影响。
在属水平上,与空白对照组相比,在3个样地中哈密瓜种植后根际土壤中Pedosphaeraceae属、Vicinamibacteraceae属、Acidibacter属、JG30-KF-CM45属和Skermanella属的相对丰度呈降低趋势,分别降低21.41%、15.64%、14.74%、12.33%和7.19%。Pedosphaeraceae属参与有机碳积累和氮储存等重要生态功能[25],哈密瓜种植后其丰度降低可能会导致营养元素失衡从而直接影响下一茬作物的生长发育及器官建成。Sarkar等[26]研究发现Vicinamibacteraceae属是干旱土壤中的关键细菌种群,Vicinamibacteraceae属相对丰度的差异可能归因于哈密瓜种植降低了根际土壤的持水能力,这还需要进一步验证。Acidibacter属是酸性条件耐受物种[27],其相对丰度的降低可能归因于哈密瓜种植后根际土壤碱化。JG30-KF-CM45属与土壤氮元素含量密切相关,并且SHEN等[28]研究表现为促进烟草生长的有益细菌属。Badri等[29]研究发现Skermanella属与拟南芥根际土壤中γ-氨基丁酸含量密切相关,γ-氨基丁酸可为微生物提供碳源和氮源并且抑制土壤病原菌[30]。在3个样地中均发现哈密瓜种植导致Pedosphaeraceae属、Vicinamibacteraceae属、JG30-KF-CM45属和Skermanella属等有益属相对丰度降低。郑立伟等[6]也发现溶杆菌属 (Lysobacter)、Steroidobacter、Thioprofundum等与有害物质分解和促生长物质分泌相关的益生菌属相对丰度随甜瓜种植而降低,但具体益生菌属变化趋势不同,可能归因于土壤微生物变化受种植作物、土壤类型、田间管理等诸多因素的影响。此外,在3个样地中哈密瓜根际土中假单胞菌属、芽孢杆菌属的相对丰度呈增加趋势,分别增加372.88%、32.81%;并且葡萄球菌属单独存在于哈密瓜根际土。芽孢杆菌属与哈密瓜种子贮藏组织对刺激种子萌发和植物生长产生协同效应及增强对病原真菌如贵腐霉菌等的抗性[31]。假单胞菌属分泌多种抗生素、多糖及铁载体,在生物防治中表现出巨大潜力[32]。葡萄球菌属能够合成生长素,表现出显著的促进植物生长特性[33]。芽孢杆菌属、假单胞菌属和葡萄球菌属等益生细菌属的相对丰度的增加可以被视为是一种环境处于恶劣时期的自我修复反应,或者说是有益细菌通过与病原微生物竞争和招募拮抗益生菌以改善根际土壤微生物群落结构,增强植物对不利环境的适应性[22]。
3.3 大田种植哈密瓜后土壤理化性质与细菌群里结构相关性规律
土壤细菌及功能群对环境因子的变化具有敏感性。哈密瓜种植导致土壤环境因子变化,会直接导致土壤微生物变化[6]。对照组和哈密瓜根际土在细菌群落结构上存在明显差异。db-RDA分析显示,土壤细菌群落结构变化与环境因子的改变密切相关,土壤pH值与TP含量是影响哈密瓜根际土与非根际土细菌优势类群分布的主要因素。研究采用Mantel检验发现“TP+pH+TK+AK+TN+AP+AN”的组合对土壤中细菌群落的变化的影响最为明显,相关系数为0.7427,这表明土壤细菌群落结构除主要受pH和TK影响外,还受多种理化因子共同影响。郑立伟等[6]研究发现pH值对甜瓜根际土壤细菌群落解释变异度最高,并且土壤pH、TN、AN、AP与鞘脂单胞菌属、假单胞菌属、芽单胞菌属、Mycothermus属等优势菌呈正相关。
4 结 论
4.1哈密瓜种植后会导致土壤理化性质变化,TP、TK、AN、AP、AK、SOM、pH和EC均发生显著性变化,其中在3个样地中pH值均随哈密瓜的种植而显著增加。
4.2哈密瓜种植后导致土壤细菌优势菌群结构存在差异,在3个样地中哈密瓜种植后酸杆菌门和绿弯菌门相对丰度降低,厚壁菌门相对丰度增加;Vicinamibacteraceae属、Pedosphaeraceae属、Skermanella属、JG30-KF-CM45属等有益属相对丰度降低,假单胞菌属和芽孢杆菌属相对丰度增加。
4.3土壤pH值与TP含量是影响哈密瓜根际土和非根际土细菌优势类群分布的主要因素。
