基于UPLC-MS技术的益肠通秘汤调控便秘的血清代谢组学分析*
2023-06-19张晓雨孙光军鲍新坤肖文洁潘姣林爱珍
张晓雨,孙光军,鲍新坤,肖文洁,潘姣,林爱珍
1.湖北省中医院,湖北 武汉 430061; 2.湖北中医药大学,湖北 武汉 430060
便秘因病程缠绵、证候复杂、波及脏腑较多、治疗缺乏统一标准而被列为难治性疾病,全球患病率约为16%[1]。目前便秘的临床管理主要依靠对症治疗,如润湿剂和各种泻药的使用。然而,由于药物的不良反应和难治性,这些治疗方法常常疗效局限。基于中医理论指导下的中药施治在慢性疾病的防治上具有独特优势。湖北省中医院肛肠科林爱珍教授认为便秘病程缠绵反复,患者长期服用攻下之药,致使津伤更甚,且攻下药多为苦寒败胃之品,使脾运化无力;且久病必虚,气虚则胃肠传导无力,阳虚则胃肠失于温煦,导致排便时间加长。林爱珍教授经过严格的辨证论治及多年的临床实践,在济川煎与补中益气汤的基础上化裁,凝练出行之有效的临证经验方——益肠通秘汤,此方具有温阳益气、润肠通便的功效,越来越多的循证医学证据表明益肠通秘汤在治疗阳虚型便秘中效如桴鼓[2-4],但关于益肠通秘汤治疗便秘的具体分子作用机制尚未见报道。
代谢组学主要用于研究影响宿主代谢及其生化功能的小分子代谢物,这些化合物在微生物选择和代谢信号通路的构建中起着关键作用[5]。相关研究显示,便秘的发生与多种代谢途径的紊乱密切相关[6]。因此,本研究应用超高液相色谱(ultra-high performance liquid chromatography,UPLC)-质谱(mass spectrum,MS)技术对各组小鼠血清进行非靶向代谢组学分析,通过分析便秘相关代谢产物探讨益肠通秘汤干预便秘的代谢途径和可能机制。
1 材料
1.1 动物48只SPF级雄性BALB/c小鼠(6周龄)购自湖北省疾病预防控制中心(动物合格证号:SYXK2020-0002),恒温(23±2) ℃、恒湿、12 h/12 h 明暗循环饲养。本研究经湖北中医药大学伦理实验委员会审批通过(伦理号:20190001-DS-20220520-001),所有动物实验程序参照并符合《国家实验动物使用法》。
1.2 药物与试剂洛派丁胺、活性炭(上海阿拉丁生化科技股份有限公司,货号:HY-B0418A、A304261);乙腈(色谱级,德国Merk公司,货号:MFCD00001878);甲酸(色谱级,美国ACS公司,货号:R003652);色胺(美国Sigma-Aldrich公司,货号:193747);其他化学试剂均为分析级或色谱级;苏木素伊红染色试剂盒(上海碧云天生物技术公司,货号:C0105S);RNA提取液(美国Ambion公司,货号:15596-026);cDNA合成试剂盒(日本Takara公司,货号:A4202-1)。肉苁蓉、怀牛膝、当归、升麻、肉桂、制何首乌、生白术、火麻仁、枳实、黄芪由湖北省中医院药学实验室提供。
1.3 仪器UPLC-MS仪(日本岛津公司,型号:LC-30A);Triple TOFTM4600型质谱仪(美国AB Sciex公司);实时荧光定量PCR仪(美国Bio-Rad公司);Kinetex C18色谱柱(规格:2.1 mm×100.0 mm,2.6 μm,美国Phenomenex公司);Waters Atlantis T3色谱柱(规格:2.1 mm×100.0 mm,3 μm,美国Waters Corp公司)。
2 方法
2.1 药物制备湖北省中医院药学实验室提供的益肠通秘汤水煎液,具体操作如下:取肉苁蓉15 g,怀牛膝10 g,当归12 g,升麻10 g,肉桂6 g,制首乌10 g,生白术20 g,火麻仁15 g,枳实10 g,黄芪15 g,常规煎煮要求,加蒸馏水煎汁后浓缩成浓度相当于生药900 g·L-1水煎液,于-40 ℃保存备用。按照《中药药理实验方法学》计算出小鼠药物灌胃剂量为15 g·kg-1·d-1(按临床常用剂量换算)[7]。
2.2 动物分组、造模与给药48只SPF级雄性BALB/c小鼠适应性喂养1周后,随机分为正常组、便秘组、益肠通秘汤组、便秘+益肠通秘汤组,每组12只。益肠通秘汤组和便秘+益肠通秘汤组小鼠灌胃给予15 g·kg-1益肠通秘汤,正常组和便秘组小鼠灌胃给予无菌水,预处理14 d后,便秘组和便秘+益肠通秘汤组小鼠灌胃洛哌丁胺(10 mg·kg-1)溶液进行造模,正常组和益肠通秘汤组小鼠灌胃等量生理盐水,每天1次,连续7 d。
2.3 便秘相关参数测定末次造模干预结束时,收集各组小鼠粪便样本,测定单只小鼠3 h内粪粒总数,然后称量新鲜粪便样本的质量即为粪便湿质量,在60 ℃下干燥12 h得到干燥的粪便,称其质量即为粪便干质量,计算粪便含水率[(粪便湿质量-粪便干质量/粪便干质量)×100%]。为评估肠道转运能力,在末次造模干预结束后禁食12 h,小鼠灌胃0.2 mL活性炭粉(10%活性炭悬液溶于0.5%羧甲基纤维素),30 min后,将小鼠麻醉处死,取小肠组织,测量活性炭在小肠中的移动距离,计算小鼠的胃肠道转运率,即为活性炭的移动距离相对于小肠全长的百分比。
2.4 组织病理学检测结肠组织采用4%多聚甲醛固定,石蜡包埋,切成4 μm厚片。固定后的切片用二甲苯脱蜡,梯度乙醇水合,蒸馏水冲洗,采用HE染色试剂盒测定结肠的形态学变化。
2.5 代谢组学分析末次给药结束后,取小鼠的血清,各组小鼠血清样本5 000×g离心10 min,取血清50 μL加入甲醇-乙腈溶液(体积为1:1),涡旋30 s,12 000×g离心10 min,收集上清液100 μL,用于UPLC-MS分析。对于疏水性代谢物,采用Kinetex C18色谱柱进行亲水交互液相色谱(hydrophilic interaction liquid chromatography,HILIC)分离。流动相包含0.1%甲酸(A)和乙腈(B),梯度洗脱:0—1 min,5% B;1—24 min,5%~100% B;24—28 min,100% B;28—28.1 min,100%~5% B;28.1—30 min,5% B。对于亲水性代谢产物,采用Waters Atlantis T3色谱柱进行反相液相色谱(reverse phase liquid chromatography,RPLC)分离。流动相包含6.5 mmol·L-1NH4HCO3(A)和95%甲醇+ 5% 6.5 mmol·L-1NH4HCO3(B),梯度洗脱顺序如下:0—1 min,2% B;1—18 min,2% B~100% B;18—22 min,100% B;22—22.1 min,100%~2% B;22.1—25 min,2% B。进样量为3 μL,流速为0.35 mL·min-1。使用TripleTOFTM4600质谱仪检测和脂质定量,该质谱仪配备有正、负模式的射流电喷雾离子源(electron spray ionization,ESI),参数如下:扫描范围50~1 000m/z;离子源温度为500 ℃;正负两种模式的离子喷雾电压:±5.5 kV;护套和辅助气体(氮气)为55 psi。碰撞能量为10 V或-10 V,聚束电压为80 V或-80 V。将Analyst TF软件与信息采集包(IDA)结合使用,用于UPLC-Q/TOF-MS数据获取。采用PeakviewTM1.2软件进行UPLC-Q/TOF-MS数据采集和处理。使用Markerview 1.2.1软件对数据进行基线校正、标度和峰值对齐分析,对所有数据集进行无偏聚类分析比较。采用SIMCA-P 14.0软件进行多变量分析统计以检验数据集的内在变异。代谢途径分析和潜在生物标志物筛选采用MetaboAnalyst 4.0软件进行分析。
2.6 结肠组织相关指标的RT-PCR检测用RNA提取液从结肠组织中分离总RNA,将分离的RNA用cDNA合成试剂盒逆转录成完整的DNA,随后采用cDNA模板在实时荧光定量PCR仪上进行RT-PCR检测。用于RT-PCR分析的指标包括芳香-l-氨基酸(dopa decarboxylase,DDC)、乙酰转移酶(arylalkylamine N-acetyltransferase,AANAT)、磷脂酶A2(phospholipaseA2,PLA2)、溶血磷脂酰胆碱酰基转移酶(lysophosphatidylcholine acyltransferase,LPCAT1)、磷脂酶D2(phospholipaseD2,PLD2)、鞘脂去饱和酶(degenerative spermatocyte homolog 2,DEGS2)、碱性神经酰胺酶(alkaline ceramidase1,ACER1)、鞘氨醇激酶(sphingosine kinase 2,SPHK2) 和GAPDH。基因的引物序列见表1。PCR程序如下:95 ℃反应10 min,40个循环,95 ℃反应10 s,然后60 ℃反应30 s。所有目的基因的表达均按照2-ΔΔCt方法进行归一化处理。

表1 引物序列
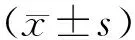
3 结果
3.1 各组小鼠便秘相关参数比较与正常组比较,便秘组小鼠3 h内粪便粒数、粪便含水率以及肠道转运率均显著降低(P<0.05或P<0.01);与便秘组比较,经益肠通秘汤处理后,便秘+益肠通秘汤组各项排便参数均有所恢复,且差异有统计学意义(P<0.05),进一步表明造模成功,同时提示益肠通秘汤具有良好的通便效果。见表2。
表2 各组小鼠排便参数比较inparagraph
3.2 各组小鼠结肠组织形态学比较各组小鼠结肠组织HE染色可见,正常组与益肠通秘汤组小鼠结肠肠腺排列整齐,杯状细胞形态、数目正常。与正常组比较,便秘组结肠绒毛排列不致密,杯状细胞明显减少,伴少许炎性细胞浸润。经益肠通秘汤治疗后,便秘+益肠通秘汤组结肠绒毛排列趋向正常,损伤情况减轻,杯状细胞数量显著增加,无明显炎性细胞浸润,表明益肠通秘汤可以有效改善便秘小鼠的结肠组织病理形态学损伤,见图1。
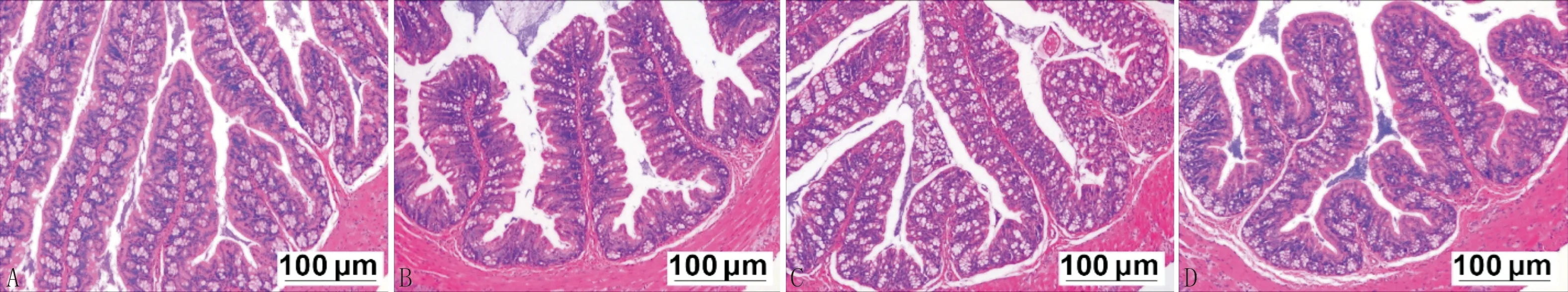
注:A:正常组;B:便秘组;C:益肠通秘汤组;D:便秘+益肠通秘汤组。图1 各组小鼠结肠组织病理形态学比较(HE染色)
3.3 小鼠血清代谢物主成分分析(principal component analysis,PCA)与正交偏最小二乘法-判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA)利用PCA和OPLS-DA来反映模式识别,发现各组样本分布于不同区域,所建立方法可良好表征不同组别代谢物的差异性。从PCA图中可以看出,四个组的血清样本分化程度较好,不同组别代谢物谱显示出较好的聚类效果,见图2A。OPLS-DA结果显示,4组样本有明显的分离,表明各组之间血清代谢物存在显著差异,见图2B。
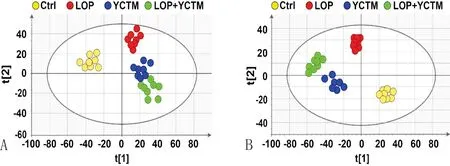
注:A:PCA分析;B:OPLS-DA分析;Ctrl:正常组;LOP:便秘组;YCTM:益肠通秘汤组;LOP+YCTM:便秘+益肠通秘汤组。图2 小鼠血清样本PCA与OPLS-DA分析
3.4 潜在标志物筛选为寻找益肠通秘汤治疗便秘的相关代谢差异物,筛选VIP值>1且P<0.05的代谢物为潜在生物标志物,通过HMDB和KEGG数据库比对分析,共鉴定出21个代谢差异物,见表3。
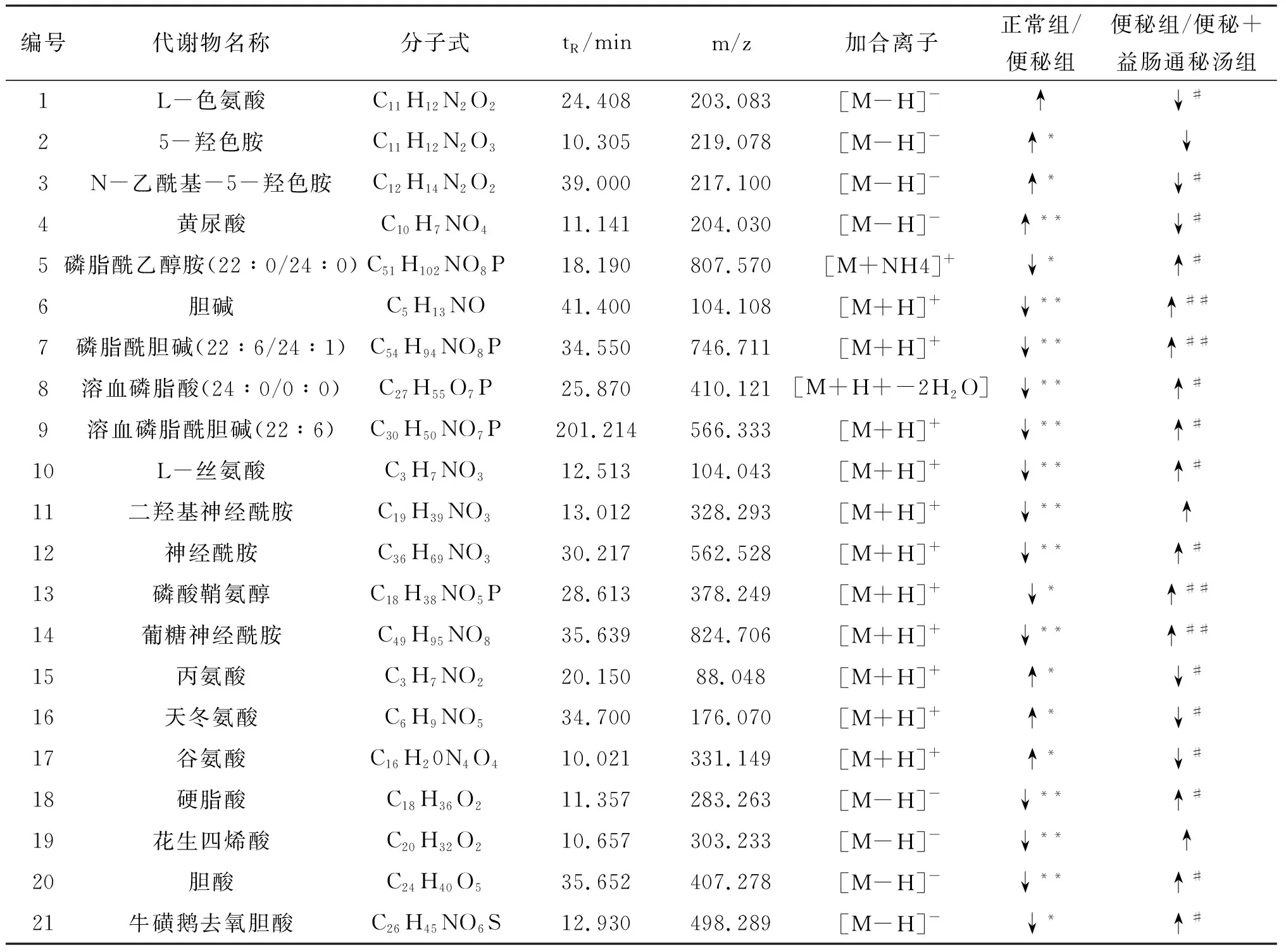
表3 益肠通秘汤治疗便秘的相关代谢差异物鉴定
3.5 代谢通路分析采用MetaboAnalyst进行代谢通路分析,评价益肠通秘汤治疗便秘过程中受到较大影响的通路。将通路影响值>0.1的代谢通路作为目标代谢通路,发现10条潜在的关键代谢路径,包括色氨酸代谢,甘油磷脂代谢,鞘脂类代谢,丙氨酸、天冬氨酸和谷氨酸代谢,不饱和脂肪酸生物合成,硫代谢,初级胆汁酸生物合成,嘧啶代谢,精氨酸生物合成和磷酸肌醇代谢,见表4和图3。
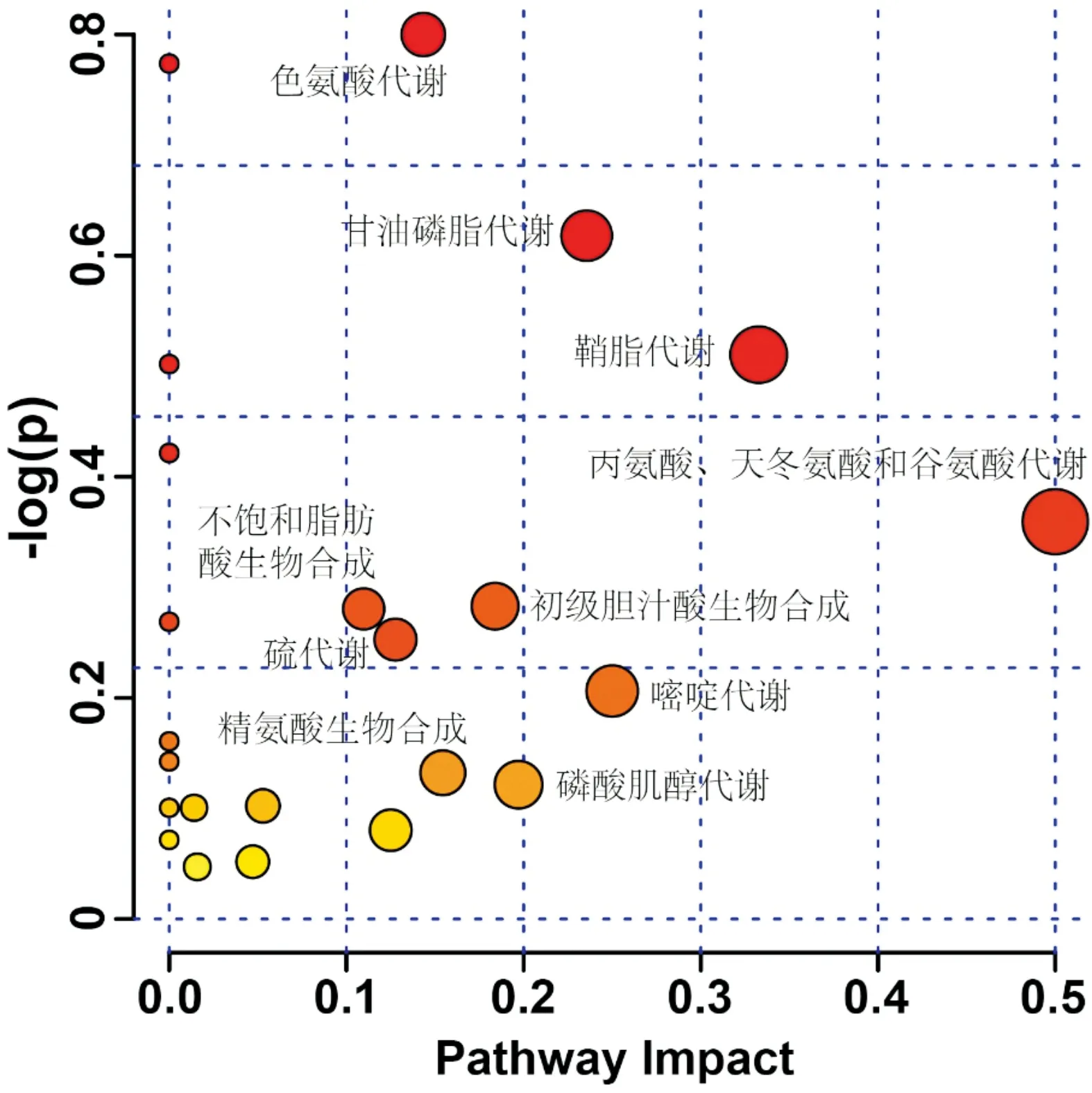
图3 主要代谢通路分析概要图

表4 主要代谢通路分析结果
3.6 色氨酸、甘油磷脂和鞘脂代谢相关酶活性分析在上述10条潜在的关键代谢路径中,发现其中3条代谢通路在益肠通秘汤治疗便秘过程中具有重要意义。DDC和AANAT分别参与色氨酸代谢通路中5-羟色胺和N-乙酰基-5-羟色胺的生成;PLA2、LPCAT1和PLD2分别参与甘油磷脂代谢通路中溶血磷脂酰胆碱、磷脂酰胆碱和溶血磷脂酸的生成;DEGS2、ACER1和SPHK2分别参与鞘脂代谢通路中神经酰胺、鞘氨醇和磷酸鞘氨醇的生成。与正常组比较,便秘组小鼠结肠组织中DDC和AANAT的mRNA含量显著降低(P<0.05或P<0.01),PLA2、LPCAT1、DEGS2、ACER1和SPHK2的mRNA含量显著上调(P<0.05或P<0.01);与便秘组比较,经益肠通秘汤治疗后,便秘+益肠通秘汤组小鼠结肠组织中AANATmRNA含量显著升高(P<0.05),LPCAT1、DEGS2、ACER1和SPHK2的mRNA含量显著降低(P<0.05或P<0.01),提示益肠通秘汤对色氨酸代谢相关酶活性的促进及其对甘油磷脂代谢、鞘脂代谢相关酶活性的抑制可能成为改善便秘的潜在途径。见图4。

注:Ctrl:正常组;LOP:便秘组;YCTM:益肠通秘汤组;LOP+YCTM:便秘+益肠通秘汤组;与正常组比较,*P<0.05,**P<0.01;与便秘组比较,#P<0.05,##P<0.01。图4 益肠通秘汤对小鼠结肠组织中色氨酸代谢、甘油磷脂代谢和鞘脂代谢相关酶活性的影响
4 讨论
便秘在临床多以“因虚致秘”为主,《丹溪心法·燥结》中描述:“虚人脏冷而血脉枯,老人脏寒而气道涩,此大肠之夹冷然也。”指出老年便秘病因病机与阳虚相关。古代医家对于便秘的治疗有较多记载,其中“凡病涉虚损,而大便闭结不通,则硝、黄攻击等剂必不可用;若势有不得不通者,宜此主之”,这里的“此”即为济川煎。另“中气不足,溲便为之便”,宜补中益气汤以虚者补之,损者益之出发,补中气之左升,而降胃以化肠燥也。益肠通秘汤在济川煎与补中益气汤的基础上化裁,方中重用肉苁蓉、肉桂,为君药,起温补肾阳、润肠通便的作用;黄芪、生白术温中行气、健脾益气,怀牛膝补肾固本,共为臣药;枳实、厚朴宽气下肠,导滞通便,当归养血通便,共为佐药;升麻为引经药,入阳明经,具有清宣升阳作用;甘草调和诸药;全方相辅相成,共同发挥了温阳行气、润肠通便的作用。
代谢组学用于识别因生物系统操作而发生变化的代谢物,具有独特的潜力来定义预测疾病发生率,影响疾病严重程度和进展的生物标志物为潜在的生理病理生理机制提供了新思路。通过评估代谢产物或内源性小分子的动态变化,筛选差异代谢物来揭示其分子机制途径。因此,代谢组学不仅提供了内源代谢活动和生物标志物的整体变化,而且有助于揭示药物在疾病发生发展中的作用机理[8]。本文采用UPLC-MS的非靶向代谢组学研究,通过对血清样品进行分析发现,便秘组和治疗组之间的代谢物特征存在显著差异。PCA和OPLS-DA等多变量分析广泛用于组间差异代谢物的鉴别,且OPLS-DA能够直接揭示导致组间差异的具体变量[9]。OPLS-DA结果充分显示了4个实验组间的不同聚类,表明造模以及益肠通秘汤干预后便秘小鼠与正常小鼠、治疗小鼠之间的代谢产物存在明显差异,血清中的代谢产物成分发生了显著变化,提示益肠通秘汤在治疗便秘小鼠中的有效性。
本研究鉴定出21种代谢差异物,经益肠通秘汤治疗后部分逆转了这些代谢物的水平。在这些变化的代谢物中,相当部分是10条潜在的关键代谢路径中色氨酸代谢、甘油磷脂代谢、鞘脂代谢途径中主要节点分子。此外,部分代谢物还参与了胆汁酸、不饱和脂肪酸的生物合成、氨基酸代谢。据报道,胆汁酸的生物合成途径的增加可增加肝肾损害的风险,同时影响肠道动力[10];不饱和脂肪酸代谢产物在便秘型肠易激综合征相关内脏痛中起着关键作用[11];痛泻药方可以通过增强氨基酸代谢增强能量代谢,调节免疫功能,改善便秘型肠易激综合征小鼠脾虚证[12],这些报道与本研究的结果一致。
色氨酸代谢是与胃肠道直接相关的关键代谢途径,通过产生5-HT来调节胃肠蠕动。L-色氨酸用于神经递质(如血清素)和神经调节剂(如色胺)的生成;5-HT可以通过作用于肠神经系统神经元增强胃肠道内脏神经的敏感性,刺激胃肠蠕动,缓解便秘[13]。为了进一步证明益肠通秘汤对色氨酸代谢途径的调节在改善便秘小鼠中发挥的作用,本研究对代谢途径中的关键酶做了进一步研究。DDC和AANAT都是色氨酸代谢通路上的酶,DDC可以激活5-HT的合成,促进神经递质的释放,进而刺激肠道蠕动;5-HT又可以通过AANAT乙酰化形成N-乙酰基5-羟色胺,通过褪黑途径调控免疫应答[14]。结果表明,经过益肠通秘汤治疗后,AANAT显著上调,提示了该代谢途径在调节便秘中发挥重要作用。因此,推测益肠通秘汤可能通过促进色氨酸代谢途径中有益代谢物的生成来参与胃肠动力的调节进而减轻便秘。
某些脂质包括磷脂衍生物会增强内脏超敏反应,引发腹痛等便秘相关症状。据报道,脂类特别是溶血磷脂酰胆碱在以便秘为主的肠易激综合征中上调最为显著。同时,溶血磷脂酰胆碱也会在溶血磷脂酶D的作用下转化为溶血磷脂酸,通过上调白细胞介素-1β诱导一氧化氮合酶激活炎症反应[15]。磷脂酰胆碱和磷脂酰乙醇胺是真核细胞膜的主要磷脂成分之一,参与炎症相关的各种信号传导途径。此外,该条代谢通路上的三种酶也与炎症密切相关,PLA2和PLD2可以通过诱导IL-6的释放来激活炎症[16],LPCAT1在巨噬细胞的表达和刺激Toll样受体4和Toll样受体2配体的释放中起关键作用[17]。经过益肠通秘汤治疗后,PLA2、PLD2及LPCAT1部分下调,推测益肠通秘汤可能通过抑制甘油磷脂代谢途径中诸如溶血磷脂酰胆碱等代谢产物介导氧化应激和肠道炎症来改善便秘。
在鞘脂代谢中,L-丝氨酸参与鞘脂的合成,与二氢神经酰胺作为神经酰胺从头合成途径的关键物质参与诱导巨噬细胞的产生和炎症标志物的表达[18];磷酸鞘氨醇生成的鞘氨醇在神经酰胺合酶的作用下合成神经酰胺,神经酰胺可激活炎症小体引发炎性浸润,炎性细胞因子如肿瘤坏死因子-α又可使葡萄糖神经酰胺积累[19]。SPHK2参与诱导细胞凋亡、刺激免疫细胞浸润,DEGS2在应激状态下有较高积累,ACER1能够介导氧化应激,促进炎症反应[20-21],经过益肠通秘汤处理后均有显著下调。本文结果表明,便秘可能与鞘磷脂代谢增强相关,过量的促炎神经酰胺输出到受体细胞,从而引起炎症状态,进一步引起肠道运动障碍。益肠通秘汤可以下调L-丝氨酸、磷酸鞘氨醇、神经酰胺以及葡糖神经酰胺的水平改善肠道炎症,缓解便秘。
越来越多的证据表明胆汁酸、不饱和脂肪酸及氨基酸代谢异常也会影响便秘的发生。胆汁酸的生物合成在减缓肠道运输中发挥重要作用。结肠运输的延长导致厌氧菌数量增加以及7α-去羟基化酶的活性增强,最终引起血清中胆酸、脱氧胆酸的比例增加[22]。本研究发现,益肠通秘汤显著降低了便秘小鼠血清中两种胆汁酸生物合成代谢物,即胆酸、牛磺鹅去氧胆酸。此外,还发现不饱和脂肪酸的生物合成同样受到益肠通秘汤的影响,其中花生四烯酸及其相关代谢途径在炎症反应中起重要作用[23]。硬脂酸通过激活内质网应激信号传导途径诱导促炎反应和氧化应激,最终导致肠道运动障碍[24]。结果表明,益肠通秘汤显著逆转了便秘小鼠血清中花生四烯酸和硬脂酸的上调。据报道,一些特定的氨基酸,包括丙氨酸、谷氨酸、精氨酸,对包括便秘在内的肠道相关疾病具有潜在的治疗作用[25-26]。研究表明,服用含有天冬氨酸的氨基酸口服液在增强小鼠肠屏障功能和维持肠道完整性中起到至关重要的作用。在洛哌丁胺诱导的便秘小鼠中,3种氨基酸水平(丙氨酸、天冬氨酸、谷氨酸)显著降低,经过益肠通秘汤治疗后得到有效恢复。因此,益肠通秘汤对便秘小鼠的改善作用可能与抑制胆汁酸、不饱和脂肪酸的生物合成,促进有益氨基酸的产生有关。
综上所述,在使用益肠通秘汤治疗洛哌丁胺诱导便秘小鼠后,内源性代谢物发生了显著变化,影响的代谢途径包括鞘脂代谢、甘油磷脂代谢、色氨酸代谢以及胆汁酸、不饱和脂肪酸的生物合成和氨基酸代谢。本研究证明了益肠通秘汤对便秘小鼠血清代谢物产生的明显影响,推测益肠通秘汤可能通过调节体内代谢物的变化来改善便秘。
