土壤利用类型和海拔对油茶根围土壤细菌和真菌多样性的影响
2023-06-17曾维军刘燕罗文敏秦维
曾维军 刘燕 罗文敏 秦维

摘要:为揭示不同土壤利用类型和不同海拔的油茶林根围土壤细菌和真菌的结构与组成,为油茶林的地力調控、精准施肥提供基础数据和指导,以贵州喀斯特地区不同土壤利用类型、不同海拔的油茶林根围土壤为材料,利用IlluminaMiSeq测序平台进行高通量测序,分析贵州喀斯特地区不同土壤利用类型和不同海拔的油茶根围土壤细菌和真菌物种多样性及其构成,并解析土壤养分对不同土壤利用类型和不同海拔的油茶根围土壤细菌、真菌群落组成及其多样性的影响。结果表明,油茶原生土壤和农业耕作土壤真菌、细菌香农指数差异不显著(P>0.05),但不同海拔梯度下差异显著;低海拔的从江(300m)与高海拔的威宁(2180m)土壤真菌和细菌群落较为丰富;门分类水平下,优势真菌为子囊菌门、担子菌门、被孢霉门,细菌为变形菌门、酸杆菌门、放线菌门;属分类水平下,农业土壤中的慢生根瘤菌、酸杆菌等细菌属的丰度显著较小;海拔升高,野生油茶根围土壤中的被孢霉属真菌相对丰度升高且土壤养分对真菌和细菌的群落分布相对影响作用呈先增后降规律;土壤中31.62%真菌和41.51%细菌暂无分类地位。说明贵州喀斯特地区油茶根围土壤中细菌、真菌资源丰富,不同海拔分布存在显著差异,土壤养分与细菌、真菌群落组成互相作用,未知微生物资源丰富,挖掘潜力较大。油茶的人工栽培存在破坏土壤中有益真菌和细菌生存环境和群落结构的可能性,从而降低土壤的分解及营养调节转化能力。
关键词:土壤利用类型;海拔;油茶;根围土壤;细菌;真菌;多样性
中图分类号:S794.401;S714.3文献标志码:A
文章编号:1002-1302(2023)10-0227-09
油茶(Camelliaspp.)属山茶科(Theaceae)山茶属(CamelliaL.)常绿小乔木或灌木,是重要的木本食用油料植物,以油茶籽为原料压榨的茶油,其不饱和脂肪酸含量高达90%,具有软化血管、降血脂和血压的功效[1]。油茶主要分布于我国南方亚热带地区的高山及丘陵地带,年油茶籽产量约为267.9万t,但仍无法满足我国的粮油自供需求,所以增加油茶茶果产量、提升茶油品质、提高资源利用率等问题亟待解决[2-4]。
土壤中微生物种类包含细菌、真菌、放线菌、藻、原生动物和病毒,其含量小于土壤质量的0.5%,但在土壤特性和演变过程中却发挥着重要作用,如参与土壤氧化、硝化等生物化学过程,促进土壤有机质分解和养分转化,是生化循环首要驱动者,它们积极影响着土壤肥力的形成和植物营养的转化[5-8]。多数油茶树表现出抗逆性强的生理特性与其土壤微生物群落特征明显相关[9]。同时季节更替、农业耕作的管理方式以及区域环境差异都对土壤微生物多样性有显著影响[10-12]。喀斯特地区的土壤贫瘠、保水能力差等因素制约油茶实现优质高产,因此探究喀斯特地区油茶土壤微生物群落特征,对实现油茶速生、丰产、优质、高抗具有重要意义。
本研究在贵州喀斯特地区不同海拔地区采集油茶原生土壤和农业耕作土壤样品,使用IlluminaMiseq平台对土样中提取的微生物DNA进行高通量测序,并进行微生物多样性分析,以期探究贵州喀斯特地区油茶林根围原生土壤和农业耕作土壤细菌和真菌的物种多样性和差异,以及不同海拔梯度土壤中细菌、真菌多样性与土壤养分的关系,为油茶的人工栽培科学施肥和提质增效提供理论支撑。
1材料与方法
1.1试验材料
1.1.1仪器
EppendorfN13462C型移液器、Eppendorf5430R型小型离心机、Eppendorf5424R型高速冷冻离心机(Eppendorf,德国);NanoDrop2000型超微量分光光度计(ThermoFisherScientific,美国);BioTekELx800型酶标仪(Biotek,美国);QL-901型旋涡混合器(海门其林贝尔仪器制造有限公司,中国);TL-48R型粉碎研磨仪(上海万柏生物科技有限公司,中国);FastPrep-245G型MP研磨仪(MP,美国);iCETM3500AAS原子吸收光谱仪(ThermoFisherScientific,美国);Kjeltec8400型全自动凯氏定氮仪(FOSS,丹麦);QuantusTMFluorometer型微型荧光计(Promega,美国);ABIGeneAmp9700型PCR仪(ABI,美国);Miseq测序仪(Illumina,美国)。
1.1.2试剂
FastDNASpinKitforSoilDNA抽提试剂盒(MPBiomedicals,美国);Agarose琼脂糖(biowest,西班牙);FastPfuPolymeraseDNA聚合酶(TransGen,中国);AxyPrepDNAGelExtractionKit试剂盒(Axygen,美国);NEXTflexRapidDNA-SeqKit建库试剂盒(BiooScientific,美国);MiSeqReagentKitv3测序试剂盒(Illumina,美国)。土壤基本营养指标检测的相关试剂(分析纯)均购置于成都金山化学试剂有限公司。
1.2试验方法
1.2.1样品采集
于2021年8月在贵州喀斯特地区主要的油茶种质资源分布县(册亨、威宁、从江、玉屏),以30~40年野生油茶林地为基础设置20m×20m规格样方,样方内“Z”形7点采集油茶根围原生土壤,混匀为一个原生土样;以5年引种移栽油茶林地为基础设置20m×20m规格样方,样方内“Z”形7点采集油茶根围农业耕作土壤,混匀为一个农业耕作土样。具体土壤采集步骤参照《土壤微生物研究原理与方法》中土壤的采集与预处理[13]。各样方概况详见表1。
1.2.2DNA提取和PCR扩增
1.2.3IlluminaMiseq测序
将同一样本的PCR产物混合后使用2%琼脂糖凝胶回收PCR产物,利用AxyPrepDNAGelExtractionKit試剂盒进行回收产物纯化,2%琼脂糖凝胶电泳检测,并用QuantusTMFluorometer型微型荧光仪对回收产物进行检测定量。使用NEXTflexTMRapidDNA-SeqKit试剂盒进行建库:(1)接头链接;(2)使用磁珠筛选去除接头自连片段;(3)利用PCR扩增进行文库模板的富集;(4)磁珠回收PCR产物得到最终的文库。利用Illumina公司的MiseqPE300平台进行测序。
1.2.4土壤基础营养指标测定
土壤全氮含量、全磷含量、全钾含量、有效磷含量、速效钾含量、pH值分别按照NY/T53—1987《土壤全氮测定法半微量开氏法》、GB/T9837—1988《土壤全磷测定法》、NY/T87—1988《土壤全钾测定法》、NY/T1121.7—2014《土壤检测第7部分:土壤有效磷的测定》、NY/T1849—2010《酸性土壤铵态氮、有效磷、速效钾的测定联合浸提—比色法》、LY/T1241—1999《森林土壤水解性总酸度的测定》测定;土壤碱解氮按照碱解扩散法[14]测定。
1.3数据处理
使用UsearchV.7.0.1090进行OTU分析和Pan分析,聚类方式采用USEARCH7-uparse算法,OTU序列相似度为0.97,物种分类数据库为unite8.0/its_fungi,分类置信度为0.7。使用mothurv.1.30.2计算Shannon指数,并对组间Shannon指数差异进行t检验。使用R语言(version3.3.1)进行物种Venn图分析和制作群落柱形图。使用Qiime计算beta多样性距离矩阵,R语言(version3.3.1)vegan软件包进行非度量多维尺度(NMDS)分析和作图。多组比较采用ruskal-Wallis秩和检验,2组比较采用t检验。
2结果与分析
2.1不同分组油茶根围土壤真菌物种多样性分析
对土样中真菌进行DNA抽取,高通量分析后,得到优化总序列数967228条,各样本序列数范围为34129~47562条,序列平均长度为227bp。由图1可知,采集土样按照海拔和土壤利用类型分组,2个分组对应的OTU总数随着观测样本数的增加而渐渐趋于平缓,说明测序样本量足够,满足后续分析需求。由图2可知,油茶根围原生土壤和农业耕作土壤真菌的香农指数差异不显著(P>0.05),但喀斯特地貌不同海拔油茶种植区根围土壤的香农指数差异极显著(P≤0.01)。随着海拔升高(300~2180m),香农指数先降后升,t检验为极显著,其中最高点威宁(海拔2180m)和最低点从江(海拔300m)的油茶根围土壤真菌香农指数分别为3.26、3.41,两者差异不显著。
2.2不同分组油茶根围土壤真菌物种组成分析
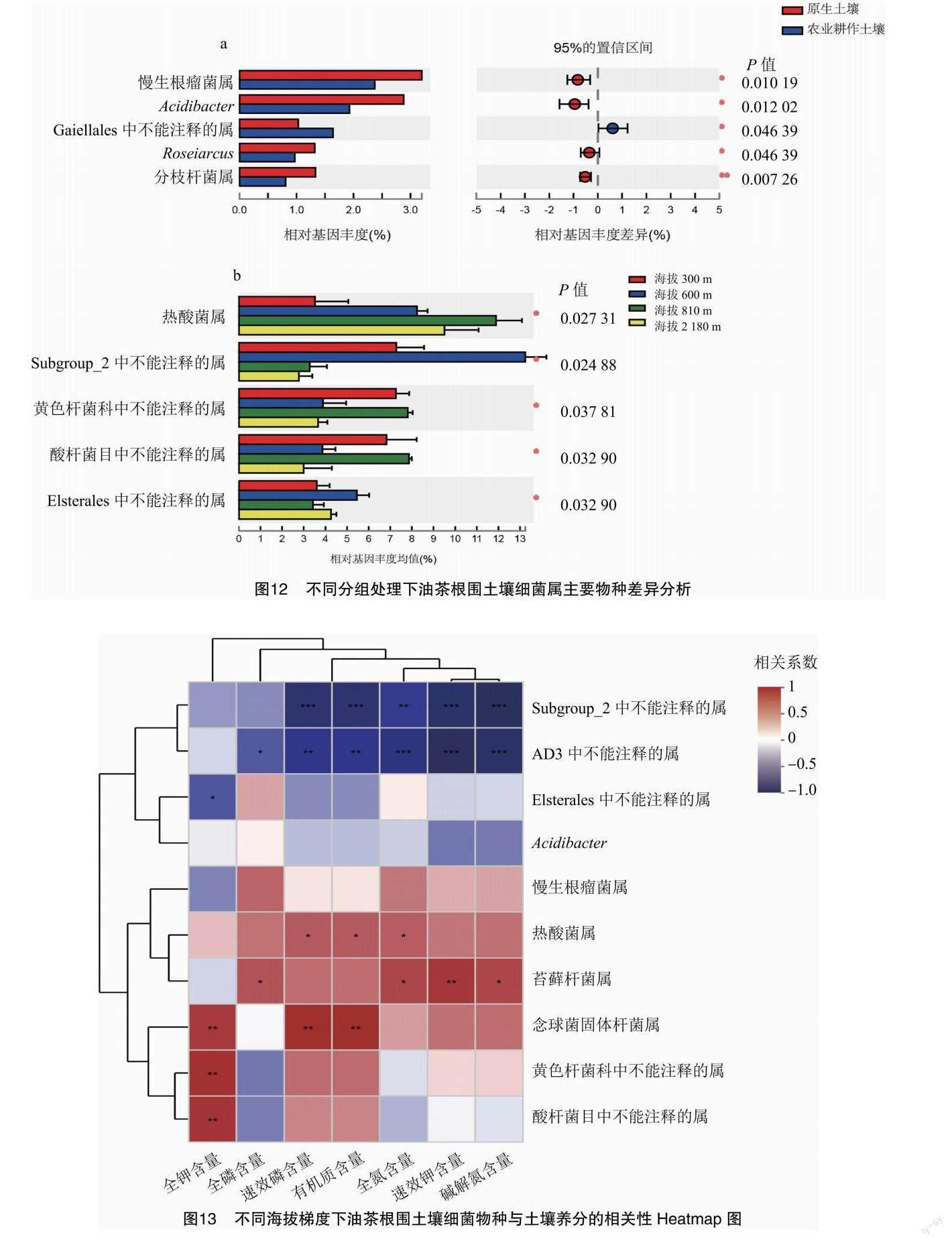
由图3可知,贵州喀斯特地区油茶根围土壤真菌在门分类水平下按相对基因丰度从大到小依次为子囊菌门(40.39%)、担子菌门(28.34%)、被孢霉门(6.07%),其中不能鉴别的真菌门占22.67%。属分类水平下按相对基因丰度从大到小依次为沙蜥属(12.81%)、被孢霉属(5.96%)、绿僵菌属(4.19%),其中不能鉴别的真菌属占22.67%,相对基因丰度低于1%的属均归于其他,占28.31%。由图4可知,非度量多维尺度(NMDS)分析的胁强系数均小于0.05,说明对分组土样的NMDS分析具有很好的代表性,其中原生土壤和农业耕作土壤中的真菌有共同物种,B1、B2、D2这3个样本点的物种组成相似。以喀斯特不同海拔地区分组的土样中,海拔810m的册亨与海拔300m的从江油茶根围土壤真菌物种组成相似。由图5-a可知,农业耕作土壤的Apiotrichum属和未知分类地位真菌属的相对基因丰度均显著大于原生土壤,木耳科无分类学地位的属(P<0.01)、Dokmaia(P<0.01)、镰刀霉属(P<0.05)的相对基因丰度均显著或极显著小于原生土壤。由图5-b可知,海拔600m的玉屏油茶根围土壤中无分类地位或未知的真菌属基因相对丰富且显著最大;海拔300m的从江和810m的册亨土壤中真菌沙蜥属、子囊菌中不能区分的属、青霉菌属的基因相对丰富且显著较大;2180m的威宁土壤中真菌被孢霉属基因相对丰富且显著较大。
2.3不同海拔下油茶根围土壤真菌物种与土壤养分的相关性分析
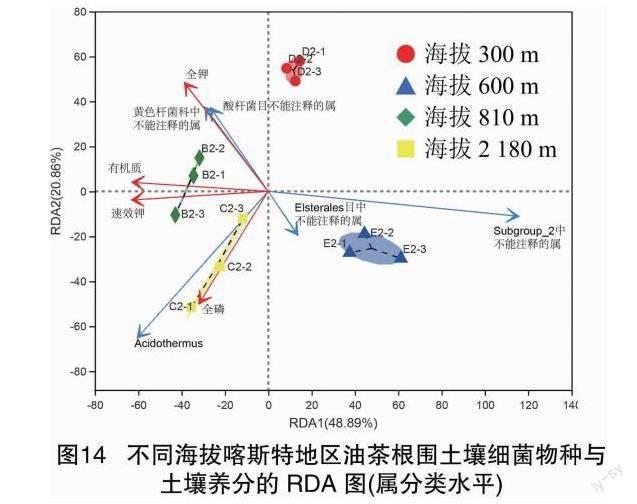
由图6可知,贵州喀斯特地区油茶根围土壤中的基本营养指标均与相对基因丰度排名前10的真菌属显著(P<0.05)或极显著(P<0.01)正相关性,其中与全钾含量显著或极显著正相关的真菌属最多,有5个属,分别为青霉属、木霉属、伞菌目中不能识别的属、沙蜥属、子囊菌中不能识别的属,相关系数为0.6883~0.8579。土壤速效钾含量和碱解氮含量同时与3个真菌属显著或极显著正相关,分别是Apiotrichum、被孢霉属、Solicoccozyma,相关系数为0.6153~0.9379。通过VIF方差膨胀因子分析,筛选出4个主要的土壤养分因子(表2)进行RDA分析。由图7可知,在海拔2180m的威宁,油茶根围土壤的全磷含量对真菌的群落分布相对影响最大,其中显著影响着该土壤中的被孢霉数量。在海拔300m的从江和810m的册亨,土壤的全钾含量对真菌的群落分布相对影响最大,其中显著影响着两地土壤中的沙蜥属真菌数量。
2.4不同分组油茶根围土壤细菌物种多样性分析
对土样中细菌进行DNA抽取,高通量分析后,得到优化总序列数1331376条,各样本序列数为40427~71865条,序列平均长度为412bp。由图8可知,采集土样不同分组下,OTU总数随着观测样本数的增加而渐渐趋于平缓,说明测序样本量足够,满足后续分析需求。由图9可知,原生土壤和农业耕作土壤的油茶根围土壤细菌香农指数差异不
显著,海拔300m的从江和海拔2180m的威宁土壤细菌香农指数较高,极显著高于海拔600m的玉屏和海拔810m的册亨(P<0.001)。
2.5不同分组油茶根围土壤细菌物种组成分析
由图10可知,变形菌门(28.69%)、酸杆菌门(21.71%)、放线菌门(18.57%)为贵州喀斯特地区油茶根围土壤的优势菌门,三者相对基因丰度总和达68.97%;热酸菌属(7.27%)是优势菌属。由图11可知,每个地区的样本点能团聚在一起,彼此没有交集,海拔300m的从江与海拔810m的册亨物种组成相比于其他地区物种组成较为相近,且胁强系数小于0.1,该结果具有较强代表性。由图12可知,在属分类水平下,原生土壤中的慢生根瘤菌、酸杆菌、罗氏菌、分支杆菌相对基因丰度均显著高于农业耕作土壤(P<0.05);热酸菌属的相对基因丰度随海拔的升高呈显著的先增后降趋势,海拔810m册亨的丰度最高。
2.6不同海拔梯度下油茶根围土壤细菌物种与土壤养分的相关性分析
由图13可知,相对基因丰度排名前10的细菌属中与全钾含量显著相关的有4个,其中念珠菌固体杆菌属与全钾含量、速效磷含量、有机质含量极显著正相关(P<0.01),相关系数分别为0.7544、0.8182、0.8181;苔藓杆菌属与全磷含量、全氮含量、速效钾含量、碱解氮含量显著或极显著正相关(P<0.05或P<0.01),相关系数分别为0.6386、0.6993、0.7622、0.7063。由图14可知,在海拔2180m的威宁,油茶根围土壤的全磷含量对细菌的群落分布相对影响最大,其中细菌群落分布中占据优势的为热酸菌属;在海拔810m的册亨,土壤有机质和速效钾的含量对细菌的群落分布相对影响最大;伴随着海拔的升高,土壤中的基础营养对细菌的群落分布相对影响作用先增后降。
3讨论与结论
影响根际微生物组构建的重要因素包括土壤碳氮含量比值、营养元素含量、pH值、水分含量以及地理位置等[15-16]。唐炜等研究发现,湖南不同油茶种植区根际的土壤养分特征和细菌群落丰富度均存在显著差异,无抚育手段干预的油茶林根际细菌和真菌的物种丰富度指数较高[17]。本研究發现,贵州喀斯特地区不同海拔的野生油茶根围土壤中的真菌和细菌物种多样性有显著差异,最低和最高海拔的土壤具有较为丰富的真菌、细菌物种,说明贵州喀斯特高、低海拔地区油茶根围土壤中的微生物资源丰富,具有较强的开发利用价值,但与前人研究结果不同的是人工引种栽培的油茶根围土壤(农业土壤)真菌和细菌多样性同野生油茶(原生土壤)相比,差异不显著,其原因可能是土壤中存在一定数量的无分类地位的真菌和细菌,在属分类水平下,其基因相对丰度分别占31.62%、41.51%,说明土壤中未知的微生物资源丰富,具有良好的挖掘前景。研究还发现,农业土壤的Apiotrichum真菌属丰度显著大于原生土壤,但其慢生根瘤菌、酸杆菌等细菌属的丰度显著较小,慢生根瘤菌具有固氮作用[18],酸杆菌可以降解植物纤维素等大分子聚合物[19],两者均是增强土壤养分的功能性细菌属,由此说明经过人为措施改良后的农业土壤不利于一些土壤功能性微生物的生存,土壤分解及营养调节转化能力可能变差。张鹏研究发现,油茶土壤的优势细菌门是绿弯菌门、变形菌门、酸杆菌门、放线菌门,优势真菌门是子囊菌门、担子菌门[20]。本研究对贵州省喀斯特野生油茶分布区的根围土壤进行微生物物种组成分析,发现和前人研究结论的区别在于土壤中的优势真菌增加了被孢霉门。吴泽龙研究发现,油茶林地土壤中,被抱霉属真菌和热酸菌属细菌的相对丰度最高,分别为12.70%、4.63%[21]。本研究与前人研究存在的差异为贵州喀斯特油茶根围土壤中的真菌以沙蜥属相对丰度最高,为12.81%,沙蜥属真菌和热酸菌属细菌目前暂无明确的生理生态功能性研究。
本研究还发现,在贵州喀斯特野生油茶林主要分布区,随着海拔升高(300~2180m),土壤速效钾和碱解氮含量同Apiotrichum、被孢霉、Solicoccozyma真菌属的相对基因丰度显著正相关,念珠菌固体杆菌属、苔藓杆菌属细菌属具有广泛的土壤养分关联性。其中,被孢霉的菌丝在有机降解过程中会影响其他微生物类群对养分的吸收,它的某些种类如高山被孢霉(Mortierellaalpina),会产生广泛的多不饱和脂肪酸,这些脂肪酸含有丰富的碳源,能改变土壤微生物的生境[22-23]。由此说明,海拔升高,喀斯特野生油茶根围土壤中的被孢霉属真菌相对丰度越高,不仅改变了土壤微生态,同时还提升了土壤速效钾和碱解氮的含量,分别在高海拔区威宁(海拔2180m)达到最大值。关于威宁的高山油茶根围土壤中是否具有丰度较高的高山被孢霉,被孢霉属真菌与土壤速效钾和碱解氮的含量又存在怎样的互作机制,有待进一步研究。
通过对贵州喀斯特地区不同土壤利用类型和不同海拔梯度的油茶根围土壤养分、微生物(真菌、细菌)物种多样性进行分析,结果表明,贵州喀斯特地区油茶林原生土壤和农业土壤在微生物多样性上差异不显著,但不同海拔梯度下差异显著。在属分类水平下,农业土壤中的慢生根瘤菌、酸杆菌等细菌属的丰度显著较小;随着海拔升高,喀斯特野生油茶根围土壤中的被孢霉属真菌相对丰度越高;土壤养分对真菌和细菌的群落分布有显著影响,随着海拔升高,作用呈先增后降趋势;另外,贵州喀斯特地区油茶根围土壤中未知微生物资源丰富,具有分类地位的微生物,其大多数生理生态功能不能明确,需进一步开发挖掘。
参考文献:
[1]单琴.油茶籽粕多糖的降血脂功效及其对肠道菌群的影响[D].合肥:合肥工业大学,2021:10-15.
[2]王金凤,谭新建,吴喜昌,等.我国油茶产业发展现状与对策建议[J].世界林业研究,2020,33(6):80-85.
[3]陈素传,季琳琳,姚小华,等.油茶品种果实主要经济性状和营养成分的差异分析[J].经济林研究,2022,40(2):1-9.
[4]梅方炜,胡静,欧天山,等.油茶深精加工研究进展[J].粮食与油脂,2021,34(11):6-8,40.
[5]罗达,史作民,李东胜.枯落物处理对格木林土壤碳氮转化和微生物群落结构的短期影响[J].应用生态学报,2018,29(7):2259-2268.
[6]张青,王辰,孙宗湜,等.土壤微生物生物量及多样性影响因素研究进展[J].北方园艺,2022(8):116-121.
[7]邹狮,严君,陈旭,等.不同植被类型对不同土层黑土土壤微生物群落功能多样性的影响[J].土壤与作物,2022,11(1):72-80.
[8]刘亚军,王文静,王红刚,等.作物轮作对甘薯田土壤微生物群落的影响[J].作物杂志,2021(6):122-128.
[9]左继林.油茶高产无性系对干旱胁迫及抗旱措施的响应[D].南京:南京林业大学,2014:1-7.
[10]杨敏芳,朱利群,韩新忠,等.耕作措施与秸秆还田对稻麦两熟制农田土壤养分、微生物生物量及酶活性的影响[J].水土保持学报,2013,27(2):272-275,281.
[11]马忠明,吕晓东,刘莉莉.耕作方式对绿洲灌区农田土壤有机碳及其分布的影响[J].应用生态学报,2015,26(1):122-128.
[12]ShenGQ,AshworthDJ,GanJ,etal.Biocharamendmenttothesoilsurfacereducesfumigantemissionsandenhancessoilmicroorganismrecovery[J].EnvironmentalScience&Technology,2016,50(3):1182-1189.
[13]林先貴.土壤微生物研究原理与方法[M].北京:高等教育出版社,2010.
[14]马献发.土壤学实验[M].1版.北京:中国林业出版社,2020.
[15]LebeisSL,RottM,DanglJL,etal.Culturingaplantmicrobiomecommunityatthecross-Rhodes[J].NewPhytologist,2012,196(2):341-344.
[16]PeifferJA,SporA,KorenO,etal.Diversityandheritabilityofthemaizerhizospheremicrobiomeunderfieldconditions[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica,2013,110(16):6548-6553.
[17]唐炜,陈隆升,陈永忠,等.湖南油茶根际微生物的群落结构特征[J].经济林研究,2021,39(4):51-59.
[18]王婧仪,曹扬荣,朱辉.天冬氨酸转氨酶在中慢生根瘤菌MAFF303099共生固氮中的作用[J].华中农业大学学报,2021,40(6):68-74.
[19]王光华,刘俊杰,于镇华,等.土壤酸杆菌门细菌生态学研究进展[J].生物技术通报,2016,32(2):14-20.
[20]张鹏.油茶林地土壤微生物群落特征[D].广州:华南农业大学,2019.
[21]吴泽龙.油茶林地土壤微生物多样性研究[D].长沙:中南林业科技大学,2016.
[22]代鹏,陈海琴,顾震南,等.高山被孢霉生产多不饱和脂肪酸发酵条件的研究进展[J].食品工业科技,2014,35(5):354-359.
[23]曹良元,蒋先军,张磊,等.麦角固醇与不同粒级团聚体土壤的相关性[J].土壤学报,2008,45(6):1184-1188.
