苹果MdPYL9基因对苹果组培苗耐盐性的影响
2023-06-17刘铭潇井俊丽李晓涵孙晔徐继忠周莎莎
刘铭潇 井俊丽 李晓涵 孙晔 徐继忠 周莎莎


摘要:以MdPYL9过表达的和未转基因(对照)的GL-3苹果组培苗为试验材料,在含有0、100、150mmol/LNaCl的MS培养基中培养15d,通过观察盐胁迫下过表达、未转基因组培苗表型的变化,测定相对电导率(REL)、保护酶[超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)]活性、丙二醛(MDA)含量、超氧阴离子(O-2·)含量、渗透调节物质(脯氨酸、可溶性蛋白)含量等生理指标及苹果抗盐相关基因表达量的变化,旨在探究MdPYL9基因对苹果组培苗耐盐性的影响。结果表明,处理15d后,对照、转基因苹果组培苗在100、150mmol/LNaCl处理下均出现盐胁迫症状,但转基因组培苗的症状较轻,对照植株的症状较重。盐处理后转基因组培苗中的MDA含量、相对电导率、超氧阴离子(O-2·)含量总体呈上升趋势,且显著低于对照。转基因组培苗中渗透调节物质可溶性蛋白在100mmol/LNaCl处理下最高,脯氨酸含量逐渐上升,并且显著高于对照。转基因苹果组培苗中SOD、POD、CAT活性在100mmol/LNaCl处理下最高,显著高于对照中的SOD、POD、CAT活性。荧光定量PCR分析结果表明,盐处理后,苹果抗盐相关基因MdSOS1、MdSOS2、MdSOS3和MdNHX1在转基因组培苗中表达量显著高于对照。由研究结果可以看出,MdPYL9基因的过表达可在一定程度上提高组培苹果苗的耐盐性。
关键词:苹果;MdPYL9基因;组培苗;耐盐性
中图分类号:S661.101文献标志码:A
文章编号:1002-1302(2023)10-0149-06
苹果(MalusdomesicaBorkh.)是世界主栽果树之一,我国的苹果种植面积和产量占世界的一半以上,居世界首位[1]。土壤盐渍化可造成果树树体营养不良、叶片发黄和产量下降等问题,是限制苹果产量的一个重要因素[2],已被认为是干旱、半干旱地区和广大灌区农业生产发展中的一个重要阻碍,并且已经受到越来越多的关注[3],全球已有约7%陆地遭受到盐碱化的胁迫,而且这个比例依然在不断提高。我国是土壤盐碱化问题严重的国家,盐碱化土壤面积一望无垠、分布广泛,不利于区域农业的发展[4]。由于苹果的遗传背景较为复杂,并且育种周期较长,通过传统杂交方法很难获得结合所有最佳品质的品种[5]。因此,尽快探索挖掘苹果胁迫基因,提高苹果的抗逆性,确保其在恶劣环境下也能增产,对于加快我国苹果产业的发展具有重要意义[6]。
脱落酸(ABA)作为植物激素,在植物生长发育的任何阶段都有举足轻重的地位,也与植物中干旱、盐分和其他逆境胁迫反应有关,因而被称为逆境激素[7]。有研究发现,通过基因工程提升ABA含量或加强ABA信号通路,可以提升植物对干旱、高浓度盐等非生物胁迫的抵抗力[8]。2009年,利用基因筛选和酵母双杂交的方法在拟南芥细胞中发现ABA受体PYR/PYL/RCAR(简称PYLs)[9-11],其主要功能是辨別ABA信号和传输启动信号[12]。有研究发现,AtPYL9与拟南芥抗旱有关[13],OsPYL9在水稻胚乳中特异性表达,提高了对ABA的敏感[14]。小麦TaPYL9对脱落酸敏感,可能参与了小麦对高盐、干旱胁迫响应的调控[15]。本研究对前期获得的MdPYL9基因过量表达的苹果GL-3组培苗进行抗盐性研究,分析MdPYL9对苹果抗盐性的调控机制,以期为苹果抗逆育种研究提供理论依据。
1材料与方法
1.1试验材料
本试验于2022年4月2日至5月30日在河北农业大学园艺学院生物技术实验室进行,试验材料为继代25d且生长良好、长势均一致的MdPYL9基因过表达苹果组培苗和非转基因GL-3组培苗。
1.2试验方法
1.2.1试验处理选择生长、长势一致的组培苗,每瓶2株,每个处理接种12瓶,设置3次重复,分别接种于含有0、100、150mmol/LNaCl的继代培养基中,于24℃光照培养。处理15d后观察表型并拍照、收集叶片,用液氮速冻后于-80℃超低温冰箱中存储待测。
1.2.2生理生化指标的测定用氮蓝四唑(NBT)法[16]测定超氧化物歧化酶(SOD)活性,用紫外吸收法[16]测定过氧化氢酶(CAT)活性,用愈创木酚法[16]测定过氧化物酶(POD)活性,用考马斯亮蓝G-250染色法[17]测定可溶性蛋白含量,用硫代巴比妥酸法[17]测定丙二醛(MDA)含量,用酸性茚三酮染色法[17]测定脯氨酸含量。相对电导率参考李银峰的方法[18]测定。
1.2.3RNA提取和qRT-PCR表达的定量分析植物总RNA的提取使用聚合美RNA分离试剂盒(M5PlantRNeasyComplexMiniKit,北京,中国),按照说明书进行操作。测定反转录得到的cDNA核酸样品浓度后,用ddH2O将cDNA全部稀释成200ng/μL。用LightCycler96荧光定量仪进行qRT-PCR分析,分析抗盐相关基因MdSOS1、MdSOS2、MdSOS3和MdNHX1表达量的变化。本研究所用引物序列见表1。
1.2.4数据处理与分析用Excel对数据进行处理,用IBMSPSSStatistics23.0进行统计分析,用单因素方差分析(ANOVA)方法进行Duncans多重比较检验,α=0.05。
2结果与分析
2.1盐胁迫下对照和转基因组培苗表型的变化
如图1-a所示,在0mmol/LNaCl处理下,转基因苹果组培苗和对照植株生长情况基本一致。用100mmol/LNaCl处理15d后,转基因组培苗和对照植株都出现盐胁迫症状,但转基因苹果组培苗叶片的褐斑数量比对照少。用150mmol/LNaCl处理15d后,转基因组培苗症状较轻,对照植株的症状更加严重。随着盐处理浓度的增加,各株系的MDA含量均在100mmol/LNaCl处理下达到最高,在150mmol/LNaCl处理下有所下降,总体呈上升趋势,但上升程度不同,0mmol/LNaCl处理转基因植株与对照株系的MDA含量没有显著差异,但是在用100、150mmol/LNaCl处理后对照MDA含量显著高于转基因株系,并且差异显著(图1-b)。由图1-c可以看出,随着盐浓度的增加,植株的相对电导率(REL)逐渐上升,并且不同处理间差异显著。
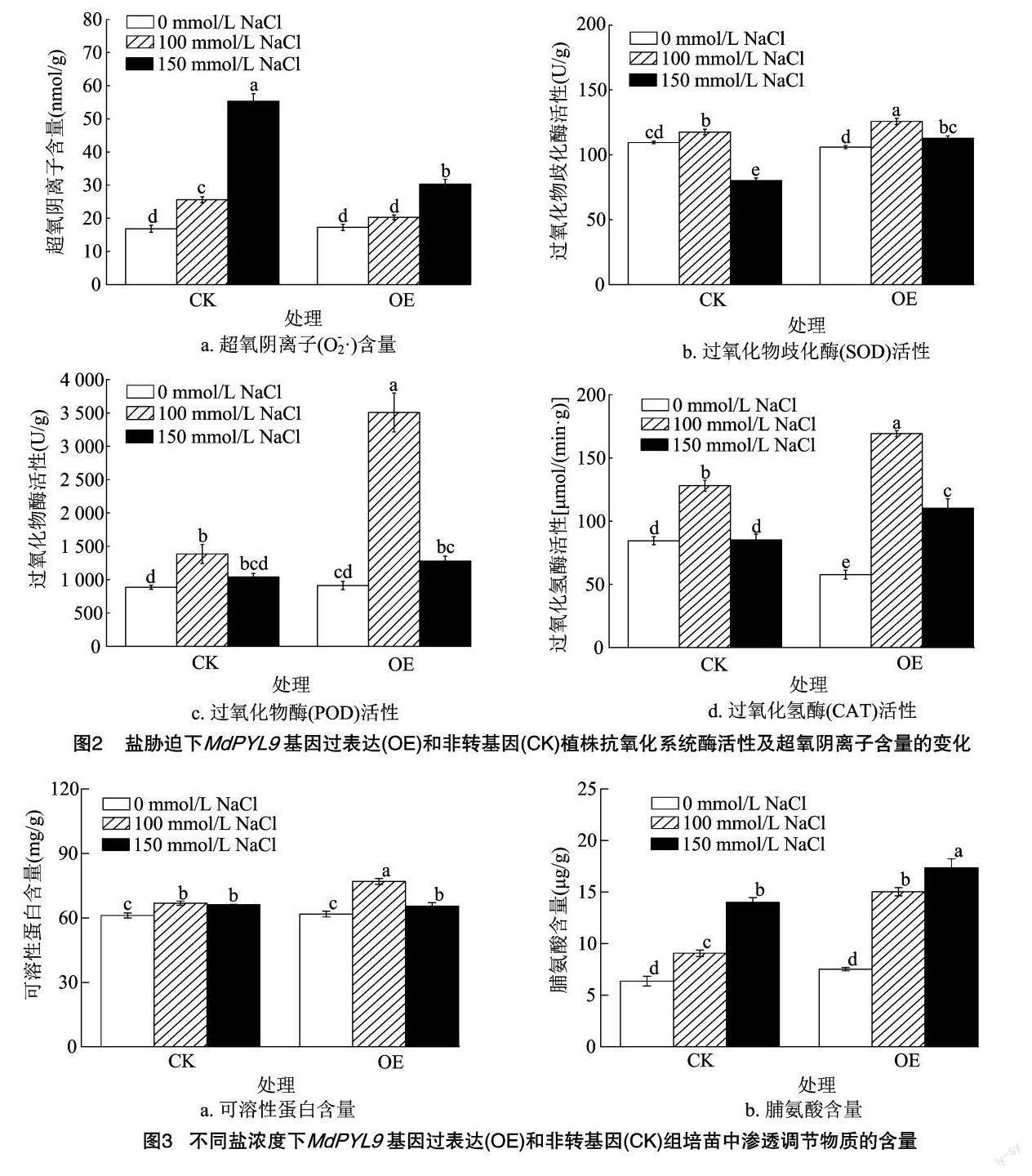
2.2超氧阴离子(O-2·)含量、保护酶活性的变化
由图2-a可以看出,用0mmol/LNaCl处理15d后,对照和转基因组培苗的超氧阴离子含量无显著差异,盐胁迫处理后,对照和转基因组培苗中超氧阴离子含量均有不同程度的上升,在150mmol/LNaCl处理下含量达到最高,对照组培苗中超氧阴离子含量显著高于转基因组培苗。从图2-b、图2-c中可发现,盐胁迫15d后,在0mmol/LNaCl处理下,对照和转基因组培苗的SOD、POD活性无显著差异,100mmol/LNaCl处理组的SOD、POD活性最高,并且转基因组培苗的SOD、POD活性显著高于对照。由图2-d可知,盐胁迫15d后,对照、转基因组培苗的CAT活性在100mmol/LNaCl处理下最高,在150mmol/LNaCl处理下,CAT活性有所下降,在0mmol/LNaCl处理下,转基因组培苗的CAT活性显著低于对照,但盐胁迫处理后CAT活性显著高于对照。
2.3渗透调节物质含量的变化
从图3-a可以看出,用0mmol/LNaCl处理15d后,对照和转基因组培苗的可溶性蛋白含量差异不显著,但在100mmol/LNaCl盐胁迫下,对照和转基因幼苗的可溶性蛋白质含量增加,转基因组培苗的可溶蛋白含量显著高于对照。在150mmol/LNaCl处理下,对照和转基因幼苗的可溶性蛋白含量较0mmol/L处理也增加,但对照和处理组两者之间没有显著差异。从图3-b可以看出,处理15d后,0mmol/LNaCl处理的对照和转基因组培苗的脯氨酸含量无显著差异,盐胁迫处理后,对照和转基因组培苗中的脯氨酸含量均有不同程度的上升,在150mmol/LNaCl处理下最高,并且转基因组培苗中
的脯氨酸含量显著高于对照。
2.4苹果抗盐相关基因表达量的变化
由图4-a至图4-d可以看出,用150mmol/LNaCl处理15d后,MdSOS1、MdSOS2、MdSOS3和MdNHX1基因的相对表达量在各转基因组培苗中显著上调,转基因组培苗内各基因的相对表达量显著高于对照。
3讨论与结论
盐胁迫会抑制植物的生长和发育,改变植株形态、影响植株生理生化和代谢特征,对植物生长不利[19]。本研究结果表明,在0mmol/LNaCl处理下,对照和转基因组培苗的表型差异不明显,在盐胁迫后都出现了受损害的现象。与100mmol/LNaCl处理相比,在150mmol/LNaCl处理后受伤害特征更加明显。但是在相同胁迫时间内,对照植株叶面褐斑和坏死现象比转基因更多。细胞中的MDA含量反映了膜脂过氧化的程度,相对电导率反映了细胞膜的通透性。相对电导率和MDA含量的变化都会在一定程度上影响植物细胞膜的完整性及对不利胁迫的反应损伤程度[6]。用100、150mmol/LNaCl处理后,植株中MDA含量和相对电导率显著提高,表明MdPYL9基因过表达缓解了盐胁迫下生物膜的受损伤程度。
盐胁迫会使植物体内活性氧含量增加,使植物体中细胞的结构受到损害[20]。本研究中,在0mmol/LNaCl处理中对照和转基因组培苗超氧阴离子含量没有显著性差异,盐胁迫后都有不同程度上升,但对照植株中超氧阴离子含量更多,表明对照植株受到的氧化胁迫更加严重,转基因在一定程度上缓解了由盐胁迫引起的氧化胁迫。植物可以触发抗氧化防御系统来清除过量的活性氧,并保护细胞不受到氧化胁迫[21]。有试验表明,盐胁迫下植物体内的SOD、POD活性升高,高盐害下植物体内的SOD、POD活性反而降低[22]。本研究结果显示,用100mmol/LNaCl处理后,对照和转基因组培苗中的SOD、POD、CAT活性都有所升高,但是转基因组培苗中的SOD、POD、CAT活性显著高于对照株系。在150mmol/LNaCl处理下,对照和转基因组培苗中的SOD、POD、CAT活性都有所下降,转基因组培苗中的SOD、CAT活性显著高于对照,POD活性没有显著差异。酶活性在100mmol/LNaCl处理下最高,在150mmol/LNaCl处理下有所下降,可能由于植物在中、低盐浓度条件下的应激反应表现为酶活性的升高,盐浓度过高会对植物组织产生过强的迫害。
在盐胁迫条件下,植物细胞中的蛋白质合成代谢活性增强,使植物自身能够合成更多的蛋白质参与渗透压调节,从而提高植物对盐胁迫环境的适应能力[23-24]。阎艳霞等在对枣的研究中发现,盐处理后枣叶中可溶性蛋白含量随着NaCl浓度的增加而增加[25]。八棱海棠可溶性蛋白含量随盐含量的增加表现为先上升后下降最后上升的趋势[26]。在本试验中,对照和转基因组培苗的可溶性蛋白质含量在0mmol/LNaCl处理下没有显著差异,盐处理后表现为先升高后降低的趋势。转基因组培苗中的可溶性蛋白含量的增幅大于对照,说明转基因组培苗具有更强的抑制细胞失水的能力,有较高的耐盐能力。众多研究结果表明,植物体内的脯氨酸含量均随外界盐浓度的增加而升高[27-29]。ZmHDZ10转基因植株中脯氨酸含量的增加提高了其对干旱和盐胁迫的耐受性[30]。在本试驗中,未添加NaCl处理的对照和转基因组培苗中脯氨酸含量没有显著差异,盐胁迫后脯氨酸含量上升,转基因组培苗中的脯氨酸含量高于对照。研究结果表明,MdPYL9通过调节脯氨酸的积累来调节苹果植株的耐盐性。在本试验中,通过分析从渗透调节物质可知,转基因植株的耐盐性更强。前人研究发现,盐胁迫会导致植物渗透调节失衡和产生离子毒害,拟南芥细胞膜上的SOS1转运蛋白是Na+/H+逆向转运蛋白,NHX为液泡膜上的Na+/H+逆向转运蛋白,过表达该基因会增强植物的抗盐性[31]。SOS2、SOS3能够调控SOS1的表达,也能够响应盐胁迫[32]。在150mmol/LNaCl处理下,转基因组培苗中MdSOS1、MdSOS2、MdSOS3和MdNHX1基因的表达量显著高于对照,因此推测MdPYL9可能参与了调控MdSOS1、MdSOS2、MdSOS3和MdNHX1的表达来调节植物耐盐性。以上研究结果表明,MdPYL9基因在提高苹果植株的抗盐性方面发挥着一定作用,过表达MdPYL9基因后苹果植株对盐胁迫的耐受性增强。
参考文献:
[1]崔家升,李晓萍.世界苹果种植概况与我国苹果生产前景展望[J].北方果树,2012(4):1-3.
[2]玉米提·哈力克,塔依尔江·艾山,张利霞,等.柯柯牙城郊防护林主要造林类型土壤改良效应研究[J].新疆大学学报(自然科学版),2015,32(3):258-264,250.
[3]郭全恩.干旱地区果树对土壤盐渍化胁迫的响应机制[D].杨凌:西北农林科技大学,2006.
[4]李建国,濮励杰,朱明,等.土壤盐渍化研究现状及未来研究热点[J].地理学报,2012,67(9):1233-1245.
[5]周瑞金,张传来.苹果转基因研究进展[J].广西农业科学,2009,40(1):71-75.
[6]马梦楠,刘媛,马锋旺,等.苹果MdGH3-2/12在盐胁迫下的功能分析[J].干旱地区农业研究,2021,39(6):39-52.
[7]王宏,蔺经,李晓刚,等.盐胁迫下的杜梨PbPYL4基因克隆及其与PbNCED2基因表达分析[J].果树学报,2014,31(6):1017-1023.
[8]马宗桓,陈佰鸿,李文芳,等.葡萄PYL基因家族的鉴定与表达分析[J].果树学报,2018,35(3):265-274.
[9]ParkSY,FungP,NishimuraN,etal.Abscisicacidinhibitstype2CproteinphosphatasesviathePYR/PYLfamilyofSTARTproteins[J].Science,2009,324(5930):1068-1071.
[10]MiyazonoK,MiyakawaT,SawanoY,etal.Structuralbasisofabscisicacidsignalling[J].Nature,2009,462(7273):609-614.
[11]MaY,SzostkiewiczI,KorteA,etal.RegulatorsofPP2Cphosphataseactivityfunctionasabscisicacidsensors[J].Science,2009,324(5930):1064-1068.
[12]KrasenskyJ,JonakC.Drought,salt,andtemperaturestress-inducedmetabolicrearrangementsandregulatorynetworks[J].JournalofExperimentalBotany,2012,63(4):1593.
[13]ZhaoY,ChanZL,GaoJH,etal.ABAreceptorPYL9promotesdroughtresistanceandleafsenescence[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica,2016,113(7):1949-1954.
[14]ChenZQ,KongL,ZhouY,etal.Endosperm-specificOsPYL8andOsPYL9actaspositiveregulatorsoftheABAsignalingpathwayinriceseedgermination[J].FunctionalPlantBiology,2017,44(6):635-645.
[15]徐园园,赵鹏,刘冬梅,等.小麦ABA受体基因TaPYL9的克隆和表达分析[J].河南农业科学,2020,49(7):18-24.
[16]高峻凤.植物生理学实验指导[M].北京:高等教育出版社,2006:211-218.
[17]王学奎.植物生理生化实验原理和技术[M].北京:高等教育出版社,2006:134-204.
[18]李银峰.转AtCBF3基因苹果株系对盐碱及重金属胁迫的响应[D].保定:河北农业大学,2014.
[19]BaathGS,ShuklaMK,BoslandPW,etal.IrrigationwatersalinityinfluencesatvariousgrowthstagesofCapsicumannuum[J].AgriculturalWaterManagement,2017,179:246-253.
[20]MudgalV,MadaanN,MudgalA.Biochemicalmechanismsofsalttoleranceinplants:areview[J].InternationalJournalofBotany,2010,6(2):136-143.
[21]辛苗苗.苹果质膜内在水通道蛋白基因MdPIP2;5的克隆和功能分析[D].杨凌:西北农林科技大学,2021.
[22]于玮玮,曹波,龙鸿,等.新疆野苹果幼苗对盐胁迫的生理响应[J].华北农学报,2016,31(1):170-174.
[23]邹琦.植物生理学试验指导[M].北京:中国农业出版社,2000:163-166.
[24]常丽丽,彭存智,王丹,等.盐芥叶片应答盐胁迫的蛋白质组学分析[J].江苏农业学报,2022,38(1):49-64.
[25]阎艳霞,王玉魁,张东.不同枣品种对NaCl胁迫的适应性研究[J].河南农业大学学报,2008,42(4):398-401.
[26]曾丽蓉,郑鑫,张婷,等.四种苹果砧木耐盐性差异比较[J].天津农业科学,2015,21(3):105-109.
[27]KumarSG,ReddyAM,SudhakarC.NaCleffectsonprolinemetabolismintwohighyieldinggenotypesofmulberry(MorusalbaL.)withcontrastingsalttolerance[J].PlantScience,2003,165(6):1245-1251.
[28]Santa-CruzA,AcostaM,RusA,etal.Short-termsalttolerancemechanismsindifferentiallysalttoleranttomatospecies[J].PlantPhysiology&Biochemistry,1999,37(1):65-71.
[29]張云起,刘世琦,杨凤娟,等.耐盐西瓜砧木筛选及其耐盐机理的研究[J].西北农业学报,2003,12(4):105-108.
[30]ZhaoY,MaQ,JinXL,etal.Anovelmaizehomeodomain-leucinezipper(HD-Zip)Igene,Zmhdz10,positivelyregulatesdroughtandsalttoleranceinbothriceandArabidopsis[J].PlantandCellPhysiology,2014,55(6):1142-1156.
[31]ShiHZ,QuinteroFJ,PardoJM,etal.TheputativeplasmamembraneNa+/H+antiporterSOS1controlslong-distanceNa+transportinplants[J].ThePlantCell,2002,14(2):465-477.
[32]曲常志.苹果MdMYB4基因表达载体构建,愈伤转化及抗盐性鉴定[D].泰安:山东农业大学,2017.
