一氧化氮对棉花幼苗生长和碳氮代谢的影响
2023-06-17吴建飞殷梦瑶任荣荣温天旺汤飞宇
吴建飞 殷梦瑶 任荣荣 温天旺 汤飞宇


摘要:探讨一氧化氮(NO)对棉花幼苗生长及碳氮含量的影响,明确幼苗生长参数与碳氮含量的相关性,揭示NO在棉花培育壮苗中的应用价值。设置NO供体硝普钠(SNP)5个浓度水平:0、100、250、500、750μmol/L,在棉花幼苗1叶1心时涂抹叶片,至3叶1心时取样观察对地上部形态指标、根系构型参数、NO含量、碳氮生理指标的影响,并对幼苗形态指标与碳氮生理指标进行相关性分析。与清水对照相比,不同水平SNP处理均有提升效果,且存在一定的浓度效应,其中500μmol/L水平SNP处理效果最好,其显著提高了根总长(18.3%)、根体积(28.6%)、根尖数(379.8%)、根系活力(10.9%)、根系干质量(23.4%)、全株鲜质量(16.1%)和壮苗指数(29.0%),叶片蔗糖含量、根系全碳含量和碳氮比显著高于对照,叶片和根系淀粉含量显著低于对照,表明SNP处理可能促进了棉花幼苗的光合碳生产和输出到根系,有利于根系的生长。幼苗地上部干质量和全株干质量与根、茎、叶全氮含量呈显著或极显著负相关,与碳氮比呈显著或极显著正相关。在棉花幼苗1叶1心期,叶片涂抹500μmol/LSNP有助于培育健壮幼苗,提高幼苗素质。
关键词:棉花;一氧化氮(NO);硝普钠(SNP);幼苗生长;根系构型
中图分类号:S562.01文献标志码:A
文章编号:1002-1302(2023)10-0084-07
前人研究发现一氧化碳(CO)、一氧化氮(NO)等气体分子广泛参与植物生长发育进程[1],其中NO是一种重要的气体信号分子,广泛参与植物的生长发育、营养吸收和对逆镜胁迫的响应等[2-5],具有促进种子萌发[6]、抑制幼苗下胚轴伸长[7-8]、影响根系形态建成[9-10]、延缓叶片衰老[11-12]、缓解重金属危害[8,13-14]等作用。NO在棉花上的应用主要涉及在缓解氮胁迫、冷害胁迫、淹水胁迫、盐胁迫中的作用[15-19]。NO主要通过提高抗氧化酶的活性和抗氧化剂的含量,降低过氧化氢(H2O2)和丙二醛(MDA)的积累,提高细胞膜结构的稳定性等增强棉花种子萌发和幼苗生长耐冷害的能力[15-16]。NO供体硝普钠(SNP)通过上调NO合成、下调糖酵解和发酵、乙烯生产、脱落酸(ABA)合成相关基因表达,提高叶片吲哚乙酸(IAA)和赤霉素(GA)水平,降低ABA和乙烯水平,减少叶片过氧化氢和MDA的产生,增加叶片叶绿素含量及光合速率等缓解棉花在淹水胁迫下的产量损失[19]。SNP延缓盐胁迫诱导的棉花叶片衰老可归结于叶片钠离子和ABA含量的显著下降及钾离子和细胞分裂素的显著增加[18]。然而,目前对于NO影响棉花早期(幼苗)生长的影响还知之甚少。
南方棉区春季常低温阴雨、日照不足、田间湿度大,影响直播棉花种子的萌发和幼苗的长势,难以达到一播全苗、壮苗早发。发苗壮苗的关键是先发根壮根,因此棉花苗期管理的重点是促发根壮根。NO具有诱导番茄侧根发生[10],抑制拟南芥和莴苣幼苗下胚轴及番茄植株节间伸长[7],提高大麦幼苗叶片叶绿素含量等作用[20],但外源NO是否能促进棉花幼苗根系发生、健壮生长和光合生产还不清楚。碳氮代谢是植物最基础的生化代謝活动,广泛影响植物的生长发育过程。本试验研究了不同SNP处理下幼苗植株根、茎、叶碳氮含量(非结构性及全量形式)的变化,并与棉花幼苗的生长参数进行相关性分析,旨在为NO应用于培育棉花壮苗、提高幼苗素质提供理论依据和技术指导。
1材料与方法
1.1试验材料与设计
试验材料为江西农业大学棉花课题组自育的陆地棉品系A201,试验于2020年10月在江西农业大学农学院4楼温室开展。采用穴盘育苗,穴盘规格长(54cm)×宽(28cm)×高(4cm),每盘105穴,穴容积25mL,上口径3.5cm,下口径1cm。培养基质为粉细的未耕种红壤土与稻壳灰按体积比1∶1调制而成,装盘备用。该基质的养分状况如下:pH值为5.4、有机质含量为36.5g/kg、有效磷含量为29.9mg/kg、速效钾含量为310.5mg/kg、全氮含量为0.07%、铵态氮含量为22.8mg/kg、硝态氮含量为30.5mg/kg。棉花种子酸脱绒后经0.2%次氯酸钠消毒、漂洗晾干,选饱满健壮种子于2020年12月24日播种于穴盘,每穴1粒,穴盘放置于塑料托盘内,每日盘内适度浇水使幼苗处于适宜水分状态。培养室条件:温度28℃/24℃(昼/夜)、光周期14h/10h(光/暗)、光照度1500lx。当幼苗长至1叶1心时,将不同浓度的NO供体SNP均匀涂抹叶片。试验处理为5个浓度梯度的SNP溶液:0(对照)、100、250、500、750μmol/L,随机区组设计,3次重复。当幼苗长至3叶1心时,每个小区收获生长整齐一致的植株3株,测量株高、茎粗后,分为2份。一份作干样,分解为根、茎(含叶柄)、叶片后经105℃杀青30min,然后于65℃下烘干至恒质量。粉细后用于碳水化合物、全碳和全氮含量的测定;另一份作鲜样,根系经扫描仪扫描和根系活力测定后,与其他部位统一保存于-80℃的超低温冰箱中,用于测定内源NO含量。
1.2测定项目与方法
1.2.1地上部形态指标的测定株高为根系着生处至主茎生长点之间的距离,用直尺测定;茎粗为幼苗下胚轴中部的直径,用游标卡尺测定。壮苗指数和日均干质量增长量(G值)的测定采用何亚飞等的方法[21]。计算公式如下:壮苗指数=(茎粗/株高+地下部干质量/地上部干质量)×全株干质量;G值=全株干质量/育苗天数;根冠比=地下部干质量/地上部干质量。
1.2.2根系构型参数的测定用EPSONExpression12000XL扫描仪对根系进行扫描,经WinRHIZOPro软件分析获取根系构型相关参数,包括根总长、根表面积、根体积、根平均直径和根尖数。
1.2.3根系活力和碳氮含量的测定根系活力的测定采用TTC染色法[22]。全碳含量采用TOC总有机碳分析仪测定(multiN/C2100+HT1300):称取研磨并烘干好的干样样品0.04g左右,放入燃烧皿中,待仪器准备好后,放入炉内进行全碳浓度的测定。全氮含量使用凯氏定氮法测定:称取研磨并烘干好的干样样品0.4g左右于消煮管内,加入5g催化剂(CuSO4·5H2O和K2SO4按9∶1的质量比均匀混合)充分混匀,然而加入10mL分析纯浓硫酸后放置于消煮炉420℃恒温消煮1h,待消解液冷却后,使用FOSS凯氏定氮仪进行全氮含量的测定。非结构性碳水化合物的提取参考陈功等的方法[23]:葡萄糖、果糖、蔗糖用80%乙醇溶液于80℃恒温条件下提取。上述提取后的残渣,烘干过夜后加入高氯酸提取淀粉。葡萄糖含量采用酶比色法[24]测定,蔗糖、果糖含量采用间苯二酚法[25]测定,淀粉含量采用蒽酮法[25]测定。
1.2.4吸氮碳成本(gC/gN)的计算该指标反映植物在获取氮素上所花费在根系上的碳投入,表征为根系全碳生物量与整株幼苗氮生物量的比值[26],根系全碳生物量=根系生物量×全碳含量,幼苗氮生物量=幼苗生物量×全氮含量。
1.2.5NO含量的测定按照南京建成生物工程研究所研制的NO测定试剂盒(A013-2-1)说明书进行。
1.2.6光合色素的测定称取叶片鲜样0.1g左右,剪碎放入10mL塑料试管内并用玻璃棒捣成糊状,加入95%乙醇,用锡箔纸包裹完整后放入4℃冰箱浸提过夜,直到叶片无色为止。叶片色素提取完成后,以95%乙醇为对照,分别在波长665nm和649nm处测吸光度。叶绿素a、b含量的计算公式如下:
叶绿素a浓度(Ca,μg/mL)=13.95D665nm-6.88D469nm;
叶绿素b浓度(Cb,μg/mL)=24.96D649nm-7.32D665nm;
叶绿素总浓度(CT)=Ca+Cb;叶绿素含量(mg/g)=(CT·V·N)/(m·1000)
式中:CT为叶绿素总浓度,mg/L;V为提取液体积,mL;N为稀释倍数;m为样品质量,g。
1.3数据统计与分析
采用随机区组单因素方差分析模型检测SNP处理效应,Duncans新复极差法分离各处理平均值,采用Pearson相关系数进行相关分析,以上统计均通过SPSS20.0软件相关统计包进行运算。使用Origin2021b软件作图。
2结果与分析
2.1不同SNP水平对棉花幼苗生长参数和干(鲜)质量的影响
由表1可知,SNP处理后株高略低于清水对照,茎粗和G值略高于对照。500μmol/LSNP处理后的壮苗指数与对照相比,显著提高了29.0%;由表2可知,500μmol/LSNP处理下根系干质量和全株鲜质量分别比对照显著增加23.4%和16.1%,且在各个浓度水平的SNP处理中表现最好。
2.2不同SNP水平对幼苗根系形態参数和根系活力的影响
由表3可知,SNP处理可促进幼苗根系的发生和伸长,提高根系活力。与对照相比,500μmol/LSNP显著提高了根总长、根体积、根尖数和根系活力,分别比对照提高了18.3%、28.6%、379.8%和10.9%。在所有水平的SNP处理中,以500μmol/L水平表现最佳。
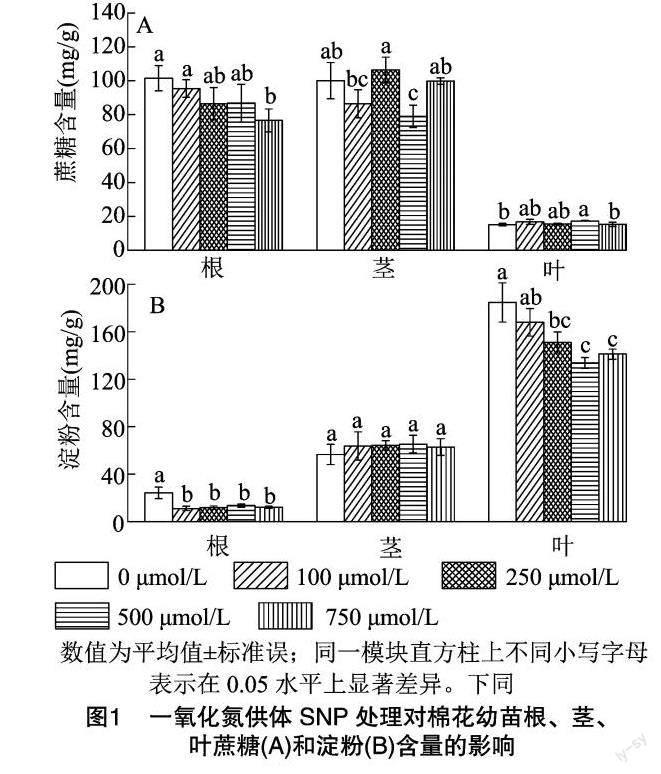
2.3不同SNP水平对幼苗棉株蔗糖和淀粉含量的影响
由图1-A可知,根系中蔗糖含量随SNP浓度增加而下降,750μmol/L水平处理下最低,比对照显著低24.5%,在500μmol/L水平下,茎中蔗糖含量比对照显著低21.0%,而叶片中蔗糖含量比对照显著高14.7%。由图1-B可知,SNP处理后,显著降低了根系中淀粉含量,对主茎淀粉含量没有影响,随着SNP处理水平升高,叶片淀粉含量呈下降趋势,且在250、500、750μmol/L水平下显著低于对照。
2.4不同SNP浓度对幼苗碳氮状况的影响
由表4可知,SNP处理对幼苗根、茎、叶全氮含量均无显著影响。SNP处理显著提高了根系全碳含量和碳生物量(根系含碳量)。750μmol/L水平与对照相比,显著降低了主茎全碳含量,但显著提高了叶片全碳含量。500μmol/L处理下根系的碳氮比与对照相比,显著提高了25.6%,且与其他SNP水平处理无显著差异。
2.5SNP处理对棉花幼苗吸氮碳成本的影响
由图2可知,500μmol/LSNP处理幼苗的吸氮碳成本显著大于对照和100μmol/LSNP处理,与其他2个处理差异不显著。
2.6SNP处理对幼苗叶片和根系内源NO含量的影响
由图3可知,500μmol/LSNP处理显著提高了叶片的内源NO水平,表明SNP通过提高棉花幼苗的内源NO水平影响其生长。
2.7SNP处理对幼苗叶片叶绿素含量的影响
由图4可知,与对照相比,500μmol/LSNP处理下叶绿素a、叶绿素b及叶绿素a+b的含量均显著降低影响。
2.8棉花幼苗生长参数与碳氮生理指标的相关性分析
用于相关性分析的棉花幼苗生长参数包括株
高、茎粗、地上部干质量、根系干质量、全株干质量、根总长、根表面积、根体积、根平均直径、根尖数、根系活力,共11个性状;碳氮生理指标包括根蔗糖含量、茎蔗糖含量、叶蔗糖含量、根淀粉含量、茎淀粉含量、叶淀粉含量、根全碳含量、茎全碳含量、叶全碳含量、根全氮含量、茎全氮含量、叶全氮含量、根碳氮比、茎碳氮比、叶碳氮比,计15个性状。由表5可知,根、茎、叶全氮含量与幼苗生长参数基本呈负相关,其中根、茎、叶全氮含量与地上部干质量、全株干质量呈显著或极显著负相关,根全氮含量、茎全氮含量与根尖数呈显著或极显著负相关,根全氮含量、叶全氮含量与根体积呈显著负相关,根全氮含量与根表面积呈显著负相关,茎全氮含量与根干质量呈显著负相关。根、茎、叶碳氮比与幼苗生长参数基本上呈正相关,其中根、茎、叶碳氮比与地上部干质量、全株干质量呈显著或极显著正相关,根碳氮比与根体积、根表面积、茎粗、根尖数呈显著或极显著正相关,茎碳氮比与根尖数、根干质量呈显著正相关。
3讨论
3.1SNP处理对棉花幼苗地上部形态和根系构型参数的影响
NO供体SNP处理显著影响了棉花幼苗根系鲜质量、干质量、根总长、根体积、根平均直径、根尖数、根系活力、全株鲜质量及壮苗指数(表1~表3),说明SNP处理主要影响棉花幼苗根系的发生和生长,以500μmol/L水平效果最佳,可能是通过提高植株内源NO水平所致(图2)。SNP处理后降低了株高,提高了茎粗、G值、地上部干鲜质量、全株干质量,但尚未达到显著差异,与Beligni等报道的NO抑制拟南芥和莴苣幼苗下胚轴及番茄植株节间伸长因而导致植株变矮的结果[7]相似。而在根系形态性状中,SNP影响最大的是根尖数,除100μmol/LSNP处理外,其他浓度的SNP处理均显著提高了幼苗根尖数,其中500μmol/L水平比对照提高了3.8倍。棉花是直根系,根系的根尖数基本上等同于侧根数,因此,SNP处理可促进棉花侧根发生,这与Correa-Aragunde等报道的NO诱导番茄侧根发生的结果[10]一致。NO诱导侧根发生可能是通过参与吲哚乙酸(IAA)信号转导途径而起作用[10]。NO可通过抑制IAA氧化酶活性减少IAA的降解[27],另一方面NO水平升高后通过抑制生长素运输载体PIN1的表达而减少IAA的向顶(根部)运输[28],因而促进侧根的发生。NO可通过调控番茄中柱鞘细胞细胞周期基因如促进CYC3;1表达,抑制KRP2表达诱导侧根原基的形成,此外,依赖生长素的细胞周期基因调控也依赖NO[29]。
3.2SNP处理对棉花幼苗碳氮状况的影响
SNP处理导致棉花幼苗叶片蔗糖含量上升、淀粉含量下降,特别是500μmol/L水平与对照相比均达到显著差异水平(图1-A、1-B),蔗糖是碳水化合物的主要运输形式,非胁迫条件下叶片蔗糖含量高通常表明叶片光合生产能力强;淀粉是碳水化合物的贮藏形式,叶片淀粉含量下降,对叶片光合作用的反馈抑制作用减弱,有利于碳水化合物的输出[30]。以上结果表明,500μmol/LSNP处理显著促进了幼苗叶片的光合生产和碳水化合物的输出,但叶片光合生产的增强可能并不是叶绿素含量的提高引起,是因为500μmol/LSNP处理下叶片的叶绿素含量较对照显著下降。叶片合成的碳水化合物向下运输至根系以满足其发育需求,SNP处理后根系的淀粉和蔗糖含量均低于对照,其中750μmol/L处理下蔗糖含量显著低于对照(图1-A),所有SNP处理淀粉含量均显著低于对照(图1-B),表明SNP可能促进了根系对非结构性碳水化合物的利用,因为根系全碳含量均显著大于对照(表4)。据报道,光合作用产生的蔗糖可以作为长距离信号分子促进拟南芥早期幼苗根系的生长[31]。外源补充蔗糖能够增强拟南芥幼苗自由态生长素的水平和向顶运输,促进下胚轴和根系伸长[32]。对拟南芥地上部施用蔗糖可以促进次生根原基的形成[33]。结合以上报道,推测NO有可能通过促进棉花幼苗叶片蔗糖的生产和向根运输,从而促进根系的发育,特别是根尖数的增多。
3.3棉花幼苗生长参数与碳氮含量的相关性
棉花幼苗生长参数与根、茎、叶全氮含量以负相关为主,与根、茎、叶碳氮比以正相关为主,其中地上部干质量、全株干质量与根、茎、叶全氮含量表现为显著或极显著负相关,与碳氮比表现为显著或极显著正相关(表5)。原因在于幼苗吸氮越多,所耗费的碳成本可能就越高。為了获取氮素,植物必须将部分光合碳分配至根系用于吸氮的能量消耗、根系本身的形态建成和根际固氮菌的繁殖[34-35]。在本研究中,SNP处理后,单株根、茎、叶全氮含量及氮生物量,单株茎、叶全碳生物量均无显著差异,但根系全碳含量和单株根系碳生物量大于对照(表4)。通常用吸氮碳成本(carboncosttoacquirenitrogen)来反映植物在获取氮素上所花费在根系的碳投入,表征为根系全碳生物量与整株幼苗氮生物量的比值(gC/gN)[26]。光照充足趋向于提高植株的吸氮碳成本,土壤氮素充足则趋向于降低植株的吸氮碳成本[26]。本研究中SNP的处理提高了棉花幼苗的吸氮碳成本,其中500μmol/LSNP处理的吸氮碳成本显著大于对照(6.94∶5.48)。当分配至根系的碳生物量较多,可能会减少分配至地上部的碳生物量,从而影响到地上部的生长。对于棉花幼苗来说,根系的生长发育依赖于叶片光合生产提供的蔗糖,充足的光合碳供应有利于根系对氮素的吸收。
4结论
棉花幼苗1叶1心期,用500μmol/LSNP涂抹叶片,提高了叶片内源NO的含量,与清水对照相比,显著提高了部分根总长、根体积、根尖数、根系活力、根系干鲜质量、全株鲜质量和壮苗指数,且叶片蔗糖含量、根系全碳含量和碳氮比显著高于对照,根叶淀粉含量显著低于对照。SNP处理可能促进了幼苗叶片的光合碳生产及输出(叶片蔗糖含量升高,淀粉含量下降),增强了根系对碳水化合物的利用(根系蔗糖和淀粉含量下降,但全碳含量及碳生物量升高),因而促进了根系的发生和生长。棉花幼苗生长参数与根、茎、叶全氮含量基本呈负相关,与根、茎、叶碳氮比基本呈正相关,在棉花幼苗1叶1心期,叶片涂抹500μmol/LSNP有助于培育健壮幼苗,提高幼苗素质,在本试验中为了精准控制SNP用量,稳定试验效果,采用叶片涂抹的方法,在生产实践中可以代之以叶片喷雾,最好在阴天天气,用量控制在叶片表面雾滴分布均匀不下落即可。
参考文献:
[1]崔庆,吴春燕,宋述尧,等.外源NO缓解黄瓜幼苗低温伤害的效果[J].江苏农业科学,2022,50(6):116-119.
[2]张艳艳,章文华,薛丽,等.一氧化氮在植物生长发育和抗逆过程中的作用研究进展[J].西北植物学报,2012,32(4):835-842.
[3]SanzL,AlbertosP,MateosI,etal.Nitricoxide(NO)andphytohormonescrosstalkduringearlyplantdevelopment[J].JournalofExperimentalBotany,2015,66(10):2857-2868.
[4]HasanuzzamanM,FotopoulosV,NaharK,etal.Reactiveoxygen,nitrogenandsulfurspeciesinplants:production,metabolism,signalinganddefensemechanisms[M].JohnWiley&Sons,Ltd:Wiley,2019.
[5]VermaN,TiwariS,SinghVP,etal.Nitricoxideinplants:anancientmoleculewithnewtasks[J].PlantGrowthRegulation,2020,90(1):1-13.
[6]蒋天仪,卓宇,唐敏,等.外源一氧化氮(NO)对铁皮石斛类原球茎生长及多糖积累的影响[J].江苏农业科学,2016,44(4):257-260.
[7]BeligniMV,LamattinaL.Nitricoxidestimulatesseedgerminationandde-etiolation,andinhibitshypocotylelongation,threelight-inducibleresponsesinplants[J].Planta,2000,210(2):215-221.
[8]KopyraM,Gwóz'dz'EA.NitricoxidestimulatesseedgerminationandcounteractstheinhibitoryeffectofheavymetalsandsalinityonrootgrowthofLupinusluteus[J].PlantPhysiologyandBiochemistry,2003,41(11/12):1011-1017.
[9]PagnussatGC,SimontacchiM,PuntaruloS,etal.Nitricoxideisrequiredforrootorganogenesis[J].PlantPhysiology,2002,129(3):954-956.
[10]Correa-AragundeN,GrazianoM,LamattinaL.Nitricoxideplaysacentralroleindetermininglateralrootdevelopmentintomato[J].Planta,2004,218(6):900-905.
[11]LeshemYY,PinchasovY.Non-invasivephotoacousticspectroscopicdeterminationofrelativeendogenousnitricoxideandethylenecontentstoichiometryduringtheripeningofstrawberriesFragariaanannasa(Duch.)andavocadosPerseaamericana(Mill.)[J].JournalofExperimentalBotany,2000,51(349):1471-1473.
[12]MishinaTE,LambC,ZeierJ.ExpressionofanitricoxidedegradingenzymeinducesasenescenceprogrammeinArabidopsis[J].Plant,Cell&Environment,2007,30(1):39-52.
[13]XiongJ,LuH,LuKX,etal.Cadmiumdecreasescrownrootnumberbydecreasingendogenousnitricoxide,whichisindispensableforcrownrootprimordiainitiationinriceseedlings[J].Planta,2009,230(4):599-610.
[14]WeiL,ZhangM,WeiS,etal.Rolesofnitricoxideinheavymetalstressinplants:cross-talkwithphytohormonesandproteinS-nitrosylation[J].EnvironmentalPollution,2020,259(C):39-43.
[15]杨美森,王雅芳,干秀霞,等.外源一氧化氮对冷害胁迫下棉花幼苗生长、抗氧化系统和光合特性的影响[J].中国农业科学,2012,45(15):3058-3067.
[16]杨美森,虎晓兵,罗宏海,等.外源一氧化氮对棉花种子吸胀期间耐冷性和发芽能力的影响[J].棉花学报,2012,24(3):265-271.
[17]陈静,刘连涛,李存东,等.NO对氮胁迫棉花幼苗根系形态的调控效应[J].河北农业大学学报,2012,35(5):15-19.
[18]KongXQ,WangT,LiWJ,etal.Exogenousnitricoxidedelayssalt-inducedleafsenescenceincotton(GossypiumhirsutumL.)[J].ActaPhysiologiaePlantarum,2016,38(3):1-9.
[19]ZhangYJ,ZhangYJ,LiuGY,etal.Nitricoxideincreasesthebiomassandlintyieldoffield-growncottonundertemporarywaterloggingthroughphysiologicalandmolecularregulation[J].FieldCropsResearch,2021,261:107989.
[20]ZhangLG,WangYD,ZhaoLQ,etal.Involvementofnitricoxideinlight-mediatedgreeningofbarleyseedlings[J].JournalofPlantPhysiology,2006,163(8):818-826.
[21]何亞飞,季延海,张彦萍,等.不同植物生长调节剂对穴盘茄子幼苗生长的影响[J].中国农学通报,2017,33(31):46-53.
[22]朱秀云,梁梦,马玉.根系活力的测定(TTC法)实验综述报告[J].广东化工,2020,47(6):211-212.
[23]陈功,彭金剑,罗海华,等.播期对棉铃对位叶蔗糖代谢及棉铃产量性状、纤维品质的影响[J].棉花学报,2020,32(2):102-112.
[24]HendrixDL.Rapidextractionandanalysisofnonstructuralcarbohydratesinplanttissues[J].CropScience,1993,33(6):1306-1311.
[25]中国科学院上海植物生理研究所.现代植物生理学实验指南[M].北京:科学出版社,1999:127.
[26]PerkowskiEA,WaringEF,SmithNG.Rootmasscarboncoststoacquirenitrogenaredeterminedbynitrogenandlightavailabilityintwospecieswithdifferentnitrogenacquisitionstrategies[J].JournalofExperimentalBotany,2021,72(15):5766-5776.
[27]XuJ,WangWY,YinHX,etal.ExogenousnitricoxideimprovesantioxidativecapacityandreducesauxindegradationinrootsofMedicagotruncatulaseedlingsundercadmiumstress[J].PlantandSoil,2009,326(1/2):321-330.
[28]Fernández-MarcosM,SanzL,LewisDR,etal.NitricoxidecausesrootapicalmeristemdefectsandgrowthinhibitionwhilereducingPIN-FORMED1(PIN1)-dependentacropetalauxintransport[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica,2011,108(45):18506-18511.
[29]Correa-AragundeN,GrazianoM,ChevalierC,etal.Nitricoxidemodulatestheexpressionofcellcycleregulatorygenesduringlateralrootformationintomato[J].JournalofExperimentalBotany,2006,57(3):581-588.
[30]ReddyAR,ReddyKR,PadjungR,etal.Nitrogennutritionand
photosynthesisinleavesofPimacotton[J].JournalofPlantNutrition,1996,19(5):755-770.
[31]KircherS,SchopferP.Photosyntheticsucroseactsascotyledon-derivedlong-distancesignaltocontrolrootgrowthduringearlyseedlingdevelopmentinArabidopsis[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica,2012,109(28):11217-11221.
[32]LilleyJL,GeeCW,SairanenI,etal.Anendogenouscarbon-sensingpathwaytriggersincreasedauxinfluxandhypocotylelongation[J].PlantPhysiology,2012,160(4):2261-2270.
[33]MacGregorDR,DeakKI,IngramPA,etal.RootsystemarchitectureinArabidopsisgrownincultureisregulatedbysucroseuptakeintheaerialtissues[J].ThePlantCell,2008,20(10):2643-2660.
[34]HgbergP,HgbergMN,GttlicherSG,etal.Hightemporalresolutiontracingofphotosynthatecarbonfromthetreecanopytoforestsoilmicroorganisms[J].TheNewPhytologist,2008,177(1):220-228.
[35]MengeDNL,LevinSA,HedinLO.Evolutionarytradeoffscanselectagainstnitrogenfixationandtherebymaintainnitrogenlimitation[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica,2008,105(5):1573-1578.
