健脾活血解毒方联合恩替卡韦对乙型病毒性肝炎合并非酒精性脂肪性肝病小鼠的干预作用及机制
2023-06-16毛垚耀何惠昌崔健娇刘光伟
毛垚耀,何惠昌,谢 露,崔健娇,刘光伟
(1. 河南中医药大学第一临床医学院,河南 郑州 450003;2. 河南中医药大学第一附属医院,河南 郑州 450003)
乙型病毒性肝炎(乙肝)和非酒精性脂肪性肝病(NAFLD)均为常见的肝病,而乙型肝炎病毒(HBV)能通过参与肝组织脂质代谢的调控,使肝细胞内脂类物质沉积,促使HBV感染患者发生肝脂肪变[1-3],使得乙肝合并NAFLD的人数明显增多[4]。当乙肝患者合并NAFLD时,核苷(酸)类似物对HBV的抗病毒疗效在一定程度上会受到影响[5-6];同时,与未合并NAFLD的乙肝患者相比,该群体的肝癌发生风险显著增加,预后更差[7-9]。然而目前缺少针对乙肝合并NAFLD安全有效的治疗手段,主要的治疗策略为口服核苷(酸)类似物并配合运动及饮食习惯干预。健脾活血解毒方为河南中医药大学第一附属医院消化科刘光伟教授自拟方,常联合恩替卡韦等核苷(酸)类似物用于乙肝合并NAFLD患者的治疗,然而其作用机制并不清楚。本实验观察了健脾活血解毒方联合恩替卡韦对乙肝合并NAFLD小鼠肝细胞内微粒体甘油三酯转运蛋白(MTTP)-载脂蛋白B(ApoB)脂质转运途径的影响,旨在为健脾活血解毒方在临床运用提供依据。
1 实验材料与方法
1.1实验动物 经重组腺相关病毒(rAAV)载体携带HBV全基因组DNA感染的C57BL/6雌性小鼠15只,4周龄,体重(15.5±1.1)g,购自北京维通达生物技术有限公司,动物合格证号:110011211103614662。饲养环境为SPF等级,室温(25±5)℃,湿度(50±10)%,24 h通风,12 h光照循环,可自由饮水进食,进驻动物房经7 d隔离检验期后用于实验。本实验经郑州大学实验动物中心伦理委员会审核通过(ZZU-LAC2021033005),实验操作符合中华人民共和国国家科委《实验动物管理条例》。
1.2实验药物及制备 健脾活血解毒方由黄芪、白术、泽泻、荷叶、薏苡仁、苦参、赤芍、柴胡组成,各药材用量比例为5∶5∶5∶5∶3∶3∶5∶3,由江阴天江药业有限公司提供的颗粒剂按相应比例制备为汤剂。恩替卡韦分散片(正大天晴药业集团股份有限公司,规格:1 mg/片),研磨后溶解至生理盐水中制备为混悬液。按照动物与人体间的等效剂量关系[10]换算给药剂量。
1.3主要试剂 4%多聚甲醛(BK539A,Biosharp);磷酸酶抑制剂(S1873,碧云天);PMSF(P105539,阿拉丁);RIPA裂解液(P0013B,碧云天);小鼠单抗β-actin(BM0627,武汉博士德生物工程有限公司);兔多抗MTTP(A1746,ABclonal);兔多抗ApoB(DF12533,Affinity);HRP标记羊抗兔二抗(BA1054,武汉博士德生物工程有限公司);Trizol(15596-026,Ambion);SYBR Green Master Mix(Q111-02,VAZYME);Taq Plus DNA Polymerase(ET105-01,TIANGEN);DL2000 DNA Marker(MD114-02,TIANGEN);dNTP(CD117,TIANGEN);谷丙转氨酶(GPT)检测试剂盒(C009-2-1,南京建成);谷草转氨酶(GOT)检测试剂盒(C010-2-1,南京建成);Mouse ApoB ELISA Kit(E-EL-M3017,Elabscuence);Mouse 极低密度脂蛋白(VLDL),ELISA Kit(EM1863,Fine Test),QIAamp Viral RNA Mini Handbook试剂盒(QIAGEN)。
1.4主要仪器 微量移液器(Eppendorf);电泳仪(DYY-7C,北京六一仪器厂);垂直电泳槽(DYCZ-24DN,北京六一仪器厂);电转仪(DYCZ-40,北京六一仪器厂);水平摇床(TS-1,江苏海门其林贝尔仪器制造有限公司);电子天平(CPA,北京赛多利斯仪器系统有限公司);酶标仪(Thermo);离心机(HI650,湖南湘仪实验室仪器开发有限公司);FlexStation 3多功能酶标仪(Molecular Devices);PCR仪(EDC-810,东胜创新生物科技有限公司);恒温培养箱(DNP-9272,上海精宏);分光光度计(752,上海舜宇恒平科学仪器有限公司)。
1.5实验方法 对rAAV载体转染的小鼠进行60%脂肪供能高脂饲料(XTHF60,协同医药生物工程有限责任公司)喂养12周建立乙肝合并NAFLD后[11],采用随机数字表法将小鼠分为模型组、恩替卡韦组和联合中药组,每组5只。恩替卡韦组给予恩替卡韦0.1 mg/kg灌胃,每日1次;联合中药组给予恩替卡韦0.1 mg/kg灌胃(每日1次)及健脾活血解毒方汤剂50 mg/kg灌胃(每周一、三、五各1次);模型组灌胃同等量生理盐水,均连续灌胃12周。
1.6检测指标及方法
1.6.1血清GOT、GPT、ApoB、VLDL水平及HBV DNA载量 小鼠麻醉后处死前眼眶取血,离心后经移液枪取血清转至灭菌后的1.5 mL EP管中,-80 ℃保存。血清样品预处理后,按照相应试剂盒说明书进行检测。
1.6.2肝脏脂肪变和纤维化情况 采用HE染色及天狼星红染色进行观察。HE染色:取4%多聚甲醛固定的肝组织,经酒精从低浓度到高浓度梯度脱水,二甲苯透明,浸蜡后包埋切片;切片先经二甲苯脱蜡,再经酒精从高浓度到低浓度梯度水化,然后苏木精-伊红染色,中性树脂封片,光学显微镜观察并采集图像(每张切片选取4个不同的视野)。天狼星红染色:切片步骤同上,对切片进行常规脱蜡、水化,使用天狼星红染色液滴染10 min,流水冲洗,去除切片表面染液,梯度脱水后二甲苯透明,中性树胶封固,光学显微镜观察并采集图像。
1.6.3肝组织中MTTP、ApoB蛋白表达情况 采用Western blot法检测:取-80 ℃保存的肝组织,使用单去污剂裂解液裂(含PMSF)提取肝组织总蛋白,酶标仪测定蛋白样品OD值,计算样品蛋白浓度。将蛋白变性,电泳分离后电转膜。用含5%脱脂奶粉的TBST(封闭液)浸泡PVDF膜,室温摇床封闭2 h。用封闭液稀释相应的一抗(β-actin 1∶200,ApoB1∶1 000,MTTP 1∶1 000),4 ℃孵育过夜,洗涤。用TBST稀释相应的HRP标记二抗(1∶50 000),孵育2 h,洗涤。显色曝光后扫描胶片,用BandScan分析胶片灰度值。
1.6.4肝组织中MTTP、ApoB mRNA表达情况 取-80 ℃保存的肝组织,Trizol法提取总RNA,采用两步法反转录成cDNA。采用Primer5软件设计目的基因的引物序列:β-actin的上游引物序列为5’-CACGATGGAGGGGCCGGACTCATC-3’,下游引物序列为5’-TAAAGACCTCTATGCCAACACAGT-3’;MTTP的上游引物序列为5’-CACTCAGGCAATTCGAGACA-3’,下游引物序列为5’-TATCGCTTTCTGGCTGAGGT-3’;ApoB的上游引物序列为5’-GCCATGTCCAGGTACGAACT-3’,下游引物序列为5’-TGGTACGGTTCCCTTTCTTG。使用EDC-810 PCR仪进行实时荧光定量PCR检测,扩增反应条件:预变性,95 ℃ 10 min,1个循环;变性,95 ℃ 15 s,退火延伸;60 ℃ 60 s,40个循环;熔解曲线采集,95 ℃ 15 s,60 ℃ 60 s,95 ℃15 s,1个循环。采用2-ΔΔCt法计算相对表达量。
2 结 果
2.1各组小鼠血清HBV DNA载量及GOT、GPT、ApoB、VLDL水平 恩替卡韦组和联合中药组血清HBV DNA载量及GOT、GPT水平均明显低于模型组(P均<0.05),且联合中药组血清HBV DNA载量及GOT、GPT水平均明显低于恩替卡韦组(P均<0.05);恩替卡韦组和联合中药组血清ApoB、VLDL水平均明显高于模型组(P均<0.05),且联合中药组血清ApoB、VLDL水平均明显高于恩替卡韦组(P均<0.05)。见图1。
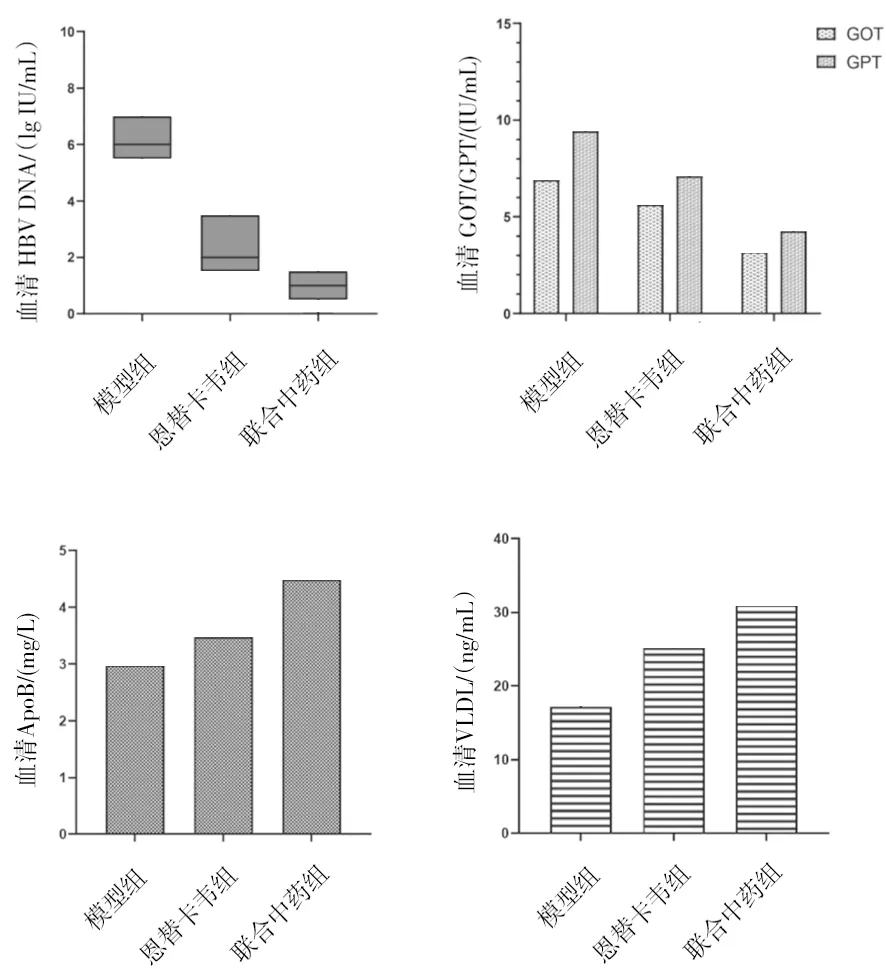
图1 各组小鼠血清HBV DNA载量及肝酶、ApoB、VLDL水平
2.2各组小鼠肝脂肪变及肝纤维化程度 所有小鼠肝脏被膜完整,整体呈粉红色,形态饱满,均未见明显缩小,可见红白相间纹理。HE染色及天狼星红染色显示:模型组小鼠肝小叶结构紊乱,小叶内肝细胞广泛水肿,大量肝细胞气球样变及脂肪变性;汇管区周围纤维化,可见大量炎症细胞浸润灶;大量胶原纤维形成条索状纤维隔,重新分隔肝小叶,形成桥接坏死。恩替卡韦组小鼠肝小叶结构尚完整,小叶内肝细胞轻度水肿,肝细胞气球样变及脂肪变性较模型组小鼠稍有减轻;汇管区周围仍有炎症细胞浸润灶;可见点状坏死。联合中药组小鼠肝细胞气球样变及脂肪变性较恩替卡韦组明显减轻,汇管区炎症细胞浸润范围及点状坏死均更少。见图2。

图2 各组小鼠肝脏组织HE染色及天狼星红染色形态
2.3各组小鼠肝脏组织中MTTP、ApoB蛋白及mRNA表达情况 恩替卡韦组ApoB蛋白及mRNA相对表达量与模型组比较差异均无统计学意义(P均>0.05),恩替卡韦组MTTP蛋白及mRNA相对表达量与联合中药组MTTP、ApoB蛋白及mRNA相对表达量均明显高于模型组(P均<0.05),且联合中药组MTTP、ApoB蛋白及mRNA相对表达量均明显高于恩替卡韦组(P均<0.05)。见图3。
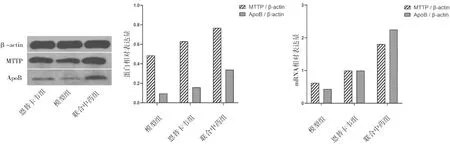
图3 各组小鼠肝脏组织中MTTP、ApoB蛋白及mRNA表达情况
3 讨 论
现代中医学者根据乙肝和NAFLD的临床表现,将其归入传统中医学中的“胁痛”“黄疸”“鼓胀”“癥积”等病证范畴。在中医理论中,肝脏具有独特的生理功能,当各种病因损及肝脏时,导致气机失于畅达,疏泄职能失司,血液贮藏调节失调,故而痰浊、瘀血乃生,久则化为浊毒内蕴;肝胆之病最易损伤脾胃,病久及肾,肝、脾、胃、肾功能失司,水液输布代谢异常,痰湿乃生,日久化瘀生热,痰、湿、瘀、热等病理产物结于体内,继而伤肝。有医家认为慢性乙肝患者机体以肝胆脉络受损为主;病邪侵袭肝脏时,肝的藏血、疏泄功能失用,致肝体肝用皆损,易循经入络入血分,气血运行停滞不畅,病理产物及脂肪堆积,易合并脂肪肝[12]。《难经》中记载“见肝之病,则知肝当传之于脾,故先实其脾气,无令得受肝之邪,故曰治未病焉”,《金匮要略》记载“见肝之病,知肝传脾,当先实脾”,均阐释了脾胃与肝病关系密切,调补脾胃有助于肝病的治疗和转归。如李知玉等[13]研究报道,干扰素联合健脾化痰祛瘀治疗乙肝合并NAFLD患者可明显降低血脂、BMI及腰臀比,减轻肝脂肪变程度,且抗病毒疗效显著提高。韩祎迪等[14]发现壳脂胶囊联合恩替卡韦治疗乙肝合并NAFLD患者可调节血脂水平及减轻肝脏炎症,升高肝脾CT比值。既往研究证实联合中药治疗对HBV DNA载量及肝脂肪变的改善效果均优于单纯西药治疗,但对其作用机制研究较少。
既往研究发现,ApoB在HBV转染的HepG2细胞中表达量较未转染细胞低, HBV对MTTP-ApoB脂质代谢途径具有抑制作用[15-17]。ApoB在肝细胞或小肠细胞的内质网中与脂类物质结合,形成含ApoB脂蛋白(B-LPs)的球状微粒,进一步将膳食脂肪和内源性脂肪通过血液循环转运至不同的组织,避免脂肪过度蓄积产生脂毒性[18-19]。MTTP是ApoB参与B-LPs组装和分泌的调节因子[20]。首先,内质网中的MTTP将胞内脂质转移至ApoB,使ApoB完成初步的脂质化,形成原始B-LPs;然后MTTP与ApoB的N-末端间离子相互作用,进一步增加脂蛋白的总长度,原始B-LPs与内质网腔内的脂滴进一步融合,转化为更大的粒子[21-22];最后B-LPs通过囊泡转运至高尔基体,进一步成熟后分泌至细胞外。当肝细胞内有HBV时,HBV抑制MTTP和ApoB在肝细胞内的表达,B-LPs的合成减少,细胞内脂质蓄积,促使肝细胞发生脂肪变,从而影响抗病毒治疗获益。现有研究表明,MTTP有望作为治疗脂质代谢相关疾病潜在药物靶点[23-25]。
本实验研究结果提示,健脾活血解毒方与恩替卡韦联用能够通过上调MTTP表达,进一步影响ApoB的丰度,削弱HBV对MTTP-ApoB脂质代谢途径的抑制作用,促进肝脏内源性脂质向外周转运,减轻肝细胞脂质蓄积。本研究为乙肝合并NAFLD患者的临床治疗及相关基础研究提供了一定参考,但受限于动物疾病模型并不能反映人体疾病发展的实际情况,健脾活血解毒方联合恩替卡韦对乙肝合并NAFLD患者的疗效及安全性仍有待随机对照大样本的临床研究进一步证实。
利益冲突:所有作者均声明不存在利益冲突。
