运动保护PM2.5暴露导致的大鼠肺部损伤:GSK3β介导的eHSP70/iHSP70平衡机制研究
2023-06-15覃飞徐旻霄崔书强瞿超艺董亚南赵杰修
覃飞,徐旻霄,崔书强,瞿超艺,董亚南,赵杰修*
运动保护PM2.5暴露导致的大鼠肺部损伤:GSK3β介导的eHSP70/iHSP70平衡机制研究
覃飞1, 2, 3,徐旻霄4,崔书强5,瞿超艺2,董亚南5,赵杰修2*
(1. 暨南大学 体育学院,广东 广州 510032;2. 国家体育总局体育科学研究所,北京 100061;3. 暨南大学 广东省速度能力研究重点实验室,广东 广州 510032;4. 首都体育学院 体育教育训练学院,北京 100191; 5. 北京市体育科学研究所,北京 100075)
探讨长期运动对亚急性PM2.5暴露致大鼠肺脏损伤的保护效应及GSK3β介导的eHSP70/iHSP70平衡机制。32只Wistar大鼠(雄性,8周龄)随机分为4组(8只/组),即安静对照组(sedentary,S)、运动训练组(exercise,E)、安静+PM2.5暴露组(sedentary+PM2.5exposures,S+PM2.5)和运动+PM2.5暴露组(exercise +PM2.5exposures,E+PM2.5)。E组和E+PM2.5组大鼠进行8周跑台运动(60 min/次、5次/周);运动结束后,S+PM2.5组和E+PM2.5组进行3周亚急性PM2.5暴露染毒(7天/周,6 h/d);暴露结束后,采用全身体描箱测试肺功能。24 h后采集大鼠肺脏、血浆及肺灌洗液,检测肺灌洗液中炎症因子(TNF-α、IL-1α、IL-6)及血浆eHSP70含量;观察肺脏组织形态结构;采用免疫印迹法检测肺脏iHSP70、TLR-4、NF-κB p65、IκBα、p-IκBα、IKKβ、p-IKKβ、P38、p-P38、HSF1、p-HSF1ser303、GSK3β和p-GSK3βser9通路蛋白分泌水平。研究发现,暴露染毒后肺组织出血,大量炎性细胞聚集在肺泡腔,肺泡间隔增厚。与S组相比,S+PM2.5组肺功指标MV、TV、EF50、PIF、PEF显著更低,PAU和Te显著更高;肺灌洗液TNF-α、IL-1α和IL-6、血浆eHSP70显著更高;肺组织iHSP70显著更低,相关通路中TLR-4、NF-κB p65、p-IκBα、IKKβ、p-IKKβ、GSK3β、p-P38和p-HSF1ser303蛋白水平显著更高,IκBα、HSF1、p-GSK3βser9显著更低。与S+PM2.5组相比,E+PM2.5组肺组织局部的出血情况、炎性浸润程度均明显改善;肺功指标TV、MV、EF50、PIF、PEF显著更高,PAU和Te显著更低;肺灌洗液IL-1α、TNF-α、IL-6和血浆eHSP70分泌水平显著更低;肺组织iHSP70显著更高,相关通路中TLR-4、NF-κB p65、p-IκBα、IKKβ、p-IKKβ、GSK3β、p-P38和p-HSF1ser303蛋白水平显著更低,IκBα、HSF1、p-GSK3βser9显著更高。研究认为,长期规律性运动可下调大鼠肺上皮细胞P38MAPK磷酸化水平,可能通过增加GSK-3β磷酸化使GSK3β失活,增加HSF1分泌水平,上调iHSP70,改善大气颗粒物所致的呼吸系统炎症机体的eHSP70/iHSP70平衡紊乱,进而阻断TLR-NFκB炎症信号通路,抑制炎症。
运动;PM2.5;颗粒物;肺损伤;炎症;HSP70
颗粒物是空气污染的首要污染物,会造成广泛的健康危害。世界卫生组织(World Health Organization,WHO)2021年发布的《全球空气质量指南》明确指出,空气污染是影响全球人类健康的主要因素。《“健康中国2030”规划纲要》也突出强调,要加强对影响健康的环境问题治理与健康风险管理。已有大量证据表明,可吸入颗粒物会引发呼吸道炎症、哮喘、肺癌和心血管疾病等,而且细颗粒物(particulate matter 2.5,PM2.5)还能够以呼吸道为效应靶点,激活局部炎症因子并引发炎症级联反应,导致机体的系统性炎症,进而增加阿尔茨海默病等神经系统损伤,以及肥胖和胰岛素抵抗等代谢性疾病的发生风险(Paul et al., 2018;Roberts et al., 2014)。因此,探究可吸入颗粒物对健康的影响及其相关防御措施至关重要。
运动作为一种绿色的非药物干预手段,可以防治多种慢性疾病。已有研究表明,运动中每分通气量(minute volume,MV)增加,在高浓度颗粒物污染下可导致更多颗粒物进入机体,增加污染物暴露风险(覃飞等, 2020)。也有研究表明,长期规律性的运动健身产生的有益效应可抵抗颗粒物造成的机体急性损伤。即“运动促进健康”和“空气污染危害健康”两者之间可能存在着一个平衡点(Giles et al., 2014;Roberts et al., 2014)。相关研究表明,在空气污染或雾霾周期开始前进行有规律的4~8周运动健身训练,可在一定程度上预防空气污染导致的机体急性损伤、抑制炎症的发生发展(Nesi et al., 2016;Qin et al., 2021;Yu et al., 2012)。但是空气污染、运动和健康三者间相互作用的现象机制尚待分析与揭示。运动是否可以有效防御可吸入颗粒物对健康的危害?何种运动方案可产生良好的保护效应?运动保护颗粒物污染所致的机体损伤的相关机制是什么?这些问题尚待进一步清晰阐明,以响应以防病为重点目标的公共卫生干预理念,保障运动健身的安全合理。
热休克蛋白(hot shock proteins 70,HSP70)被称为“应激蛋白”,与环境应激(Baldissera et al., 2018)和运动(Kostrycki et al., 2019)密切相关。近年来的研究发现HSP70具有多种相互拮抗的功能,其功能差异依赖于其所存在的部位不同,即细胞内或细胞外(Krause et al., 2015)。细胞内HSP70(intracellular HSP70,iHSP70)可诱导NF-κB失活,并发挥重要的抗炎作用(Heck et al., 2017);而细胞外HSP70(extracellular HSP70,eHSP70)具有促炎效应,其可与Toll样受体(Toll-like receptors,TLR)结合,进而激活NF-κB炎症通路(Asea et al., 2002)。大量证据亦表明颗粒物暴露后,机体eHSP70含量升高,并且与呼吸道炎症的发生密切相关(Sancini et al., 2014)。因此,eHSP70与iHSP70的比率,又称“H指数”,可以作为空气污染引起的炎症的生物标志物。此外,规律性体育锻炼会降低eHSP70分泌水平并提高iHSP70表达(Bittencourt et al., 2017;Krause et al., 2015)。由此推断,运动可调控或维持eHSP70/iHSP70的平衡,进而抵抗颗粒物污染等致病因素,维持机体健康。然而运动对HSP70细胞内外平衡的影响及其相关机制尚不明晰。
运动诱导的iHSP70的增多可增强细胞内的抗炎作用。HSP70的合成调节主要发生在基因转录水平,由热休克转录因子(heat shock transcription factors,HSFs)家族调控,其中HSF1是HSP的主要调控因子(Akerfelt et al., 2010)。而糖原合酶激酶3β(glycogen synthase kinase-3β,GSK3β)作为体内大量代谢酶和转录因子的调控因子,被认为是控制转录因子激活的“看门人”,可使HSF1在ser303位点发生磷酸化,维持细胞质中HSF1处于无活性状态,进而减少HSP的合成(Hietakangas et al., 2006)。相关研究已在心肌(Martherus et al., 2016)、神经(Liu et al., 2013)、骨骼肌(Léger et al., 2006)等不同组织内发现急性运动和慢性运动均可以不同程度地下调GSK3β。因此,推断GSK3β可能是运动调控HSF1的关键靶点之一。而运动是否可以通过降低GSK3β活性进而缓解其对HSF1的抑制作用,促进iHSP70的合成,影响eHSP70/iHSP70平衡,有待进一步研究。
综上所述,本研究采用浓缩富集全身暴露系统模拟大气暴露的真实环境,首先对大鼠进行8周的运动干预,随后施加亚急性(21天)PM2.5暴露,评估长期规律性运动对颗粒物暴露大鼠肺脏损伤的保护效应,并进一步检测GSK3β和eHSP70/iHSP70平衡介导的HSP/TLR/NF-κB炎症信号通路,以明确长期规律性运动对亚急性PM2.5暴露导致的肺组织损伤的保护效应及其相关机制。
1 材料与方法
1.1 实验动物及分组
SPF级8周龄Wistar 鼠32只,购买于北京维通利华实验动物技术有限公司[许可证号:SCXK(京)2016-0006]。自由饮食,12 h/12 h昼夜循环,室温(23±2)℃。实验程序严格遵守国家体育总局体育科学研究所伦理委员会要求(编号:CISSLA-2017003)。大鼠适应性饲养1周后,随机分为安静对照组(sedentary, S)、运动干预组(exercise, E)、安静对照+PM2.5暴露组(sedentary+PM2.5exposures, S+PM2.5)和运动干预+PM2.5暴露组(exercise+PM2.5exposures,E+PM2.5),每组8只。
1.2 运动方案
所有运动干预组进行8周间歇性跑台训练。间歇性跑台训练方案依据Jiang等(2014)的间歇训练方案,先以50%~55%V̇O2max对应的跑台速度进行5 min热身,随后进行4 min的高强度运动(80%~90%V̇O2max),再进行3 min低强度运动(65%~70%V̇O2max),并循环重复7次,最后以50%~55%V̇O2max的对应速度进行5 min的整理运动后结束训练。运动干预5天/周,1 h/天。使用大鼠代谢监测系统(Columbus,美国)采集大鼠运动中的摄氧量数据,以确定运动强度所对应的跑台速度(Qin et al., 2020a)。每2周测定一次最大摄氧量,调整运动强度。
1.3 PM2.5 颗粒物暴露方案
8周运动训练后,S+PM2.5和E+PM2.5组的大鼠采用PM2.5在线浓度富集系统进行全身暴露染毒。暴露时间为2018年10月15日—11月5日,6 h/天,连续染毒21天。S和E组大鼠饲养在独立通风笼饲养系统中,PM2.5浓度为0。使用DUSTTARK II-8530(TSI,美国)测试仪器实时检测暴露舱内PM2.5浓度。在暴露期间,根据美国环境保护署对于采样标准流程的规定采集舱内气体样本(采样气流0.17 L/min),应用气相色谱-质谱联用法(GC-MS)分析PM2.5暴露期间16种多环芳烃。使用电感耦合等离子体质谱法(ICP-MS)对铬(Cr)、铜(Cu)、镉(Cd)、镍(Ni)、锰(Mn)、锌(Zn)和砷(As)等金属成分进行定量。为了监测暴露仓中存在的潜在有害生物因素,在暴露仓中安置哨兵鼠,并对其进行微生物检查。
1.4 肺功能测试
采用FinePointe WBP全身体积描积系统(BUXCO Research Systems,美国)测试各组大鼠呼吸功能变化。将大鼠放入检测室适应20 min,测试全程保持环境安静。采集呼吸频率(frequency,F)、MV、潮气量(tidal volume,TV)、呼气中期流速(expiratory flow 50,EF50)、暂时停顿(pause,PAU)、吸气时间(inspiration time,Ti)、呼气时间(expiration time,Te)、吸气流峰值(peak inspiratory flow,PIF)、呼气流峰值(peak expiratory flow,PEF)等指标。
1.5 样品采集
染毒结束后24 h取材,所有大鼠禁食12 h。称重后,麻醉大鼠。打开大鼠腹腔,于腹主动脉取血。大鼠处死后开胸结扎左侧主支气管,用2 ml 4 ℃生理盐水反复灌注右侧主支气管并回抽,回抽率50%~80%,获取支气管肺泡灌洗液,将灌洗液在3 000 r/min转速下离心10 min,上清液分装并保存在-20 ℃冰箱中待测。
1.6 光镜测试
肺脏组织用中性甲醛固定48 h后,样品通过梯度酒精脱水、二甲苯透明、石蜡包埋等步骤制成切片(5 μm)。肺组织切片用苏木精-伊红(H&E)染色,用光学显微镜(200×和400×)观察。采用急性肺损伤评分标准进行量化评价。
1.7 酶联免疫试验
采用酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)测量肺灌洗液中IL-1a、TNF-α、IL-6及血浆中HSP70含量,并测试肺灌洗液中蛋白含量。检测步骤按照试剂盒说明书进行。
1.8 蛋白印迹(Western blotting)法
RIPA试剂盒用于提取肺组织样品的总蛋白,并进行BCA蛋白定量。随后进行电泳、转膜、封闭、孵育一抗等步骤,各指标一抗孵育浓度如下:TLR-4(1∶4 000)、iHSP70(1∶2 000)、P38(1∶2 000)、p-P38(1∶1 000)、NF-κB p65(1∶1 000)、IκBα(1∶500)、p-IκBα(1∶1 000)、IKKβ(1∶1 000)、p-IKKβ(1∶1 000)、HSF1(1∶1 000)、p-HSF1ser303(1∶2 000)、GSK3β(1∶4 000)、p-GSK3βser9(1∶500)、β-actin(1∶10 000)。一抗4 ℃孵育过夜后,用TBST缓冲液洗5 min×3次,孵育山羊抗兔/小鼠二抗(1∶10 000)40 min后,TBST洗涤膜5 min×3次。使用增强化学发光(enhanced chemiluminescence,ECL)试剂盒观察免疫反应带。采用ImageJ软件分析积分光密度(integrated optical density,IOD)值。
1.9 eHSP70和iHSP70的测量和eHSP70/iHSP70的计算
利用ELISA检测血浆中eHSP70含量。通过蛋白印迹法检测肺组织中iHSP70的表达。将安静对照组eHSP70/iHSP70设为基线值(Kostrycki et al., 2019, Qin et al., 2021a),实验组应激状态下的eHSP70/ iHSP70比值为各组值相对于基线值的商。
1.10 统计分析
所有实验数据均采用SPSS 22.0软件进行分析,数据用平均数±标准差(±)表示。各项数据进行正态分布和方差齐性检验后,采用双因素方差分析进行主效应和交互效应分析;当交互效应具有统计学意义时,进一步采用单因素方差分析进行简单效应分析,并采用LSD(方差齐性)或Dennett’s T3(方差不齐性)法进行各组间的两两比较。变量变换后仍为非正态分布资料时,应用Kruskal-Wallis Test进行非参数检验,显著性水平取<0.05。此外,计算Cohen’s效应量(effect size,ES)双重检验显著性(组间两两比较),>0.2为小效应,ES>0.5为中效应,ES>0.8为大效应(Lakens, 2013)。
2 实验结果
2.1 可吸入颗粒物暴露浓度及颗粒物成分
PM2.5暴露21天,暴露仓内平均浓度变化为(237.01±206.41)μg/m3,最高日平均暴露浓度为651.35 μg/m3,最低日平均暴露浓度为20.95 μg/m3。其中,轻度污染4天,中度污染以上11天,其余为优和良好。根据我国PM2.5检测网的空气质量标准,仓内平均浓度相当于重度空气污染浓度。利用GC-MS和ICP-MS检测舱内重金属和多环芳烃含量,结果见表1。此外,通过监测室内的潜在有害生物进行卫生监督,实验期间暴露仓内、饲养环境所有微生物结果均为阴性。
2.2 肺功能检测结果
利用FinePointe WBP检测各组肺通气、肺容量、肺阻塞程度及传导性(呼吸肌力量)相关指标。颗粒物暴露3周后,与S组相比,S+PM2.5组大鼠MV(<0.05,=1.79;图1B)、TV(<0.05,=2.06;图1C)、EF50(<0.05,=1.68;图1G)、PIF(<0.05,=1.78;图1H)、PEF(<0.05,=1.81;图1I)显著更低, PAU(<0.05,=1.67;图1D)和Te(<0.05,=1.31;图1E)显著更高。上述结果表明,PM2.5可导致肺通气功能(TV和MV)下降,气道阻塞程度(EF50、PAU和Te)加重,呼吸肌力量(PIF和PEF)减弱。
与S+PM2.5组相比,E+PM2.5组大鼠的MV(<0.05,=1.11;图1B)、TV(<0.05,=1.33;图1C)、EF50(<0.05,=1.10;图1G)、PIF(<0.05,=1.46;图1H)、PEF(>0.05;=0.91;图1I)显著更高;PAU(>0.05,=0.72;图1D)和Te(<0.05,=1.09;图1E)显著更低。由此可见,8周运动训练可减轻PM2.5引起的肺功能障碍,尤其是颗粒物污染导致的肺通气功能下降、呼吸道梗阻和呼吸肌力下降。

注:*P<0.05;下同。
Figure 1.Effects of Exercise on Pulmonary Function in Rats with PM2.5Exposure
2.3 肺组织形态学改变
通过肺组织染色评估各组大鼠肺脏形态结构的损伤程度,S组(图2A)和E组(图2B)大鼠肺泡结构完整,肺动脉管壁层次清晰、平滑,无异常。小支气管、终末细支气管黏膜平整,没有硬化现象。S+PM2.5组(图2C)大鼠肺脏出现出血,大量炎性细胞聚集在肺泡腔、肺动脉、支气管以及终末细支气管管壁外周,肺泡间隔增厚,局部出血并存在脓液填充,肺动脉血管壁明显增厚(图2F);产生了组织炎症,部分肺组织出现明显的纤维化,部分支气管黏膜结构不完整并出现脱落(图2E)。与S+PM2.5组(图2C)相比,E+PM2.5(图2D)组大鼠肺部整体结构完整,肺组织局部的出血情况、炎性浸润程度和血管壁的病变程度均明显改善。虽仍可见肺泡内有脓液、淋巴细胞、巨噬细胞填充,但肺泡结构总体较清晰(图2D)。此外,采用肺损伤评分进行半定量分析,S+PM2.5组的肺损伤评分显著高于S组(<0.05,=3.80)和E+PM2.5组(<0.05,=2.46;图2G)。
2.4 大鼠肺脏相关炎症因子及eHSP70/iHSP70比值
与S组相比,S+PM2.5组大鼠肺脏TNF-α(<0.05,=2.12;图3A)、IL-1α(<0.05,=1.37;图3B)和IL-6(<0.05,=2.21;图3C)均显著更高。与S+PM2.5组相比,E+PM2.5组大鼠TNF-α(<0.05,=1.37;图3A)、肺脏IL-1α(<0.05,=1.27;图3B)、IL-6(<0.05,=1.12;图3C)分泌水平显著更低。上述指标变化表明8周运动可有效抑制可吸入颗粒物导致的肺部炎症。
Figure 2.Effects of Exercise on Lung Photomicrographs in Rats with PM2.5Exposure
注:A.S组;B.E组;C.S+PM2.5组;D.E+PM2.5组;E.气管黏膜脱落出血、炎性浸润;F.肺组织纤维化为肺动脉血管壁明显增厚;G.急性肺损伤病理评分组间比较。
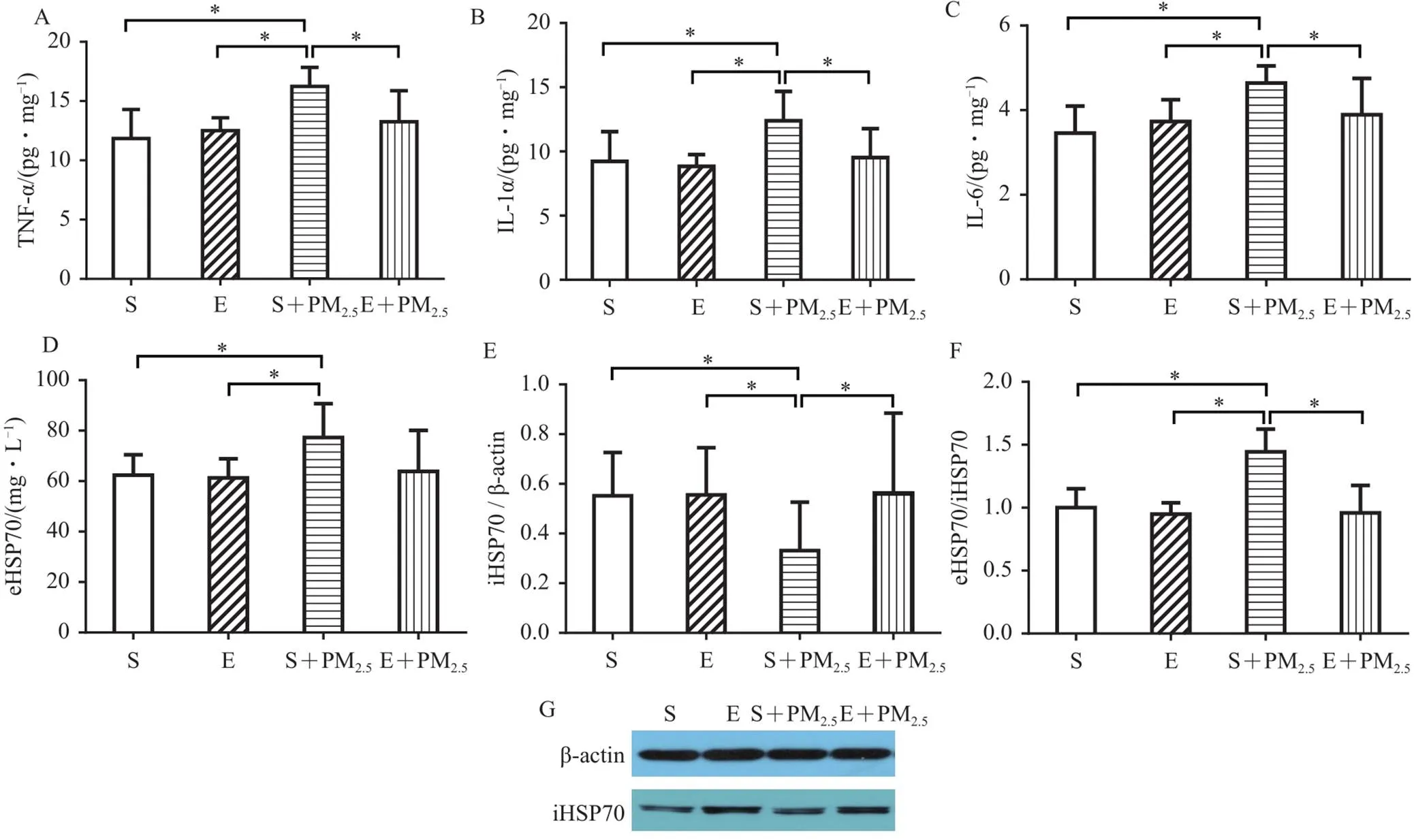
图3 运动对PM2.5致大鼠炎症程度的影响
Figure 3.Effects of Exercise on Inflammation in Rats with PM2.5Exposure
此外,进一步分析各组eHSP70和iHSP70的表达及eHSP70/iHSP70发现,与S组相比,S+PM2.5组大鼠eHSP70分泌水平(<0.05,=1.35;图3C)和eHSP70/iHSP70(<0.05,=2.68;图3F)显著更高,iHSP70(<0.05,=1.19;图3D、3G)显著更低。与S+PM2.5组相比,E+PM2.5组大鼠eHSP70分泌水平(>0.05,=0.84;图3C)和eHSP70/iHSP70(<0.05,=1.59;图3F)显著更低,iHSP70分泌水平(<0.05,=0.86;图3E、3G)显著更高。提示,长期规律性运动可激活机体的抗炎状态,有效扭转eHSP70/iHSP70平衡紊乱,且以上调iHSP70为主。
2.5 TLR-4/NF-κB信号通路相关蛋白
各组大鼠肺脏TLR-4/NF-κB信号通路相关调节蛋白水平如图4所示。与S组相比,S+PM2.5组大鼠TLR-4(<0.05,=1.11;图4A、4G)、NF-κB p65(<0.05,=1.01;图4B、4G)、p-IκBα (>0.05,=0.85;图4D、4G)、IKKβ(<0.05,=0.89;图4E、4G)和p-IKKβ(<0.05,=1.64;图4F、4G)均显著更高,IκBα(>0.05,0.05;图4C、4G)显著更低。与S+PM2.5组相比较,E+PM2.5组大鼠肺脏TLR-4(0.05,=0.77;图4A、4G)、NF-κB p65(<0.05,=1.11;图4B、4G)、p-IκBα(<0.05,=1.28;图4D、4G)、IKKβ(<0.05,=1.37;图4E、4G)和p-IKKβ(<0.05,=1.55;图4F、4G)分泌水平显著更低,IκBα(>0.05=1.16;图4C)分泌水平显著更高。综上所述,长期规律性运动可下调有害应激时细胞外与细胞内HSP70比值,抑制TLR-4/NF-κB信号通路。

图4 运动和颗粒物暴露对大鼠eHSP70/iHSP70介导的TLR-4/NF-κB信号通路的影响
Figure 4.Effects of Exercise and PM2.5on the Extracellular-to-Intracellular HSP70 Ratio Mediated TLR-4/NF-κB Signaling Pathways in Rats
2.6 P38MAPK-GSK3β-HSF1调控途径相关蛋白
蛋白印迹法结果显示,与S组相比,S+PM2.5组大鼠肺脏P38磷酸化水平(<0.05,=1.04;图5B、5G)、GSK3β(<0.05,=1.18;图5C、5G)和HSF1ser303磷酸化水平(<0.05,=1.77;图5F、5G)均显著更高,GSK3βser9磷酸化水平(<0.05,=1.16;图5D、5G)及HSF1(<0.05,=0.97;图5E、5G)显著更低。与S+PM2.5组相比,E+PM2.5组大鼠肺脏p-GSK3βser9水平(<0.05,=1.15;图5D、5G)及HSF1(<0.05,=1.10;图5E、5G)显著更高,GSK3β(<0.05,=1.18;图5C、5G)、p-P38(>0.05,=0.91;图5B、5G)和p-HSF1ser303(<0.05,=1.71;图5F、5G)分泌水平显著更低。综上所述,长期规律性运动可通过抑制GSK3β激活HSF1进而促进iHSP70生成,抵抗颗粒物污染时导致的肺部急性炎症损伤,可能是运动产生良好效应的重要靶点。
3 分析与讨论
明确运动对大气颗粒物所致的肺脏急性损伤的保护效应及其机制,在大气环境质量未能得到有效控制的情况下,对于增强群众健康防病意识,建立良好的健身习惯具有非常重要的意义。前期研究发现,8周中等强度有氧运动可有效保护14天亚急性PM2.5暴露所致的老年大鼠肺脏损伤(Qin et al., 2021a),8周有规律运动可有效保护一次性中度(269.31±30.79)μg/m3、重度(509.84±36.74)μg/m3PM2.5污染所致的成年大鼠肺部急性损伤,抵抗炎症和氧化应激(Qin et al., 2020b)。本研究进一步探析了长期运动保护亚急性PM2.5暴露所致的大鼠肺部损伤的作用机制。
3.1 染毒方式及空气成分
鉴于传统气管滴注方式的有创性、染毒浓度较大、暴露方式难以与实际颗粒物暴露环境相对应,以及暴露期间实验动物产生较大的应激和感染风险等(库婷婷, 2017)原因,本研究选取全身暴露浓缩富集染毒方式,该方法无创且能够更好地模拟现实空气暴露环境,有效减少动物应激反应(Allen et al., 2014;Sioutas et al., 1995)。研究已证实不同时长的全身暴露染毒系统处理可导致呼吸系统、内分泌系统、消化系统、神经系统损伤及病变(Chu et al., 2019;Li et al., 2019),说明其可作为可吸入颗粒物影响健康的相关研究的实验处理方法。

图5 运动和颗粒物暴露对大鼠GSK3β调控iHSP70的影响
Figure 5.Effects of Exercise and PM2.5on GSK3β Regulating iHSP70 in Rats
鉴于雾霾具有周期性和季节性,本研究选择暴露周期为21天的亚急性染毒实验,21天暴露仓内的PM2.5浓度变化模拟了我国北方京津冀地区初冬的大气污染状况。研究结果表明,与安静对照组相比,亚急性PM2.5暴露3周后,S+PM2.5大鼠出现明显气道阻塞、呼吸肌力量下降、支气管黏膜脱落、细支气管周围中性粒细胞浸润、肺血管管腔狭窄,肺灌洗液中促炎因子(TNF-α、IL-1α和IL-6)分泌水平显著升高。Li等(2019)和Yang等(2018)的实验亦表明亚急性PM2.5暴露可导致肺组织损伤。
PM2.5暴露导致的肺损伤与PM2.5的浓度、持续时间和成分有关(Ning et al., 2019)。鉴于此,本研究分析了暴露仓内PM2.5的成分含量,发现暴露仓内多环芳烃以菲为主,其次为芴和苊。已有研究表明,低水平多环芳烃暴露与青年人群肺功能降低有关(Alhamdow et al., 2021)。菲暴露可诱发大鼠肺脏和肝脏组织氧化应激和炎症(Ma et al., 2020)。使用ICP-MS法测试暴露仓内与机体健康相关的重金属含量发现,Zn、Mn和Cu为含量最高的3种重金属元素。PM2.5中的重金属、多环芳烃类物质与肺损伤及病变的发展密切相关(Ning et al., 2019;Qin et al., 2021a)。相关研究发现,普遍存在的有毒重金属(如Zn、Cr等)可激活肺组织的氧化应激和炎症(Ma et al., 2020;Maret, 2012),PM2.5增加1 μg/m3和Zn增加1 ng/mL与肺癌相关(Bai et al., 2021)。此外,也有一些研究发现,重金属(Zn、Cu和Cr)和多环芳烃(苊和菲)与柴油和汽油尾气排放有关(Hu et al., 2016;Valavanidis et al., 2006)。本研究的暴露仓位于多条高速公路和城市主干道附近,推测该环境PM2.5的主要点源为机动车尾气,提示交通来源的空气污染可能与肺健康密切相关,应尽量减少在交通高峰时段的暴露活动时间。
3.2 运动对可吸入颗粒物致肺部损伤的保护效应
运动有益健康已被大量实验研究和流行病学调查所证实(Petridou et al., 2019;Simpson et al., 2020)。尽管已有一些研究认为,运动过程中参与者MV增加,导致更多颗粒物进入机体,增加气道和血管损伤的敏感性(Daigle et al., 2003);但也有研究发现,长期规律性的运动可保护空气污染导致的机体损害,即运动促进健康的正面效应可能大于空气污染导致的负面效应(Qin et al., 2019)。另一方面,meta分析揭示,空气污染影响居民的日常体育活动相关行为(An et al., 2020),久坐不动对机体产生的危害大于在空气污染中运动产生的危害(Roberts et al., 2014)。提示,应建立健康科学的生活方式和应对措施,使大众能够适应环境质量的动态变化,而不是被动盲目地停止体育活动。
间歇性运动可以提供与传统中等强度持续性运动相似或更全面的心肺功能锻炼效果,并具有运动节奏多变、减脂效率高等诸多优点,已成为年轻人群青睐的锻炼方式。相关研究表明,高强度间歇运动对年轻人心脏代谢健康、体质量管理、认知功能、炎症发生发展具有良好的干预效果(Cooper et al., 2016)。研究结果表明,8周间歇性运动可有效保护PM2.5亚急性暴露导致的肺通气功能和呼吸肌力量下降,缓解肺阻塞程度以及细支气管周围炎症浸润和血管壁病变,肺灌洗液中促炎因子升高幅度明显降低。已有研究发现,高强度间歇训练可提高慢性阻塞性肺病患者心肺健康和运动能力(Sawyer et al., 2020)。急性间歇运动可激活机体的抗炎效应,运动后血清IL-10水平和IL-10/TNF-α比率均升高(Cabral-Santos et al., 2015)。提示,有规律的运动训练可有效提高呼吸系统防御能力,缓解颗粒物所致肺部炎症的发生发展。
3.3 运动对可吸入颗粒物致肺部损伤的保护机制
HSP70是HSP家族中的重要成员,长期以来HSP70被认为是一种胞浆蛋白,定位于细胞内发挥作用,即iHSP70。但是越来越多的证据表明,HSP70也可释放到细胞外空间,成为eHSP70(Hulina-Tomašković et al., 2019)。细胞内的iHSP70具有抗炎功能,其机制主要是抑制NF-κB的活化(Costa-Beber et al., 2022)。与iHSP70相反,eHSP70具有促炎作用。既往研究多通过检测血浆中HSP70含量来评估eHSP70分泌水平(Baldissera et al., 2018;Mai et al., 2017)。Goettems-Fiorin等(2016)研究发现,暴露于细颗粒物(PM2.5)的机体eHSP70/iHSP70比值反映了细胞应激反应的改变,可作为空气颗粒导致的急性炎症或慢性低度炎症状态和风险的相关生物标志物。另一方面,Mai等(2017)研究也表明,运动形成的生理刺激足以引起生物体HSP的表达改变,12周的高强度间歇运动可抑制PM2.5暴露导致的心脏炎症和氧化应激,运动干预后eHSP70/iHSP70比值显著下降,提示HSP分泌水平与运动这一干预因素及运动机能状态密切相关。本研究结果显示,在PM2.5暴露下,随着eHSP70水平的增加,eHSP70/iHSP70出现失衡。TLR-4作为动员NF-κB的受体,可能被颗粒物中脂多糖(Lipopolysaccharides, LPS)、重金属等物质激活,促进炎症细胞因子的释放,在炎症反应中发挥关键作用(Shi et al., 2019)。本研究提示,PM2.5颗粒物暴露可促进更多的eHSP70与TLR-4结合,激活NF-κB炎症通路,导致炎症产生。8周运动可在一定程度上提高iHSP70含量,降低eHSP70含量,抑制NF-κB炎症通路激活,且iHSP70的升高程度相对于eHSP70降低程度更明显。
HSP70的合成调节主要发生在基因转录水平,由HSFs家族调控,其中HSF1是HSP的主要调控因子(Zheng et al., 2013)。在HSF1合成过程中,一方面GSK3β作为体内大量代谢酶和转录因子的调控因子,与HSF1的合成密切相关(Wang et al., 2020)。GSK3β可以使HSF1在ser303位点发生磷酸化,维持细胞质中HSF1处于无活性状态,进而减少HSP的合成(Hietakangas et al., 2006)。另一方面,P38MAPK(肌肉因子丝裂原活化蛋白激酶)可调控GSK3β磷酸化位点(ser9),进而抑制GSK3β活性(Thornton et al., 2008)。鉴于此,本研究对各组P38MAPK-GSK3β-HSF1调控途径进行评估发现,长期规律性运动可下调大鼠肺上皮细胞P38MAPK磷酸化水平,可能通过增加GSK-3β磷酸化使GSK3β失活,上调iHSP70分泌水平,改善大气颗粒物致呼吸系统炎症机体的eHSP70/iHSP70平衡紊乱,抑制PM2.5导致的HSP/TLR/NF-κB炎症信号通路,同时提升肺上皮细胞内的抗炎作用(图6)。亦有研究表明,运动上调GSK3β磷酸化位点(ser9)激活,从而抑制GSK3β活性(Liu et al., 2015)。因此推断GSK3β可能是运动保护可吸入颗粒物致呼吸系统炎症的关键因子之一,也是运动防治可吸入颗粒物健康危害的有效干预靶标。

注:→表示激活,┤表示抑制。
Figure 6.Potential Mechanisms for the Exercise Training Against PM2.5Induced Lung Injury
3.4 研究局限
由于医学伦理,本研究仅进行了运动和/或可吸入颗粒物PM2.5暴露对大鼠肺脏健康影响的动物实验,在真实应用场景中的可推广性有待商榷;在通路验证方面,未采取阻断、拮抗或转基因动物的实验进行验证。后续研究中,拟开展针对信号通路相关的细胞阻断实验,以相关通路基因敲除动物为研究对象进一步验证相关假说。
4 结论
PM2.5亚急性暴露可导致大鼠出现明显的肺脏损伤,表现为肺功能障碍、支气管黏膜脱落和炎症反应。长期规律性运动对PM2.5亚急性暴露导致的肺脏损伤具有保护作用。长期规律性运动可下调大鼠肺上皮细胞P38MAPK磷酸化水平,可能通过增加GSK-3β磷酸化位点(ser9)使GSK3β失活,增加HSF1分泌水平,上调iHSP70,改善大气颗粒物致呼吸系统炎症机体的eHSP70/iHSP70平衡,进而阻断TLR-NFκB炎症信号通路,抑制炎症。
库婷婷, 2017. PM2.5暴露诱导神经毒性及其相关分子机制研究[D].太原:山西大学.
覃飞,徐旻霄,瞿超艺,等, 2020.空气污染暴露与体育活动:如何保障健康[J].体育科学, 40(2): 58-69.
AKERFELT M, MORIMOTO R I, SISTONEN L, 2010. Heat shock factors: Integrators of cell stress, development and lifespan[J]. Nat Rev Mol Cell Biol, 11(8): 545-555.
ALHAMDOW A, ZETTERGREN A, KULL I, et al., 2021. Low-level exposure to polycyclic aromatic hydrocarbons is associated with reduced lung function among Swedish young adults[J]. Environ Res, doi: 10.1016/j.envres.2021.111169.
ALLEN J L, LIU X, PELKOWSKI S, et al., 2014. Early postnatal exposure to ultrafine particulate matter air pollution: Persistent ventriculomegaly, neurochemical disruption, and glial activation preferentially in male mice[J]. Environ Health Perspect, 122(9): 939-945.
AN R P, KANG H J, CAO L Z, et al., 2020. Engagement in outdoor physical activity under ambient fine particulate matter pollution: A risk-benefit analysis[J]. J Sport Health Sci, 11(4):537-544
ASEA A, REHLI M, KABINGU E, et al., 2002. Novel signal transduction pathway utilized by extracellular HSP70: Role of toll-like receptor (TLR) 2 and TLR4[J]. J Biol Chem, 277(17):15028-15034.
BAI K J, HO S C, TSAI C Y, et al., 2021. Exposure to PM(2.5) is associated with malignant pleural effusion in lung cancer patients[J]. Ecotoxicol Environ Saf, doi: 10.1016/j.ecoenv.2020.111618.
BALDISSERA F G, DOS SANTOS A B, SULZBACHER M M, et al., 2018. Subacute exposure to residual oil fly ash (ROFA) increases eHSP70 content and extracellular-to-intracellular HSP70 ratio: A relation with oxidative stress markers[J]. Cell Stress Chaperones, 23(6):1185-1192.
BITTENCOURT A, PORTO R R, 2017. eHSP70/iHSP70 and divergent functions on the challenge: Effect of exercise and tissue specificity in response to stress[J]. Clin Physiol Funct Imaging, 37(2):99-105.
CABRAL-SANTOS C, GEROSA-NETO J, INOUE D S, et al., 2015. Similar anti-inflammatory acute responses from moderate-intensity continuous and high-intensity intermittent exercise[J]. J Sports Sci Med, 14(4):849-856.
CHU C, ZHANG H Y, CUI S J, et al., 2019. Ambient PM2.5caused depressive-like responses through Nrf2/NLRP3 signaling pathway modulating inflammation[J]. J Hazard Mater, 369: 180-190.
COOPER S B, DRING K J, NEVILL M E, 2016. High-intensity intermittent exercise: Effect on young people’s cardiometabolic health and cognition[J]. Curr Sports Med Rep, 15(4):245-251.
COSTA-BEBER L C, HIRSCH G E, HECK T G, et al., 2022. Chaperone duality: The role of extracellular and intracellular HSP70 as a biomarker of endothelial dysfunction in the development of atherosclerosis[J]. Arch Physiol Biochem, 128(4):1016-1023.
DAIGLE C C, CHALUPA D C, GIBB F R, et al., 2003. Ultrafine particle deposition in humans during rest and exercise[J]. Inhal Toxicol, 15(6):539-552.
GILES L V, KOEHLE M S, 2014. The health effects of exercising in air pollution[J]. Sports Med, 44(2):223-249.
GOETTEMS-FIORIN P B, GROCHANKE B S, BALDISSERA F G, et al., 2016. Fine particulate matter potentiates type 2 diabetes development in high-fat diet-treated mice: Stress response and extracellular to intracellular HSP70 ratio analysis[J]. J Physiol Biochem, 72(4):643-656.
HECK T G, SCOMAZZON S P, NUNES P R, et al., 2017. Acute exercise boosts cell proliferation and the heat shock response in lymphocytes: Correlation with cytokine production and extracellular-to-intracellular HSP70 ratio[J]. Cell Stress Chaperones, 22(2):271-291.
HIETAKANGAS V, ANCKAR J, BLOMSTER H A, et al., 2006. PDSM, a motif for phosphorylation-dependent SUMO modification[J]. Proc Natl Acad Sci USA, 103(1):45-50.
HU W W, HU M, HU W, et al., 2016. Chemical composition, sources and aging process of sub-micron aerosols in Beijing: Contrast between summer and winter[J]. J Geophys Res Atmos, 121(4): 1955-1977.
HULINA-TOMAŠKOVIĆ A, SOMBORAC-BAČURA A, GRDIĆ RAJKOVIĆ M, et al., 2019. Effects of extracellular Hsp70 and cigarette smoke on differentiated THP-1 cells and human monocyte-derived macrophages[J]. Mol Immunol, 111: 53-63.
JIANG H K,WANG Y H, SUN L, et al., 2014. Aerobic interval training attenuates mitochondrial dysfunction in rats post-myocardial infarction: Roles of mitochondrial network dynamics[J]. Int J Mol Sci, 15(4):5304-5322.
KOSTRYCKI I M, WILDNER G, DONATO Y H, et al., 2019. Effects of high-fat diet on eHSP72 and extra-to-intracellular HSP70 levels in mice submitted to exercise under exposure to fine particulate matter[J]. J Diabetes Res, doi: 10.1155/2019/4858740.
KRAUSE M, HECK T G, BITTENCOURT A, et al., 2015. The chaperone balance hypothesis: The importance of the extracellular to intracellular HSP70 ratio to inflammation-driven type 2 diabetes, the effect of exercise, and the implications for clinical management[J]. Mediators Inflamm, doi: 10.1155/2015/249205.
LAKENS D,2013. Calculating and reporting effect sizes to facilitate cumulative science: A practical primer for t-tests and ANOVAs[J]. Front Psychol, doi: 10.3389/fpsyg.2013.00863.
LÉGER B, CARTONI R, PRAZ M, et al., 2006. Akt signalling through GSK-3beta, mTOR and Foxo1 is involved in human skeletal muscle hypertrophy and atrophy[J]. J Physiol, 576(Pt 3):923-933.
LI D C, ZHANG R, CUI L H, et al., 2019. Multiple organ injury in male C57BL/6J mice exposed to ambient particulate matter in a real-ambient PM exposure system in Shijiazhuang[J]. China Environ Pollut, 248: 874-887.
LIU H L, ZHAO G, ZHANG H, et al., 2013. Long-term treadmill exercise inhibits the progression of Alzheimer’s disease-like neuropathology in the hippocampus of APP/PS1 transgenic mice[J]. Behav Brain Res, 256: 261-272.
MA H T, WANG H L, ZHANG H J, et al., 2020. Effects of phenanthrene on oxidative stress and inflammation in lung and liver of female rats[J]. Environ Toxicol, 35(1):37-46.
MAI A S, DOS SANTOS A B, BEBER L C C, et al., 2017. Exercise training under exposure to low levels of fine particulate matter: Effects on heart oxidative stress and extra-to-intracellular HSP70 ratio[J]. Oxid Med Cell Longev, doi: 10.1155/2017/9067875.
MARET W, 2012. New perspectives of zinc coordination environments in proteins[J]. J Inorg Biochem, 111: 110-116.
MARTHERUS R, JAIN R, TAKAGI K, et al., 2016. Accelerated cardiac remodeling in desmoplakin transgenic mice in response to endurance exercise is associated with perturbed Wnt/β-catenin signaling[J]. Am J Physiol Heart Circ Physiol, 310(2):H174-H187.
NESI R T, DE SOUZA P S, DOS SANTOS G P, et al., 2016. Physical exercise is effective in preventing cigarette smoke-induced pulmonary oxidative response in mice[J]. Int J Chron Obstruct Pulmon Dis, 11: 603-610.
NING J, LI P, ZHANG B, et al., 2019. miRNAs deregulation in serum of mice is associated with lung cancer related pathway deregulation induced by PM2.5[J]. Environ Pollut, 254(Pt A):112875.
PAUL K C, JERRETT M, RITZ B, 2018. Type 2 diabetes mellitus and Alzheimer’s disease: Overlapping biologic mechanisms and environmental risk factors[J]. Curr Environ Health Rep, 5(1):44-58.
PETRIDOU A, SIOPI A, MOUGIOS V, 2019. Exercise in the management of obesity[J]. Metabolism, 92:163-169.
QIN F, CUI S Q, DONG Y N, et al., 2021. Aerobic exercise ameliorates particulate matter-induced lung injury in aging rats[J]. Environ Pollut, doi: 10.1016/j.envpol.2021.116889.
QIN F, DONG Y N, WANG S T, et al., 2020a. Maximum oxygen consumption and quantification of exercise intensity in untrained male Wistar rats[J]. Sci Rep, 10(1):11520.
QIN F, XU M X, WANG Z W, et al., 2020b. Effect of aerobic exercise and different levels of fine particulate matter (PM2.5) on pulmonary response in Wistar rats[J]. Life Sci, doi: 10.1016/j.lfs.2020. 117355.
QIN F, YANG Y, WANG S T, et al., 2019. Exercise and air pollutants exposure: A systematic review and meta-analysis[J]. Life Sci, 218: 153-164.
ROBERTS J D, VOSS J D, KNIGHT B, 2014. The association of ambient air pollution and physical inactivity in the United States[J]. PLoS One, 9(3): e90143.
SANCINI G, FARINA F, BATTAGLIA C, et al., 2014. Health risk assessment for air pollutants: Alterations in lung and cardiac gene expression in mice exposed to Milano winter fine particulate matter (PM2.5)[J]. PLoS One, 9(10): e109685.
SAWYER A, CAVALHERI V, HILL K, 2020. Effects of high intensity interval training on exercise capacity in people with chronic pulmonary conditions: A narrative review[J]. BMC Sports Sci Med Rehabil, doi: 10.1186/s13102-020-00167-y.
SHI X J, WANG S S, LUAN H L, et al., 2019. Clinopodium chinense attenuates palmitic acid-induced vascular endothelial inflammation and insulin resistance through TLR4-mediated NF- κ B and MAPK pathways[J]. Am J Chin Med, 47(1):97-117.
SIMPSON R J, CAMPBELL J P, GLEESON M, et al., 2020. Can exercise affect immune function to increase susceptibility to infection?[J]. Exerc Immunol Rev, 26: 8-22.
SIOUTAS C, KOUTRAKIS P, BURTON R M, 1995. A technique to expose animals to concentrated fine ambient aerosols[J]. Environ Health Perspect, 103(2):172-177.
THORNTON T M, PEDRAZA-ALVA G, DENG B, et al., 2008. Phosphorylation by p38 MAPK as an alternative pathway for GSK3beta inactivation[J]. Science, 320(5876):667-670.
VALAVANIDIS A, FIOTAKIS K, VLAHOGIANNI T, et al., 2006. Characterization of atmospheric particulates, particle-bound transition metals and polycyclic aromatic hydrocarbons of urban air in the centre of Athens (Greece)[J]. Chemosphere, 65(5):760-768.
WANG Y, CHEN Z D, LI Y, et al., 2020. Low density lipoprotein receptor related protein 6 (LRP6) protects heart against oxidative stress by the crosstalk of HSF1 and GSK3β[J]. Redox Biol, doi: 10.1016/j.redox.2020.101699.
YANG B, GUO J, XIAO C L, 2018. Effect of PM2.5 environmental pollution on rat lung[J]. Environ Sci Pollut Res Int, 25(36):36136-36146.
YU Y B, LIAO Y W, SU K H, et al., 2012. Prior exercise training alleviates the lung inflammation induced by subsequent exposure to environmental cigarette smoke[J]. Acta Physiol (Oxf), 205(4):532-540.
ZHENG Z, XU X H, ZHANG X B, et al., 2013. Exposure to ambient particulate matter induces a NASH-like phenotype and impairs hepatic glucose metabolism in an animal model[J]. J Hepatol, 58(1):148-154.
Exercise Protects Lung Injury Induced by PM2.5Exposure in Rats: Mediated by GSK3β on Extracellular to Intracellular HSP70 Ratio
QIN Fei1, 2, 3,XU Minxiao4,CUI Shuqiang5,QU Chaoyi2,DONG Yanan5,ZHAO Jiexiu2*
To explore the protective effects of long-term exercise on lung injury induced by PM2.5and the mechanism of extracellular to intracellular HSP70 ratio mediated by GSK3β. Male Wistar rats (aged 8 weeks) were randomly divided into four groups: Sedentary (S), exercise (E), sedentary+PM2.5exposure (S+PM2.5) and exercise+PM2.5exposure (E+PM2.5). All rats in exercise-related groups were trained by running on a treadmill for 8 weeks (60 min/time, 5 times/week). Rats in the PM-related groups were exposed to ambient PM2.5(7 times/week, 6 h/time) for 3 weeks after an 8-week exercise intervention or sedentary treatment. Finally, all rats' pulmonary function, lung morphology, degree of inflammation, and relevant protein expression levels were examined. It was found that PM2.5exposure led to neutrophil infiltration, alveolar hemorrhage, and alveolar septal thickening. Compared with S group, the significant decrease of MV, TV, EF50, PIF, PEF, iHSP70, IκBα, HSF1 and p-GSK3βser9were observed, but the obvious increase of PAU, Te, TNF-α, IL-1α, IL-6, eHSP70, TLR-4, NFκB p65, p-IκBα, IKKβ, p-IKKβ, GSK3β, p-P38 and p-HSF1ser303were presented in S+PM2.5group. The lung injury was significantly improved in the E+PM2.5group compared with that of S+PM2.5group. Compared with S+PM2.5group, the MV, TV, EF50, PIF, PEF, iHSP70, IκBα, HSF1 and p-GSK3βser9were significantly increased , but the PAU, Te, TNF-α, IL-1α, IL-6, eHSP70, TLR-4, NFκB p65, p-IκBα, IKKβ, p-IKKβ, GSK3β, p-P38 and p-HSF1ser303were obviously decreased in E+PM2.5group. 8-week exercise training expressed protective effects on lung injury and reduced vulnerability to inflammation induced by PM2.5exposure, it was possibly through the P38 MAPK/GSK3β/HSF1 signaling pathways mediated by the extracellular-to-intracellular HSP70 ratio.
1000-677X(2023)01-0050-10
10.16469/j.css.202301006
2022-08-29;
2022-12-18
国家自然科学基金青年项目(31900845);国家自然科学基金面上项目(11775059)。
覃飞(1987-),女,副教授,博士,主要研究方向为运动免疫与健康,E-mail: qinfei8707@jnu.edu.cn。
赵杰修(1975-),男,研究员,博士,主要研究方向为运动与特殊环境,E-mail: zhaojiexiu@ciss.cn。
G804.7
A
