柑桔衰退病毒JY基因型在我国的发生分布及其分子特征
2023-06-15李双花黄爱军
李双花,周 俊,游 平,黄爱军,易 龙
(赣南师范大学生命科学学院/国家脐橙工程技术研究中心,江西赣州,341000)
柑桔衰退病是由柑桔衰退病毒(Citrustristezavirus,CTV)引起的对柑桔产业具有毁灭性危害的一种病毒病害,严重影响柑桔产业的可持续性发展。柑桔衰退病已在美洲、亚洲、非洲、欧洲、太平洋及地中海地区等区域的50多个国家或地区发生,保守估计全世界柑桔产业因衰退病爆发和流行造成的损失已达数亿美元,并且彻底改变了柑桔产业的发展方向[1]。CTV是长线形病毒科(Closteroviridae)长线形病毒属(Closterovirus)中的一员,是世界上已知的、最大的植物病毒,其基因组长约19.3 kb,拥有12个开放阅读框,5’端和3’端各有1个非编码区,编码至少19种蛋白质[1-3]。CTV主要通过染病的接穗嫁接和苗木调运扩散,其不能经种子传播。在自然条件下,CTV可以通过介体蚜虫以半持久性方式进行传播,其中褐色桔蚜的传播效率最高[4]。根据CTV在不同寄主上引起不同的症状,将其分为苗黄型(Seeding yellow,SY)、速衰型(Quick decline,QD)和茎陷点型(Stem pitting,SP)[1,5]。CTV存在复杂的株系分化,已报道的CTV基因型有11种:T3、VT、T36、RB、T68、T30、HA16-5、A18、S1、L1、M1[6-11]。不同柑桔寄主对不同基因型CTV侵染的敏感度存在较大差异,酸橙、甜橙和柚等柑桔种类对T3、VT、T36、T68较为敏感[6-8],而枳及其杂交种对大部分基因型具有抗性[12]。同时,CTV不同基因型的致病性存在一定差异,VT、T3、T68基因型可诱发茎陷点症状,T36基因型主要引起酸橙砧木的速衰型衰退病,S1和T30基因型一般不引起症状[5,6],但随着RB基因型突破了枳的抗性[13],并在枳上鉴定到L1和M1两种新基因型[11],表明CTV种群仍处于扩张期,这对于抗性品种培育和防治策略研制带来了新的挑战。
最近,本课题组从来自湖南江永的一份道县野桔上得到一株CTV分离物,根据序列多样性和遗传演化分析,推定其归属一种新的基因型,将其命名为JY(Genbank登录号为ON094625)。为了明确JY基因型在我国的发生情况及其遗传多样性,对在湖南江永、湖南道县、湖南宜章(莽山)和江西崇义地区采集的野生柑桔样品,以及福建、浙江、广东、广西、湖北、重庆、四川、江西和湖南采集的栽培柑桔样品进行RT-PCR检测,分析ORF1b、p33、p25、p23基因序列的多样性,测定JY基因型种群内和种群间的遗传分化系数(Fst),构建系统发育树。本研究结果将有助于明确JY基因型的遗传特性和进一步探索CTV基因型的多样性,为探明CTV的遗传演化提供帮助。
1 材料与方法
1.1 柑桔材料及试剂
在湖南的江永(东经111.34082°、北纬25.27233°)、宜章(莽山,东经112.59467°、北纬24. 56694°)、道县(东经111.60195°、北纬25.52766°)及江西的崇义(东经114.30835°、北纬25.68186°)分别采集道县野桔(Citrusdaoxianensis)、莽山野桔(C.mangshanensis)和崇义野桔(C.reticulata)样品共358份,各样品采集地的生长环境见图1。另外,从福建、浙江、广东、广西、湖北、重庆、四川、江西和湖南(JY-2采集地附近栽培果园)等柑桔主产区采集的1 439份栽培柑桔样品。

图1 野生柑桔样品生长环境示例
RNAiso Plus总RNA提取试剂、TaqDNA polymerase、10×TaqBuffer、T载体和DH5α感受态细胞购自购自大连宝生物公司(TaKaRa)。M-MLV逆转录酶购自普洛麦格(Promega)公司。dNTPs、DNA Marker、DNase/RNase Free ddH2O和DNA凝胶回收试剂盒购自北京天根生化科技有限公司。
1.2 引物设计与合成
根据CTV JY-2分离物(Genbank登录号为ON 094625)全长序列设计JY基因型的检测引物及ORF1b、p33、p25、p23基因序列扩增引物(表1),引物由南京金斯瑞生物科技有限公司合成。

表1 柑桔衰退病毒JY基因型检测所用引物的信息
1.3 总RNA提取及反转录
取柑桔叶片叶柄及中脉约0.1 g,利用RNAiso Plus(TaKaRa)提取总RNA,具体操作方法参照试剂盒说明书。利用NanoDrop ND-2000(Thermo Scientific,USA)检测总RNA浓度和纯度,RNA样品保存于-80 ℃冰箱。以1 μL总RNA为模板,以随机六聚体(6N)为引物,按照M-MLV反转录酶推荐方法进行体系配制,在 37 ℃条件下反应60 min合成cDNA,20 ℃冰箱保存备用。
1.4 PCR扩增及克隆测序
PCR反应体系(25 μL):10 ×TaqBuffer(含Mg2+)4.5 μL,dNTPs 2.0 μL,上、下游引物(F/R)各0.5 μL,cDNA 1 μL,TaqDNA polymerase 0.4 μL,ddH2O 16.1 μL。PCR扩增程序为:95 ℃ 5 min;95 ℃ 30 s,退火温度30 s,72 ℃ 60 s/kb,35个循环;72 ℃ 5 min。PCR产物进行1.2%琼脂糖凝胶电泳观察结果。
参照DNA凝胶回收试剂盒方法,将扩增到的预期大小的PCR产物回收。将回收的目的片段连接到pMD-19 T载体中,并转入大肠杆菌DH5α感受态细胞。挑取单菌落进行培养,通过PCR扩增筛选阳性单克隆4~6个,送生工生物工程(上海)股份有限公司测序。
1.5 遗传多样性分析及系统发育分析
用MAFFT[14]软件进行序列比对,通过Lasergene[15]序列分析软件包中的MegAlign进行序列同源性分析。运用Dnasp[16]计算核苷酸多样性、核苷酸分散度、种群间的遗传分化系数(Fst)[17]和进行Tajima’s D检验,分析种群内及种群间的核苷酸差异。以GenAIEx[18]软件对CTV种群进行分子变异分析及主成分分析。应用MEGA 7.0[19]软件构建单个基因序列的ML系统发育树,参数设置为1 000 bootstrap重复。另外将比对好的各基因序列由Seqkit[20]软件进行拼接后,用MEGA软件构建4个基因序列的联合ML树。
2 结果与分析
2.1 CTV及JY基因型发生情况
检测结果发现,各地栽培柑桔样品CTV阳性检出率:福建50.6%,浙江33.3%,广东100%,广西48.6%,湖北100%,重庆50.5%,四川59.3%,江西34.1%,湖南47.1%。各地野生柑桔样品CTV阳性检出率:崇义51.1%,道县22.4%,莽山43.1%,江永32.6%(见表2)。对所有的CTV阳性样品进行JY基因型检测的结果发现,仅江永的道县野桔样品中检测出JY基因型(见图2)。以上结果说明CTV在我国栽培柑桔产区普遍发生,且野生柑桔也感染了CTV,但JY基因型仅分布于少数地区。

表2 野生柑桔和栽培柑桔上柑桔衰退病毒及JY基因型的检测结果 个

注:M为DNA 2 000 marker,PC为阳性对照,NC为阴性对照,WC为水对照,1—15为检测样品。

图3 柑桔衰退病毒野生柑桔种群与栽培柑桔种群主成分分析结果
2.2 JY基因型分离物遗传特征
2.2.1 序列多样性分析 将获得的12个JY分离物的ORF1b、p33、p25、p23基因序列与JY-2的对应基因序列进行相似性分析,结果发现各分离物ORF1b、p33、p25的核苷酸(nt)和氨基酸(aa)序列相似性非常高:ORF1b基因nt相似性为99.8%~100%,aa相似性为99.8%~100%;p33基因nt相似性为99.0%~100%,aa相似性为98.3%~100%;p25基因nt相似性为99.7%~100%,aa相似性为100%。与ORF1b、p33、p25相比,p23具有较高的多样性,nt相似性为96.8%~100%,aa相似性为97.1%~100%。总体而言,JY分离物之间4个基因序列相似性均较高。说明,JY基因型种群内的遗传变异较少,种群较为稳定。
进一步将所有JY分离物的ORF1b、p33、p25、p23基因序列与CTV各基因型代表分离物的对应基因序列进行序列相似性比对分析,结果显示JY分离物ORF1b、p33、p25、p23基因序列与CTV各基因型代表分离物的平均核苷酸序列相似性分别为79.2%~92.7%、80.8%~85.9%、90.5%~93.6%、87.5%~91.8%,而平均氨基酸序列相似性分别为89.5%~98.1%、80.8%~84.4%、93.7%~97.3%、85.4%~91.6%(见表3)。说明,JY基因型分离物ORF1b、p25蛋白氨基酸序列较p33、p23蛋白保守。另外,与CTV JY-2基因组全长序列分析结果一致[21],ORF1b、p33基因序列与CN-M1-ZT1分离物相似性最高,而p25、p23基因序列与A18分离物相似性最高(见表3)。

表3 柑桔衰退病毒JY基因型分离物与其他基因型代表分离物在4个基因序列上的平均核苷酸和氨基酸序列一致性 %
2.2.2 遗传分化与种群动态分析 为进一步明确JY分离物与现存已报道的CTV基因型分离物之间的遗传分化程度与种群动态,运用Dnasp计算核苷酸多样性、核苷酸分散度、种群间遗传分化系数(Fst)和进行Tajima’s D检验。结果发现,ORF1b、p33、p25、p23基因的核苷酸多样性分别为0.121 53、0.119 22、0.061 36和0.076 28,说明CTV种群ORF1b、p33基因的核苷酸多样性显著高于p23、p25基因;ORF1b、p33、p25、p23基因的Tajima’s D检验值分别为-0.263 15、-0.747 63、-0.878 30和-0.355 29,但差异不显著(p>0.1),表明CTV种群可能处于扩张趋势中。JY基因型分离物与CTV其他基因型分离物之间,在ORF1b、p33、p25、p23等4个基因上的Fst均大于0.25(见表4)。这说明JY基因型与CTV其他基因型存在明显的遗传分化。另外,核苷酸分散度分析结果显示,JY分离物与VT、T30、T3、T68、S1、T36分离物ORF1b基因的Ks(Silent)和Ks(JC-Silent)较高,分别为0.177 95~0.206 36和0.203 13~0.241 33;JY分离物与RB、VT、T30、T3、T68、S1、T36分离物p33基因的Ks(Silent)和Ks(JC-Silent)较高,分别为0.167 85~0.189 05和0.190 01~0.217 83;JY基因型分离物与CTV其他基因型分离物p25、p23的核苷酸分散度较低,p25的Ks(Silent)和Ks(JC-Silent)分别为0.079 11~0.090 84和0.083 60~0.096 83,p23的Ks(Silent)和Ks(JC-Silent)分别为0.083 88~0.117 34和0.088 96~0.127 60(见表4)。这说明JY分离物与CTV其他基因型遗传分化来自ORF1b和p33基因的贡献高于p23和p25基因。

表4 柑桔衰退病毒JY基因型分离物与其他基因型分离物在4个基因上的核苷酸分散度及遗传分化系数(Fst)
2.2.3 分子变异分析及主成分分析 为探究JY基因型遗传分化的来源,根据CTV分离物来源将其划分为野生柑桔种群(JY基因型分离物)和栽培柑桔种群(大部分其他基因型分离物)。分子变异分析结果显示,来自CTV野生柑桔种群与栽培柑桔种群间、CTV野生柑桔种群内个体间、CTV栽培柑桔种群内个体间的变异分别占43%、42%和15%,说明CTV野生柑桔种群与栽培柑桔种群的主要变异来自种群间;CTV野生柑桔种群与栽培柑桔种群间差异的p值为0.001(p<0.05为显著),且Nm(Haploid) =0.396<1{Nm(Haploid) = [(1 / PhiPT) - 1] / 2},说明差异非常大,且基因交流小。因此,推测野生柑桔独特的生境可能是影响JY基因型种群出现明显遗传分化的重要因素。主成分分析显示,CTV野生柑桔种群与栽培柑桔种群明显分开(见图 3),进一步证实两种群间存在明显遗传分化。
2.3 系统发育
单基因的ML树显示,12个JY基因型分离物均与JY-2聚集在同一簇,且独立于现有CTV基因型之外;但不同基因的系统发育中显示的亲缘关系有所差异,ORF1b基因ML树显示JY基因型分离物与M1基因型分离物亲缘关系最近,p25和p33基因ML树显示JY基因型分离物与M1和L1基因型分离物亲缘关系最近,p23基因的ML树显示JY基因型分离物与T30、S1基因型分离物亲缘关系最近。在单基因系统发育分析结果中,ORF1b、p33和p23系统发育分析结果与基因序列多样性分析和核苷酸分散度分析结果基本一致,仅p25基因略有不同。联合4个基因构建ML树,发现与ORF1b单基因系统发育树和JY-2全基因组序列分析[21]结果最为相似,即JY基因型与M1基因型分离物亲缘关系最近,其次是T36、RB、A18基因型(见图4)。
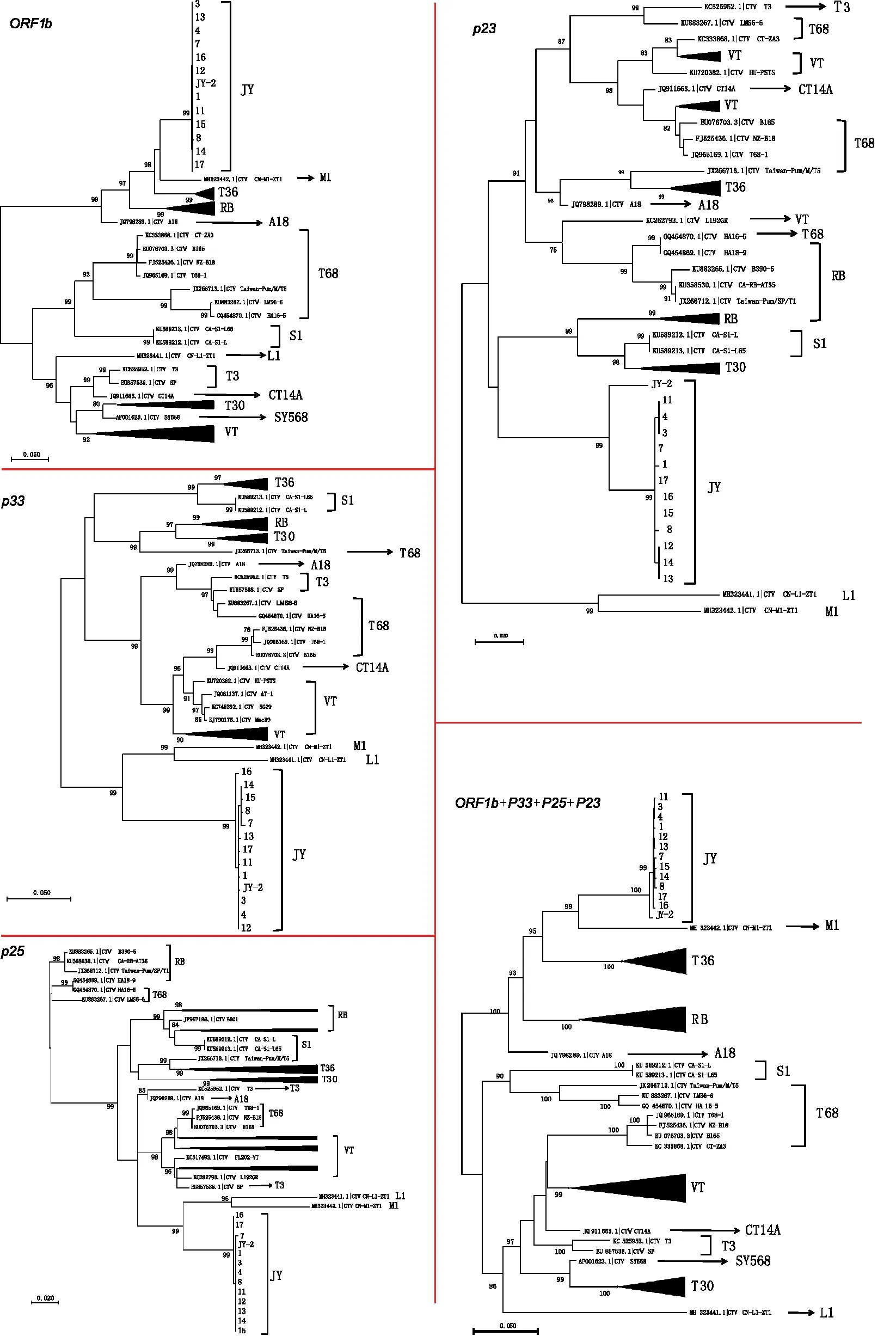
图4 柑桔衰退病毒JY基因型12个分离物基于4个基因的系统发育树(ML)
3 讨论
本研究对湖南的道县、江永、宜章(莽山)和江西的崇义4个地区的野生柑桔样品,以及湖南、江西、浙江、福建、重庆、四川、湖北、广西、广东等柑桔主产区的栽培柑桔样品进行了CTV JY基因型的检测,结果仅湖南都庞岭山脉江永地区的野生柑桔样品检出JY基因型分离物,说明JY基因型的发生和分布并不普遍。2020年,从枳上鉴定到L1和M1两种CTV新基因型[11],两者也仅在重庆采集的样品中检出。此外,有研究在云南省哀牢山地区的野生柑桔中鉴定了4种长线形病毒,包括CTV和长线形病毒科的3个新成员(CiVB、CaAV-1、CaAV-2),同样这些新的柑桔长线形病毒分布并不广泛[22]。因此,推测柑桔中可能存在许多未知的长线形病毒或CTV新基因型,但前期缺乏相关研究[23]。尽管这些新病毒与CTV新基因型目前发生和分布并不普遍,但野生柑桔中的未知长线形病毒和CTV新基因型很可能通过人为和昆虫媒介的方式传播至附近的栽培柑桔果园,从而对柑桔产业造成威胁。
本研究通过克隆测序ORF1b、p33、p25和p23 等4个基因序列,进一步分析了JY基因型分离物的分子特征。其中,ORF1b编码蛋白参与病毒基因组复制[24-25];p33编码蛋白具有多种,如与致病性、寄主范围、重复侵染和运动等有关[26];p25编码蛋白是CTV主要的外壳蛋白[2]同时也作为RNA沉默抑制子[27];p23为CTV沉默抑制子[27]。遗传多样性分析显示,JY基因型分离物间ORF1b、p33、p25、p23基因序列的核苷酸和氨基酸序列相似性(>96.8%)非常高,说明JY基因型种群内的遗传变异较少,种群较为稳定;其中,p23基因核苷酸和氨基酸序列多样性相对最为丰富,这可能与其作为CTV RNA沉默抑制子的功能有关[27]。遗传多样性、遗传分化、分子变异及主成分分析的结果均证实,JY基因型分离物与CTV其他基因型分离物存在明显的遗传分化。进一步通过核苷酸分散度分析发现,JY基因型分离物与CTV其他基因型分离物ORF1b、p33基因的分化程度明显高于p23、p25基因,说明4个基因尽管种群内都较为稳定但其面临的选择压却不同。这一结果与之前的报道[6]一致,即CTV 5’端基因序列多样性高于3’端。
基于ORF1b、p33、p25、p23基因单独及4个基因联合的系统发育分析,表明JY基因型分离物均聚集在同一分支,且独立于现有CTV基因型之外。尽管ORF1b、p33、p25系统发育分析显示JY基因型分离物与M1基因型分离物亲缘关系较近,但p23基因系统发育分析显示JY基因型分离物与T30、S1基因型分离物亲缘关系较近,遗传多样分析也显示JY基因型分离物的p25、p23基因与M1基因型分离物的相似性低于A18基因型分离物。M1基因型分离物可检测到多个重组事件[11],推测其为重组而产生的新基因型,但JY基因型分离物未检测到重组事件。因此,推测JY基因型与M1基因型拥有共同的母系基因型,但分化后JY基因型与M1基因型是相互独立演化的。
本研究以JY新基因型为研究对象,通过分子检测、序列多样性分析、遗传分化分析、分子变异分析和系统发育分析,明确了JY基因型分离物发生分布范围和种群分化特征,丰富了关于CTV种群多样性的信息,将对解析CTV起源和进化提供参考。
