蓝莓3个ZIP转运子的克隆及其生物学功能
2023-06-15沈芷琦朱林梢余颖陶歆钰周非陈侨月
沈芷琦 朱林梢 余颖 陶歆钰 周非 陈侨月
摘 要:藍莓Vaccinium spp.的生长代谢极大程度受到金属离子平衡的影响,ZIP转运蛋白家族在调节植物体金属稳态中起着关键性作用,但目前有关蓝莓ZIP转运蛋白的相关研究较少。为探究蓝莓ZIP转运蛋白基因对铁(Fe)、 锌(Zn)、 镉(Cd)等金属离子的吸收转运机制,以北高丛蓝莓布里吉塔为研究材料,对蓝莓ZIP基因家族成员进行克隆,采用生物信息学方法分析得到候选基因的核苷酸序列、氨基酸序列、跨膜结构域,对比其他植物的ZIP家族基因,构建系统进化树并筛选得到高相似性的重点研究对象;通过添加金属水培蓝莓的VcZIPs基因表达量分析,探究蓝莓中ZIP转运子的生物学功能;通过转基因酵母金属耐性分析试验,验证VcZIPs异源表达时的功能。结果表明:克隆得到8个VcZIPs全长cDNA序列,其中筛选出3个转运子VcZIP4、VcZIP7、VcZIP9具有ZIP家族的典型二级结构,或为潜在的ZIP家族成员。qRTPCR结果表明,蓝莓叶部ZIP转运子的基因转录水平普遍受到过量金属离子的抑制;蓝莓根部的VcZIPs基因表达普遍受根际过量金属离子诱导,VcZIP4基因的表达量在缺Fe、过量Fe以及超量Cd处理组中分别上调为对照(CK)的5.3、86.5、和45.4倍,VcZIP7基因的表达量在过量Fe处理组中上调为对照的27.2倍,VcZIP 9基因的表达量在过量Cd、超量Cd条件下响应最显著,分别上调为对照(CK)的142.8倍和360.2倍。转基因酵母金属耐性分析试验表明,VcZIP7可能具有镉转运的功能;VcZIP4、VcZIP9均能介导锰的转运而VcZIP7不具备转运锰的能力;VcZIP4、VcZIP7、VcZIP9均具有铁转运功能,其中VcZIP7的铁转运功能最高,其相对较低的表达可能是蓝莓铁营养低效的重要原因。研究结果可为揭示蓝莓ZIP金属转运子家族的运输机制奠定基础。
关键词:蓝莓;ZIP转运蛋白;克隆;生物学
中图分类号:S 663.9 文献标志码:A 文章编号:0253-2301(2023)03-0020-08
DOI: 10.13651/j.cnki.fjnykj.2023.03.004
Abstract: The growth and metabolism of blueberry were greatly affected by the balance of metal ions. ZIP transporter protein family played a key role in regulating the metal homeostasis in plants. However, there were few studies on ZIP transporter protein in blueberry. In order to explore the absorption and transport mechanism of ZIP transporter protein gene in blueberry to the metal ions, such as ferric ion (Fe), zinc (Zn), cadmium (Cd), the members of ZIP gene family in blueberry were cloned by using the northern highbush blueberry Brigitta as the research material. The nucleotide sequence, amino acid sequence and transmembrane domain of the candidate genes were obtained by using the bioinformatics method. Compared with the ZIP family genes of other plants, the phylogenetic tree was constructed and the key research objects with high similarity were screened. The biological function of ZIP transporters in blueberry was explored by analyzing the expression of VcZIPs gene in blueberry with metal hydroponics. The function of heterologous expression of VcZIPs was verified by carrying out the metal tolerance analysis test of transgenic yeast. The results showed that: eight fulllength cDNA sequences of VcZIPs were cloned, among which the three transporters, including VcZIP4, VcZIP7 and VcZIP9 had the typical secondary structure of the ZIP family or were the potential members of the ZIP family. The results of qRTPCR showed that the gene transcription level of ZIP transporter in the leaves of blueberry was generally inhibited by the excessive metal ions. The expression of VcZIPs genes in the roots of blueberry was generally induced by the excessive metal ions in rhizosphere. The expression level of VcZIP4 gene was upregulated by 5.3, 86.5, and 45.4 times compared with the control (CK) in the deficient Fe, excessive Fe and excessive Cd treatment groups, respectively. The expression level of VcZIP7 gene was upregulated by 27.2 times compared with the control in the excessive Fe treatment group. The expression level of VcZIP9 gene was the most significant under the conditions of excessive Fe and excessive Cd treatments, which was upregulated by 142.8 times and 360.2 times compared with the control (CK), respectively. The metal tolerance analysis of transgenic yeast showed that, VcZIP7 might have the function of cadmium transport. Both VcZIP4 and VcZIP9 could mediate the transport of manganese, while VcZIP7 didn′t have the ability to transport manganese. VcZIP4, VcZIP7 and VcZIP9 all had the function of iron transport, among which VcZIP7 had the highest function of iron transport, and its relatively low expression might be an important reason for the low efficiency of iron nutrition of blueberry. The results could lay a foundation for revealing the transportation mechanism of the ZIP metal transporter family of blueberry.
Key words: Blueberry; ZIP transporter protein; Cloning; Biology
微量元素是植物生长发育所必需的成分,主要以离子的形式存在,参与多种生化反应,在植物的生长发育和代谢过程中至关重要[1]。缺乏或过量的矿质元素,如锌、铁和铜,会对植物体内的许多关键的生物化学反应和代谢途径产生严重的影响[2]。过量摄入某些重金属元素可能导致植株生长受阻、生理紊乱甚至死亡。因此,为确保植物正常生长和发育,调节植物体内的金属元素平衡极为关键[3-5]。
植物中金属离子转运蛋白家族种类繁多,目前已得到鉴定的包括 ZIP(Znregulated,Ironregulated transporterlike Protein)家族、NRAMP(Natural Resistance And Macrophage Protein)家族、CDF(CationDiffusion Factor)家族等。这些转运蛋白调节植物体内金属离子的吸收和运输,在植物生长调节过程中承担重要角色[6]。ZIP家族是植物中最先被分离出来的转运蛋白,定位在细胞膜上,其中两个主要成员是ZRT(Zincregulated transporter)和IRT(Iron regulated transporter),参与调控Zn、Fe、Mn、Cu等金属元素的吸收及Cd、Ni、Co等重金属元素的转运。目前已克隆得到的ZIP家族成员主要在拟南芥[7]、水稻[8]、大麦[9]、玉米[10]等模式植物中,在拟南芥中克隆得到15个成员(AtIRT1~AtIRT3、AtZIP1~AtZIP12);水稻中克隆得到18个成员(OsIRT1、OsIRT2、OsZIP1~OsZIP16);大麦中克隆得到13个成员(HvIRT1、HvZIP1~HvZIP3、HvZIP5~HvZIP8、HvZIP10~HvZIP11、HvZIP13~HvZIP14、HvZIP16);玉米中克隆得到9个成员(ZmIRT1、ZmZIP1~ZmZIP8)。现有研究表明,ZIP转运蛋白主要承担多种二价金属阳离子的转运,如Zn2+、Fe2+、Cu2+、Cd2+等[11]。同时,编码ZIP蛋白的不同基因受环境金属离子浓度的调节,在植物的地上部、根部及种子等部位的表达中呈现出差异性[12-16]。
在部分模式植物中,ZIP转运蛋白家族已被证实能够促进Zn、Fe、Mn和Cu等金属元素的吸收、运输和分隔,在调节金属离子稳态中起到至关重要的作用,而蓝莓ZIP转运子家族的相关研究却鲜见报道。蓝莓在非酸性根际及有机质匮乏的土壤里常出现叶片黄化、脉间失绿等典型缺Fe症状。因此栽培蓝莓时常常采取降低土壤pH值的方法来增加土壤中有效Fe的浓度,从而提高蓝莓对铁的吸收和利用效率。然而,土壤酸度的上升会同时提高其他重金属离子的可溶性,导致蓝莓生长过程中表现出生理性重金属中毒,对蓝莓的品质和产量造成严重的影响[17-19]。因此,研究蓝莓对Cd、Zn等重金属毒害的耐受性及其相关机理具有重要的实践意义。本研究从蓝莓中克隆得到3个ZIP转运蛋白家族基因cDNA,并利用qRTPCR和转基因酵母金属耐性分析试验,研究ZIP转运子的表达模式及金属转运功能,以揭示蓝莓对金属元素的吸收利用机制,提升蓝莓中矿质元素的吸收效率并缓解重金属的胁迫作用。
1 材料与方法
1.1 试验材料
采用长势相近的1年生北高丛蓝莓布里吉塔(Brigitta),大肠杆菌(Escherichia coli)感受态DH5α,酵母表达载体pDR195,酵母材料包括:野生型DY1457(ade can1100oc his3 leu2 trp1 ura3),锌镉敏感型突变体△zrc1(MAT α;his△1;leu2△0;met15△0;YMR243::kanMX4),锰吸收缺陷型突变体△smf1(SLY8;MAT α ura3 lys2 ade2 trp1 his3 leu2 smf1::HIS3),铁吸收缺陷型突变体DDY4(ura3 trp1 leu2 can1)。
1.2 仪器和试剂
仪器设备选用PCR扩增仪、电泳仪、高速冷冻离心机、水浴锅、恒温振荡器、-80℃超低温冰箱、电子天平、pH计、凝胶成像系统、显微镜、NanoDrop 2000分光光度计、荧光定量 PCR仪、人工气候培养箱、氧气泵等。
试剂选用PrimeScript 1st strand cDNA Synthesis kit试剂盒(TaKaRa,日本)、CTAB提取液、Hoagland营养液、SDURA培养基等。
1.3 试验方法
1.3.1 蓝莓总RNA提取及ZIP家族基因克隆 参照Vashisth等[20]和Tripti等[21]改良后的CTAB法提取蓝莓叶、根系总RNA,利用检测仪对样本RNA浓度进行检测,并置于-80℃保存。采用PrimeScript 1st strand cDNA Synthesis kit试剂盒(TaKaRa,日本)合成得到cDNA的第一链,并置于-20℃溶液中保存。以实验室前期已知的VcIRT1特异序列為探针,对比蓝莓的基因数据库,得到VcIRT1基因的同源序列,并采用ExPASy Translate tool软件反向推导出氨基酸序列,通过NCBI的Blast功能筛选得出可能属于ZIP金属转运蛋白家族的各组同源序列。采用Premier 5.0设计引物,以蓝莓叶、根系总cDNA为模板,克隆得到目的基因片段,并将片段通过载体pMD19T Vector转化至大肠杆菌感受态DH5α,用于验证目的基因片段的可靠性。
1.3.2 蓝莓ZIP家族基因核苷酸序列、氨基酸序列分析及系统发育树构建 采用ExPASy Translate tool软件分析测序所得的候选ZIP家族基因的核苷酸序列,推导得知其氨基酸序列;采用TMHMM 2.0软件分析候选ZIP金属转运子的跨膜结构域;采用NCBI的GenBank数据库获取其他植物中已知的ZIP家族基因的氨基酸序列,通过MEGA5.0软件构建系统进化树,并进行多序列比对分析。将候选ZIP金属转运子分析得到的二级结构与ZIP家族的典型二级结构进行比对,筛选得到高相似性的重点研究对象,进一步验证其对金属转运的能力。
1.3.3 添加金属离子水培对蓝莓生长的影响 采用改良后的Hoagland营养液水培蓝莓,参考蓝莓水培中金属离子过量的常用浓度,共设6个处理组,分别为对照(CK,含Fe 40 μmol·L-1);过量Fe(100 μmol·L-1);缺Fe(0 μmol·L-1);过量Zn(50 μmol·L-1);过量Cd(5 μmol·L-1);超量Cd(50 μmol·L-1)。每个处理组3次重复,每次重复为10 株蓝莓苗。培养30 d后,观察不同金属处理组中蓝莓苗的根、茎、叶生长状况。
1.3.4 添加金属离子水培对蓝莓3个ZIP家族基因表达量的影响 采用1.3.1方法提取水培处理后蓝莓的叶、根系总RNA,并合成得到cDNA第一链,置于-20℃溶液中保存。利用Premier 5.0设计定量引物,使用ABI Prism 7000定量扩增仪进行实时荧光定量PCR分析,对比不同处理组的蓝莓叶、根中VcZIPs基因表达量的差异。采用 2-ΔΔCt法通过内参基因 GAPDH对数据进行归一化处理。
1.3.5 转基因酵母对金屬Cd、Mn、Fe的耐性分析 (1)pDR195VcZIPs表达载体构建及酵母转化 以载体pDR195为基础,利用双酶切-T4连接法构建转基因酵母金属耐性分析试验表达载体,将VcZIPs分别连接至pDR195,构建重组质粒并转化至大肠杆菌感受态DH5α进行扩增,验证目的片段的有效性。酵母转化方法参照Gietz等[22]提出的醋酸锂酵母转化法,将pDR195VcZIPs重组质粒分别转入野生型DY1457、锌镉敏感型突变体△zrc1、锰吸收缺陷型突变体△smf1、铁吸收缺陷型突变体DDY4中,用于验证候选基因在缺陷型酵母中是否起到金属运输功能互补的作用。(2)转基因酵母金属耐性分析 依据不同突变体酵母的营养需求,分别采用缺失相应氨基酸的选择性SDURA液体培养基筛选转化成功的酵母单克隆,并置于液体培养基中培养至浓度达到OD600=1.0。针对不同的缺陷型酵母的金属吸收特性,在缺失相应氨基酸的选择性SDURA固体培养基中进行不同金属处理,以观察转化后的酵母对金属的耐性是否改变。(a)锌镉敏感型突变体△zrc1:选择性SDURA固体培养基(CK)、添加50 μmol·L-1CdCl2的SDURA固体培养基;(b)锰吸收缺陷型突变体 smf1:选择性SDURA固体培养基(CK)、添加20 μmol·L-1EGTA+15 mmol·L-1 MES的SDURA固体培养基;(c)铁吸收缺陷型突变体DDY4:选择性SDURA固体培养基(CK)、pH=5.6 SDURA固体培养基、5.8 SDURA固体培养基。
将OD600=1.0的酵母菌液以10倍梯度连续稀释4次,获得OD600=0.1、0.01、0.001、0.0001的梯度浓度菌液,分别点板至各处理组的SDURA固体培养基上。在30℃恒温箱中培养2~3 d后对比生长状况,并拍照记录试验结果[23]。
2 结果与分析
2.1 蓝莓ZIP家族基因生物信息学分析
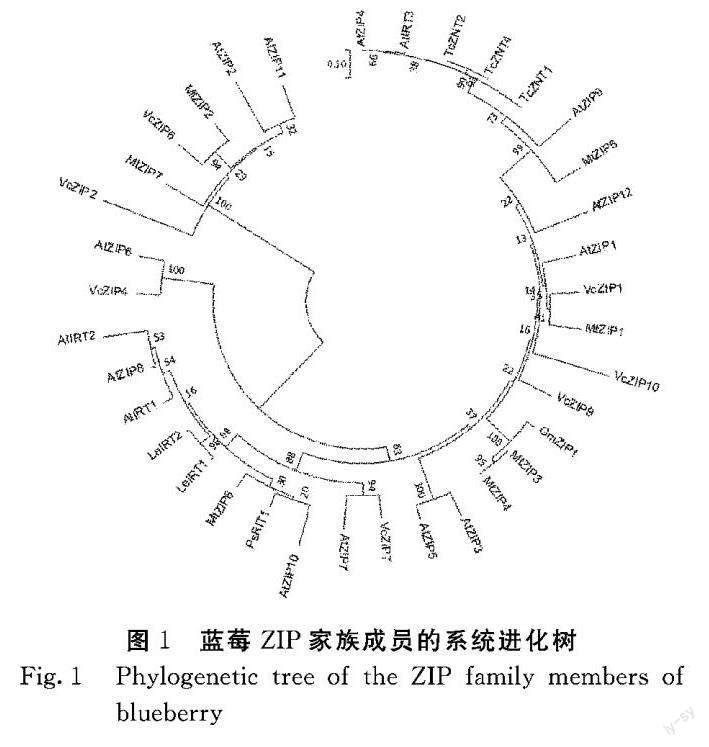
8个ZIP基因编码的多肽长约350(337~397)个氨基酸。两两对比显示,序列间存在较大差异,相似性低至19%(VcZIP2和VcZIP7),高达91%(VcZIP9和VcZIP11)。通过8个ZIP家族基因的转膜域预测结果对比筛选结果显示,VcZIP4、VcZIP7、VcZIP9具有ZIP家族的典型二级结构,包括8个转膜域、C末端的短肽且在Ⅲ与Ⅳ转膜域间存在一序列长度多变的富含组氨酸的链。为进一步确认VcZIP4、VcZIP7、VcZIP9具备潜在的金属转运功能,将上述3个基因与拟南芥中AtIRT1~AtIRT3这3个典型金属转运基因进行联配,分析结果显示基因结构类似。因此,本试验重点研究VcZIP4、VcZIP7和VcZIP9转运子的生物学功能。
将8个蓝莓ZIP家族基因序列和30个已知植物ZIP家族基因序列联配,并通过MEGA 6.0软件构建系统进化树(图1)。结果显示,根据分支长度与垂直距离,VcZIP4与AtZIP6基因的进化分歧时间短,蛋白质相似性为67%;VcZIP7和AtZIP7基因的亲缘关系较近,位于同一分支;VcZIP9基因同样位于VcZIP7和AtZIP7所在分支。
2.2 添加金属离子对蓝莓表观生长情况的影响
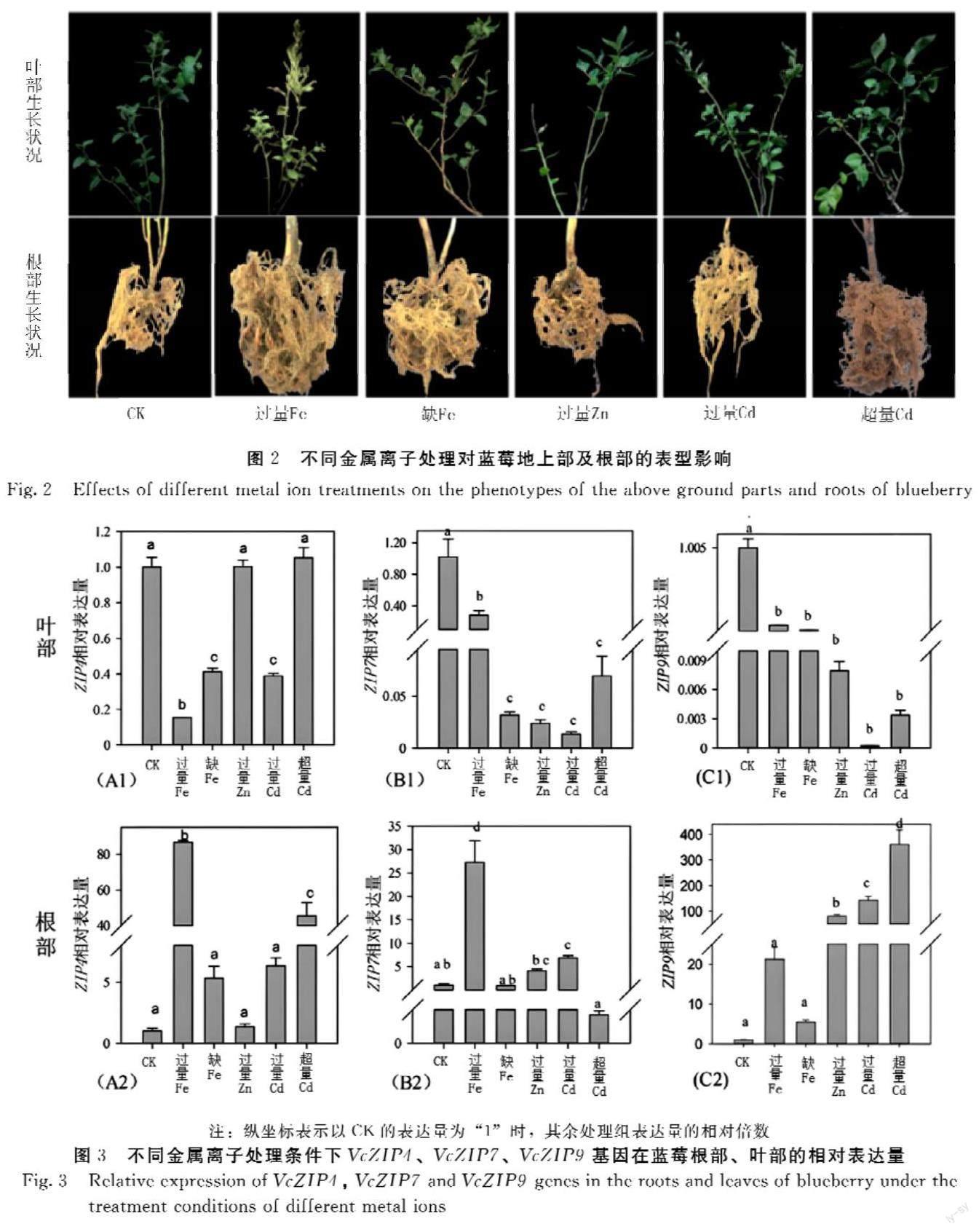
1年生蓝莓苗经过Fe、Zn、Cd金属水培处理30 d后,各处理组蓝莓的生长均表现出典型特征(图2)。对照处理(CK)生长环境中,蓝莓植株茎秆粗壮,叶片生长茂盛且呈深绿色,根系发达,根尖有明显伸长;过量Fe组植株矮小,蓝莓植株茎秆细长,叶片缘呈杯状卷起或卷皱,顶端叶片呈现锈色,根系生长异常,局部呈现棕褐色;缺Fe组枝顶端嫩叶出现典型缺铁症状,如脉间失绿黄化、叶片卷曲等,根系生长受到明显抑制,新根量低;过量Zn组蓝莓植株较为矮小,枝条稀疏,叶片脱落严重,少数叶片叶尖出现褐色,生长受到抑制;过量Cd组根尖呈黑褐色,嫩芽萎蔫,老叶叶缘呈褐色失绿;超量Cd组根系受损严重,脆弱易断,嫩叶严重萎蔫,叶色由绿色转褐色。
2.3 添加金属离子水培处理对蓝莓ZIP家族基因表达量的影响
利用分段克隆再拼接的方法成功分离得到蓝莓VcZIP4、VcZIP7、VcZIP9等3个转运子的全长cDNA,并在此基础上,采用定量PCR检测VcZIP4、VcZIP7、VcZIP9等3个基因的相对表达量。经过不同金属离子水培处理30 d后的蓝莓植株中,其VcZIP4、VcZIP7、VcZIP9基因的表达水平均表现出差异显著(图3)。在叶部,3个转运子的基因转录水平普遍受到抑制,相对于对照,降幅为58.8%~99.9%。根部的变化则更为复杂,其中缺Fe、过量Fe以及超量Cd处理条件下蓝莓根部的VcZIP4基因的表达显著上调,转录水平分别为对照的5.3、86.5和45.4倍;VcZIP7基因的表达量在过量Fe处理条件下上调明显,达到27.2倍,其余金属离子过量的表达量无显著变化(图3B1、B2);VcZIP9基因表达量在根际各金属离子过量条件下表达量均大幅上升(图3C1、C2),其中在过量Cd、超量Cd条件下分别达到对照的142.8倍和360.2倍。
2.4 转基因酵母金属耐性分析与异源表达研究
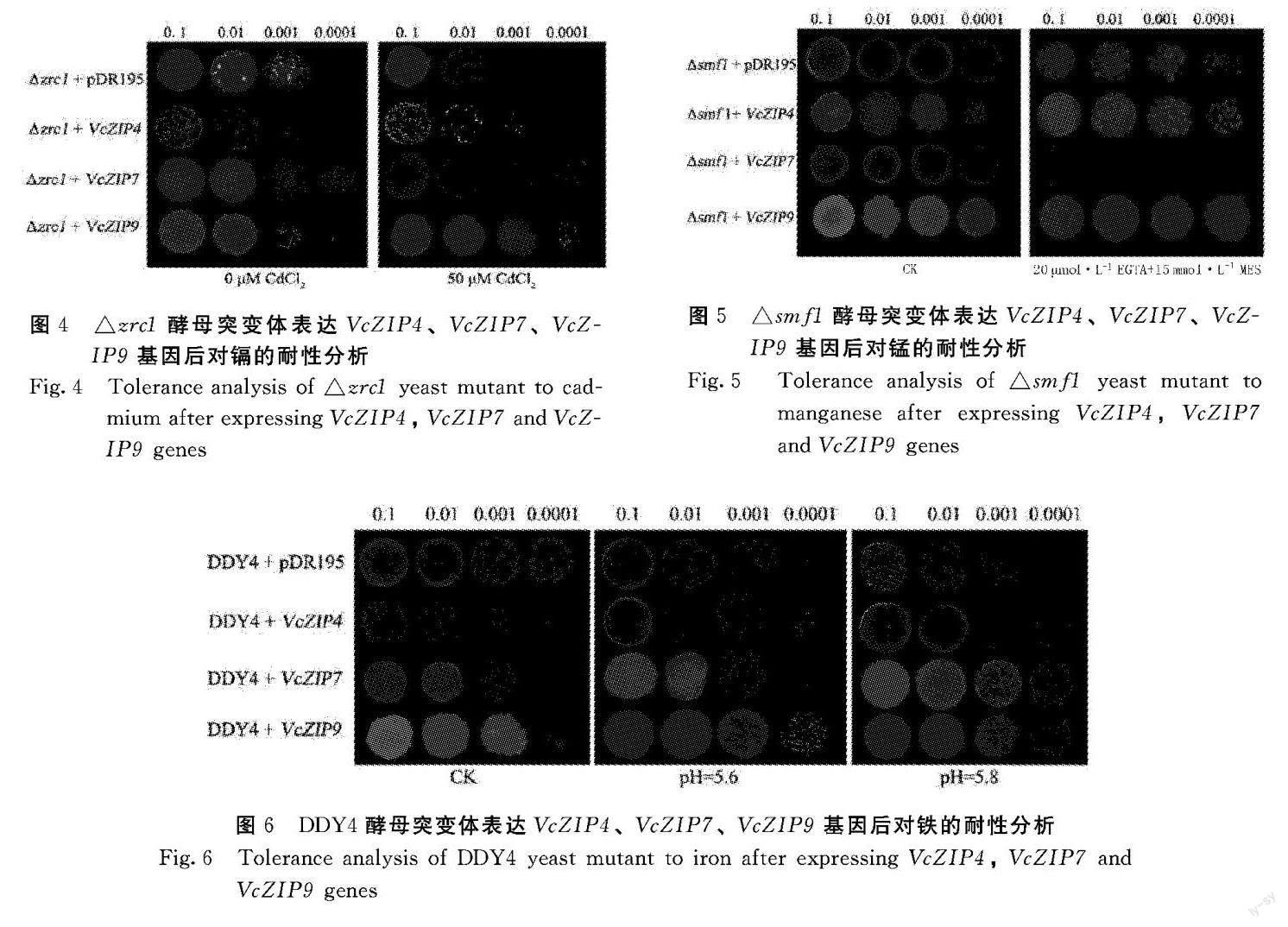
2.4.1 △zrc1异源表达VcZIP4、VcZIP7、VcZIP9后对镉的耐性 锌镉敏感型突变体△zrc1转化VcZIP4、VcZIP7、VcZIP9基因后,在富镉培养基上表现出不同长势,用于揭示ZIP转运子在酵母中对镉的转运能力。由图4可知,在添加50 μmol·L-1 CdCl2处理的培养基上,与表达空载体pDR195的酵母菌株相比,转化VcZIP4或VcZIP9提升了△zrc1突变体对镉的耐受性,说明转化了VcZIP4或VcZIP9基因的酵母可以互补这一抑制表型;而转化VcZIP7使得突变体对镉更加敏感,生长明显受到抑制,这说明VcZIP7的转化提高了△zrc1突变体对镉的敏感性,或在酵母中承担介导镉转运的功能。
2.4.2 △smf1异源表达VcZIP4、VcZIP7、VcZIP9后对锰的耐性 锰吸收缺陷型突变体△smf1转化VcZIP4、VcZIP7、VcZIP9基因后,在缺锰培养基上表现出不同长势,用于揭示ZIP转运子在酵母中转运铁的能力。由图5可知,在正常培養基上,表达空载体pDR195的酵母生长状况均良好;在添加20 μmol·L-1 EGTA和15 mmol·L-1 MES的缺锰培养基上,表达VcZIP4和VcZIP9的突变体依旧生长良好,而表达空载体pDR195或VcZIP7的突变体受到明显的生长抑制;说明VcZIP4、VcZIP9基因能够提高酵母对锰的吸收效率,或在酵母中承担介导锰吸收的功能。
2.4.3 DDY4异源表达VcZIP4、VcZIP7、VcZIP9后对铁的耐性 铁吸收缺陷型突变体DDY4转化VcZIP4、VcZIP7、VcZIP9基因后,在不同铁浓度培养基上表现出不同长势,用于揭示ZIP转运子在酵母中转运铁的能力。由图6可知,随着pH5.6升至pH 5.8,培养基中可溶性铁含量降低,表达空载体pDR195的酵母长势随之发生减弱。然而,表达VcZIP4、VcZIP9、VcZIP7基因的酵母长势良好,特别是转化VcZIP7或VcZIP9的酵母表现出了明显的生长优势,与正常Fe浓度的培养基相比,其生长几乎没有受到抑制。因此得出推断,VcZIP4、VcZIP7、VcZIP9基因在酵母中或承担介导铁吸收的功能。
3 讨论
蓝莓对土质要求极为严格,其Fe营养具有明显的低效性。同时,蓝莓强烈的嗜酸性使根际其他重金属被活化也极易导致蓝莓的生理性重金属中毒,这些因素严重影响蓝莓的产量和质量[18]。作为植物中最主要的金属离子转运子,ZIP家族基因主要参与了金属元素的跨膜运输过程[8,24]。生物信息学分析显示,蓝莓ZIP金属转运蛋白家族中至少含有8个家族成员,在所构建的ZIP基因系统进化树中,VcZIP4、VcZIP7、VcZIP9基因分别归属于3个不同的大类中,说明这3个基因在进化中距离较远,并不是相同基因的不同拷贝,或许在植物体内承担不同的功能[25]。也有学者认为,ZIP转运子在第Ⅲ与Ⅳ转膜域之间的这段富含组氨酸的链可能是ZIP基因结合金属离子的靶位,对ZIP基因转运底物的选择性具有决定作用[23]。因此,本研究重点对这3个基因进行克隆及生物学功能的研究。
定量PCR结果显示,VcZIP4、VcZIP7、VcZIP9基因对在不同的金属处理组表现出完全不同的表达模式,在此基础上推断,VcZIP4、VcZIP7、VcZIP9基因在蓝莓的生物学功能上可能存在一定的差异性[23]。VcZIP4、VcZIP7、VcZIP9基因在根部的响应均要强于叶部的响应,这可能是由于上述基因主要在根部承担离子吸收、转运的功能[9]。当根际Cd过量时,蓝莓根部的VcZIP4和VcZIP9基因的表达量上调,但二者并不具备Cd的转运功能,推测VcZIP4和VcZIP9基因的过量表达可能是为了提高胞内Fe等离子浓度以拮抗Cd毒害作用。在拟南芥[26]、水稻[27]中的研究同样揭示了ZIP转运子的过量表达对于环境Cd毒害胁迫具有缓解作用。过量Zn(50 μmol·L-1)处理时,VcZIP4在蓝莓叶及根部的表达水平未出现明显的变化,暗示该基因不参与锌的转运,与此类似,水稻的OsIRT1亦仅具有转运Fe而不具备Zn的转运功能[28-29]。缺铁条件下,VcZIP4和VcZIP9在根部的表达明显上调,且转基因酵母金属耐性分析试验显示二者均有转运Fe及Mn的功能,可见,VcZIP4和VcZIP9是根中的铁响应基因,介导铁在根中的转运。VcZIP7使缺陷型酵母在缺铁培养基中长势最好,表明其具有高效的Fe转运功能,但缺Fe处理条件下,VcZIP7的表达并未出现显著上调,这可能是蓝莓Fe营养低效的重要原因。
本研究在一定程度上揭示了蓝莓中ZIP转运子家族的功能,在此基础上,为进一步验证VcZIP4、VcZIP7、VcZIP9基因的功能,可进行拟南芥的遗传转化试验,探究不同金属浓度处理对拟南芥生长状况的影响,以更深层次地探讨上述基因的功能。
参考文献:
[1]PERSEN S,SVENSSON B,HAKANSSON T,et al.BlueberrySoil interactions from an organic perspective[J].Scientia Horticulturae,2016,208(29):78-91.
[2]ROUACHED H,RHEE S Y.Systemlevel understanding of plant mineral nutrition in the big data era[J].Current Opinion in Systems Biology,2017,4(2):71-77.
[3]ZAYNEB C,BASSEM K,ZEINEB K,et al.Physiological responses of fenugreek seedlings and plants treated with cadmium[J].Environmental Science & Pollution Research International,2015,22(14): 10679-10689.
[4]SARWAR N,IMRAN M,SHAHEEN M R,et al.Phytoremediation strategies for soils contaminated with heavy metals:modifications and future perspectives[J].Chemosphere,2016,171(3):710-721.
[5]SHAHID M,DUMAT C,KHALID S,et al.Foliar heavy uptake,toxicity and detoxification in plants:A comparison of foliar and root metal uptake[J].Journal of Hazardous Materials,2017,325(5):36-58.
[6]蒲琦,李素贞,李盼.植物锌铁转运蛋白ZIP基因家族的研究进展[J].生物技术通报,2012,28(10):15-19.
[7]MASER P,THOMINE S,SCHROEDER J I,et al.Phylogenetic relationships within cation transporter families of arabidopsis[J].Plant Physiology,2001,126(4):1646-1667.
[8]ISHIMARU Y,SUZUKI M,KOBAYASHI T,et al.OsZIP4,a novel zincregulated zinc transporter in rice[J].Journal of Experimental Botany,2005,56(4):3207-3214.
[9]TIONG J,MCDONALD GK,GENC Y,et al.HvZIP7 mediates zinc accumulation in barley (Hordeum vulgare) at moderately high zinc supply[J].New Phytologist,2014,201(1):131.
[10]LI S,ZHOU X,HUANG Y,et al.Identification and characterization of the zincregulated transporters, ironregulated transporterlike protein (ZIP) gene family in maize[J].BMC Plant Biology,2013,13(1):114.
[11]GUERINOT M L.The ZIP family of metal transporters[J].Biochimica et Biophysica Acta,2000,1465(2): 190-196.
[12]EIDE D,BRODERIUS M,FETT J,et al.A novel iron regulated metal transporter from plants identified by functional expression in yeast[J]. Proceedings of the National Academy of Sciences of the United States of America,1996,93(11):5624-5628.
[13]VERT G,GROTZ N,DEDALDECHAMP F,et a1.IRTl,an Arabidopsis transporter essential for iron uptake from the soil and for plant growth[J].Plant Cell,2002,14(6):1223-1233.
[14]HCARIQUES R,JASIK J,KLEIN M.Knockout of arabidopsis metal transporter gene IRT1 results in iron deficiency accompanied by cell differentiation defects[J].Plant Molecular Biology,2002,50(5):587-597.
[15]VAROTTO C,MAIWALD D,PESARESI P,et al.The metal ion transporter IRTl is necessary for iron homeostasis and efficient photosynthesis in arabidopsis thaliana[J].Plant Journal,2002,31(5):589-599.
[16]傅明輝,陈肖丽.植物锌铁转运蛋白ZIP家族的生物信息学分析[J].广东农业科学,2015,42(1): 124-127.
[17]于强波,苏丹,孟凡丽,等.蓝莓缺铁失绿症产生原因与防治技术[J].北方园艺,2011 (7):67-68.
[18]REBECCA L,DARNELL,NICACIO CRUZHUERTA.Uptake and assimilation of nitrate and iron in cultivated and wild Vaccinium Species[J]. International Journal of Fruit Science,2011,11(2):136-150.
[19]HALL J L.Cellular mechanisms for heavy metal detoxification and tolerance.Journal of Experimental Botany,2002,53(3):1-11.
[20]VASHISTH T,JOHNSON L K,MALLADI A.An efficient RNA isolation procedure and identification of reference genes for normalization of gene expression in blueberry[J].Plant Cell Reports,2011,30(12):2167-2176.
[21]余柯达,叶美娟,陈文荣,等.蓝莓组织RNA提取方法的研究[J]. 浙江师范大学学报:自然科学版, 2016(1):60-64.
[22]GIETZ R D,SCHIESTL R H.Highefficiency yeast transformation using the LiAc/SS carrier DNA/PEG method [J].Nature Protocols,2007,2(1):38-41.
[23]马晓晓.锌/镉超积累植物东南景天两个锌转运蛋白基因的功能研究[D].杭州:浙江大学,2015.
[24]LIN Y F,LIANG H M,YANG S Y,et al.Arabidopsis IRT3 is a zincregulated and plasma membrane localized zinc/iron transporter[J].New Phytologist,2009,182(2):392-404.
[25]高峻.超积累东南景天转录组学分析与ZIP家族基因功能研究[D].杭州:浙江大学,2013.
[26]VERT G,BARBERON M,ZELAZNY E,et al.Arabidopsis IRT2 cooperates with the highaffinity iron uptake system to maintain iron homeostasis in root epidermal cells[J].Planta,2009,229(6):1171-1179.
[27]LEE S,GYNHEUNG A N.Overexpression of OsIRT1 leads to increased iron and zinc accumulations in rice[J].Plant Cell & Environment,2009,32(4):408-416.
[28]BUGHIO N,YAMAGUCHI H,NISHIZAWA N K,et al.Cloning an ironregulated metal transporter from rice[J].Journal of Experimental Botany,2002,53(3):1677-1682.
[29]ISHIMARU Y,SUZUKI M,TSUKAMOTO T,et al.Rice plants take up iron as an Fe3+ phytosiderophore and as Fe2+[J].Plant Journal for Cell & Molecular Biology,2006,45(3):335-346.
(責任编辑:林玲娜)
