光学相干断层成像指导冠状动脉支架内再狭窄介入治疗进展
2023-06-14韩燕袁晓航高磊
韩燕 袁晓航 高磊
近年来,经皮冠状动脉介入治疗(p e r c u t a n e o u s coronary intervention,PCI)技术发展迅速,包括PCI辅助器械、支架设计、药物治疗等方面均取得了巨大进步,手术流程得到简化,并发症发生风险降低,手术成功率增加,越来越多的高危复杂病变可以接受PCI[1]。但是,冠状动脉支架内再狭窄(in-stent restenosis,ISR)事件和由此引发的再次靶血管血运重建的年发生率仍较高,临床实践中药物洗脱支架(drug-eluting stent,DES)所致ISR仍占接受PCI患者的5%~10%[2]。研究显示,与原位冠状动脉病变的PCI相比,ISR相关的主要不良心血管事件风险更高[3-4]。考虑到全球每年约有数百万的DES置入[5],ISR是一个具有重要意义的临床公共卫生问题。
鉴于ISR形成机制复杂,危险因素众多且预后不佳,大量随机对照试验致力于不同治疗手段对ISR患者的疗效评价[6],但均未强制将腔内影像作为常规手段用于指导ISR患者的介入治疗。腔内影像技术克服了传统血管造影的诊断局限性,在更准确地评估ISR狭窄程度的同时,还能够识别ISR潜在的病理生理发生机制,为定义和分类ISR提供丰富信息[7-8]。2018年欧洲血运重建指南[9]和欧洲冠状动脉腔内影像专家共识[10]均推荐腔内影像技术,包括光学相干断层成像(optical coherence tomography,OCT)与血管内超声(intravascular ultrasound,IVUS)作为指导ISR诊治的重要手段。尽管缺乏前瞻性随机对照研究证实腔内影像在指导ISR介入治疗方面的数据,近年来观察性研究初步证实OCT与IVUS能有效降低接受冠状动脉支架置入患者的心血管性死亡及不良事件[11]。
本文 旨在探讨OCT在识别ISR原因方面的潜在价值,介绍近年来OCT指导ISR介入治疗研究结果和相关治疗流程。
1 ISR 的流行病学特点
ISR被认为是现代PCI的“阿喀琉斯之踵”,其形成机制复杂,多种因素参与其中,包括生物因素、解剖因素及手术或支架因素等[12]。随着支架技术的更新迭代,DES在PCI中被广泛应用,ISR发生率由30%下降至5%~10%[13-15],然而由于行PCI的冠心病患者逐年增多以及手术复杂程度的增加,针对ISR的介入治疗仍是临床所面临的一大挑战。
目前DES已成为冠状动脉疾病患者行PCI的主流支架类型。越来越多的证据表明,DES-ISR与裸金属支架内再狭窄(bare metal stent-ISR,BMS-ISR)在发生时间、病变形态、病理生理学特点以及抗再狭窄疗效方面均存在差异[16-19]。DES-ISR患者中13%可表现为急性冠状动脉综合征的症状,多在DES置入后6~9个月后发病且发病风险逐渐增加直至术后2年。相较于BMS-ISR,DES-ISR预后更差,复发性ISR及不良心血管事件发生率更高[20-21]。在DES-ISR中,不同的病变形态间预后同样存在差异,与局灶性ISR相比,弥漫性ISR的复发率增加1.2倍,闭塞性ISR增加3.9倍,且弥漫性或闭塞性ISR再次发生ISR时往往同样表现为弥漫性或闭塞性的病变形态[20]。
2 OCT 对ISR 发生机制的认识
凭借极高的轴向分辨率及接近离体病理水平的解剖成像优势,OCT可为ISR潜在病因及形成机制提供更为可靠的证据(图1)[22]。对于ISR常见的机械因素而言,如支架膨胀不全、支架断裂、边缘夹层等,OCT的检出识别能力可与IVUS媲美,甚至优于IVUS[23-24]。2018年欧洲血运重建指南[9]及腔内影像专家共识[10]均建议,使用OCT进行冠状动脉内成像来阐明ISR的机制(Ⅱa类)。
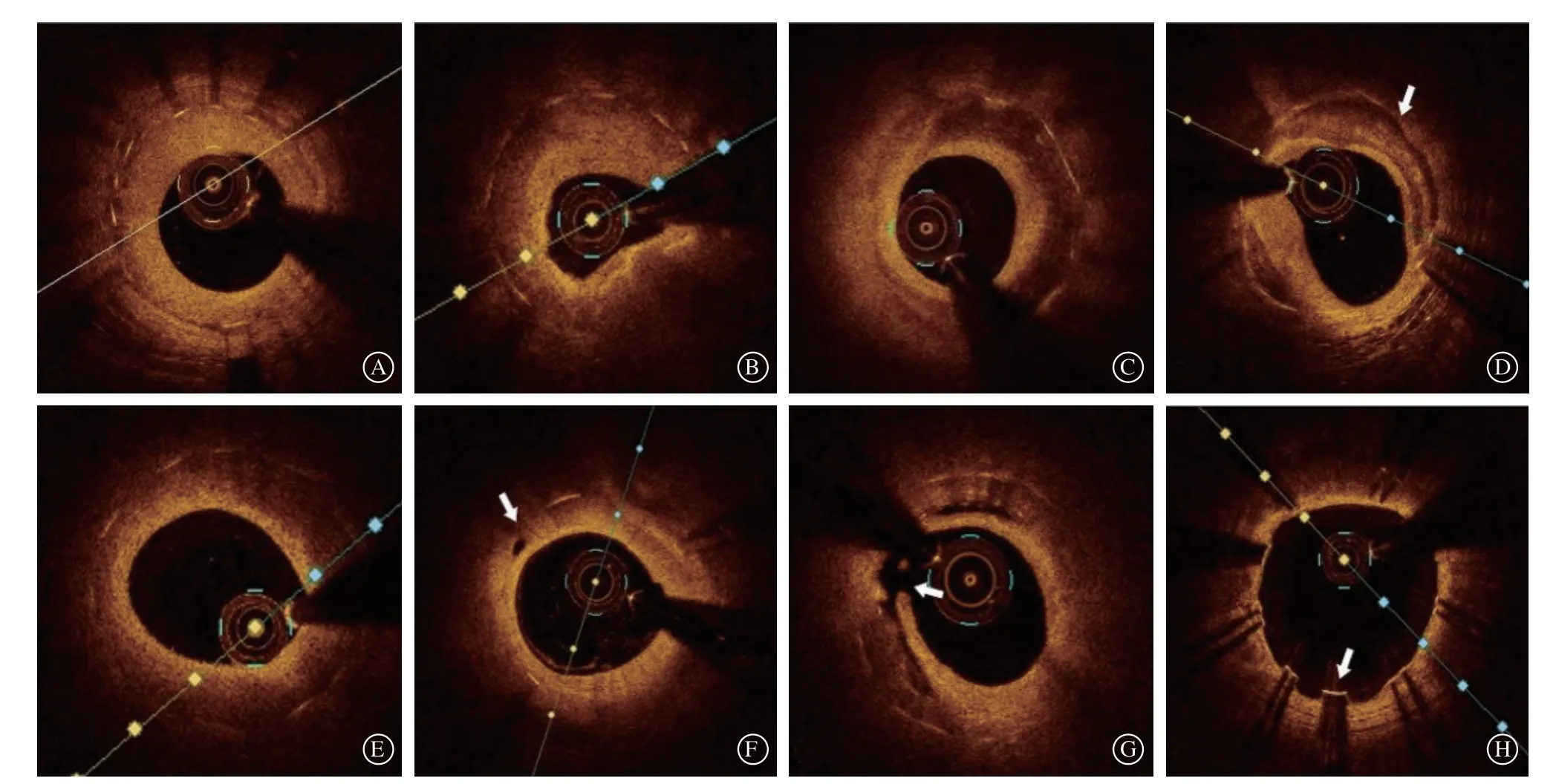
图1 不同类型ISR 的OCT 典型影像 A.均质型新生内膜;B.异质型新生内膜;C.分层型新生内膜;D.钙化性新生内膜(箭头所示);E.脂质性新生内膜;F.微通道(箭头所示);G.斑块破裂(箭头所示);H.支架贴壁不良(箭头所示)Figure 1 OCT typical images of in-stent restenosis with diff erent mechanisms
此外,OCT可更好地描述组织特征,描绘管腔新生内膜界面。2009年,Gonzalo等[25]根据ISR组织在OCT上的外观将其分为均质型、异质型和分层型三种类型,各分型分别反映了新生内膜的不同组织特性。BMS-ISR在OCT上普遍表现为均匀的高信号组织带,反映了新生内膜组织中富含平滑肌细胞。相反,DES-ISR在OCT上表现为衰减、分层、异质型组织,这可能代表富含蛋白多糖的新生内膜组织或新生动脉粥样硬化斑块。由于炎症、蛋白聚糖积累和水肿,支架小梁周围低信号区域与加速形成ISR有关[18]。鉴于在临床实践中部分病变无法对应到该分型的任何一种类型,Yamamoto等[26]于2020年对该分型进行了修正,根据ISR组织在OCT上的表现分为了六种类型。该分型能够有效区分脂质、钙化性病变,并可识别新生动脉粥样硬化,具有潜在的指导治疗及预后价值。
OCT有助于确定新生动脉粥样硬化,通常被定义为连续≥3帧图像上观察到包含脂质或钙化斑块的新生内膜增生,或存在脂质性新生内膜增生破裂。一项针对二代DES置入后新生动脉粥样硬化的回顾性观察研究[7]显示:新生动脉粥样硬化在二代DES置入后再狭窄患者中的患病率约为28.5%,且随着支架置入时间的延长而增加,支架置入后1~3年患病率为19%,3~5年为32%,5~7年为31%,7年之后高达75%[27]。新生动脉粥样硬化是DES-ISR和血栓形成的共同途径。在PRESTIGE(prevention of late stent thrombosis by a interdisciplinary global european effort)登记系统[28]中,231例血栓形成患者接受了OCT,新生动脉粥样硬化是极晚期(1年)患者中最常见的表现(33.3%)。Ali等[29]利用OCT和近红外光谱进一步确定了新生动脉粥样硬化的类型,包括薄帽型、厚帽型、支架周围型新生动脉粥样硬化及既往存在的纤维动脉粥样硬化。Kang等[30]对DES-ISR进行OCT分析显示,在50例极晚期DES-ISR(PCI术后20个月)患者中,52%的病变有至少1个部位含有薄帽纤维动脉粥样硬化,58%有至少1个部位的支架内新生内膜破裂,58%有血栓形成。
基于OCT的新生动脉粥样硬化评估对指导临床治疗及预后评估具有重要价值。Nakamura等[31]对比伴或不伴有新生动脉粥样硬化ISR的预后,发现支架内新生动脉粥样硬化的PCI术后3年预后更差[临床驱动靶病变血运重建(target lesion revascularization,TLR)率,41.7%比29.6%,P=0.024]。Chen等[27]基于OCT图像分析不同类型新生动脉粥样硬化的预后,认为脂质性新生动脉粥样硬化与更高的靶病变失败(心原性死亡、靶血管梗死、靶病变明确的支架内血栓形成或临床驱动的TLR)相关[风险比(hazard ratio,HR)2.05,95%CI1.36~3.09,P<0.001)]。而另外一项研究[32]则发现在ISR中,大量的钙化(厚度>0.5 mm,弧度>180°,既包含钙化性新生动脉粥样硬化又包含支架周围钙化)与支架膨胀不全相关,进而导致更差的临床结局。
3 新生内膜性质与ISR 介入治疗策略
得益于优越的轴向分辨率,OCT可根据不同的信号特点进一步识别ISR新生内膜性质,有证据表明其可间接反映ISR介入治疗后的血管壁反应。Tada等[33]通过对214处ISR病变进行OCT分析并比较接受普通球囊血管成形术(plain old balloon angioplasty,POBA)组及POBA联合药物涂层球囊(drug-coated balloon,DCB)组间的预后差异。发现随访6~8个月后,当新生内膜信号均匀或非富脂时,POBA联合DCB组相较于单纯POBA组ISR和TLR发生率均较低,而当新生内膜信号不均匀或分层时并未发现显著的组间差异。该研究团队进一步比较POBA组、DCB组与DES组3组间预后差异时同样得出了相似的结果,表现均匀的新生内膜病变中,POBA组的ISR和TLR发生率均显著高于DCB组和DES组,而在表现不均匀的新生内膜病变中则未发现上述差异[34]。另外两项基于OCT不同新生内膜表现评估ISR接受DCB治疗预后差异的研究提示,新生内膜均匀组较不均匀组接受DCB治疗的预后更好[35-36]。而一项旨在探讨ISR新生内膜不同性质对接受DCB或DES治疗的交互影响的研究结果同样支持上述发现,即新生内膜高异质性组接受DCB治疗较DES治疗的主要不良心血管事件(全因死亡、心肌梗死或临床驱动TLR)发生率更高,而低异质性组不同干预措施的预后相似[37]。上述研究均证实术前识别ISR不同新生内膜性质可指导优化介入治疗策略,其潜在原因或为DCB的作用机制主要是抑制平滑肌细胞增殖,而在均质型新生内膜中主要成分为平滑肌细胞,故DCB对均质型增殖新生内膜抑制作用更加显著;相反,异质型内膜组成分复杂(细胞外基质、蛋白多糖、巨噬细胞、机化血栓等),DCB效果不佳显而易见。
富含钙化成分的新生动脉粥样硬化或钙化结节是ISR治疗的一个难点,针对钙化病灶需要进行充分的斑块减容预处理(特殊球囊、旋磨、准分子激光、震波球囊等)以达到最佳的介入治疗条件。OCT可实现钙化病变的准确识别与评估,对指导介入治疗、降低手术并发症发生率、改善患者预后具有重要意义。在OCT图像上,钙化斑块具有低背反射和低衰减的特性,通常表现为边缘锐利的低信号或不均匀信号区域。相较于IVUS,OCT空间分辨率更高,更易于检出钙化病变及评估严重程度(范围及厚度),其诊断钙化病变的敏感度及特异度分别可达96%、97%[38]。需要强调的是,钙化斑块较厚时(超过1.6 mm),受限于较弱的斑块穿透能力,OCT可能观测不到钙化斑块后缘轮廓。
4 OCT 指导ISR 的介入治疗流程
欧洲目前指南将DES或DCB治疗ISR作为Ⅰ类推荐[9]。最新的美国冠状动脉血运重建指南[39]中,推荐重复DES置入作为ISR介入治疗的首选方法(ⅠA)。然而,对于特定的ISR病变需要采取更多的预处理措施以优化治疗方案:支架膨胀不全需要使用高压球囊进行预扩张;顽固性支架膨胀不全需要超高压球囊、血管内碎石、准分子激光或斑块旋磨术进行干预;而对于多层(>2层)支架置入后的ISR推荐行冠状动脉旁路移植术;如进行PCI则应避免DES再次置入,可考虑采用DCB和高压切割或积分球囊以及血管内近距离放射治疗的联合处理措施来减少反复ISR的风险[12]。腔内影像技术,尤其是OCT凭借其极高的轴向分辨率可通过定性及定量参数辅助指导术者准确评估ISR发生机制并进行针对性预处理。
O C T引导下介入治疗流程国内外尚未形成共识。Waksman分型是目前被临床广泛接受,也是目前唯一专门基于OCT提出的对ISR治疗具有指导意义的一种分型[40]。该分型根据不同的病因及病变性质,将ISR分为了5种类型,包括,Ⅰ型:机械因素导致的ISR(A.支架膨胀不全;B.支架断裂);Ⅱ型:生物因素导致的ISR(A.新生内膜增生;B.新生动脉粥样硬化,不伴钙化;C.新生动脉粥样硬化伴钙化);Ⅲ型混合因素(机械及生物因素)导致的ISR、Ⅳ型慢性阻塞性ISR;Ⅴ型多层支架置入型ISR。针对不同分型,作者提供了针对性的干预策略,对于OCT指导ISR介入治疗具有显著的指导意义。
除专门基于OCT提出的Waksman分型外,既往研究借助腔内影像技术(血管造影、IVUS及OCT)已提出了数种不同版本的ISR治疗流程,在指导ISR治疗方面各有特点。Dorset心脏中心提出的基于腔内影像技术的ISR治疗流程,分别针对新生内膜增生/新生动脉粥样硬化、支架膨胀不全、支架尺寸过小及边缘病变提供了具体的预处理及介入治疗技术[41]。与之相似的是2020年欧洲经皮心血管介入协会提出的流程,其进一步阐明了重复DES置入与DCB治疗的适应证[42]。Erdogan等[23]于2022年提出的ISR治疗流程中,首次针对不同新生内膜性质病变给予了治疗策略推荐,而Giustino等[12]则提出了更为详细的ISR治疗流程,将其新生内膜增生/新生动脉粥样硬化ISR进一步细分为单层支架、双层支架以及局灶性或边缘性ISR、慢性阻塞性或弥漫性ISR。此外,该流程还指出对于解剖结构复杂(左主干、左前降支近段、多血管病变)且手术条件良好的患者建议考虑冠状动脉旁路移植术治疗。
无论是基于腔内影像技术,还是基于OCT提出的ISR治疗流程,尽管针对不同类型的病变提供了治疗策略推荐,但是在临床实际工作中如何按步骤进行病变的预处理、介入治疗及术后评估,上述流程并未提供路线清晰、易于实操的流程图。近期,本团队初步探究出一套分步骤进行OCT指导ISR治疗的标准化流程,初步结果已证实该方法安全有效[43]。该流程可归纳为3个主要步骤,具体步骤如下(图2):(1)制定预处理措施。根据首次OCT所示ISR病变性质选择合适的预处理措施(机械性原因:使用高压球囊扩张、准分子激光切除或旋磨术等;生物性原因:使用顺应性或非顺应性球囊),必要时需要反复处理(棘突球囊或切割球囊等),处理结束后评估预处理效果。(2)制定具体的治疗策略。根据预处理后OCT所示的管腔残余狭窄情况决定使用DES或DCB进行治疗。当出现血管壁无夹层,或者仅有A型、B型夹层,心肌梗死溶栓治疗试验血流分级Ⅲ级,残余狭窄≤30%时使用DCB,否则使用DES。治疗结束后再次进行OCT检查。(3)评估术后情况,根据治疗后OCT结果来决定是否进一步优化处理。当有以下指标时则无需进一步优化处理:①最小管腔面积≥80%的参考血管管腔面积;②DES贴壁完全;③支架膨胀良好:最小支架面积/参考管腔面积≥0.8;④无血栓、内膜脱垂和影响血流的夹层。如果有不良并发症发生则在进一步治疗后再次行OCT评估。经过上述3步处理后,可最大程度保证ISR手术的精确与完善。该“三步法”治疗流程是国内首次提出的基于OCT指导ISR治疗的标准化流程,但其是否适用于我国国情及临床实际,需要更多临床数据支持。

图2 OCT“三步法”优化指导ISR 介入治疗 流程Figure 2 The algorithm of the three-step strategy of OCT-guided ISR intervention
5 未来展望
综上所述,OCT对ISR形成机制及病变性质的评估具有较大优势,对指导ISR介入治疗、提高手术成功率、减少手术相关并发症、改善患者预后具有显著作用。基于OCT的新生内膜性质对治疗策略及预后的影响仍有待进一步探索。本团队提出的基于OCT指导ISR介入治疗流程需要更大样本、更长随访时间的前瞻性研究予以验证优化。未来期待专门设计的比较OCT指导与单纯造影指导ISR介入治疗的前瞻性随机对照研究结果。
利益冲突 所有作者均声明不存在利益冲突
