异甘草酸镁对山羊心肌缺血再灌注损伤的保护作用及机制研究
2023-06-14王铎刘晓林赵冀山李晓琼王义华甘甜李猛
王铎 刘晓林 赵冀山 李晓琼 王义华 甘甜 李猛
急性心肌梗死(acute myocardial infarction,AMI)是一种十分常见的心血管疾病,在全球范围内发病率和死亡率总体呈上升态势。而最及时有效的治疗措施是改善心肌缺血,限制心肌梗死面积。临床上常通过血管成形术或溶栓治疗迅速恢复心肌血液供应[1]。然而,这种突然的再灌注会导致继发性级联损伤,称为心肌缺血再灌注损伤(myocardial ischemia reperfusion injury,MIRI),这会恶化缺血性损伤并进一步扩大梗死面积[2]。研究显示,MIRI可能引发多种病理变化,包括局部急性炎症反应、代谢紊乱和细胞凋亡和(或)坏死,最终导致心脏功能障碍[3]。MIRI的发病机制复杂,涉及多个分子过程,如活性氧(reactive oxygen species,ROS)积累[4]、钙离子超载[5]、炎性细胞因子流入[6]以及细胞线粒体通透性转换孔(m i t oc h o n d r ia l permeability transition pore,mPTP)开放[7]。其中冠状动脉微血管功能障碍(coronary microvascular dysfunction,CMD)又是MIRI中亟待解决的关键环节[8-10]。甘草酸(glycyrrhizic acid,GA)是从甘草植物的根茎部分离提纯出来的三萜类化合物,具有广泛的药理活性和生物活性[11]。在各种疾病模型中,GA均显示出抗氧化应激和抗炎反应的巨大潜力。既往研究发现GA预处理可逆转异丙肾上腺素对组织氧化应激的诱导作用,对心肌缺血具有保护作用[12]。此外,GA已被证明通过抑制高迁移率族蛋白B1介导的Toll样受体-4/核因子κB(Toll-like receptor 4,TLR4/nuclear factor kappa B,NF-κB)通路来保护脑的再灌注损伤[13]。目前对于GA改善MIRI的作用及其机制研究有限,特别是对CMD相关的MIRI研究更为有限。本研究选用GA的衍生物制剂——异甘草酸镁作为研究对象,旨在对GA在MIRI中的作用进行研究,并阐明可能的相关机制,验证GA对山羊MIRI的保护作用。
1 材料与方法
1.1 研究对象
1.1.1 实验动物 雄性萨能奶山羊16只,5~8月龄,体质量18.8~31.4 kg[西安臻品生物科技有限公司,动物许可证号:SCXK(陕)2020-003]。
1.1.2 实验试剂 本研究中所使用的化学试剂和生化试剂均为分析级和最高纯度。异甘草酸镁注射液(批号:H20051942,江苏南京正大天晴药业)、B细胞淋巴因子2(B-cell lymphoma-2,Bcl-2)检测试剂(批号:C20210814D)、Bcl-2相关X蛋白(Bll-2 associated X protem,Bax)检测试剂(批号:C20210814D)、半胱氨酸蛋白酶3(Casepase-3)检测试剂(批号:C20210814D)、超氧化物歧化酶(superonide dismutase,SOD)检测试剂(批号:C20210814D)、丙二醛(malondialdehyde,MDA)检测试剂(批号:C20210814D)、谷胱甘肽(glutathione,GSH)检测试剂(批号:C20210814D)、白细胞介素-10(interleukin-10,IL-10)检测试剂(批号:C20210814D)、白细胞介素-6(interleukin-6,IL-6)检测试剂(批号:C20210814D)均由武汉纯度生物科技有限公司提供。
1.2 实验方法
1.2.1 实验动物分组、准备及麻醉 将16只山羊随机分为4组(采用Excel软件随机生成相应的数字),分别为对照组、栓塞组、异甘草酸镁低剂量组、异甘草酸镁高剂量组,每组4只。异甘草酸镁组采用灌胃的方法,分别给予4 mg/kg(低剂量组)、10 mg/kg(高剂量组)异甘草酸镁、每日1次,对照组及栓塞组予以等量0.9%生理盐水,连续灌胃7 d。山羊术前禁食24 h、禁水8 h,备皮(耳朵/胸前区/四肢)后沿耳缘静脉穿刺静脉留置针,连接三通管。诱导麻醉:丙泊酚2.5~3.5 mg/kg;维持麻醉:丙泊酚22~30 mg/kg,并根据麻醉深浅程度及手术需要追加。术中注意观察山羊呼吸情况,记录12导联心电图并行心电监护。
1.2.2 动物模型制备 诱导麻醉后捆绑四肢,取左侧卧位固定于手术台。常规消毒铺巾后采用Seldinger’s法于右侧股动脉穿刺,穿刺成功后注入肝素100 U/kg,再置入Medtronic-6 F动脉鞘管,在透视下将6 F EBU 3.0指引导管送达山羊左冠状动脉开口行冠状动脉造影。对照组只做冠状动脉左回旋支(left circumflex branch,LCX)造影,其余3组即MIRI微循环障碍模型组参照文献[14]构建,沿指引导管送入BMW导引导丝,并送达LCX血管远段,选择与血管直径相匹配的球囊顺导引导丝进入LCX近中1/3处,扩张封堵30 min后,抽取2 ml充分混匀的混合液(20 μm微球原液1 ml,微球计数约5.8×106个,非离子对比剂碘海醇9 ml),借助于1.9 F微导管在LCX远段缓慢分批释放,再抽取适量生理盐水缓慢注入。术中出现心律失常时对症处理。术毕按压股动脉30 min后逐步麻醉苏醒。
1.2.3 体表心电图的变化 在整个实验中,所有动物模型均记录球囊闭塞前、闭塞30 min时及缺血再灌注2 h心电图。心电图ST段弓背向上抬高(2个或2个以上相邻的导联出现ST段抬高),胸前导联≥0.2 mV,肢体导联≥0.1 mV则提示心肌梗死,ST段回落≤30%判断为心肌微循环出现灌注障碍,表明造模成功。
1.2.4 生化指标检测 术后72 h清晨抽取静脉血,以3000 r/min离心后,留取血清待测。氧化应激指标检测:采用黄嘌呤氧化酶法检测SOD活性,采用硫代巴比妥酸法测定MDA水平,采用比色法测定GSH活性。炎症反应相关指标检测:采用双抗体夹心酶联免疫吸附试验(ELISA)测定IL-10、IL-6,严格按照ELISA试剂盒说明书操作,使用酶标仪(HBS-1096C,南京德铁实验设备有限公司生产)在450 nm处测定吸光度(optical density,OD)值。使用试剂标准物的浓度与 OD值计算出标准曲线的直线回归方程,将标本的OD值代入回归方程,计算出标本样品浓度,之后乘以稀释倍数,得出标本的实际浓度。凋亡相关指标检测:Bax、Bcl-2、Casepase-3同样采用ELISA方法测定。上述检测过程均严格按照试剂盒的说明书执行。
1.2.5 病理学检查 采用空气栓塞法于造模1周后处死实验动物,由病理科医师迅速取出心脏,冰冻后从心尖到心底部,沿垂直于心室长轴的方向,切为20 mm薄片,依据2,3,5-氯化三苯基四氮唑(2,3,5-triphenyl-2H-tetrazolium chloride,TTC)染色(存活心肌染色为砖红色,梗死心肌不能染成红色)结果判断心肌各节段情况。LCX供血区域各节段心肌以4%多聚甲醛溶液浸泡固定12 h,常规石蜡包埋,间断均匀切片(2 μm)。行苏木素-伊红(hematoxylin and eosin,HE)染色,光镜下观察心肌组织的病理学变化。
1.3 统计学分析
运用SPSS 22.0(SPSS Inc.,Chicago,USA)软件进行统计分析。计量资料采用(±s)进行统计描述,正态性检验采用单样本K-S拟合优度法。服从正态分布的多组均数间比较采用方差分析,两两比较采用Bonferroni法。以P<0.05为差异有统计学意义。
2 结果
2.1 实验动物一般情况
16只山羊均分在4组,体质量分别为对照组(24.71±1.28)kg,栓塞组(26.41±0.74)kg,低剂量组(25.70±1.32)kg,高剂量组(25.93±1.38)kg,组间差异无统计学意义(F=2.485,P=0.111)。
2.2 体表心电图变化及冠状动脉造影图像
山羊体表心电图的演变规律符合临床AMI及缺血再灌注过程:急性缺血后T波高尖,胸前区导联快速出现ST段弓背向上抬高,渐与高大的T波融合,R波逐渐降低,再灌注后ST段回落≤30%,提示心肌微循环出现灌注障碍(图1~3);山羊选择性冠状动脉LCX造影,球囊封堵30 min后,经微导管注入微球(图4~6)。
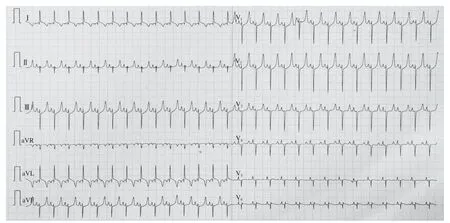
图1 术前心电图Figure 1 Preoperative electrocardiogram
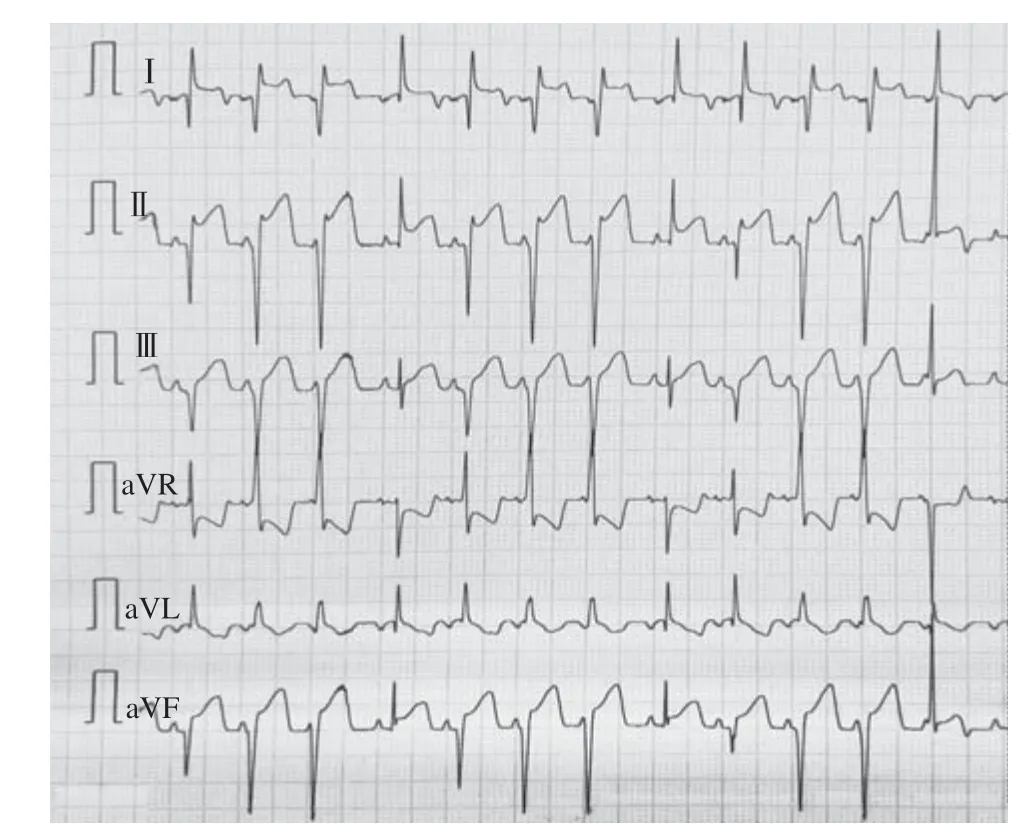
图2 球囊封堵30 min 心电图Figure 2 30 minutes electrocardiogram after balloon occlusion
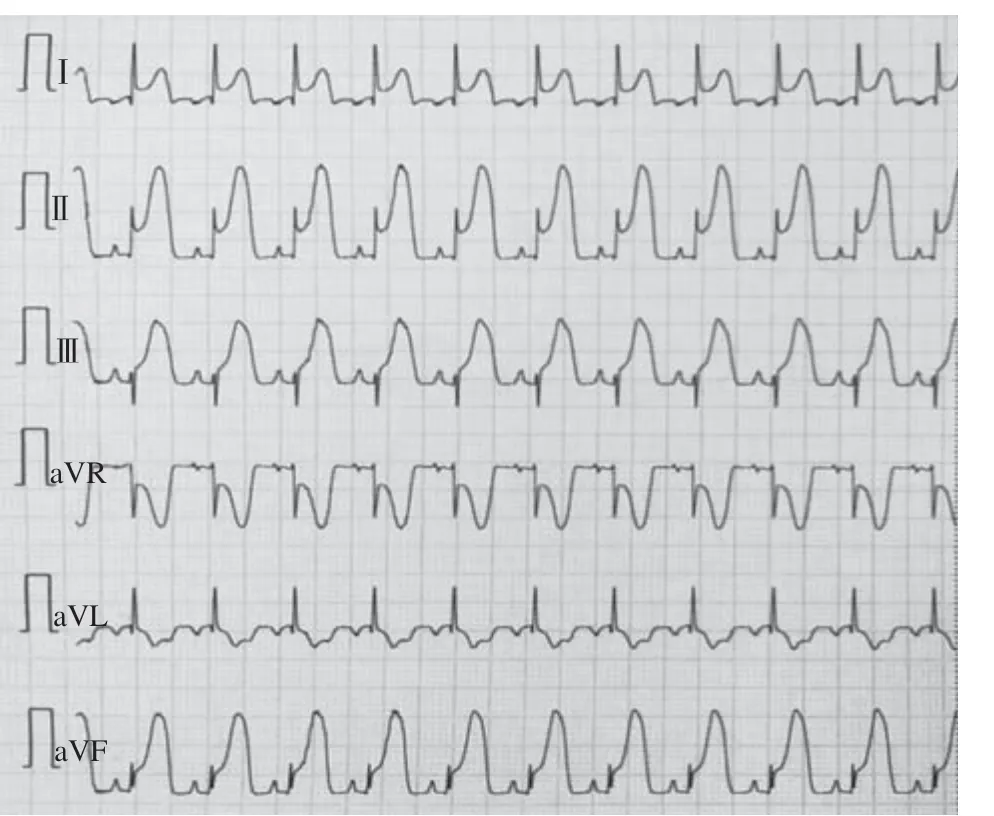
图3 再灌注心电图Figure 3 Reperfusion electrocardiogram
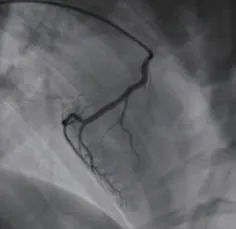
图4 左回旋支造影Figure 4 Left circumf lex branch angiography
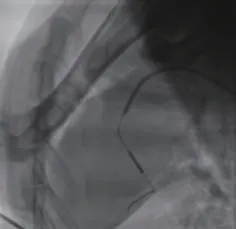
图5 球囊封堵Figure 5 Balloon closure
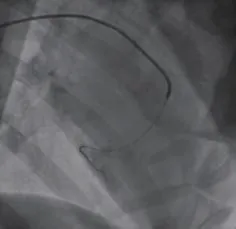
图6 微球栓塞Figure 6 Microsphere Embolization
2.3 异甘草酸镁对MIRI山羊心肌细胞氧化应激反应的影响
在栓塞组中,GSH浓度显著降低,SO D的活性显著降低,MDA浓度升高,在异甘草酸镁预处理治疗组中则有效降低了山羊血清中MDA的含量,显著增强了SOD的活性,升高了GSH浓度,并且呈剂量依赖(表1)。
表1 异甘草酸镁对心肌缺血再灌注损伤山羊的外周静脉血清中SOD、MDA、GSH 氧化应激的影响(±s)Table 1 Eff ects of magnesium isoglycyrrhizinate on oxidative stress of SOD,MDA and GSH in peripheral venous serum of goats with myocardial ischemia-reperfusion injury (±s)

表1 异甘草酸镁对心肌缺血再灌注损伤山羊的外周静脉血清中SOD、MDA、GSH 氧化应激的影响(±s)Table 1 Eff ects of magnesium isoglycyrrhizinate on oxidative stress of SOD,MDA and GSH in peripheral venous serum of goats with myocardial ischemia-reperfusion injury (±s)
注:a,与对照组比较,P <0.05;b,与栓塞组比较,P <0.05;c,与低剂量组比较,P <0.05;SOD,超氧化物歧化酶;MDA,丙二醛;GSH,谷胱甘肽。
指标 对照组(4 只)栓塞组(4 只)异甘草酸镁 F 值 P 值低剂量组(4 只)高剂量组(4 只)SOD(U/ml)148.58±1.67 107.57±4.28a 123.05±5.21ab 134.78±4.24abc 171.927 <0.001 MDA(nmol/ml)1.83±0.99 4.29±0.06a 3.26±0.19ab 2.11±0.11abc 347.557 <0.001 GSH(μmol/ml)0.43±0.01 0.12±0.01a 0.23±0.02ab 0.33±0.02abc 354.298 <0.001
2.4 异甘草酸镁对MIRI山羊心肌细胞炎症介质的影响
炎症反应也是再灌注损伤中导致心肌细胞损伤和坏死的重要机制。检测结果表明,与栓塞组相比,异甘草酸镁预处理治疗可以使IL-6水平显著降低,而IL-10水平显著升高,且存在剂量依赖(表2)。
表2 异甘草酸镁对心肌缺血再灌注损伤山羊心肌细胞炎症因子浓度的影响(pg/ml,±s)Table 2 Eff ect of magnesium isoglycyrrhetinic acid on the concentration of inf lammatory factors in goat myocardial cells after myocardial ischemia-reperfusion injury(pg/ml,±s)

表2 异甘草酸镁对心肌缺血再灌注损伤山羊心肌细胞炎症因子浓度的影响(pg/ml,±s)Table 2 Eff ect of magnesium isoglycyrrhetinic acid on the concentration of inf lammatory factors in goat myocardial cells after myocardial ischemia-reperfusion injury(pg/ml,±s)
注:a,与对照组比较,P <0.05;b,与栓塞组比较,P <0.05;c,与低剂量组比较,P <0.05;IL-6,白细胞介素6;IL-10,白细胞介素10。
指标 对照组(4 只)栓塞组(4 只)异甘草酸镁 F 值 P 值低剂量组(4 只)高剂量组(4 只)IL-6 68.21±3.19 152.93±5.45a 115.08±4.35ab 74.94±3.50abc 398.776 <0.001 IL-10 60.54±1.99 22.63±2.22a 34.35±1.78ab 42.97±1.99abc 254.902 <0.001
2.5 异甘草酸镁对MIRI山羊心肌细胞Casepase-3、Bcl-2、Bax的影响
与栓塞组相比,异甘草酸镁的预处理治疗显著降低了山羊外周血清中Casepase-3、Bax的水平,升高了Bcl-2水平,并呈剂量依赖(表3)。
表3 异甘草酸镁对心肌缺血再灌注损伤山羊心肌细胞 Casepase-3、Bcl-2、Bax 的影响(±s)Table 3 Eff ects of magnesium isoglycyrrhetinic acid on Casepase-3,Bcl-2,and Bax in goat myocardial cells after myocardial ischemia-reperfusion injury(±s)
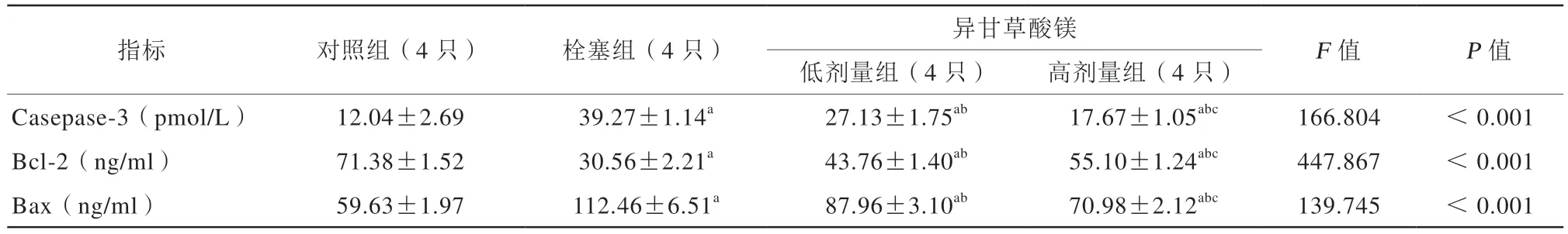
表3 异甘草酸镁对心肌缺血再灌注损伤山羊心肌细胞 Casepase-3、Bcl-2、Bax 的影响(±s)Table 3 Eff ects of magnesium isoglycyrrhetinic acid on Casepase-3,Bcl-2,and Bax in goat myocardial cells after myocardial ischemia-reperfusion injury(±s)
注:a,与对照组比较,P <0.05;b,与栓塞组比较,P <0.05;c,与低剂量组比较,P <0.05;Casepase-3,半胱氨酸蛋白酶3;Bcl-2,B细胞淋巴因子2;Bax,Bcl-2 相关X 蛋白。
指标 对照组(4 只)栓塞组(4 只)异甘草酸镁 F 值 P 值低剂量组(4 只)高剂量组(4 只)Casepase-3(pmol/L)12.04±2.69 39.27±1.14a 27.13±1.75ab 17.67±1.05abc 166.804 < 0.001 Bcl-2(ng/ml)71.38±1.52 30.56±2.21a 43.76±1.40ab 55.10±1.24abc 447.867 < 0.001 Bax(ng/ml)59.63±1.97 112.46±6.51a 87.96±3.10ab 70.98±2.12abc 139.745 < 0.001
2.6 心肌梗死面积TTC染色
TTC染色图中苍白色点片状为缺血坏死区域,正常区域为砖红色。心肌坏死区域评价结果显示,对照组中未发现有心肌梗死表现,栓塞组、低剂量组、高剂量组均可见心肌组织坏死明显。而在异甘草酸镁预处理后的山羊接受MIRI手术后,其心肌梗死面积比栓塞组的心肌梗死面积小,高剂量组的心肌梗死面积也小于低剂量组。将各组的心肌组织用数码相机摄取成为图片后用IPP病理图片处理软件进行分析,得出相应的数据结果:对照组、栓塞组、低剂量组、高剂量组梗死面积比值,组间比较[(0.00±0.00)比(55.19±2.93)比(38.34±1.29)比(22.77±2.26),P<0.01],差异有统计学意义;低剂量组、高剂量组与栓塞组比较,梗死面积减少(P<0.01);高剂量组梗死面积显著小于低剂量组(P<0.01),提示异甘草酸镁可以降低MIRI山羊的心肌梗死面积,且呈剂量依赖(图7~10)。
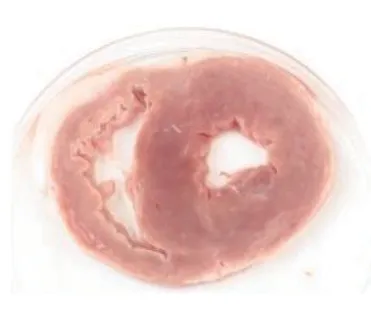
图7 无梗死心肌Figure 7 Infarction free myocardium
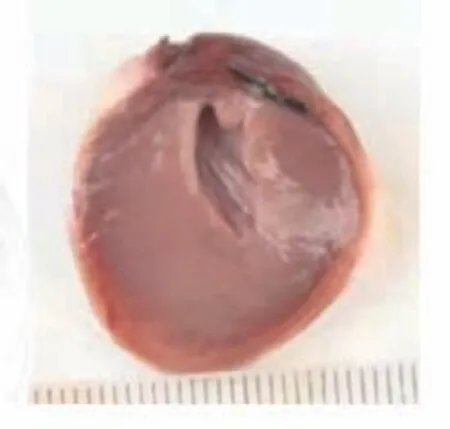
图8 栓塞组梗死心肌Figure 8 Embolization group with infarcted myocardium
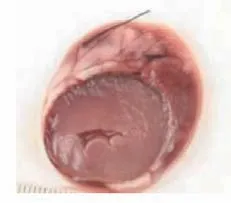
图9 低剂量组梗死心肌Figure 9 Low dose group with infarcted myocardium
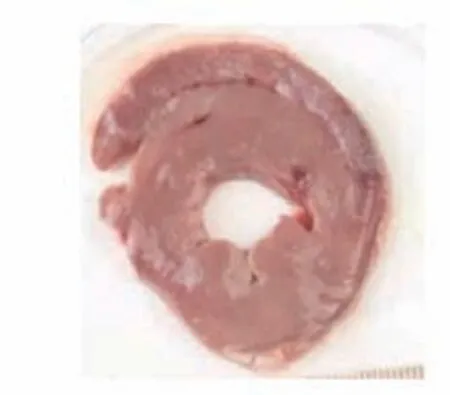
图10 高剂量组梗死心肌Figure 10 High dose group with infarcted myocardium
2.7 HE染色
观察各组术后1周心肌组织的镜下形态学表现,图11是正常心肌组织。在栓塞组可以看到组织坏死、中性粒细胞浸润、间隙性水肿和血管改变等表现(图12),而在经过异甘草酸镁处理的心肌细胞中,这种病理性改变明显减轻。其中,高剂量组病理改变明显较低剂量组轻,细胞排列相对规则,组织坏死少,炎症细胞浸润范围小,成纤维细胞增生少,对比分析可知异甘草酸镁的保护作用呈剂量依赖(图13~14)。
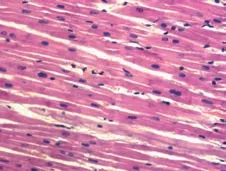
图11 正常心肌组织(HE×100)Figure 11 Normal myocardial tissue(HE×100)
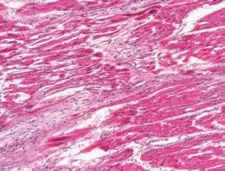
图12 栓塞组心肌组织(HE×100)Figure 12 Myocardial tissue in the embolization group(HE×100)
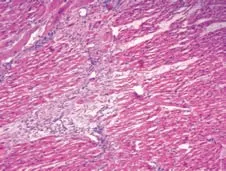
图13 低剂量组心肌组织(HE×100)Figure 13 Low dose group myocardial tissue(HE×100)
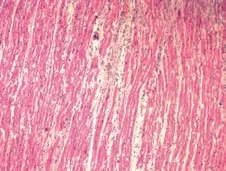
图14 高剂量组心肌组织(HE×100)Figure 14 High dose group myocardial tissue(HE×100)
3 讨论
随着我国人民生活方式的改变及人口老龄化的进展,心血管疾病逐渐成为威胁我国人民群众身体健康的主要公共卫生问题。这其中以心肌梗死最为凶险,致死、致残率较高。在急性期及早开通闭塞的冠状动脉血管,及时恢复血流是目前公认的有效降低AMI致死、致残的积极方法。多数情况下,缺血后再灌注可使心肌功能得到恢复,损伤的结构得到修复,但有时缺血后再灌注反而进一步导致心肌细胞的损伤和死亡,加重心脏功能障碍和心肌结构损伤,即MIRI,也是AMI早期开通血管过程中不可避免的问题。因此,如何降低MIRI是目前心血管疾病的研究热点之一。
经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)可以提高AMI的生存率,但仍有30%以上的患者会出现CMD和心力衰竭,冠状动脉树由作为容量血管的心外膜动脉和作为阻力血管并调节冠状动脉血流和营养代谢的微循环(包括前微动脉、微动脉、毛细血管和微静脉,直径<500 μm)组成[15],所以AMI患者行PCI后即使心外膜动脉通畅,冠状动脉微循环障碍仍会导致心肌灌注无法完全恢复,越来越多的研究认识到CMD在PCI术后心肌缺血和心绞痛中的核心致病作用,且与负性预后显著相关。因此,建立模拟临床上心肌缺血再灌注治疗中CMD的动物模型就显得很有必要,同时也是研究CMD类疾病发展转归及评价药物治疗作用必不可少的工具。
CMD发病机制涉及血管内皮损伤、血管平滑肌功能异常、机械性压迫、冠状动脉微栓塞以及MIRI等[15]。目前国内外MIRI模型常采用开胸后选择性冠状动脉结扎的方法,以造成左心室缺血或梗死[16],无法完全模拟出临床上AMI后血运重建过程中的病理生理学过程,如冠状动脉微血管阻塞等改变。相比之下,在大多数动物模型中健康的冠状动脉被进行闭塞和再灌注,而冠状动脉微栓塞的问题在很大程度上被忽视了。早期再灌注期间的冠状动脉微栓塞不仅会导致MIRI,而且也是损伤心脏自身保护性改变对心肌潜在抢救的混杂因素。
冠状动脉微循环模型多采用直接冠状动脉内注射微栓塞球法、自体微血栓法及化学损伤法[17],虽适用于不同发病机制导致的CMD实验研究,但是其模型构建并未在动物已经发生心肌梗死的基础上。本模型则综合了上述多种方法,采用直径为20 μm的聚苯乙烯单分散微球,通过球囊扩张及微导管选择性注入的介入方法,成功建立山羊MIRI-CMD模型。本模型从接近临床实际的角度为缺血性心脏病中CMD病理生理改变的深入研究创造了可能,并为预防和治疗干预提供了转化模型。本研究所选用的山羊被认为是心血管研究的良好模型[18],其冠状动脉循环与人类相似,且冠状动脉侧支发育较小[19]。选择性栓塞可有效控制心肌损伤的面积,而非缺血区可部分代偿栓塞区的功能,从而提高动物的存活率。山羊因其体型较大,易于进行介入操作,避免开胸等不良创伤因素对心脏病理生理学的影响,从而保证研究的可靠性。丙泊酚耳缘静脉输注,具有起效快、作用时间短、安全不易蓄积、易于操作等优点,心脏节律保持平稳,效果可靠。实验山羊均为左冠状动脉优势型血供,LCX较粗大、右冠状动脉短小,所有动物均于LCX中远段释放微球,以组织病理学为金标准,结合心电图检查表明球囊扩张30 min后,再灌注时注入适量微球诱导微栓塞,可以造成局部心肌坏死及不同程度的成纤维细胞增生和血管内微球填充。与栓塞组相比,非栓塞组显示心肌损伤轻微,且病理结果证实缺血心肌多为前壁、间隔壁,其中重要的损伤机制涉及到氧化应激、炎症反应、细胞凋亡等。选取术后72 h抽取山羊静脉血,一方面是基于现有的文献阐述,另一方面是考虑到损伤后的相关检测物质浓度改变需要时间,而且微球栓塞的不均一性(由于冠状动脉微循环血管内径不同,心肌缺血时不同部位损伤程度不同,再灌注时血流恢复情况不同等)也会延长损伤反应表现。由于经费等问题,未能进行连续动态的血清生物化学指标检测,为本动物实验的不足之处。需注意的是,研究发现山羊对于丙泊酚的耐受性较高,造模开始后,需要密切观察麻醉深度以确保实验安全顺利进行。
研究表明,炎症、氧化应激和细胞凋亡[20-21],在MIRI的发病机制中起着关键作用,而抑制炎症和抗氧化可作为预防或干预MIRI的有效策略。GA的抗炎和抗氧化特性已被广泛报道[22],可降低结肠癌大鼠的过度增殖反应,下调促炎细胞因子、炎症和血管生成标志物以及凋亡水平[23-24]。其作用可能与心肌Nrf-2/HO-1的激活和抑制心肌NF-κB信号通路有关[25]。此外,体内实验显示,GA治疗可显著减轻MIRI引起的左心室功能障碍、纤维化和心肌凋亡,同时抑制炎症反应和减少氧化因子的表达。这些结果表明,GA治疗通过下调炎症反应和氧化水平来缓解缺血/再灌注大鼠的MIRI[26-27]。MIRI是再灌注治疗的主要障碍,预防心肌缺血后心肌细胞死亡是控制MIRI的最佳方法。所以本实验选择异甘草酸镁作为预处理药物,以验证其对于山羊MIRI的保护作用。
研究表明,在体内SOD是抗氧化酶中清除氧自由基的主力军[28];GSH发挥作用的机制是当体内自由基含量增加、氧化应激反应明显时,通过其结构中的巯基被氧化脱氢来清除体内多余的自由基[29];MDA是脂质过氧化物代谢后的终产物,MDA含量常常与机体组织氧化损伤程度呈正比[30]。本研究表明,与栓塞组血清中MDA、GSH、SOD指标相比,异甘草酸镁的预处理有效降低了山羊血清中MDA的含量,增强了SOD的活性,升高了GSH浓度,并且呈一种剂量依赖性的方式。提示GA的心血管保护作用是由于它具有抗氧化潜力,能够减轻MIRI山羊心肌细胞的氧化应激反应,维护心肌细胞膜的稳定。
心肌梗死后,M1巨噬细胞渗入受损的心脏组织,引发炎症并释放促炎细胞因子,包括一氧化氮合酶、肿瘤坏死因子α、IL-1β和IL-6。相反,抗炎巨噬细胞产生抗炎细胞因子(精氨酸酶、IL-4和IL-10),并促进伤口愈合和瘢痕形成[31]。MIRI的病理过程可引发有害的炎症反应,涉及多种炎症细胞(如中性粒细胞、巨噬细胞和淋巴细胞)的浸润和促炎细胞因子的累积,最终导致严重的心脏功能障碍。本实验检测了炎症介质IL-10、IL-6,不同组的IL-6、IL-10含量存在差异,而予以异甘草酸镁处理后的山羊心肌梗死细胞的IL-6水平则明显降低,且存在一定的剂量依赖。
心肌细胞的凋亡是一个由一系列程序控制的细胞死亡的过程,这与细胞坏死不同。心肌细胞凋亡开始于心肌缺血并被再灌注放大,导致部分心肌细胞的死亡。通过细胞外信号或通过线粒体释放凋亡酶激活因子均可以激活凋亡酶Casepase(半胱氨酸天冬氨酸蛋白水解酶),启动凋亡程序。Casepase是引起细胞凋亡最关键、最重要、最核心的酶[32],在大多数凋亡的检测实验中,Casepase-3是必不可少的。Casepase-3的激活很大程度上依赖于细胞色素C的释放,而Bcl-2家族中的Bcl-2、Bax也是凋亡过程中的重要调控基因,它们可以通过线粒体途径介导胱抑素C的释放。Bcl-2、Bax、Casepase-3在细胞凋亡信号传导过程中相互影响、相互制约、相互促进,Bcl-2、Bax既可以作为Casepase-3的上游调控基因,也可以作为Casepase-3的直接底物[33]。Bax/Bcl-2比例在凋亡过程中也具有重要的意义,上调Bcl-2或下调Bax均可以抑制细胞凋亡。正如前述实验表明,异甘草酸镁预处理能够有效减轻心肌梗死细胞的氧化应激反应,抑制炎症介质生成,并且能够上调Bcl-2的蛋白表达,下调Bax的表达,改变Bcl-2/Bax的比值,从而有效地减弱细胞凋亡过程。本实验认为,异甘草酸镁预处理可以有效减少心肌梗死后心肌细胞的凋亡。
本研究观察了山羊心肌MIRI的大体心肌梗死面积及组织病理改变,在栓塞组山羊心肌梗死面积较大,病理切片可以观察到组织坏死、肌纤维排列紊乱、中性粒细胞浸润、间隙性水肿和血管改变,坏死的心肌细胞胞浆中HE染色明显。而异甘草酸镁预处理组的心肌梗死面积减小,病理结果提示心肌细胞的结构改变较少,心肌细胞排列相对整齐、规则,炎性细胞浸润较少,损伤较轻。这一结果提示异甘草酸镁对于心肌细胞在结构上具有保护作用,并减轻了山羊MIRI的细胞形态学损伤。
综上所述,本实验认为,异甘草酸镁能通过抑制氧化应激反应、减少炎性介质释放,起到有效抑制心肌细胞凋亡的作用,从而有效地减轻由心肌梗死及再灌注引起的心肌损伤,并最大限度降低梗死面积。本实验发现对于心肌梗死的患者,异甘草酸镁可能是潜在的心血管保护药物。本实验研究了异甘草酸镁在MIRI过程中的作用及其潜在的分子机制,发现其作用可能与抑制氧化应激和凋亡相关,且呈现出浓度依赖的方式,抑制炎症和抗氧化应激可作为预防或干预MIRI的有效策略。甘草作为我国传统中医药的重要组成部分,入药历史悠久,应用范围广泛,具有多种药理作用和生物活性,近年来,国内外对其不同提取物进行研究,发现了更多独特的临床应用价值。在内蒙古,甘草作为当地特产,如能进一步开发利用,将带动系列产业链发展。本研究选用GA的衍生物制剂——异甘草酸镁作为研究对象,以探究其对于模型动物MIRI的保护作用及机制,为其进一步的推广和应用提供更多的理论依据。因条件所限,本课题组所建模型数量比较少且观察时间较短,未能通过心脏超声检查评估不同组别造模后不同时间段心功能状态,将在以后的实验中逐步完善。
利益冲突所有作者均声明不存在利益冲突
