不同胰蛋白酶在制备腮腺炎减毒活疫苗中的效果比较
2023-06-14宋阳宋雪杨生宝张燕刘建凯
宋阳,宋雪,杨生宝,张燕,刘建凯
·论著·
不同胰蛋白酶在制备腮腺炎减毒活疫苗中的效果比较
宋阳,宋雪,杨生宝,张燕,刘建凯
102600 京民海生物科技有限公司/北京市新型联合疫苗工程技术研究中心
比较基因重组胰蛋白酶和猪源胰蛋白酶在腮腺炎减毒活疫苗中的使用效果。使用浓度为 10%、15%、20% 基因重组胰蛋白酶制备鸡胚成纤维细胞,通过细胞密度、细胞活性、24 h 以及48 h 细胞贴壁状态等指标确定基因重组胰蛋白酶使用浓度;与猪源胰蛋白酶进行比较,通过细胞密度、细胞活性、48 h 细胞贴壁状态以及病毒滴度等指标比较两种胰蛋白酶的使用效果;使用基因重组胰蛋白酶制备 3 批腮腺炎减毒活疫苗,检定疫苗的稳定性;规模化放大验证该工艺的稳定性。通过研究发现基因重组胰蛋白酶的使用浓度为 15%;与猪源胰蛋白酶进行比较,两种胰酶制备的细胞密度水平一致,无显著性差异(> 0.05),48 h 后细胞均生长至单层,细胞状态良好,按照同一 MOI 进行接毒,病毒滴度无显著性差异(> 0.05);使用 CF-10 进行试验,病毒滴度也无差异(> 0.05);连续 3 批使用基因重组胰蛋白酶制备的疫苗热稳定性良好,且该工艺可以规模化放大。在制备腮腺炎减毒活疫苗中可以使用浓度 15% 的基因重组胰蛋白酶替代猪源胰蛋白酶,作为鸡胚成纤维细胞消化液使用。
基因重组胰蛋白酶; 猪源胰蛋白酶; 鸡胚成纤维细胞; 腮腺炎病毒
流行性腮腺炎,是由腮腺炎病毒感染导致的急性呼吸道传染病,主要通过飞沫在空气中进行传播,其主要威胁儿童等免疫力较为低下的人群,被我国列为法定传染病之一,根据国家卫生健康委员会统计,我国在 2021 年共发生 119 955 例(人)的感染,给公共卫生和人民健康带来巨大威胁。
接种腮腺炎减毒活疫苗是控制该病流行的重要手段[1]。目前我国使用的腮腺炎疫苗均为减毒活疫苗,在生产时需要将其弱毒株接种在细胞基质上。腮腺炎减毒活疫苗使用的细胞基质为鸡胚成纤维细胞,在制备该细胞时需要使用胰蛋白酶将鸡胚组织细胞消化[2]。目前在此工艺中使用的胰蛋白酶多为猪源胰蛋白酶。但是在疫苗制备过程中需要严格控制原料的来源与质量[3],而目前仍有使用动物源性胰蛋白酶造成产品被外源因子污染的现象发生[4]。此外,猪源胰蛋白酶中杂质较多,杂质主要来源于胰腺的脂类、蛋白和核酸等,在胰蛋白酶处理细胞的过程中,杂质可能会影响细胞的生长[5],是严重影响病毒复制和提高病毒滴度的重要因素之一,尤其在大规模工厂化生产时,会导致原材料损失和经济成本的增加[6-7]。
基因重组胰蛋白酶是使用基因工程方法生产的新型蛋白酶,生产过程不使用任何动物源性原料,不存在外源性的病毒污染的可能性。而且其具有纯度高、比活高、性状比较均一且质量比较稳定等特点,目前已经开始被大量应用在疫苗研究和生产等环节中[8]。
本研究通过摸索基因重组胰蛋白酶使用浓度,并与猪源胰蛋白酶进行比较,通过细胞密度、细胞活性以及病毒滴度等重要参数确定基因重组胰蛋白酶能否替代猪源胰蛋白酶应用在腮腺炎减毒活疫苗制备中,为后期大规模应用和其他生物制品的研究和生产提供重要理论和数据支持。
1 材料与方法
1.1 材料
1.1.1 实验材料 SPF 鸡胚购自北京勃林格殷格翰维通生物技术有限公司;猪源胰蛋白酶购自美国 Gibco 公司;基因重组胰蛋白酶购自美国 Thermo Fisher 公司;腮腺炎病毒为 Jeryl Lynn 株,由北京民海生物科技有限公司自制。
1.1.2 仪器设备 Counstar 自动细胞计数仪购自上海睿钰生物科技有限公司;倒置显微镜购自日本Olympus 公司。
1.2 方法
1.2.1 基因重组胰蛋白酶浓度的确定 选用10 日龄鸡胚,经消毒后,取出鸡胚,去除鸡胚头部及内脏,剪成碎块。使用 0.01 mol/L 磷酸盐缓冲液(pH 7.2 ~ 7.4)将基因重组胰蛋白酶(10×)稀释成 10%、15%、20%,将其分别加入至鸡胚进行消化,37 ℃水浴消化 20 ~ 30 min 后,弃去上清液。吹打分散细胞并使用含新生牛血清的水解乳蛋白溶液进行鸡胚成纤维细胞制备,使用自动细胞计数仪测定细胞密度以及活率。培养 24、48 h 后观察细胞状态。48 h 后各取 1 瓶,用胰酶消化细胞并计数,计算体外培养 48 h 的细胞增殖比。
1.2.2 基因重组胰蛋白酶与猪源胰蛋白酶比较 选用 10 日龄鸡胚,经消毒后,取出鸡胚,去除鸡胚头部及内脏,剪成碎块。实验组按照确定好的浓度使用基因重组胰蛋白酶进行消化,对照组使用猪源胰蛋白酶进行消化。吹打分散细胞并使用含新生牛血清的水解乳蛋白溶液进行鸡胚成纤维细胞制备,测定细胞密度以及活率。按同一 MOI 接种腮腺炎病毒,病毒培养 48 h 后进行细胞洗涤及换液,当细胞病变达到 40% 以上时进行腮腺炎病毒收获,对收获液进行病毒滴定。
1.2.3 三批腮腺炎单次病毒收获液特性的比较 按照上述方法制备腮腺炎单次病毒收获液,并对收获液进行病毒滴定、无菌检查和支原体检查。配制得到腮腺炎病毒原液(即腮腺炎减毒活疫苗半成品),冻干后得到成品,对原液及成品进行检定。同时将成品于 37 ℃放置 7 d 后,对冻干成品进行热稳定性研究。
1.2.4 规模化放大验证 每批次使用 16 个细胞工厂进行连续 3 批工艺规模化放大验证。
1.3 统计学处理
采用 GraphPad Prism7 软件进行统计学分析,组间比较采用检验,以< 0.05 为差异有统计学意义。
2 结果
2.1 基因重组胰蛋白酶浓度的确定
使用 15%、20% 基因重组胰蛋白酶制备的细胞密度可达 6.0 × 105个/ml 以上,细胞活性分别为86%、81%。10% 基因重组胰蛋白酶制备的细胞密度仅为 5.0 × 105个/ml,细胞活性在 84%,结果见图 1。在相同的培养情况下,24 h 观察细胞状态,10% 基因重组胰蛋白酶制备的细胞 50% 贴壁、15% 基因重组胰蛋白酶制备的细胞 90% 贴壁、20% 基因重组胰蛋白酶制备的细胞 85% 贴壁,贴壁细胞状态良好;48 h 时,10%、15%、20% 三组依次有 80%、100%、100% 细胞贴壁,贴壁细胞状态良好且 48 h 后的细胞增殖比无统计学差异(图 2 和图 3)。根据实验结果,15%、20% 基因重组胰蛋白酶的消化能力相当,基于生产成本考虑,确定基因重组胰蛋白酶使用浓度为 15%。
2.2 基因重组胰蛋白酶(15%)与猪源胰蛋白酶比较
使用基因重组胰蛋白酶(15%)与猪源胰蛋白酶进行比较,细胞培养在 T225 瓶中或 CF-10 中,实验结果如图 4 所示,两种胰酶制备的细胞密度和细胞活性水平一致,无统计学差异(0.227)。48 h 后细胞均生长至单层,细胞状态良好(图 5)。按照同一 MOI 进行接毒,收获后进行病毒滴度测定,基因重组胰蛋白酶(15%)组病毒滴度为6.5 lgCCID50/ml,猪源胰蛋白酶组病毒滴度为6.6 lgCCID50/ml,无显著性差异(0.379);使用 CF-10 进行工艺放大,病毒滴度均为6.9 lgCCID50/ml,无显著性差异(0.649),结果见图 6。

图1 不同浓度基因重组胰蛋白酶制备鸡胚成纤维细胞密度(A)和活性(B)比较
Figure 1 Comparison of density (A) and activity (B) of chicken embryo fibroblasts prepared with different concentrations of recombinant trypsin

图2 不同浓度基因重组胰蛋白酶制备鸡胚成纤维细胞生长状态比较
Figure 2 Comparison of growth status of chicken embryo fibroblasts prepared with different concentrations of recombinant trypsin
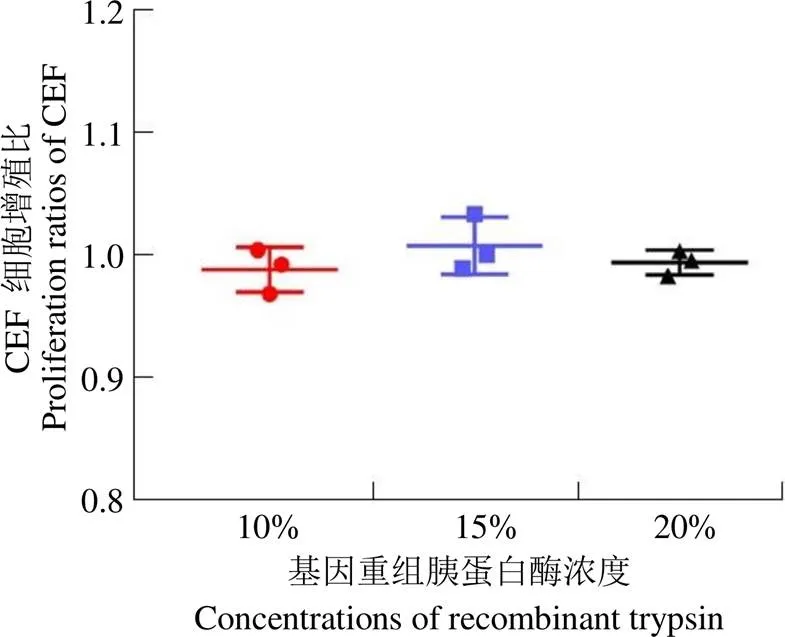
图3 不同浓度基因重组胰蛋白酶制备鸡胚成纤维细胞 48 h 增殖比
Figure 3 Comparison of proliferation ratios of chicken embryo fibroblasts prepared with different concentrations of recombinant trypsin

图4 不同胰蛋白酶制备鸡胚成纤维细胞密度(A)和活性(B)比较
Figure 4 Comparison of density (A) and activity (B) of chicken embryo fibroblasts prepared by different trypsin
Figure 5 Comparison of cell growth status of chicken embryo fibroblasts prepared by porcine trypsin (A) and recombinant trypsin (B)
Figure 6 Comparison of titers of mumps single virus harvest prepared by different trypsin
表1 腮腺炎单次病毒收获液检定结果
Table 1 The results of control tests on mumps virus single harvests
批次 Batch病毒滴度(lgCCID50/ml) Virus titer (lgCCID50/ml)无菌检查 Sterility test支原体检查 Mycoplasma test 16.3符合规定 Conforms符合规定 Conforms 26.4符合规定 Conforms符合规定 Conforms 36.3符合规定 Conforms符合规定 Conforms
表2 腮腺炎病毒原液检定结果
Table 2 The results of control tests on mumps virus bulks
批次Batch鉴别试验Identification test病毒滴度(lgCCID50/ml)Virus titer (lgCCID50/ml)无菌检查Sterility test支原体检查Mycoplasma test牛血清白蛋白残留量(ng/ml)BSA residue (ng/ml) 1符合规定 Conforms5.5符合规定 Conforms符合规定 Conforms20.3 2符合规定 Conforms5.6符合规定 Conforms符合规定 Conforms20.3 3符合规定 Conforms5.6符合规定 Conforms符合规定 Conforms22.6
2.3 3 批腮腺炎减毒活疫苗比较分析
进行连续 3 批腮腺炎减毒活疫苗实验,对腮腺炎单次病毒收获液、原液进行检定,结果见表 1、表 2。
表2 结果表明,腮腺炎病毒原液各项检测均符合要求。制成 3 批成品并于 37 ℃放置 7 d,病毒滴度结果见表 3。各批次腮腺炎病毒滴度结果均不低于 4.0 lgCCID50/ml,病毒滴度下降均不高于1.0 lgCCID50/ml,符合现行版药典对于腮腺炎病毒滴度标准要求。
表3 腮腺炎减毒活疫苗成品 37 ℃热加速稳定性结果(lgCCID/ml)
Table 3 The thermal stability results of mumps virus t 37 ℃(lgCCID/ml)
批次 Batch0 天 0 day 7 天 7 day 14.84.6 25.34.5 34.84.5
以上数据说明,使用重组胰蛋白酶制备的腮腺炎减毒活疫苗的各项指标符合标准要求。
2.4 规模化放大验证
使用基因重组胰蛋白酶(15%)进行 3 批腮腺炎减毒活疫苗制备工艺规模化放大验证,每批次使用 16 个细胞工厂,对腮腺炎单次病毒收获液、原液进行检定,结果见表 4、表 5。
表4、5 结果表明,腮腺炎单次病毒收获液和病毒原液各项检测均符合要求。制成 3 批成品检定结果见表 6,各项检定结果均符合现行版药典对于腮腺炎减毒活疫苗成品的要求。
使用重组胰蛋白酶制备的腮腺炎减毒活疫苗的各项检定均符合标准要求,经过规模化放大验证,重组胰蛋白酶可以用于替代猪源胰蛋白酶使用。
3 讨论
目前国内外生产腮腺炎减毒活疫苗主要是以鸡胚细胞为基质。有研究使用二倍体细胞进行腮腺炎减毒活疫苗的制备[9]。虽然使用二倍体细胞可以建立细胞工作库,有利于质量控制以及工艺的稳定。而鸡胚细胞由于其是原代细胞系,更有益于保留病毒的免疫原性,腮腺炎病毒等更易感染和扩增,所以目前鸡胚细胞制备仍是生产腮腺炎减毒活疫苗的关键环节。但是鸡胚成纤维细胞也存在质量不均一、生物安全性高等问题,已有研究通过对其永生化试图解决该问题,但目前还未有成功构建稳定细胞系的报道[10]。
对于原料的严格控制是影响生物制品产品质量的最为重要的环节之一,《中国药典》三部(2020 版)明确要求,动物源胰酶用于疫苗生产时,需检测胰酶相关的外源性病毒[11]。由于我国外来动物疫病和重要人畜共患病防控压力的加大,对于重要动物源性疾病对生物制品的威胁也愈发严峻,同时因外来动物疫病检测方法缺失和相关检测方法敏感性的不足,导致目前不能完全消除外源性病毒污染的风险。所以使用动物源性原料作为原料生产的减毒活疫苗,其带来的外源因子污染的风险始终不能忽视[12]。
表4 工艺放大实验中腮腺炎单次病毒收获液检定结果
Table 4 The results of control tests on mumps virus single harvests in amplification
批次 Batch病毒滴度(lgCCID50/ml) Virus titer (lgCCID50/ml)无菌检查 Sterility test支原体检查 Mycoplasma test 16.3符合规定 Conforms符合规定 Conforms 26.4符合规定 Conforms符合规定 Conforms 36.6符合规定 Conforms符合规定 Conforms
表5 工艺放大实验中腮腺炎病毒原液检定结果
Table 5 The results of control tests on mumps virus bulks in amplification
批次Batch鉴别试验Identification test病毒滴度(lgCCID50/ml)Virus titer (lgCCID50/ml)无菌检查Sterility test支原体检查Mycoplasma test牛血清白蛋白残留量(ng/ml)BSA residue (ng/ml) 1符合规定 Conforms5.5符合规定 Conforms符合规定 Conforms18 2符合规定 Conforms5.3符合规定 Conforms符合规定 Conforms18 3符合规定 Conforms5.3符合规定 Conforms符合规定 Conforms19
表6 腮腺炎减毒活疫苗成品检定结果
Table 6 The results of control tests on mumps vaccine
项目Items批次 Batch 123 无菌检查 Sterility test符合规定 Conforms符合规定 Conforms符合规定 Conforms 鉴别试验 Identification test符合规定 Conforms符合规定 Conforms符合规定 Conforms 外观 Appearance inspection符合规定 Conforms符合规定 Conforms符合规定 Conforms pH7.47.27.3 渗透压摩尔浓度(mOsmol/kg) Osmolality (mOsmol/kg)801799783 牛血清白蛋白残留量(ng/剂) BSA residue (ng/dose)101516 异常毒性 Abnormal toxicity符合规定 Conforms符合规定 Conforms符合规定 Conforms 细菌内毒素(EU/剂) Bacterial endotoxin (EU/dose)< 50< 50< 50 水分(%) Water (%)1.82.02.1 病毒滴度(lgCCID50/ml) Virus titer (lgCCID50/ml)4.55.04.6 37 ℃,7 d 病毒滴度(lgCCID50/ml)Virus titer at 37 ℃ 7 day (lgCCID50/ml)4.14.64.2
使用基因重组胰蛋白酶替代动物源性胰蛋白酶是解决上述困境的方法之一。随着目前生物工程等技术的发展,基因重组胰蛋白酶的生产技术和成本日趋简单和廉价,使得其作为生产原材料用于生物制品的生产成为可能,而且其具有纯度高、安全系数较高等先天优势。使用基因重组胰蛋白酶成为趋势[13]。
研究中我们首先确定了用于鸡胚细胞制备的重组胰蛋白酶浓度为 15%。使用 10% 浓度制备的鸡胚细胞密度少,导致贴壁细胞率较低,无法满足后续工艺要求。原因可能在于低浓度的胰蛋白酶对于制备鸡胚成纤维细胞尤其是大量制备时的消化状态不理想,容易形成细胞团块,导致细胞贴壁效果差。我们在研究中发现,虽然猪源胰蛋白酶与基因重组胰蛋白酶在细胞活性、细胞密度和病毒滴度等参数上无统计学差异,但基因重组胰蛋白酶组的离散度要低于猪源胰蛋白酶组,组间稳定性更好。分析其原因一是基因重组胰蛋白酶由于其生产不受原材料和提取技术限制,纯度和批间稳定性更好;二是基因重组胰蛋白酶的理化性质更加稳定,在配制时更为方便,差异更小。
本研究通过比较两种胰蛋白酶在腮腺炎减毒活疫苗中的应用,基因重组胰蛋白酶达到猪源胰蛋白酶的效果,细胞密度和细胞活性达到工艺需求,且生产出的腮腺炎单次病毒收获液滴度无显著差异,初步建立了使用基因重组胰蛋白酶制备腮腺炎减毒活疫苗的方法,为优化相应工艺提供依据。
[1] Su SB, Chang HL, Chen AK. Current status of mumps virus infection: Epidemiology, pathogenesis, and vaccine. Int J Environ Res Public Health, 2020, 17(5):1686.
[2] Gu YL, Niu B, Ruan JC, et al. Application of recombinant porcine trypsin in preparation of rabies vaccine(chicken embryo fibroblasts). Chin J Biol, 2021, 34(1):5-9. (in Chinese)
顾玉林, 牛彪, 阮俊程, 等. 重组猪胰蛋白酶在制备狂犬病疫苗(鸡胚成纤维细胞)中的应用. 中国生物制品学杂志, 2021, 34(1):5-9.
[3] Gu HY, Lv M, Ding L, et al. Establishment of PCR detection method for porcine derived virus in vaccine raw materials. Chin Med Biotechnol, 2019, 14(4):373-376. (in Chinese)
谷海燕, 律苗, 丁玲, 等. 疫苗用原辅料中猪源性病毒PCR检测方法的建立. 中国医药生物技术, 2019, 14(4):373-376.
[4] Du Y, Hao PB, Xie QH, et al. Exogenous detection of porcine materials in vaccine production. China Health Industry, 2018, 15(7): 140-141. (in Chinese)
杜岩, 郝鹏博, 谢秋红, 等. 疫苗生产中猪源材料的外源性病毒检测. 中国卫生产业, 2018, 15(7):140-141.
[5] Li SX. USP 2014 Appendix "Recombinant Trypsin" Standard//China Academic Journal Electronic Publishing House. 2014:1-4. (in Chinese)
李素霞. 美国药典2014附录“重组胰蛋白酶”标准//2014年中国药学大会暨第十四届中国药师周论文集. 2014:1-4.
[6] Feng XT, Liu SL, Huang X, et al. Cloning and expression of porcine-recombination trypsinogen gene and its activity analysis. Prog Pharm Sci, 2014, 38(12):916-921. (in Chinese)
冯雪婷, 刘素丽, 黄潇, 等. 重组猪源胰蛋白酶原的构建,表达与活性分析. 药学进展, 2014, 38(12):916-921.
[7] Liu LL, Han L, Guo ZB, et al. Study on partial influencing factors of the extraction of pig trypsin. Sci Technol Food Industry, 2010, 31(5):284-286. (in Chinese)
刘亮亮, 韩玲, 郭兆斌, 等. 影响猪胰蛋白酶提取部分工艺因素研究. 食品工业科技, 2010, 31(5):284-286.
[8] Ruan CL, Chen HB, Zhang ZH, et al. Comparison of digestion of vero cells and KMB-17 cells with different types of digestive solutions.
J Yunnan Univ (Nat Sci Ed), 2022, 44(5):1069-1076. (in Chinese)
阮朝列, 陈洪波, 张泽珩, 等. 不同类型胰蛋白酶消化Vero细胞和KMB-17细胞的比较. 云南大学学报(自然科学版), 2022, 44(5): 1069-1076.
[9] Wang W, Qiu H, Yang ZQ, et al. Proliferation of mumps virus SP-A strain of genotype F in human diploid cells with cell factory. Prog Microbiol Immunol, 2020, 48(1):63-68. (in Chinese)
王微, 邱恒, 杨振清, 等. 细胞工厂中F基因型腮腺炎病毒SP-A株在人二倍体细胞上的增殖研究. 微生物学免疫学进展, 2020, 48(1):63-68.
[10] Shang H. Preliminary study on immortalization of chicken embryo fibroblasts. Wuhan: Huazhong Agricultural University, 2008. (in Chinese)
商恒. 鸡胚成纤维细胞永生化的初步研究. 武汉: 华中农业大学, 2008.
[11] Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China. Volume 2, 2020. Beijing: China Medical Science Press, 2020. (in Chinese)
国家药典委员会. 中华人民共和国药典. 2020年版二部. 北京: 中国医药科技出版社, 2020.
[12] Ling Y. Safety risk assessment and quality control of adventitious agents throughout the life cycle of vaccine products. China Pharm, 2022, 31(6):16-21. (in Chinese)
凌媛. 疫苗产品全生命周期外源因子安全性风险评估及质量控制探讨. 中国药业,2022, 31(6):16-21.
[13] Xu XF. Fermentation and expression of recombinant trypsin in Escherichia coli. Xuzhou: China University of Mining and Technology, 2016. (in Chinese)
徐晓峰. 重组胰蛋白酶大肠杆菌的发酵与表达. 徐州: 中国矿业大学, 2016.
Comparison of the effects of different trypsin on the preparation of live attenuated mumps vaccine
SONG Yang, SONG Xue, YANG Sheng-bao, ZHANG Yan, LIU Jian-kai
Author Affiliation: Beijing Minhai Biotechnology Co. Ltd, Beijing Engineering Technology Research Center for New Conjugate Vaccine, Beijing 102600, China
To compare the efficacy of recombinant trypsin and porcine trypsin in live attenuated mumps vaccine.Chicken embryo cells were prepared by using 10%, 15%, 20% recombinant trypsin, and the concentration of recombinant trypsin was determined by cell density, cell viability, 24 h and 48 h cell adhesion. The effects of the two trypsins were compared by cell density, cell activity, 48 h cell adherence status and virus titer. Three batches of live attenuated mumps vaccine were prepared with recombinant trypsin, and the stability of the vaccine was tested. The stability of the process was verified by large-scale amplification.The concentration of recombinant trypsin was 15%. The results showed that the density levels of the cells prepared by the two trypsins were the same with no significant difference (> 0.05). After 48 h, the cells grew to monolayer, and the cells were in good condition. After being infected according to the same MOI, there was no significant difference in disease progression and virus titer (> 0.05). There was no difference in virus titer when CF-10 was used for process amplification (> 0.05). The vaccine prepared by using recombinant trypsin in three consecutive batches possessed good thermal stability, and the process could be scaled up.Recombinant trypsin (15%) can be used as chicken embryo cell digest in the preparation of live attenuated mumps vaccine.
recombinant trypsin; porcine trypsin; chicken embryo fibroblasts; mumps virus
ZHANG Yan, Email: zhangyan@biominhai.com
10.3969/j.issn.1673-713X.2023.03.007
张燕,Email:zhangyan@biominhai.com
2023-01-12
