一例从国内鹦鹉鉴定到鹦鹉博尔纳病毒2 型的诊断研究
2023-06-13吴俊仪陈武翟俊琼
吴俊仪,陈武,翟俊琼※
(1.南宁市动物园,广西 南宁 530003;2.广州动物园&广州市野生动物研究中心,广东 广州 510070)
博尔纳病毒(Borna disease virus,BDV)是单股负链、不分节段和嗜神经性的RNA 病毒,可感染鸟类及大多数恒温哺乳动物。禽博尔纳病毒(Avian borna virus,ABV)是导致鸟类腺胃扩张症(Proventricular dilatanon disease,PDD)的主要病原,对养殖业具有严重威胁,造成较大的经济损失。20 世纪70 年代,首次在一只精神沉郁、严重呕吐的金刚鹦鹉上发现PDD,目前已有报道显示70 多种鹦鹉产生PDD[1]。2008 年,在一只患有PDD 的鹦鹉上首次发现ABV[2]。到目前为止,国内对鹦鹉感染ABV 的相关报道较少,主要为博尔纳病毒4 型,且集中在对博尔纳病毒的检测和序列分析方面[3-7]。本研究在临床中遇到1 例非洲灰鹦鹉出现腺胃扩张症的案例,经过尸体剖检检查、病理变化及实验室核酸检测和测序,证实感染鹦鹉的是博尔纳病毒2 型(PaBV-2),为国内的首次发现。
1 材料与方法
1.1 病料
2021 年3 月,广东省某养殖场鹦鹉出现死亡,无菌采集病死鹦鹉脑、腺胃。
1.2 主要试剂
病毒RNA/DNA 提取试剂盒(AxyPrePTM Body Fluid Viral DNA/RNA Miniprep Kit)购自AXYGEN,反转录试剂盒(PrimeScriptTM1st Strand cDNA Synthesis Kit)购自TaKaRa,胶回收试剂盒(D2500-02 Gel Extraction Kit D2500)购自OMEGA,酶制剂[PCR Master Mix(2X)]购自Thermo Fisher。
1.3 方法
1.3.1 疑似PaBV 感染的临床症状以及病理观察观察疑似PaBV 感染的鹦鹉症状以及死后剖检变化,并取病变较严重的组织做切片观察。
1.3.2 引物的设计与合成 参照GenBank 上发表的鹦鹉博尔纳病毒序列,设计合成一对用于扩增鹦鹉博尔纳病毒的通用引物(PaBV-F 和PaBV-R)(表1),扩增长度约350bp,引物由北京擎科生物科技有限公司合成。

表1 鹦鹉博尔纳病毒鉴定引物Table 1 Primers for identification of parrots Bornavirus
1.3.3 疑似PaBV 感染的RT-PCR 鉴定 取鹦鹉脑和腺胃组织,用研钵研磨,根据病毒RNA/DNA 提取试剂盒说明提取RNA,按照TaKaRa 反转录试剂盒说明反转录为cDNA,使用1.3.2 引物进行RT-PCR检测。PCR 反应体系:Mix 12.5L,PCR Forward Primer 1L,PCR Reverse Primer 1L,cDNA 1L,Nuclease-free Water 9.5L。反应程序:95℃,4min;95℃30s,55℃30s,72 ℃45 (s1 kb/min),35 个循环;72 ℃10 min。1%电泳观察结果。
1.3.4 产物测序及序列分析 将阳性RT-PCR产物送至北京擎科生物科技有限公司进行测序。应用MEGA7对NCBI 上下载的8 个基因型PaBV 序列与本研究测到的序列进行遗传进化分析。
2 结果
2.1 临床症状及病理变化
该非洲灰鹦鹉病初食欲下降、精神萎靡、呕吐、偶有墨绿色粪便,伴头撞墙等症状。随病程发展,鹦鹉出现虚弱、精神沉郁、死亡症状。死后剖检发现腺胃有明显扩张,是正常腺胃的几倍大,占据腹腔大部分体积,胃内有大量未消化食物并伴酸臭味,胃壁变薄,脑部充血,见图1。

图1 非洲灰鹦鹉脑Fig.1 African grey parrot brain
取腺胃组织浸泡甲醛固定液,送至武汉长衍病理科技有限公司进行病理切片制作。由图2 可知,腺胃组织切片可见部分黏膜组织及间质水肿(红色),间质可见灶性淋巴细胞浸润(蓝色)。
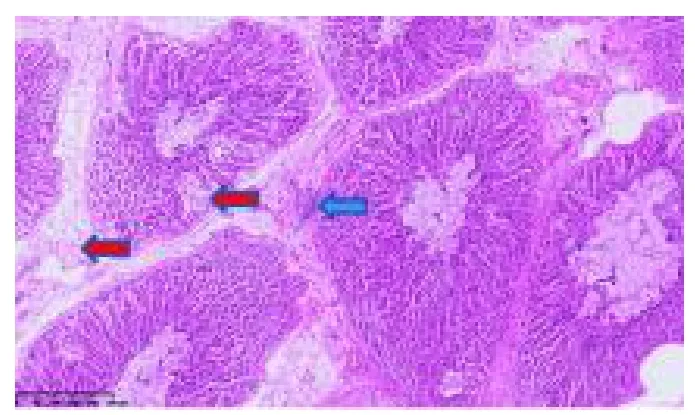
图2 腺胃病理切片图(100 )Fig.2 Glandular gastropathy section(100 )
2.2 PaBV的检测及序列分析
将RT-PCR 产物进行凝胶电泳,扩增产物约350bp(图3),与目的基因序列大小相符,将产物送至北京擎科生物科技有限公司进行测序,得到扩增片段的序列。通过比对分析建立遗传进化树(图4),发现本研究鉴定出的鹦鹉博尔纳病毒与美国及泰国的7 株鹦鹉博尔纳病毒2 型同属一个分支。

图3 鹦鹉博尔纳病毒检测电泳图Fig.3 Electrophoresis of borna virus detection in parrots

图4 根据M 基因序列建立遗传进化树Fig.4 Genetic evolution tree based on M gene sequence
3 讨论
ABV 自1970 年报道发现以来,多感染鹦鹉、金丝雀等鸟类,致死率高,各类珍禽受到很大威胁。由于广泛的商贸活动,使得PDD 在宠物鸟中持续传播至世界各国。巨嘴鸟、加拿大鹅、鸵鸟、番鸭、鸽、鹑哥、猫头鹰、鹜、密雀、织雀及其它雀形目鸟类已经检出该病毒,家禽中,鸭、鹅及鸽也携带该病毒[8]。研究显示,ABV 感染宿主后,主要侵害鸟类的神经系统,特别是鸟类胃肠道上部自主神经系统,导致腺胃扩张,无法正常蠕动,肠内细菌由于过度繁殖导致动物出现败血症和死亡。感染ABV 后,还可能出现精神沉郁、食欲减退、消瘦、腹泻及粪便内出现未消化完全食物等症状,但在临床上,症状往往不固定,也不够单一,可能表现出一种或几种症状,携带该病毒的鸟类也可能不表现出特有的临床症状,或者症状不明显,这给诊断带来困难[5]。有研究表明,ABV 可通过尿 粪 口途径传播,但目前的数据仍无法支撑,还有待进一步研究证实[9-12]。已知感染ABV 的鸟类可通过排泄物间歇性排毒,且有研究在粪便及被粪便、尿液污染的羽毛中检测到该病毒[13],因此对于活体的诊断,最好能做到间歇性多次采样以减少假阴性;对于死亡个体,可通过剖检观察脏器变化、病理切片以及分子检测来确诊。NCBI上能查到鹦鹉感染禽博尔纳病毒共有PaBV-1~8 共8 个型,以PaBV-2 和PaBV-4 型最多[9],本研究通过病理变化及RT-PCR 检测后测序证实该鹦鹉感染PaBV-2,在国内首次报道。该病毒基因型的遗传化分析表明,与欧美相关基因型的毒株同源性较近,结合动物来源分析,该鸟的亲鸟是从美洲地区引进至该养殖场的,推测是由亲鸟传播导致该鸟感染。禽博尔纳病毒感染的途径多种多样,禽博尔纳病毒毒株的来源也可以来源世界多个地区[14-17]。由于目前国内样本数量不足,检测不系统,且仅能采集零星发病的病例样本检测,其流行情况和地理分布规律均有待进一步研究。
迄今为止,暂没有疫苗和特效药用于预防和治疗该病,曾有研究证实核苷酸类似物利巴韦林可以抑制细胞系中的博尔纳病毒增殖,但无法完全消除该病毒,且仅限于细胞层面,在动物体内的应用效果还有待进一步证实[18]。有研究者尝试对鹦鹉进行口服利巴韦林进行治疗,发现既没有对该病有任何治疗效果,也没有对鸟类产生有害影响[13];最近,抗病毒化合物法匹拉韦(T-705)被证明在细胞培养物中抑制博尔纳病毒的效率明显高于利巴韦林,并且可能能够从持续感染的培养物中完全消除博尔纳病毒[19],是否也能在体内提供抗病毒效果,以及接受治疗的鸟类是否耐受该药物,仍有待阐明。目前主要是通过监测病毒来实施鸟群管理,对感染的鸟类通过隔离、消毒和净化等闭环管理防控,同时防止病毒进一步传播,因此,实验室病原监测能有效防控鹦鹉感染博尔纳病毒,而对于感染鸟类则主要采用支持疗法、对症治疗或采取隔离消毒等措施自我净化[20]。
综上所述,本研究通过临床症状、病理变化以及分子检测证实广东省某鹦鹉养殖场鹦鹉感染博尔纳病毒2 型,为国内首次发现,本研究为博尔纳病毒的诊断提供了依据,并为后续该病的防控提供了参考。
