二参真武汤调控PI3K/AKT/mTOR信号通路抑制心肌纤维化的体外实验研究
2023-06-13甘芮溪张小月程晓昱彭代银王红松陈卫东
赵 研,甘芮溪,张小月,程晓昱,葛 岚,彭代银,王红松,陈卫东,3,4,5
(1.安徽中医药大学药学院,安徽 合肥 230012; 2.安徽中医药大学第一附属医院,安徽 合肥 230031;3.安徽道地中药材品质提升协同创新中心,安徽 合肥 230012;4.中药饮片制造新技术与研发安徽省重点实验室,安徽 合肥 230012;5.中药复方安徽省重点实验室,安徽 合肥 230012)
心肌纤维化是心功能障碍时心脏自身的代偿反应,是许多心脏疾病终末期的共同病理生理机制[1]。纤维化的特点是成纤维细胞过度繁殖,导致细胞外基质蛋白沉积增加,虽然轻度的纤维化对心脏起到一定的保护作用,但是过度增殖和沉积会使心脏扩展下降,心脏的舒张活动降低,心肌僵硬,最终导致患者心律失常或心力衰竭[2]。目前,还没有治疗心肌纤维化的最佳治疗方案,如果能够早发现、早对症治疗,可能会极大提高患者的生命安全。
二参真武汤是安徽中医药大学第一附属医院结合多年临床用药经验[3],基于《伤寒论》真武汤增加红参、丹参组成的中药复方。二参真武汤能显著改善心肾阳虚型慢性心力衰竭患者心功能,降低醛固酮、活性氧、血管紧张素Ⅱ(angiotensin Ⅱ,AngⅡ)水平[4]。二参真武汤也可抑制免疫炎症反应,抑制心肌细胞凋亡,保护心肌细胞,改善慢性心力衰竭患者心肌纤维化[5]。但是,其治疗心肌纤维化的作用机制仍不清楚。
PI3K/AKT/mTOR信号通路是一种常见的细胞信号通路,参与哺乳动物多种病理生理过程,并参与细胞周期和细胞生长的过程。有研究表明,硫化氢通过调节PI3K/AKT/mTOR信号通路,增加细胞自噬而减轻阿霉素诱导的大鼠心肌纤维化[6],芪参益气丸通过PI3K/AKT/mTOR通路激活自噬而减轻心肌纤维化[7],姜辣素通过PI3K/AKT/mTOR信号通路抑制细胞凋亡和自噬从而改善心肌纤维化[8]。PI3K/AKT/mTOR信号通路通过调节细胞的存活、凋亡、生长及心肌收缩甚至相关基因的转录等参与调控心肌纤维化的发生、发展和病理形成,通过调节自噬减轻心肌纤维化,在心血管疾病的发病机制中具有重要的作用。基于上述原因,本实验将PI3K/AKT/mTOR信号通路相关蛋白及其mRNA作为心肌纤维化的特异性指标,采用原代心肌成纤维细胞进行实验研究,以二参真武汤含药血清进行干预,并以贝那普利作为阳性对照,探究二参真武汤治疗心肌纤维化的机制。
1 材料
1.1 试剂 附子、红参、茯苓、白术、白芍、丹参购于安徽普仁公司,生姜自制,经安徽中医药大学俞年军教授鉴定可用。贝那普利(批号 H200533390):中国成都地奥制药集团有限公司;胶原蛋白(Collagen,Col)-Ⅰ(批号 ED-30514)、Col-Ⅲ(批号 ED-30513):中国厦门仑昌硕公司;GAPDH(批号 A01020)、山羊抗兔IgG(批号 BS13278)、山羊抗鼠IgG(批号 A21010):美国Abbkin;α-平滑肌肌动蛋白(alpha-smooth muscle actin,α-SMA)(批号 ab283851)、PI3K/AKT/mTOR(批号 ab283852):美国Abcam公司;TRIzol(批号 15596-026):美国Invitrogen;SYBR PreMix Ex TaqTMⅡ试剂盒(批号 201):日本Takara;DMEM高糖培养基(批号 11995040):美国Thermo Fisher Scientific。
1.2 仪器 全波长酶标仪(Multiskan Spectrum):赛默飞公司;高速冷冻离心机(Centrifuge 5810R):上海天美有限公司;倒置光学显微镜(DMI6000B):麦克奥迪;超灵敏多功能成像仪(Amersham Image 600):美国GE;qRT-PCR仪(MX3000P):美国安捷伦。
1.3 动物 将大鼠置于温度(20±2)℃、相对湿度(50±5)%的环境中饲养1周。本实验所用动物由河南省郑州市惠济区华兴实验动物养殖场[生产许可证号为SCXK(豫)2019-0002]提供。实验程序按照《实验动物护理和使用指南》进行,并获得安徽中医药大学伦理委员会批准(批文编号:AHUCM-rats-2021032)。
2 方法
2.1 含药血清的制备 按照文献[4]制备含药血清。采用水提回流法提取二参真武汤(丹参30 g,白芍、焦白术、茯苓各10 g,生姜、红参各6 g,制附子5 g),加入10倍量去离子水,制附子武火先煎0.5 h,文火煎1 h,再加入其他6味药共煎0.5 h,过滤,滤渣再加8倍量去离子水,煎煮0.5 h,沉降过滤后,将每次煮出的药液合并,浓缩后备用。
将18只SPF大鼠平均分为3组:空白血清组(生理盐水10 mL/kg),二参真武汤含药血清组(二参真武汤15.84 g/kg),贝那普利组(贝那普利0.5 mg/kg),灌胃给药,每日1次,共7 d,最后1次灌胃后1 h取血,室温放置30 min后,4 ℃离心,取血清,56 ℃水浴锅灭菌,过0.45 μm滤头除菌,备用。
2.2 原代心肌成纤维细胞的提取 按照文献[9]方法提取原代心肌成纤维细胞。在无菌房内,取出乳鼠心脏剪碎,加入0.1%胶原酶Ⅱ,放置在4 ℃冰箱静置4 h,取上清铺板,放入37 ℃、5% CO2细胞培养箱静置,等待贴壁,1 h后取出细胞培养皿,显微镜下观察贴壁情况,贴壁细胞即为心脏成纤维细胞,后续实验使用2~4代细胞。
2.3 免疫荧光检测波形蛋白(Vimentin) 将第3次传代的细胞以每孔1.2×104接种至装有细胞爬片的6孔板上,用多聚甲醛固定。滴加一抗波形蛋白(Vimentin),4 ℃过夜,取出,在室温下等待30 min,洗片后二抗孵育3 min,PBS洗片5 min,使用透明指甲油封片,荧光显微镜观察拍照,使用美国国立卫生研究院Image J软件(版本号1.6.0)进行免疫荧光分析,得到抗体阳性面积。
2.4 台盼蓝染色观察细胞成活率 将原代心肌成纤维细胞消化,制备成2×105的细胞悬液,在9 mL细胞悬液中滴加1 mL 0.4%台盼蓝溶液,在3~5 min内使用显微镜观察计数,带有蓝色的细胞是死细胞,将图片中死细胞和总细胞进行计数。细胞成活率=(总细胞数量-死细胞数量)/总细胞数量×100%。
2.5 细胞活力检测 将原代心肌成纤维细胞置于96孔板中(每孔1×104个,100 μL),在标准条件下培养24 h,用CCK-8法检测细胞活力,根据结果选择最佳的含药血清浓度。首先加入含有0、2.5%、5%、10%、15%、20%含药血清的DMEM高糖培养基,培养24 h后,加入CCK-8试剂,每孔加10 μL,等待反应1 h后在酶标仪450 nm下测定吸光度。用CCK-8法检测细胞活力,根据细胞活力优选复制心肌纤维化模型所使用的AngⅡ浓度和作用时间,加入含有不同浓度(0.1、1、10 μmol/L)的Ang Ⅱ培养基分别培养细胞12、24、48 h,每孔加10 μL CCK-8试剂,反应1 h后在酶标仪450 nm下测定吸光度。
2.6 分组与给药 将原代心肌成纤维细胞分为正常组(加入含有10%空白血清的培养基)、模型组(1 μmol/L AngⅡ刺激24 h后加入含有10%空白血清的培养基)、二参真武汤组(1 μmol/L AngⅡ刺激24 h后加入含有10%二参真武汤含药血清的培养基)、贝那普利组(1 μmol/L AngⅡ刺激24 h后,加入含有10%贝那普利含药血清的培养基)。
2.7 ELISA检测Col-Ⅰ和Col-Ⅲ含量 将原代心肌成纤维细胞以1×106/mL的密度接种在6孔板上,加入10%含有不同含药血清的培养基刺激24 h后,取细胞上清液,根据ELASA试剂盒说明书检测Col-Ⅰ和Col-Ⅲ含量。
2.8 Western blot法检测α-SMA、Col-Ⅰ、Col-Ⅲ、PI3K、p-PI3K、AKT、p-AKT、mTOR、p-mTOR蛋白表达水平 将原代心肌成纤维细胞以1×106/mL的密度接种在6孔板上,使用1 μmol/L AngⅡ刺激24 h后分为4组,加入10%含有不同含药血清的培养基刺激24 h后,配置含有蛋白酶和磷酸酶抑制剂的裂解液,提取细胞蛋白,每个培养皿加入1 mL配置好的裂解液,等待30 min后,吸出混合液,离心,取上清,上清液以4∶1的比例加入蛋白上样缓冲液,将混合液体样品煮沸12 min,蛋白定量以后进行电泳,转移到硝酸纤维素膜上,放在一抗中过夜,二抗孵育2 h后曝光出现条带,使用Image J进行蛋白定量。
2.9 qRT-PCR法检测α-SMA、Col-Ⅰ、Col-Ⅲ、PI3K、AKT、mTOR mRNA表达水平 将原代心肌成纤维细胞以每毫升1×106个的密度接种于6孔板上,使用1 μmol/L AngⅡ刺激24 h后分为4组,加入10%含有不同含药血清的培养基刺激24 h后,在培养皿中加入1 mL Trizol,提取细胞中总RNA,将总RNA逆转录成cDNA后,采用Master Mix试剂盒进行检测。将3-磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)作对照。引物序列见表1。

表1 RT-PCR基因引物信息

3 结果
3.1 原代心肌成纤维细胞的鉴定与模型复制 免疫荧光检测原代心肌成纤维细胞标志性蛋白Vimentin,结果显示Vimentin单抗染色阳性大于95%(见图1)。台盼蓝染色检测原代心肌成纤维细胞的存活率,根据计数得知细胞存活率在98%以上(见图2)。分别采用含有0.1、1、10 μmol/L的AngⅡ培养基刺激细胞12、24、48 h,结果显示1 μmol/L AngⅡ刺激细胞24 h后细胞活力最强(P<0.05)(见图3)。采用Western blot法检测纤维化标志物α-SMA、Col-Ⅰ、Col-Ⅲ蛋白的表达水平(见图4),结果显示模型组(1 μmol/L AngⅡ刺激24 h组)Col-Ⅰ、Col-Ⅲ、α-SMA蛋白表达水平显著高于正常组(0 μmol/L AngⅡ刺激24 h组)(P<0.05),说明心肌细胞纤维化模型复制成功。
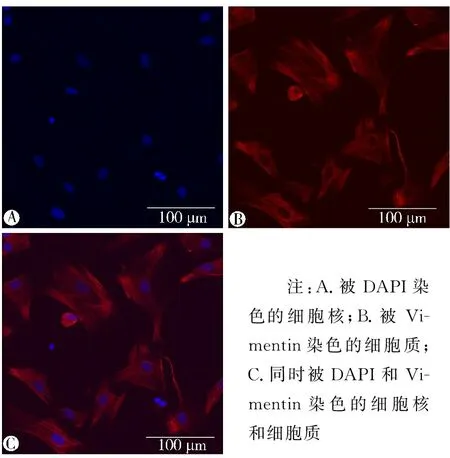
注:A.被DAPI染色的细胞核;B.被Vi-mentin染色的细胞质;C.同时被DAPI和Vi-mentin染色的细胞核和细胞质图1 原代心肌成纤维细胞纯度(免疫荧光染色,10×20倍)

图2 原代心肌成纤维细胞成活率(台盼蓝染色,10×20倍)
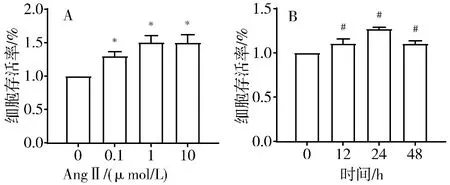
注:与0 μmol/L AngⅡ组比较,*P<0.05;与1 μmol/L AngⅡ刺激0 h组比较,#P<0.05图3 不同浓度AngⅡ刺激24 h(A)和1 μmol/L AngⅡ刺激不同时间(B)后原代心肌成纤维蛋白表达水平比较

注:A.正常组(0 μmol/L AngⅡ刺激24 h);B. 模型组(1 μmol/L AngⅡ刺激24 h);与正常组比较,#P<0.05图4 原代心肌成纤维细胞中Col-Ⅰ、Col-Ⅲ、α-SMA细胞成活率比较
3.2 二参真武汤含药血清的最佳浓度 随着二参真武汤含药血清浓度升高,原代心肌成纤维细胞活力降低,由于15%和20%二参真武汤含药血清的抑制作用过强,对原代心肌成纤维细胞的伤害过大,故选择10%二参真武汤含药血清进行后续实验。见图5。
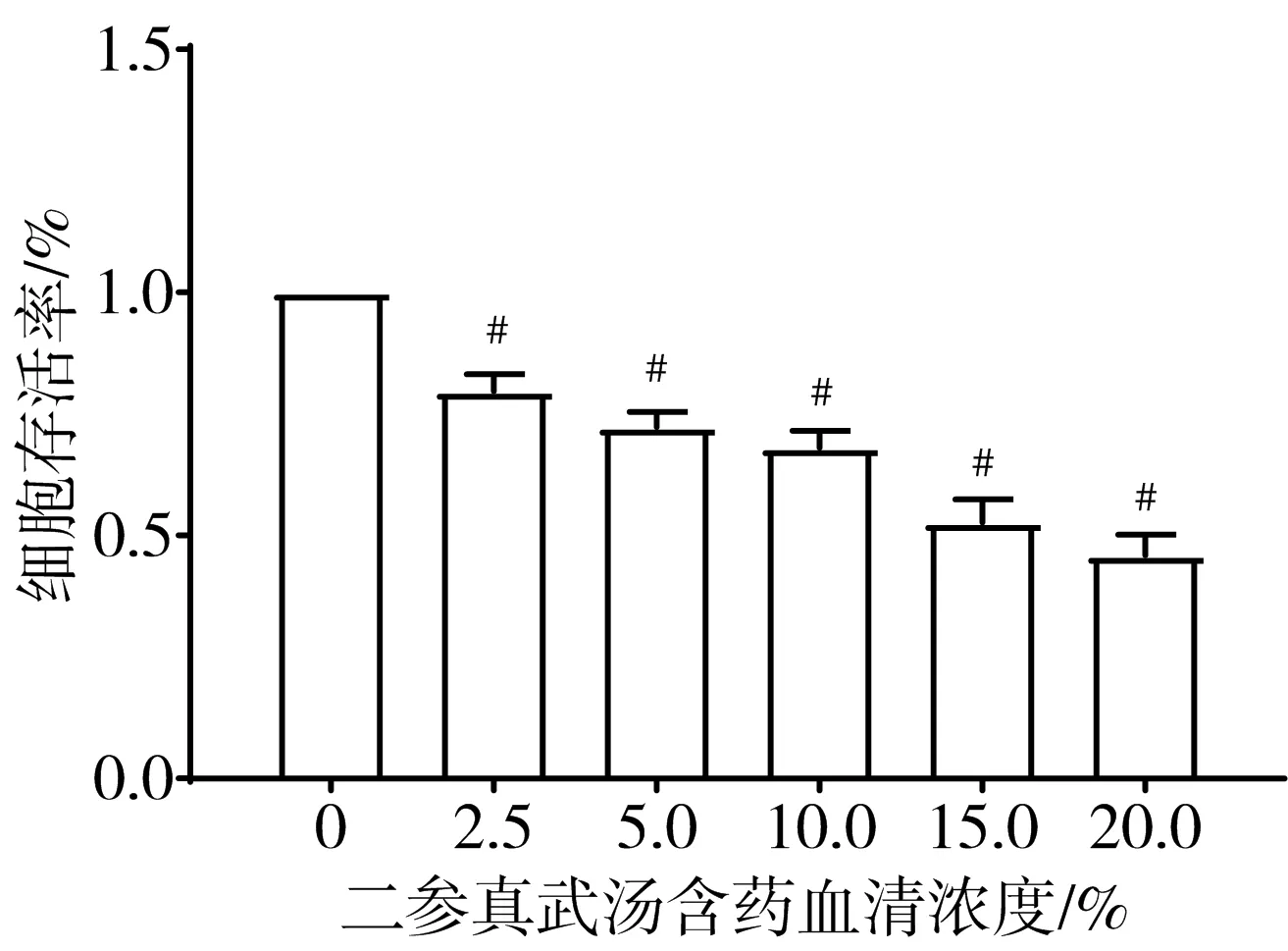
注:与不含二参真武汤含药血清组比较,#P<0.05图5 不同剂量二参真武汤含药血清组原代心肌成纤维细胞活力比较
3.3 ELISA法检测的4组原代心肌成纤维细胞中Col-Ⅰ和Col-Ⅲ含量比较 模型组Col-Ⅰ和Col-Ⅲ含量显著高于正常组(P<0.05),经过10%二参真武汤含药血清处理后,Col-Ⅰ和Col-Ⅲ含量显著降低(P<0.05)。见图6。

注:A.正常组;B.模型组;C.二参真武汤组;D.贝那普利组;与正常组比较,#P<0.05;与模型组比较,*P<0.05图6 4组原代心肌成纤维细胞中Col-Ⅰ、Col-Ⅲ含量比较
3.4 qRT-PCR检测的4组原代心肌成纤维细胞中α-SMA、Col-Ⅰ、Col-Ⅲ mRNA表达水平比较 模型组α-SMA、Col-Ⅰ、Col-Ⅲ mRNA表达水平显著高于正常组(P<0.05),经过10%二参真武汤含药血清处理后,α-SMA、Col-Ⅰ、Col-Ⅲ mRNA显著降低(P<0.05)。见图7。
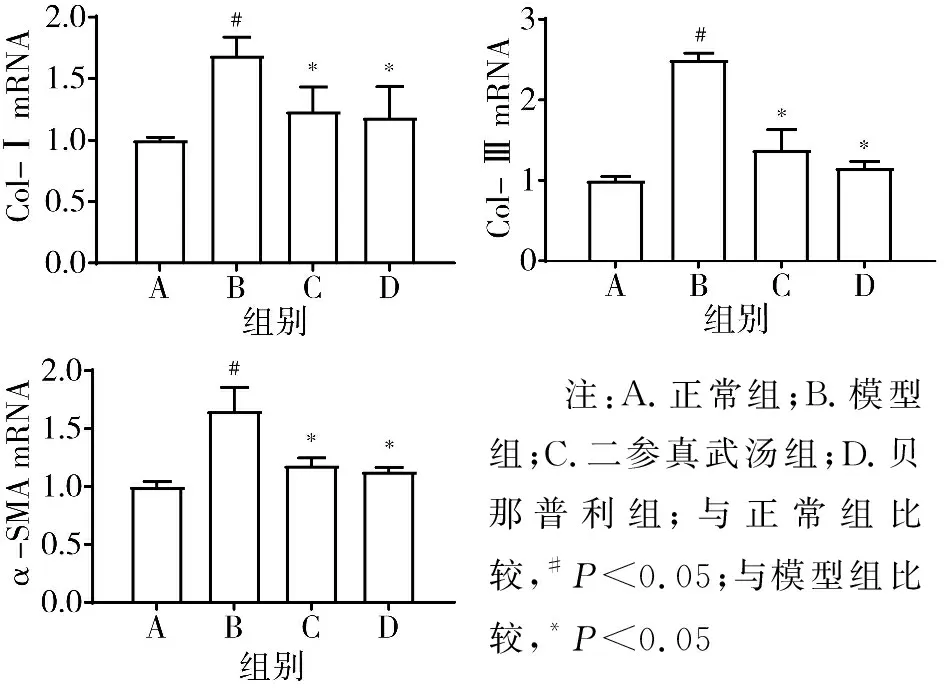
注:A.正常组;B.模型组;C.二参真武汤组;D.贝那普利组;与正常组比较,#P<0.05;与模型组比较,*P<0.05图7 4组α-SMA、Col-Ⅰ、Col-Ⅲ mRNA相对表达水平比较
3.5 Western blot检测的4组原代心肌成纤维细胞中p-PI3K、p-AKT、p-mTOR蛋白表达水平比较 模型组p-PI3K、p-AKT、p-mTOR蛋白表达水平显著高于正常组(P<0.05),经过10%二参真武汤含药血清处理后,p-PI3K、p-AKT、p-mTOR蛋白表达水平显著降低(P<0.05)。见图8。
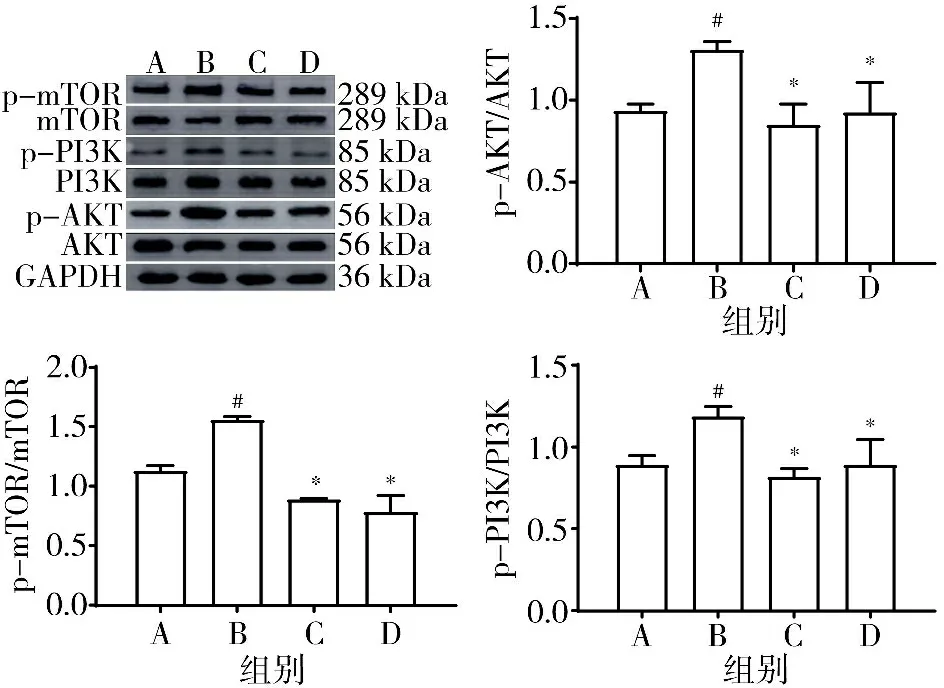
注:A.正常组;B.模型组;C.二参真武汤组;D.贝那普利组;与正常组比较,#P<0.05;与模型组比较,*P<0.05图8 4组原代心肌成纤维细胞中p-PI3K、p-AKT、p-mTOR蛋白表达水平比较
3.6 qRT-PCR检测的4组原代成纤维细胞中PI3K、AKT、mTOR mRNA表达水平比较 模型组PI3K、AKT、mTOR mRNA表达水平均显著高于正常组(P<0.05);经过10%二参真武汤含药血清处理后, PI3K、AKT、mTOR mRNA表达水平均显著下降(P<0.05)。见图9。
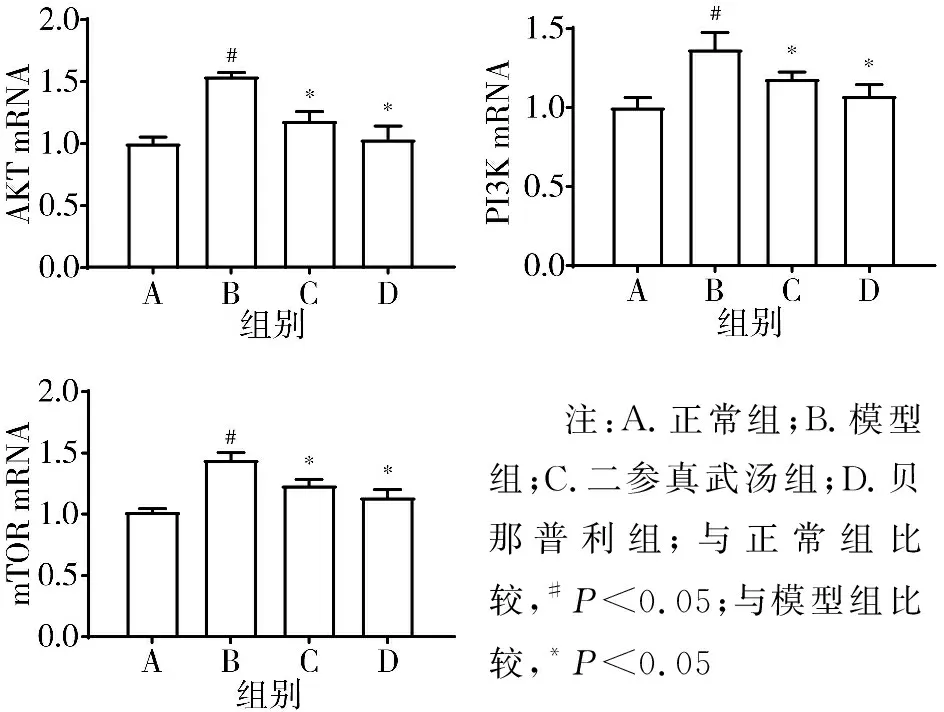
注:A.正常组;B.模型组;C.二参真武汤组;D.贝那普利组;与正常组比较,#P<0.05;与模型组比较,*P<0.05图9 4组原代成纤维细胞中PI3K、AKT、mTOR mRNA表达水平比较
4 讨论
心肌纤维化的主要特征是细胞外基质蛋白在心肌中过度沉积,导致α-SMA的过度表达和胶原的产生,主要为Col-Ⅰ与Col-Ⅲ比值增加[10]。心肌纤维化可使心肌兴奋-收缩耦联失调,损害收缩和舒张功能,从而加快心脏疾病的进展,导致心力衰竭[11]。心脏病尤其是心力衰竭患者心肌纤维化严重程度与死亡率相关。本研究使用AngⅡ刺激原代心肌成纤维细胞建立细胞模型作为研究对象,结果表明,二参真武汤可以降低心肌纤维化细胞的标志因子α-SMA、Col-Ⅰ、Col-Ⅲ的表达水平,产生这种结果的原因可能是二参真武汤可以减少胶原纤维的产生和沉积,抑制心肌成纤维细胞激活,减轻心肌纤维化,二参真武汤可以降低心肌纤维化细胞PI3K/AKT/mTOR信号通路相关蛋白和mRNA表达,改善心肌纤维化。
二参真武汤的有效成分含有三七皂苷,丹参酮,芍药苷,人参皂苷Rg1、Re、Rb1[12]。三七皂苷Rg1可以增加细胞自噬,减少细胞增殖,是调控PI3K/AKT/m TOR信号通路实现的[13]。丹参酮ⅡA可抑制PI3K/AKT/mTOR信号通路,增强自噬,诱发自噬性死亡[14]。芍药苷抑制PI3K/AKT信号通路增加细胞的自噬,减少炎症因子产生[15]。PI3K/Akt/mTOR通路是细胞对细胞外刺激反应的关键细胞级联,越来越多的证据表明,PI3K/Akt/mTOR通路参与细胞增殖、分化、代谢、细胞骨架重组和凋亡[16-17]。AngⅡ刺激原代心肌成纤维细胞,使PI3K增加,激活AKT,使AKT磷酸化,最后激活mTOR,使原代心肌成纤维细胞代谢和生长改变,增加Col-Ⅰ、Col-Ⅲ沉积,最后导致心肌纤维化。使用二参真武汤含药血清干预后,PI3K/AKT/mTOR通路相关蛋白和mRNA表达水平均明显降低。已有研究[18]表明,一些关键分子和信号通路可以调节自噬,其中mTOR可以调节多种细胞信号通路和过程,如细胞凋亡和自噬。本研究发现,用二参真武汤处理的模型细胞中p-PI3K、p-AKT、p-mTOR蛋白表达水平显著降低,心肌纤维化程度减轻,提示二参真武汤通过调控PI3K/AKT/mTOR信号通路增加细胞自噬抑制心肌纤维化。
综上所述,二参真武汤可能是通过调控PI3K/AKT/mTOR信号通路相关蛋白和基因的表达,增加自噬活性,诱导纤维化细胞自噬性死亡来改善心肌纤维化,对纤维化的原代心肌成纤维细胞起到保护作用。
