小鼠中央内侧丘脑-前额叶皮层通路在丙泊酚麻醉中的作用
2023-06-12陈倚秋高敬岩
陈倚秋,高敬岩,付 豹
0 引 言
丙泊酚作为临床常见的全身麻醉药物,其如何可逆性引起意识消失,目前仍不完全清楚。中央内侧丘脑(central medial thalamus, CMT)作为中线核团板内群中的其中之一核团,可接受皮质大脑皮质信息输入,同时也可向皮质投射形成皮质-丘脑-皮质通路,对非快动眼睡眠(non rapid eye movement sleep,NREM)、睡眠恢复和觉醒具有重要作用[1]。本研究前期显示CMT参与丙泊酚麻醉苏醒过程,而具体通路尚不清楚[2-3]。内侧前额叶皮层(medial prefrontal cortex, mPFC)作为执行高级功能的前额叶皮层(prefrontal cortex, PFC)的一部分,在意识形成和维持中具有重要作用。七氟烷麻醉中,mPFC注射卡巴酚可减少进入清醒状态的潜伏期,增加进入清醒状态的时间,扭转麻醉相关特征,从而达到唤醒作用[4-5];除此之外,mPFC的失活可促进七氟烷麻醉诱导并延长麻醉时间[2,6]。此外,作为意识形成的高级中枢,mPFC其与许多与睡眠-觉醒相关核团有广泛的联系[7]。CMT与mPFC之间也存在联系,因此CMT-mPFC通路可能参与丙泊酚麻醉过程[8]。因此,本研究旨在运用钙信号、化学遗传学技术分析CMT-mPFC通路在全身麻醉中的作用。
1 材料与方法
1.1 实验动物及材料健康成年雄性C57BL/6JJ(8-12周龄,20-25 g)小鼠,共40只,购买自湖南斯莱克景达实验动物有限公司,动物许可证号:SCXK(湘)2019-0004。常规饲养1周后开始实验,12 h白天/夜晚轮换人工光照,自由进食进水及活动。丙泊酚(乐维静,国药准字H20030115),氯氮平-N-氧化物(CNO, MedChemExpress),异氟醚(瑞沃德生命科技有限公司),钙信号病毒(rAAV-hSyn-GCaMp6s-WPRE-hGH-polyA,Ca信号病毒,武汉枢密科学技术有限公司),化学遗传激活病毒(rAAV-Efl-DIO-hM3D(Gq)-EGFP-WPRE,M3,武汉枢密科学技术有限公司),化学遗传抑制病毒(rAAV-Efl-DIO-hM4D(Gi)-EGFP-WPREs,M4,武汉枢密科学技术有限公司),特异性化学遗传空病毒(rAAv-Efl-DIO-EGFP-WPRE-pA,武汉枢密科学技术有限公司),逆行标记病毒(AAV2/Retro-rAAV-hSyn-CRE-mCherry-hGH,武汉枢密科学技术有限公司),光纤陶瓷插芯(Fiber Core:200 um,NA:0.37,Fiber Length:2.8 mm,杭州纽顿科技有限公司)。
1.2钙信号模型随机数字选取8只小鼠,以1.4%异氟醚麻醉后持续维持,待呼吸稳定且翻正反射消失(loss of right reflex,LORR)后将其固定于立体定位仪上。剔除头部毛发后碘伏消毒,沿着颅骨中线暴露头皮。根据Bregma和Lambda点进行前后、左右调平,保持颅骨水平。依据小鼠脑图谱,以Bregma点为参照点定位CMT的注射位点(AP:-1.2 mm,ML:0.0 mm,DV:-3.6 mm)和mPFC的注射位点(AP:+1.7 mm,ML:0.3 mm,DV:-2.6 mm)。使用颅骨钻暴露硬脑膜后用针尖戳破硬脑膜,使用棉签清理颅骨孔周围。在CMT处注射病毒,以20 nL/min速度抽取钙信号病毒,以20 nL/min速度向目标脑区注射量为200 nL病毒,注射针原位停留10 min;注射病毒后将光纤陶瓷插芯缓慢插入mPFC区并固定。手术后小鼠独笼饲养,3周病毒转染后进行实验记录。
1.3化学遗传学模型根据注射病毒不同按随机数字表法分成:化学遗传激活组(M3组)、化学遗传抑制组(M4组)、化学遗传空病毒组(对照组),每组8只。按上述方法麻醉和固定小鼠,暴露头皮并进行调平。置入脑电记录电极,采用牙科水泥将电极固定在颅骨表面。手术后小鼠独笼饲养,3周病毒转染后进行实验记录。M3组:在mPFC处注射病毒,以20 nL/min速度抽取M3病毒,以20 nL/min速度注射200 nL病毒到目标脑区,注射针原位停留10 min;在CMT处注射M3病毒,以20 nL/min速度抽取病毒注射到目标脑区,以20 nL/min速度注射200 nL病毒到目标脑区,注射针原位停留10 min,置入脑电记录电极,采用牙科水泥将电极固定在颅骨表面。M4组:在mPFC处注射M4病毒,以20 nL/min速度抽取病毒,以20 nL/min速度注射200 nL病毒到目标脑区,注射针原位停留10 min;在CMT处注射病毒M4病毒,以20 nL/min速度抽取病毒注射到目标脑区,以2 0 nL/min速度注射200nL病毒到目标脑区,注射针原位停留10 min,置入脑电记录电极,采用牙科水泥将电极固定在颅骨表面。对照组:在mPFC处注射病毒,以20 nL/min速度抽取逆行病毒,以20 nL/min速度注射200 nL病毒注射到目标脑区,注射针原位停留10 min;在CMT处注射对照病毒,以20 nL/min速度抽取病毒注射到目标脑区,以20 nL/min速度注射200 nL病毒到目标脑区,注射针原位停留10 min。手术后小鼠独笼饲养,3周病毒转染后进行实验记录。置入脑电记录电极,采用牙科水泥将电极固定在颅骨表面。
1.4光纤钙信号实验在避光条件下,测量原始的光强待基线稳定后,将小鼠在透明诱导箱内适应10 min后,连接跳线与小鼠头部的陶瓷插芯,记录小鼠的光纤信号。清醒状态下记录5 min,然后以20 mg/kg剂量尾静脉单次注射丙泊酚,标记小鼠翻正反射消失(loss of right reflex,LORR)和翻正反射恢复(recovery of right reflex,RORR)时间点,待小鼠RORR后继续记录5 min。LORR定义为将小鼠置于仰卧位,30 s内不能从仰卧位变为俯卧位。RORR定义为小鼠在仰卧位时,5 s内能够恢复正常体位(即四脚同时着地)。选取LORR和RORR两个事件前后100 s时间段:即LORR前100 s即(-100 s)、LORR后100 s(-100-0 s)、RORR前100 s即(-100 s)、RORR后100 s(-100-0 s)四个部分分析Ca2+信号。
1.5化学遗传实验
1.5.1 行为学记录将3组化学遗传模型小鼠在实验前90 min小鼠腹腔注射氯氮平N-氧化物(CNO)1 mg/kg或等渗盐水1 mg/kg(作为自身对照),90 min药物起效高峰开始实验记录。用脑电连接线连接小鼠头部脑电记录板与脑电记录记录系统连续记录脑电信号,观察并记录小鼠RORR时间。RORR时间以停止麻醉注射时间为起点,大鼠翻正反射恢复的时间为终点计算而得。
1.5.2脑电记录实验前30 min时3组化学遗传模型小鼠腹腔注射CNO (1 mg/kg)或等渗盐水(1 mg/kg)(作为自身对照),90 min药物起效高峰后将小鼠放入诱导箱内适应10 min后,以20 mg/kg剂量尾静脉单次注射丙泊酚,使小鼠出现LORR,并且连续记录mPFC脑电活动,观察注射CNO或等渗盐水对小鼠mPFC脑电活动[δ波(1~4 Hz)、θ波(4-8 Hz)、α波(8~12 Hz)、β波(12~25 Hz)、γ波(25~60 Hz)]的影响。待小鼠RORR出现则停止脑电记录。
1.5.3免疫荧光及免疫组化验证待以上实验结束后均进行组织学验证,确定病毒位置是否注射正确。1.4%异氟醚麻醉后,立刻在剑突下取适当的切口,充分暴露小鼠心脏,4%的多聚甲醛灌流固定脑组织,灌流结束后断头咬除颅骨,取出脑组织浸泡在4%多聚甲醛溶液中固定24 h,再将其浸泡在30%葡萄糖溶液中。脑组织沉底后,根据解剖标志确定CMT位置,利用振荡切片机进行冠状位组织切片,厚度为30 μm。将切片置于荧光显微镜下观察病毒注射位置是否正确,将病毒位置准确的数据进行统计学分析,位置不正确的数据舍弃。
1.6分析指标钙信号实验分析指标为Ca+信号指标,选取小鼠单次丙泊酚(20 mg/kg)尾静脉注射后LORR和RORR两个事件前后100 s时间段中四个部分:清醒期,即LORR前100 s(-100 s);麻醉期,LORR后100s(-100-0 s);麻醉期,RORR前100 s(-100 s);苏醒期,RORR后100s(-100-0 s),分析Ca2+荧光信号强度变化。化学遗传实验分析指标包括行为学指标、化学遗传脑电指标。行为学指标:计算RORR时间(以停止麻醉注射时间为起点,小鼠翻正反射恢复的时间为终点计算而得)。化学遗传脑电指标:记录时长以小鼠在诱导箱内适应时间为起点,小鼠翻正反射恢复后5 min为终点。脑电分析包括五个频段,即:δ波(1-4 Hz)、θ波(4-8 Hz)、α波(8-12 Hz)、β波(12-25 Hz)、γ波(25-60 Hz)。

2 结 果
2.1 丙泊酚麻醉对CMT-mPFC通路钙信号的影响在丙泊酚诱导至LORR过程中,与苏醒期比较,丙泊酚麻醉期Ca+信号明显升高(P<0.01);丙泊酚麻醉至RORR期间,与丙泊酚麻醉期比较,苏醒期Ca+信号明显上升(P<0.05)。见图1。

a、b、c:分别为LORR时的线图、热图及钙信号变化;d、e、f、:分别为RORR后的线图、热图及钙信号变化
2.2化学遗传调控CMT-mPFC通路在丙泊酚中的作用
2.2.1 激活CMT-mPFC通路在丙泊酚中的作用M3组注射CNO后,RORR时间较对照组注射CNO后明显缩短(P<0.001),脑电图的δ波频段较对照组注射CNO后的功率降低(P<0.05)。M3组注射等渗盐水后,RORR时间较注射CNO后明显延长(P<0.05 ),脑电图的δ波、θ波频段的功率较注射CNO后升高(P<0.01),脑电图的γ波功率较注射CNO后降低(P<0.05)。见表1、表2。
2.2.2抑制CMT-mPFC通路在丙泊酚中的作用M4组注射CNO后脑电图的δ波频段较对照组注射CNO后的功率增加(P<0.01)。M4组注射等渗盐水后,RORR时间较注射CNO后明显缩短(P<0.05 ),脑电图δ波频段的功率较注射CNO后降低(P<0.05),脑电图β波、γ波频段的功率较注射CNO后升高(P<0.01)。见表1、表2。化学遗传实验结束后,将小鼠灌注取脑,荧光显微镜下可观察到实验小鼠注射的化学遗传病毒位置在CMT脑区,证明位置正确。见图2。
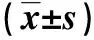
表 1 各组注射CNO、等渗盐水的LORR时间比较
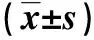
表 2 各组注射CNO、等渗盐水前后脑电的比较

a:CMT注射化学遗传病毒;b:mPFC投射至CMT处逆行病毒;c:化学遗传病毒与逆行病毒共染
3 讨 论
CMT作为中线丘脑中一个重要的核团,研究发现,CMT的损伤与觉醒、认知和睡眠障碍有关[1]。在丙泊酚麻醉大鼠的CMT中注射去甲肾上腺素(norepinephrine,NE)时候发现,增加皮层脑电θ波频率,从而加速大鼠皮层脑电的觉醒[9]。除此之外,其参与维持觉醒及全身麻醉,当激活CMT神经元时,可促进非快速眼动睡眠(non-rapid eye movements, NREM)向清醒状态转变[10-11]。
mPFC作为大脑皮层重要组成部分,研究发现在全身麻醉或深度睡眠时,mPFC的活动减少;且前额叶皮质失活可延迟七氟醚麻醉的苏醒[6,12]。作为mPFC的亚结构边缘前皮层(prelimbic cortex,PL)和边缘下皮层(infralimbic cortex ,IL)可接受从中线丘脑(midline thalamus,MT)区域接收功能输入[13]。而丙泊酚诱导的意识下降可造成额叶网络中的皮质皮质和丘脑皮层连通性降低[14]。最近一项研究表明,丘脑与内侧前额叶的功能连接在在丙泊酚麻醉期间减少最多[15]。既往研究发现CMT与mPFC之间存在投射关系[8]。本研究进一步发现CMT-mPFC通路中神经元参与丙泊酚麻醉过程。本研究首先采用钙信号方法来检测在丙泊酚麻醉期间该通路中神经元是否会有变化。由实验结果可以看出, CMT-mPFC通路中神经元在丙泊酚麻醉时出现钙信号活性的降低,而在之后苏醒阶段中,钙信号的活性上升。因此认为CMT-mPFC通路中神经元活性在丙泊酚麻醉过程中有变化。
本研究采用化学遗传方法进一步调控CMT-mPFC通路中的神经元,为研究CMT-mPFC通路中神经元在丙泊酚麻醉中对小鼠的行为学和皮层脑电的影响。可发现尽管从组织学层面证明CMT-mPFC存在投射关系,但无论是激活还是抑制CMT-mPFC通路中神经元,对小鼠行为学的影响并不是很大,这可能是因为CMT作为丘脑非特异性核团之一,其可以向纹状体提供最重的丘脑输入,但是对皮质的投射相对较弱的原因[16-20]。这一点与本研究荧光染色图所表述的相一致;除此之外,脑中众多核团在麻醉中也具有促苏醒的作用,这也可能麻醉调节也受到其他核团的调控[21]。因而尽管CMT-mPFC通路会对麻醉有所影响,但可能不是发挥主要作用的通路。
而小鼠除了行为学变化外,激活或抑制CMT-mPFC通路神经元时可皮层脑电的变化;当激活CMT-mPFC通路神经元时,可降低θ波的功率,增加γ波的功率。然而,抑制CMT-mPFC通路神经元时,可使皮层脑电中的δ功率显著增加,β波和γ波功率降低。这些数据表明无论是激活还是抑制CMT-mPFC通路神经元,都可以对于丙泊酚麻醉时皮层脑电产生影响。这可能是因为CMT在睡眠和睡眠恢复期间分别控制额叶和全脑皮层活动,从而实现对睡眠慢波和从NREM睡眠中觉醒的双重控制;然而本研究也发现在化学遗传抑制CMT-mPFC通路后,脑电变化并不是很明显;除此之外,在病毒位置验证图上,mPFC向下传递的神经元并不是很多,因而认为CMT-mPFC通路神经元在对于丙泊酚麻醉并不是必要的。
而本实验也存在一些局限性。首先,实验过程中只是记录了单次给予丙泊酚后,观察小鼠的RORR的变化,忽略了小鼠在LORR阶段脑电行为学以及钙信号的变化。并且在实验中对于小鼠行为学的检测并没有结合肌电图进一步的判断,这会使行为学实验可能存在一些主观性。综上所述,本研究结果显示CMT-mPFC通路参与丙泊酚麻醉恢复的调节,激活CMT-mPFC通路可促进麻醉的恢复,对抑制CMT-mPFC通路可延迟麻醉恢复,但是它的进一步的机制有待进一步研究。
