新疆枸杞子不同商品等级规格内涵研究
2023-06-11高学侠王斌林钦贤梁伟龙康志英郭长达吴振斌
高学侠 王斌 林钦贤 梁伟龙 康志英 郭长达 吴振斌
摘要 [目的]探究新疆枸杞子不同商品等级规格与质量的内在关系。[方法]首次应用现代科学技术,以多成分含量为指标,测定不同等级规格的枸杞子中总灰分、浸出物、枸杞多糖、甜菜碱、总糖、氨基酸、蛋白质、脂肪、二氧化硫残留量等指标含量,综合评价新疆枸杞子的不同等级间质量差异。[结果]新疆枸杞子总灰分、二氧化硫残留量均超出药典标准,且与其等级高低无相关性,浸出物、总糖含量与等级呈正相关,枸杞多糖、甜菜碱、氨基酸、蛋白质、脂肪含量与等级总体呈负相关。[结论]利用质量指标的方法评价枸杞子与传统分级具有一定的相关性,以外观形状结合内在质量指标来划分枸杞子商品等级的方法更科學、可靠。
关键词 新疆枸杞子;商品等级规格;含量测定;综合评价;相关性
中图分类号 R284.1 文献标识码 A
文章编号 0517-6611(2023)10-0162-05
doi:10.3969/j.issn.0517-6611.2023.10.036
Abstract [Objective]To explore the intrinsic relationship between different commodity grades and quality of Lycium barbarum fruit in Xinjiang.[Method]For the first time,combining modern science and technology,with multicomponent as the indicator,the contents of total ash,extract,Lycium barbarum polysaccharide (LBP),betaine,total sugar,amino acids,protein,fat and sulfur dioxide residue in Lycium barbarum fruit of different commodity grades were determined,and the quality differences between different grades of Lycium barbarum fruit in Xinjiang were comprehensively evaluated.[Result]The contents of total ash and sulfur dioxide of Lycium barbarum fruit in Xinjiang exceeded the pharmacopeia standard and were not correlated with the grades.The contents of extract and the total sugar and the grades were positively correlated,and overall,the contents of LBP,betaine,amino acids,protein and fat were negatively correlated with the grades.[Conclusion]There is a certain correlation between using quality index to evaluate Lycium barbarum fruit and traditional grading,and the method of dividing Lycium barbarum fruit commodity grades by combination of appearance and shape combined with intrinsic quality index is more scientific and reliable.
Key words Lycium barbarum fruit in Xinjiang;Commodity grades and specifications;Content determination;Comprehensive evaluation;Correlation
枸杞子为茄科枸杞属植物宁夏枸杞(Lycium barbarum L.)的干燥成熟果实,具有益精明目、滋补肝肾的功用,用于腰膝酸软、眩晕耳鸣、阳痿遗精、虚劳精亏、内热消渴、目昏不明[1-3],主产于宁夏、青海、新疆及甘肃等地[4-10]。枸杞子作为药食两用的药材,有悠久的临床应用历史,新疆作为枸杞子主产区之一,已具备一定种植规模,产量也逐年增长,然而鲜有新疆枸杞子商品规格的研究报道。该研究通过对新疆枸杞子的枸杞多糖、甜菜碱、总糖、蛋白质及氨基酸等有效成分进行含量测定,并检测其二氧化硫残留量等安全性指标,通过对不同等级规格的新疆枸杞子进行质量综合研究,探索枸杞子不同等级规格与其质量之间的内在关系。
1 仪器与材料
1.1 仪器 戴安Ultimate 3000液相色谱仪(赛默飞世尔科技有限公司);安捷伦1200液相色谱仪(美国安捷伦科技有限公司);XS204型、MS603S型电子天平(瑞士梅特勒-托利多);HWS28型电热恒温水浴锅(上海一恒科学仪器有限公司);DHG-9245A型电热鼓风干燥箱(上海一恒科学仪器有限公司);SXL-1208马弗炉(上海精宏实验设备有限公司);TU-1901双光束紫外可见分光光度计(北京普析通用仪器有限责任公司)。
1.2 材料
D-无水葡萄糖对照品(批号110833-202109,中国食品药品检定研究院,含量以99.9%计);甜菜碱对照品(批号110894-202105,中国食品药品检定研究院,含量以98.5%计);氨基酸对照品(批号14001,中国计量科学研究院);异硫氰酸苯酯、三乙胺、正己烷、乙腈等均为色谱纯;甲醇、乙醚等其余试剂均为分析纯;超纯水。根据枸杞子的采收期,于2020年8月份实地采收新疆产区枸杞子,经亳州市沪谯药业郭长达高级工程师鉴定均为真品。根据《七十六种药材商品规格标准》[11],结合GB/T 18672—2014《枸杞》[12]对枸杞子进行等级划分,详细信息及各等级性状见表1。
2 方法与结果
2.1 总灰分、浸出物含量、二氧化硫残留量的测定 参照《中国药典》2020年版[1],分别测定新疆不同等级枸杞子总灰分、浸出物含量、二氧化硫残留量,结果见表2。从表2可以看出,浸出物符合要求,总灰分、二氧化硫残留量均超出药典标准。
2.2 枸杞多糖的含量测定
2.2.1 对照品溶液的制备。取D-无水葡萄糖对照品约25.0 mg,精密称定,置于250 mL容量瓶中,加入超纯水适量,稀释至刻度,摇匀,即得。
2.2.2 标准曲线的绘制。精密量取葡萄糖对照品溶液0.2、0.4、0.6、0.8、1.0 mL分别置于具塞试管中,分别加入超纯水补至2.0 mL,再精密加入5%苯酚溶液1 mL,振荡摇匀,迅速精密加入硫酸5 mL,振荡摇匀,于试验台上静置10 min,置40 ℃恒温水浴锅中再保温15 min,取出,迅速冷却至室温(25 ℃),以相应的试剂为空白,按照UV-Vis法,在波长为490 nm处测定其吸光度,以葡萄糖浓度为横坐标(X)、吸光度为纵坐标(Y)绘制标准曲线,得出回归方程为Y=16.159 47X+0.145 04(R2=0.999 5),表明葡萄糖浓度在25~125 μg/mL呈良好的线性关系。
2.2.3 含量测定。取样品粗粉约0.5 g于锥形瓶中,精密称定,加入乙醚约100 mL,于恒温水浴锅中加热回流提取1 h,静置冷却至室温,弃去乙醚液,残渣置于恒温水浴锅上挥干乙醚。再次加入80%乙醇溶液约100 mL,于恒温水浴锅中加热回流提取l h,趁热滤过,滤渣与滤器用温热的80%乙醇溶液多次洗涤,每次约30 mL,滤渣连同滤纸置于锥形瓶中,加入超纯水约150 mL,于恒温水浴锅中加热回流提取2 h。趁热滤过,用少量的热水冲洗过滤器,每次约30 mL,合并滤液与洗液,静置放冷,转移至250 mL容量瓶中,用超纯水稀释至刻度,摇匀静置,精密移取1 mL溶液,置于具塞试管中,精密加入超纯水1.0 mL,根据“2.2.2”项下的方法,自“精密加入5%苯酚溶液1 mL”起测定其吸光度,从标准曲线上读出供试品溶液中葡萄糖的重量(mg),计算样品中枸杞多糖的含量,结果见表2。由表2可知,各等级枸杞子枸杞多糖含量均符合药典标准,并以特优级枸杞子枸杞多糖含量最低,乙级含量最高。
2.3 甜菜碱的含量测定
2.3.1 供试品溶液的制备。取样品粗粉约2 g于锥形瓶中,精密称定,加入80%甲醇溶液约50 mL,称定重量,超声(500 W,40 kHz)处理30 min,冷却至室温(25 ℃),再称定重量,用80%甲醇溶液补足其减失的重量,摇匀,用0.22 μm滤膜滤过,即得。
2.3.2 对照品溶液的制备。取甜菜碱对照品适量,精密称定,加甲醇制成浓度为1.0 mg/mL的对照品溶液,即得。
2.3.3 色谱条件。色谱柱为Venusil HILIC(4.6 mm×250 mm,5 μm);流动相为乙腈(A)-10 mmol/L甲酸铵(pH 3.0)(B)85∶15;流速1.0 mL/min;柱温30 ℃;进样量10 μL;检测器为蒸发光散射检测器(ELSD)。分别精密吸取对照品溶液5、10 μL 与供试品溶液10 μL,注入液相色谱仪,分别连续进样3次,取3次平均值测定,以外标两点法对数方程计算含量,即得。
2.3.4 精密度试验。精密吸取甜菜碱对照品溶液10 μL,按“2.3.3”色谱条件连续进样6次,分别记录甜菜碱对照品的峰面积,以其峰面积计算RSD。结果发现,甜菜碱峰面积的RSD为1.4%,表明该仪器的精密度良好。
2.3.5 重复性试验。取同一批枸杞子粉末,精密称定6份,按“2.3.1”方法制备供试品溶液,按“2.3.3”色谱条件进样测定,记录甜菜碱的峰面积。结果发现,甜菜碱峰面积的RSD为1.3%,表明该方法重复性良好。
2.3.6 稳定性试验。取同一批枸杞子粉末按“2.3.1”方法制备供试品溶液,按“2.3.3”色谱条件分别于0、2、4、8、12、24 h进样检测,记录甜菜碱峰面积并计算甜菜碱含量。结果发现,甜菜碱峰面积的RSD为1.0%,表明样品溶液在24 h内基本稳定。
2.3.7 耐用性试验。
2.3.7.1 柱温的考察。取同一份样品,分别按“2.3.3”色谱条件进样分析,柱温分别设置为25、30、35 ℃,记录相应色谱图,结果显示不同柱温条件下,甜菜碱的分离度和峰形无明显变化,可见柱温的波动对该色谱条件下枸杞子甜菜碱的检测无明显影响。综合考虑,选择30 ℃作为最终的测定温度。
2.3.7.2 流速的考察。取同一份样品,分别按“2.3.3”色谱条件进样分析,流速分别设置为0.8、1.0、1.2 mL/min,记录相应色谱图,结果显示不同流速条件下,甜菜碱的分离度和峰形无明显变化,可见流速的波动对该色谱条件下枸杞子甜菜碱的检测无明显影响。综合考虑,选择1.0 mL/min作为流速。
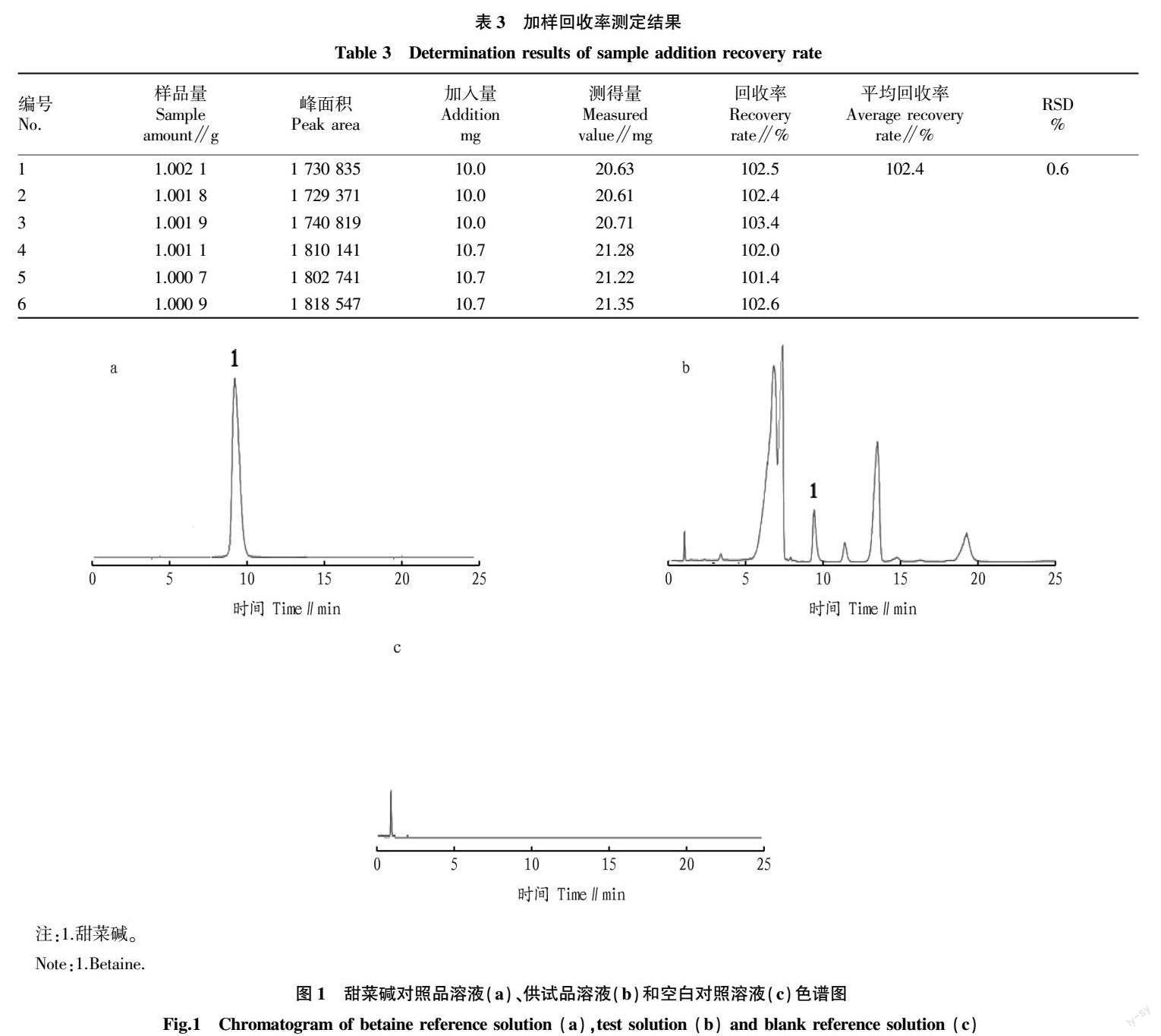
2.3.8 加样回收率。精密称取同一批已知含量的样品粉末约1 g,分别精密加入等量的甜菜碱对照品,按“2.3.1”方法制备供试品溶液,按“2.3.3”色谱条件进样测定,计算回收率,结果见表3。从表3可以看出,平均回收率为102.4%,RSD为0.6%,表明该方法回收率良好、方法准确。
2.3.9 含量测定。按“2.3.1”方法制备各样品溶液,按“2.3.3”色谱条件进样测定甜菜碱含量(表2),其中甜菜碱对照品溶液、供试品溶液、空白对照溶液色谱图见图1。由表2可知,各等级枸杞子甜菜碱含量均符合药典标准,并以特优级枸杞子含量最低,乙级含量最高。
2.4 总糖的含量测定
2.4.1 供试品溶液的制备。取样品粗粉约2.5 g,精密称定,置于250 mL容量瓶中,加入超纯水至容积约为200 mL,置(80±2)℃恒温水浴锅中保温30 min,期间摇动多次,取出,放冷至室溫,加入乙酸锌及亚铁氰化钾溶液各5 mL,摇匀,用超纯水定容至刻度,过滤,滤液备用。移取滤液50 mL于100 mL 容量瓶中,加入6 mol/L盐酸溶液10 mL,在75~80 ℃恒温水浴锅中水解15 min,取出,放冷至室温,加入甲基红指示剂1滴,用200 g/L氢氧化钠溶液中和,再用水定容至刻度,备用[12]。
2.4.2 标定碱性酒石酸铜溶液。精密移取费林试剂甲液、乙液各2.0 mL,置于250 mL锥形瓶中,加入15.0 mL葡萄糖标准溶液,置于小电炉加热煮至沸腾,立即加入亚甲基蓝指示剂5滴,并继续以2~3滴/s的滴速滴定至二价铜离子完全被还原生成砖红色氧化亚铜沉淀,溶液蓝色褪尽为终点,记录消耗葡萄糖标准溶液总体积。
2.4.3 含量测定。精密移取费林试剂甲液、乙液各2.0 mL,置于250 mL锥形瓶中,加入待测液5.0 mL,混合液置于小电炉加热煮沸至沸腾,立即加入亚甲基蓝指示剂5滴,并继续以2~3滴/s的速度滴定至二价铜离子完全被还原成砖红色氧化亚铜沉淀,溶液的蓝色褪尽即为终点,记录消耗的葡萄糖溶液总体积,计算各样品总糖含量,结果见表2。由表2可知,各等级枸杞子总糖含量均符合标准GB/T 18672—2014《枸杞》,并以特优级枸杞子总糖含量最高,乙级含量最低。
2.5 蛋白质的含量测定
2.5.1 供试品溶液的制备。取样品粗粉约2 g,精密称定,置于干燥的定氮瓶中,分别加入0.2 g硫酸铜、6 g硫酸钾、20 mL 硫酸溶液,轻轻振荡摇匀后于瓶口放一小漏斗,将瓶以45°角斜支于有小孔的石棉网上。缓慢加热,待里面的内容物全部炭化,泡沫完全停止后,逐渐加强火力,保持瓶内的液体微沸状态,直至液体变成蓝绿色并澄清透明后,再继续加热0.5~1.0 h,取下,冷却至室温,加入20 mL超纯水。冷却,转移至100 mL容量瓶中,并用少量超纯水冲洗定氮瓶,洗液并入容量瓶中,再加入超纯水至刻度,摇匀后备用,同时做试剂空白试验。
2.5.2 含量测定。向定氮蒸馏装置的水蒸气发生器内装入超纯水至2/3处,加入玻璃珠数粒,再加入甲基红乙醇溶液几滴及硫酸溶液几毫升,目的是保持水呈酸性,加热煮沸水蒸气发生器内的水并保持沸腾状态。向接收瓶内准确移取硼酸溶液10.0 mL及混合指示液1~2滴,并使冷凝管的下端插入至液面下方,根据试样中氮的含量多少,精密移取试样处理液2.0~10.0 mL由小玻杯注入反应室中,以10 mL超纯水冲洗小玻杯并使之流入到反应室内,接着塞紧棒状玻塞。之后将氢氧化钠溶液10.0 mL倒入小玻杯,提起玻塞使其缓缓流入反应室中,马上将玻塞盖紧,并加入超纯水于小玻杯以防漏气。夹紧螺旋夹,开始进行蒸馏。蒸馏10 min后挪动蒸馏液接收瓶,液面随即离开冷凝管的下端,再蒸馏1 min。接着再用少量的超纯水洗涤冷凝管下端外部,取下蒸馏液接收瓶。用盐酸标准滴定溶液滴定至终点,同时作试剂空白。计算各枸杞子样品蛋白质含量,结果见表2。由表2可知,特优级枸杞子蛋白质含量最低,乙级含量最高,特级与甲级差别不大。
2.6 氨基酸的含量测定
2.6.1 色谱条件。色谱柱为月旭 Amino Acid(4.6 mm×250 mm,5 μm);流动相A为0.1 mol/L醋酸钠溶液(pH 6.5)∶乙腈=93∶7,流动相B为水∶乙腈=20∶80,梯度洗脱,洗脱程序见表4;流速1.0 mL/min;柱温40 ℃;进样量1 μL;检测波长254 nm。
2.6.2 衍生试剂的制备。衍生试剂A(PITC):精密移取0.3 mL PITC,置于25 mL棕色容量瓶中,用乙腈稀释至刻度,得到浓度为0.1 mol/L的溶液,摇匀即得,于4 ℃密封保存;衍生试剂B(三乙胺):精密移取1.38 mL三乙胺溶液,置于10 mL棕色容量瓶中,用乙腈溶液稀释至刻度,得到浓度为1 mol/L 的溶液,摇匀即得,于4 ℃密封保存。
2.6.3 对照品溶液的制备。精密移取1 mL对照品溶液,用超纯水溶解于10 mL棕色容量瓶中,用超纯水稀释至刻度,摇匀即得。精密移取对照品溶液1 mL,置于具塞试管中,分别加入“2.6.2”衍生试剂A、B溶液各0.5 mL,摇匀,于室温下静置放置60 min,取出,加入正己烷溶液2 mL振摇10 s,静置60 s后,用孔径为0.45 μm滤膜过滤,取澄清的下层液进行分析试验。
2.6.4 供试品溶液的制备。取样品粗粉0.5 g,精密称定,在水解管内加6 mol/L盐酸溶液15 mL,之后将水解管转移放入冷冻剂(食盐∶冰=1∶3)中,冷冻5 min,然后接到真空泵的抽气管上,抽取空气成真空状态,再充入高纯氮气;再抽真空填充满氮气,重复操作3次,在充氮气的状态下拧紧其螺丝盖,将密封好的水解管放入在(110±1)℃的恒温干燥箱内,水解22 h后,取出放冷。打开水解管,将水解液过滤后,用去离子水重复多次洗涤水解管,将水解液全部转移到50 mL容量瓶内,再用去离子水定容至刻度。精密移取滤液2 mL于茄形瓶中,用旋转蒸发仪蒸发至干,残留物用2 mL超纯水溶解,再旋干,反复进行2次至蒸干,用超纯水2 mL使其溶解,并转入至10 mL容量瓶中,用超纯水定容至刻度。供试品的衍生步骤与对照品一致。同“2.6.3”项下“精密移取供试品溶液1 mL,置于具塞试管中……取澄清的下层液进行分析试验”。
2.6.5 线性关系的考察。分别精密移取对照品母液0.5、1.0、1.5、2.0、2.5、3.0 μL注入液相色谱仪中,记录各氨基酸的峰面积,再以各氨基酸的峰面积为纵坐标(Y)、氨基酸含量为横坐标(X),绘制其标准曲线,进行线性回归。其中16种氨基酸的决定系数(R2)≥0.999 0,表明各成分在其线性范围内线性关系良好。其中各个氨基酸标准曲线及线性范围分别为:①门冬氨酸Y=9 399X + 0.32,R2=0.999 1,线性范围为1.697 0~10.182 2 ng;②谷氨酸Y=9 097X + 0.44,R2=0.999 5,线性范围为1.839 1~11.034 8 ng;③丝氨酸Y=14 259X-0.426,R2=0.999 4,线性范围为1.313 6~7.881 8 ng;④甘氨酸Y=21 170X-0.886,R2=0.999 1,线性范围为0.957 1~5.742 9 ng;⑤组氨酸Y=9 219X-0.353,R2=0.999 5,线性范围为1.937 5~11.625 0 ng;⑥精氨酸Y=8 122X-0.086,R2=0.999 2,线性范围为2.199 3 ~13.195 6 ng;⑦苏氨酸Y=10 788X-0.053,R2=0.999 2,线性范围为1.489 0~8.934 0 ng;⑧丙氨酸Y=16 259X-0.373,R2=0.999 0,线性范围为1.135 9~6.815 4 ng;⑨脯氨酸Y=16 000X-0.640,R2=0.999 1,线性范围为1.439 1~8.6348 ng;⑩酪氨酸Y=9 430X-1.326,R2=0.999 3,线性范围为2.287 6~13.725 9 ng;B11缬氨酸Y=14 442X-0.513,R2=0.999 4,线性范围为1.449 7~8.698 4 ng;B12蛋氨酸Y=11 210X-0.046,R2=0.999 1,线性范围为1.865 1~11.190 8 ng;B13异亮氨酸Y=13 190X-1.060,R2=0.999 0,线性范围为1.672 4~10.034 5 ng;B14亮氨酸Y=12 370X-0.153,R2=0.999 1,線性范围为1.688 9~10.133 6 ng;B15苯丙氨酸Y=10 434X-0.593,R2=0.999 0,线性范围为2.064 9~12.389 2 ng;B16赖氨酸Y=20 041X-2.013,R2=0.999 0,线性范围为1.827 4~10.964 2 ng。
2.6.6 精密度试验。精密移取“2.6.3”对照品溶液1 μL,按“2.6.1”色谱条件连续进样6次,记录各氨基酸峰面积,以其峰面积计算RSD。结果发现16种氨基酸的峰面积RSD均符合要求,表明该试验仪器精密度良好。
2.6.7 重复性试验。取样品粉末,精密称定6份,按“2.6.4”方法制备各样品溶液,按“2.6.1”色谱条件进样测定,记录各氨基酸峰面积,以各氨基酸含量计算RSD,结果发现16种氨基酸的峰面积RSD均符合要求,表明该方法具有良好的重复性。
2.6.8 稳定性试验。按“2.6.4”方法制备供试品溶液,按“2.6.1”色谱条件分别于0、2、4、8、12、24 h重复进样,测得各氨基酸峰面积,以其峰面积计算RSD,结果发现,蛋氨酸由于含量低误差较大,其余各氨基酸峰面积的RSD均符合要求,表明该供试品在24 h内稳定性良好。
2.6.9 含量测定。按“2.6.4”方法制备各样品溶液,按“2.6.1”色谱条件进样测定氨基酸含量(表2),其中氨基酸对照品溶液、供试品溶液色谱图见图2。由表2可知,特优级枸杞子氨基酸含量最低,乙级含量最高,特级与甲级差别不大。
2.7 脂肪的测定
取样品粗粉约4 g,精密称定,置于尼龙纱布中,包扎好后,置于索氏提取器中,加入乙醚至瓶内容积的2/3处,于恒温水浴锅上加热回流,使乙醚溶液不断提取(6~8次/h),抽提6~8 h,回收溶剂至干,用乙醚溶液溶解,转移至已恒重的蒸发皿中,于(100±5)℃干燥器中干燥2 h,放干燥器内冷却0.5 h后称定重量。重复以上操作直至恒量,计算样品中脂肪含量,结果见表2。由表2可知,特优级枸杞子脂肪含量最低,乙级含量最高,不同等级脂肪含量差别较大。
2.8 统计分析 根据各指标成分测定结果(表2),采用SPSS统计分析软件对不同等级规格的新疆枸杞子進行主成分分析,由特征值及方差贡献率结果(表5)可知,前2个特征值>1,其累计方差贡献率可达95.727%,故提取2个主成分(F1、F2)以评价不同等级规格枸杞子综合质量情况,结果见表6。
3 讨论与结论
该研究建立的HPLC-ELSD法测定枸杞子中甜菜碱的含量方法学考察均符合要求,其中,供试品制备方法采用超声法,相对于2015、2020年版《中国药典》枸杞子甜菜碱含量项下所规定的薄层色谱扫描法(TLCS法)、固相萃取法操作更加简单且快速高效、准确度高、重现性好。
从检测结果发现,枸杞子中浸出物、总糖含量与等级呈正相关,即规格等级越高,浸出物和总糖含量也越高。枸杞多糖、甜菜碱、氨基酸、蛋白质和脂肪含量与等级总体呈负相关,即规格等级越高,含量反而低。主成分分析结果显示,乙级枸杞子综合得分最高,多项检测指标结果最优,表明枸杞子质量并非外观越好(粒径越大),质量越佳,药材质量优劣除了外观性状,还需结合内在质量进行综合评价。
另外,总灰分及二氧化硫残留量均超出《中国药典》标准且与等级高低无相关性,结合实地走访调研,目前新疆枸杞子标准化生产不规范、深加工能力不足,总灰分、二氧化硫残留量易超标,对新疆枸杞子的市场影响力、竞争力及国外市场开拓都是不利的因素。只有充分发挥自身优势,走标准化道路,强化深加工能力,才能促进新疆枸杞产业快速、健康发展。
该研究在传统枸杞子等级规格划分方法的基础上,结合现代科学技术,首次增加现代科学内涵(如总糖、蛋白质、氨基酸、脂肪等含量)评价不同等级枸杞子的质量,使饮片等级划分更具科学性,而且给中药饮片的研究、生产、经营与管理等带来了极大的方便,也为市场上饮片优质优价管理提供理论支撑。中药材商品规格等级是在商品交易过程中逐步形成的,而目前所使用的《七十六种药材商品规格标准》制定至今已有30余年,许多药材商品规格标准已经与现在市场常见药材规格出现偏离,同时,中药材等级规格的制定应视具体品种而定,不同产地、品系、采收季节出现的性状差异难以通过标准准确表征[13],不应只看外观,更应结合产地、品种、加工、质量指标等因素,才能使中药饮片等级规格划分更合理、科学、规范。
参考文献
[1]国家药典委员会.中华人民共和国药典:2020年版一部[S].北京:中国医药科技出版社,2020:260-261.
[2] 宋艳梅,张启立,崔治家,等.枸杞子化学成分和药理作用的研究进展及质量标志物的预测分析[J].华西药学杂志,2022,37(2):206-213.
[3] 谭真真,刘颖,马丽杰.基于网络药理学的枸杞子药理作用及其机制研究[J].中国医药导刊,2020,22(1):28-33.
[4] 徐春波.本草古籍常用道地药材考[M].北京:人民卫生出版社,2007:177-180.
[5] 王培根.宁夏中宁县枸杞产业竞争力研究[D].杨凌:西北农林科技大学,2013.
[6] 孙正风,王金保,马戈,等.宁夏枸杞主产区环境质量现状评价[J].宁夏农林科技,2003,44(6):69-71.
[7] 董静洲,杨俊军,王瑛.我国枸杞属物种资源及国内外研究进展[J].中国中药杂志,2008,33(18):2020-2027.
[8] 卢有媛,郭盛,张芳,等.枸杞属药用植物资源系统利用与产业化开发[J].中国现代中药,2019,21(1):29-36.
[9] 胡婷婷,刘苏情,沈梦雅,等.枸杞子药食产品现状及发展趋势[J].信阳农林学院学报,2021,31(4):105-109.
[10] 时保国,杨文智.青海省有机枸杞产业发展现状与对策[J].安徽农业科学,2019,47(7):229-231.
[11] 国家医药管理局,中华人民共和国卫生部.七十六种药材商品规格标准[国药联材字(84)第72号文附件][S].国家医药管理局,中华人民共和国卫生部,1984:9.
[12] 中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.枸杞:GB/T 18672—2014[S].北京:中国标准出版社,2014.
[13] 张悦,邓爱平,方文韬,等.果实种子类药材商品规格等级标准:以枸杞子 枳壳 栀子 柏子仁等6种药材为例[J].中国现代中药,2019,21(6):717-722.
