血小板分布宽度与系统性红斑狼疮相关肺动脉高压患者预后的相关性
2023-06-10代萌萌张纯祎高聪聪王倩倩岳润芝姚孟辉郑朝晖
代萌萌,张纯祎,高聪聪,王倩倩,岳润芝,姚孟辉,郑朝晖
(郑州大学第一附属医院 风湿免疫科,河南 郑州 450052)
肺动脉高压(pulmonary arterial hypertension,PAH)是系统性红斑狼疮(systemic lupus erythematosus,SLE)一种常见且严重的并发症,是引起SLE患者死亡的重要原因之一。西方国家系统性硬化症在结缔组织病相关PAH中患病率最高[1],而中国SLE相关PAH(SLE-PAH)最为常见[2]。SLE-PAH起病隐匿,临床表现缺乏特异性,病情进展迅速,致死率高,5 a生存率为68%~84%[3-4]。尽管近年来PAH靶向药物已经取得了重大进展,SLE-PAH患者的预后仍然不佳[4]。因此,探索新型预后标志物对于评估SLE-PAH患者病情、识别高危患者、及时干预治疗并降低死亡风险具有重要意义。血小板分布宽度(platelet distribution width,PDW)代表血小板容积异质性,其水平升高提示外周血中血小板大小悬殊,均一性降低,是衡量血小板活动的有效指标[5]。已有研究报道PDW在心脑血管疾病、自身免疫疾病中的重要作用[6-7]。本研究将评估PDW与SLE-PAH预后的潜在关联,以期为临床诊疗提供有价值的线索。
1 对象与方法
1.1 研究对象选取2014年7月至2021年6月在郑州大学第一附属医院出院时诊断为SLE-PAH的163例患者为研究对象。SLE诊断满足1997年美国风湿病学会修订的SLE分类标准[8];PAH诊断符合右心导管测的海平面静息状态下肺动脉压力≥20 mmHg(1 mmHg=0.133 kPa),肺动脉楔压≤15 mmHg,肺血管阻力≥2 Wood units,或经胸超声心动图(transthoracic echocardiography,TTE)测量肺动脉收缩压高于35 mmHg[9-10]。排除年龄<16岁及合并先天性心脏病、风湿性心脏病、高血压性心脏病、心肌梗死、肺静脉闭塞、肺栓塞、门静脉高压、慢性阻塞性肺疾病、肺恶性肿瘤、血吸虫及左心疾病所致的PAH等,并排除其他结缔组织病相关PAH。
1.2 资料采集采集并汇总入组的163例患者的人口统计学信息、临床表现、实验室常规检查和特殊检查、TTE指标、SLE疾病活动指数(SLE disease activity index,SLEDAI)等临床相关资料进行。随访:患者初次明确诊断后,每3~6个月进行电话或门诊随访。本研究主要随访结局事件为全因死亡,存活者随访日期截至2022年6月30日,其间无患者失访。生存时间定义为患者确诊并入选为研究对象的日期与任何因素所致死亡的日期或随访终止日期的间隔。
1.3 统计学分析采用SPSS 26.0、GraphPad Prism 9.3.1、R语言4.2.2统计软件进行数据处理及分析。采用“survivalROC”R包确定PDW最佳截断值,根据该截断值将PDW转化为分类变量。不符合正态分布的计量资料以中位数及四分位数[M(P25,P75)]表示,组间比较运用Mann-WhitneyU检验;计数资料以频数和百分数(%)表示,组间比较运用χ2检验。采用Kaplan-Meier法计算生存率,采用log-rank法比较组间整体生存率。采用Cox比例风险模型评估SLE-PAH患者基线PDW与预后的关系,单因素分析PDW与其他混杂因素,随后将P<0.05的混杂因素纳入多因素分析进行校正。P<0.05为差异有统计学意义。
2 结果
2.1 根据PDW水平对SLE-PAH患者进行分组根据受试者工作特征(receiver operating characteristic,ROC)曲线,基线PDW第1、3、5年的曲线下面积(area under the curve,AUC)分别为0.754、0.663和0.730,第1、3、5年的最佳截断值均为17.4 fL,根据该临界值将SLE-PAH患者分为两组:PDW≥17.4 fL组(45例)以及PDW<17.4 fL组(118例)。
2.2 相关因素分析163例SLE-PAH患者中女157例,男6例,男女比例约为1∶26.2,发病年龄16~81岁,发病年龄中位数为37.0(30.0,49.0)岁。WHO心功能Ⅲ/Ⅳ级共119例(69.3%),合并浆膜炎共100例(61.1%)。PDW≥17.4 fL的患者罹患神经精神狼疮的比率更高,血红蛋白及血小板水平更低,而红细胞沉降率及SLEDAI水平更高(P<0.05);两组性别、WHO心功能、除神经精神狼疮外其他临床表现、免疫学特征(补体及自身抗体)、TTE指标等比较差异无统计学意义(P>0.05)。见表1。
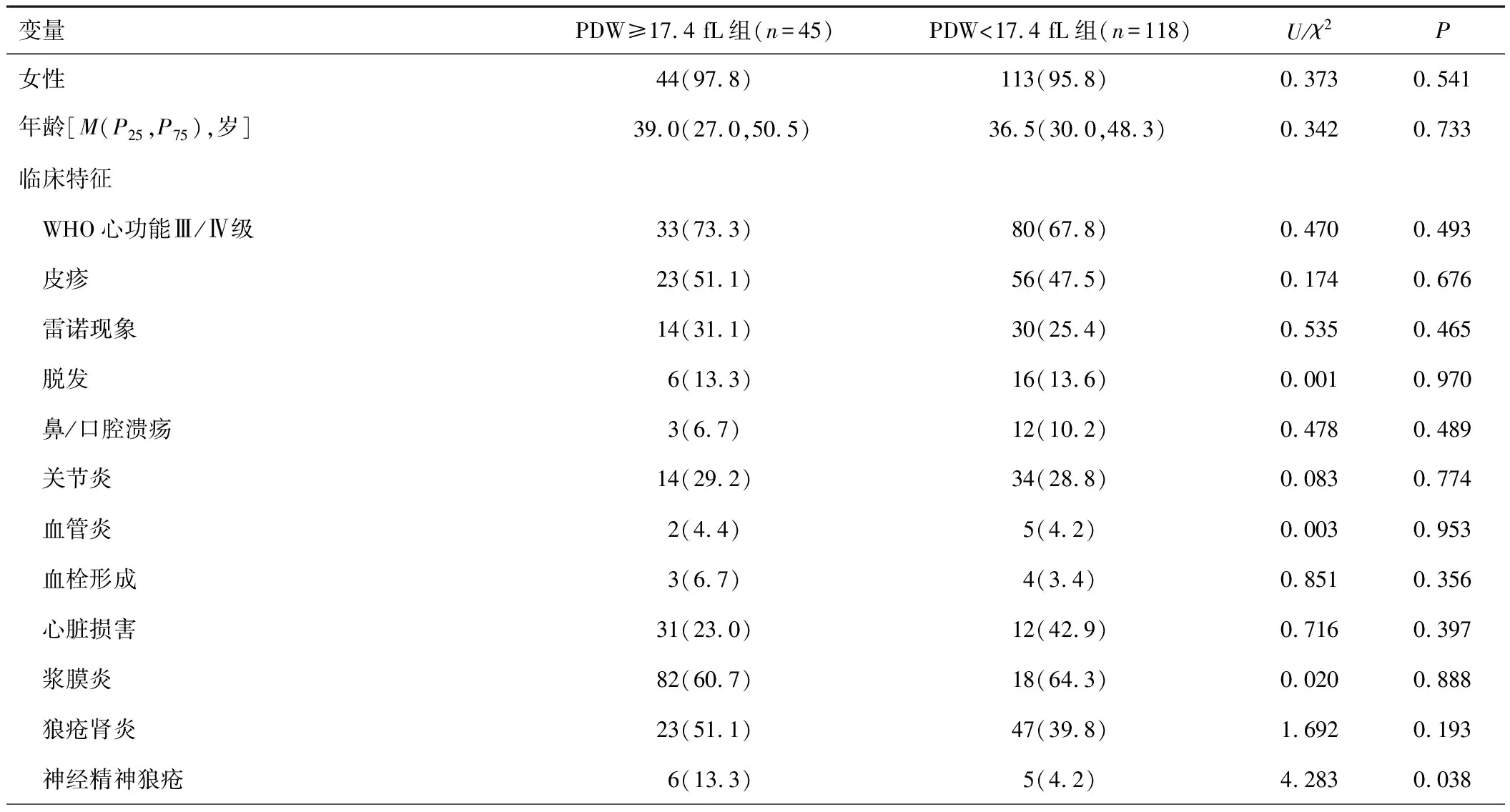
表1 163例SLE-PAH患者相关因素分析
2.3 生存曲线分析至随访结束时,163例SLE-PAH患者中共28例于确诊27.0(7.3,66.5)个月后死亡。生存曲线显示PDW≥17.4 fL患者的总体生存率低于PDW<17.4 fL的患者(P<0.05)。见图1。
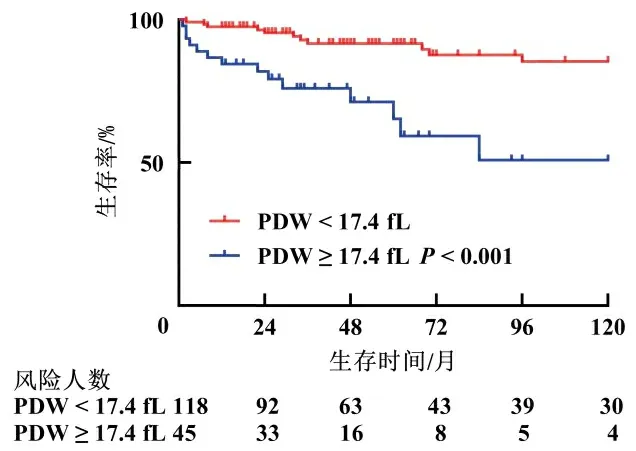
图1 两组的生存曲线分析
2.4 SLE-PAH患者死亡的影响因素分析为进一步验证PDW水平与SLE-PAH预后的相关性,单因素Cox回归分析发现PDW≥17.4 fL与不良预后显著相关(HR:3.734,95% CI:1.757~7.937,P=0.001),将单因素分析中P<0.05的因素,即年龄、血红蛋白、血小板、红细胞沉降率、抗dsDNA抗体、抗着丝点抗体、WHO心功能分级Ⅲ/Ⅳ级及心脏损害纳入多因素回归进行混杂因素校正,显示PDW≥17.4 fL仍为死亡的独立危险因素(模型1,HR:3.879,95% CI:1.813~8.300,P<0.001;模型2,HR:3.551,95% CI:1.386~9.099,P=0.008;模型3,HR:3.354,95% CI:1.238~9.002,P=0.016)。见表2及表3。

表2 SLE-PAH患者预后的相关因素Cox回归分析
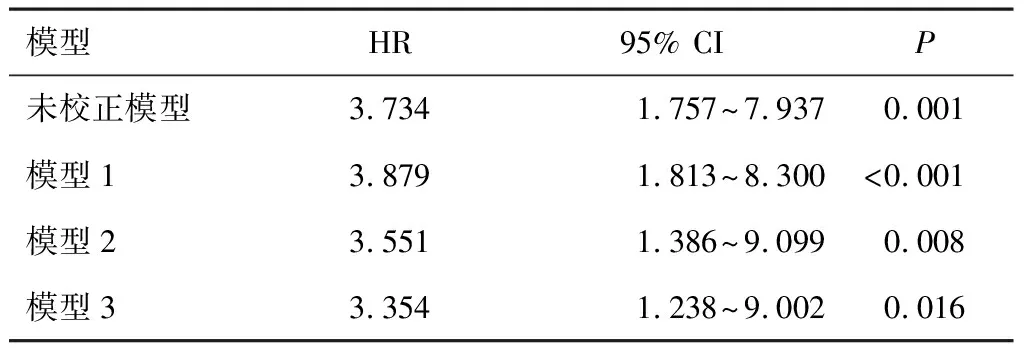
表3 基线PDW对SLE-PAH患者预后影响的多因素Cox回归分析
3 讨论
PAH是SLE患者死亡的主要原因之一,早期诊断困难,半数患者确诊时已进展至疾病中晚期,病死率高。因此,通过预后标志物早期识别SLE-PAH高危患者并及时干预治疗,对于改善预后尤为重要。本研究通过分析PDW与SLE-PAH患者预后的相关性,校正混杂因素后,确定PDW为SLE-PAH患者死亡的独立危险因素。
近年来陆续有研究对PAH预后危险因素进行相关探讨,并综合多个临床指标构建危险分层模型或评分量表,如2022年欧洲心脏病协会/欧洲呼吸病协会提出的肺高压(pulmonary hypertension,PH)综合版及简化版预后风险分层,及美国基于早期及长期PAH疾病管理队列的PAH预后模型等[9,11],但因SLE-PAH具有独特的临床特点及自身抗体,PAH预后模型对高风险的SLE-PAH患者区分度并不佳,且部分指标存在有创、经济成本、耗时等缺点[12],因此无创、简便、经济的预后标志物将有助于临床对SLE-PAH患者预后的精准评估。
既往研究表明血小板减少与SLE-PAH的不良预后相关[13]。PDW是血常规的常见指标之一,可以反映血小板容积大小离散度,近年来已发现其在SLE及PAH中潜在的指示作用。研究表明PDW与SLE疾病活动度呈正相关[14]。本研究结果显示PDW≥17.4 fL的患者SLEDAI和红细胞沉降率更高,血小板及血红蛋白的水平更低,反映了PDW与SLE疾病活动的密切关联。既往研究发现PDW水平在特发性PAH或慢性肺部疾病所致的PAH中增高[15-16]。He等[17]则指出PDW是SLE-PAH患者的早期诊断标志物。本研究则进一步证明PDW为SLE-PAH患者死亡的独立危险因素。这些结果均提示PDW在SLE-PAH发生发展中的潜在作用。PDW升高提示血小板被激活与破坏,刺激SLE患者释放炎症因子及补体,形成免疫复合物沉积于血管壁,参与损伤肺血管内皮细胞;同时,异常的血小板也会导致血小板黏附与聚集,形成微血栓,最终促使肺血管阻力及肺动脉压升高,肺血管疾病发生[18-19]。但PDW与SLE-PAH的具体关联机制仍待研究进一步阐明。
本研究仍存在一定局限性。首先,PDW作为单一的预后标志物其预测能力有限,未来应需联合多种预后变量共同评估SLE-PAH患者病情。其次,本研究中经右心导管诊断的患者只有一部分。尽管既往研究将TTE中的肺动脉收缩压35 mmHg定义为诊断PAH的界值,但右心导管被认为是PAH诊断的金标准。最后,本研究样本量较小,未来需要前瞻性及多中心队列研究进一步验证。
综上,本研究确定了PDW≥17.4 fL为SLE-PAH患者不良预后的高危因素。根据高水平的PDW及时识别高危患者,对于临床早期实现达标治疗、改善患者生存质量及预后具有重要的临床价值。
