益生菌鼠李糖乳杆菌通过下调促炎性Th17改善实验性牙周炎
2023-06-10罗振华郭力嘉徐骏疾
贾 璐 杜 鹃 罗振华 郭力嘉 徐骏疾 刘 怡
牙周炎(periodontitis,PD)是常见的由菌斑生物膜触发的口腔慢性感染性疾病,不仅导致牙周支持组织的破坏和牙齿松动脱落,还与炎症性肠病、糖尿病、心脑血管疾病等多种系统性疾病密切相关[1,2]。宿主免疫反应与牙周致病菌之间的相互作用被认为是牙周炎的主要发病机制。此外,全身性疾病或其他组织的局部感染也是牙周炎病理的促进因素[3]。
近来肠道菌群被认为是决定机体是否健康的核心调控机制,因为肠道微生物及其代谢物不仅影响肠道屏障功能、机体炎症反应,而且与宿主免疫系统密切相关,比如CD4+T 细胞亚群平衡等[4]。课题组前期证实PD 致病菌-牙龈卟啉单胞菌(P.gingivalis)和益生菌-LGG 能够分别通过TLR4 和TLR2 信号通路介导促炎性Th17 细胞和免疫抑制性Treg 细胞之间的平衡,进而调控肠道免疫性炎症的进展[5]。Meta 分析表明根面平整结合局部辅助应用益生菌制剂(罗伊氏乳杆菌Lactobacillus reuteri、LGG)相较于单纯进行根面平整,更有助于改善牙周炎患者的附着丧失、牙龈出血和牙周探诊深度[6,7]。LGG 是正常肠道菌群之一,在肠道的定植力强,具有调节肠道菌群及增强感染防御的功能;也是目前研究最多的益生菌菌株,能够在胃和十二指肠胆汁酸中存活并在体内发挥抗炎特性,有益于提升机体免疫力[8]。
研究对实验性牙周炎小鼠实施灌胃LGG 的措施,发现能显著减轻牙周炎的牙槽骨吸收,同时能够通过下调牙周局部和全身促炎性Th17 细胞百分比进而降低炎症水平。
材料和方法
1. 材料和试剂:乳酸菌培养基(MRS 培养基,Thermo);流式抗体Anti-mouse CD4 FITC、Antimouse IL-17A PE、Anti-mouse CD25 PE、Antimouse FoxP3 eFluor 450(eBioscience);引物(生工);丝线(金环);注射器(BD);cDNA 反转录试剂盒(Takara);Cell Activation Cocktail(Biolegend);核内因子固定/渗透缓冲液(eBioscience);胞内因子固定/破膜缓冲液(Biolegend);流式细胞仪LSRFortessa(BD);酶标仪(Thermo)。
2. 培养鼠李糖乳杆菌:本实验采用LGG 菌株CICC 6141(首都医科大学附属北京口腔医院组织再生和免疫学实验室微生物平台保种)。参照前期发表文献,采用MRS 培养基置于37℃及厌氧条件下培养48 h 至细菌对数生长期[5]。通过测量光密度(波长为600 nm)来标准化菌落形成单位(CFU)的数量。每次量化2×109个CFU 悬浮在200 μL 生理盐水制成LGG 活菌液,以用于灌胃实验。用1 mL 注射器配合灌胃针头抽取定量200 μL LGG 活菌液,自小鼠食道至胃部推注,避免菌液从口中流出。
3.建立小鼠实验性牙周炎模型:选用6~8 周雄性C57BL/6 小鼠作为本实验动物,由北京斯贝福公司提供,饲养在首都医科大学附属北京口腔医院动物房。实验方案得到首都医科大学动物伦理委员会批准(KQYY-201712-002),所有动物均按照实验动物伦理委员会的要求进行管理和操作。参照先前研究通过丝线结扎诱导小鼠实验性牙周炎[9~11]。将5-0 丝线环绕悬吊在6~8 周小鼠上颌第二磨牙周围,为期2周。每隔1 天检查一次结扎情况,一旦丝线脱落,立即再次结扎。每只小鼠每隔1 天灌胃200 μL 生理盐水或LGG 活菌液,共7 次。实验分为2 组,牙周炎对照组(PD 组)和灌胃LGG 实验组(PD+LGG 组),每组5 只小鼠。
4. 流式检测下颌淋巴结及脾脏内IL-17A+Th17和CD25+Foxp3+Treg:分离各组小鼠的下颌淋巴结及脾脏内淋巴细胞。对于IL-17A+Th17 染色,细胞先用含有Brefeldin A 的Cell Activation Cocktail 在37℃下刺激5 h,然后用Anti-mouse CD4 FITC 抗体标记,依据使用说明用胞内因子固定/破膜缓冲液使细胞打孔后,再用Anti-mouse IL-17A PE 抗体进行染色;对于CD25+Foxp3+Treg 染色,细胞先用Antimouse CD4 FITC 抗体和Anti-mouse CD25 PE 抗体进行表面标记,依据使用说明用核内因子固定/渗透缓冲液使细胞打孔固定后,再用Anti-mouse FoxP3 eFluor 450 抗体进行染色。染色细胞在流式细胞仪上检测,采用FlowJo 软件分析数据,并对IL-17A+Th17细胞和CD25+Foxp3+Treg 细胞分别占CD4+T 细胞总数的百分比进行统计学分析。
5.RT-qPCR:收集各组PD 小鼠的牙龈组织,按照RNA 提取及反转录试剂盒的说明书步骤操作,将RNA 反转录成cDNA,检测cDNA 纯度,加入反转录酶等反应物,加入引物以及SYBR Green 上机运行qPCR。以Gapdh为内参基因。
Gapdh引物:上游5’-TGAAGCAGGCATCTGAG GG-3’,下游3’-CGAAGGTGGAAGAGTGGGAG-5’;Il-17a引物:上游5’-TTTAACTCCCTTGGCGCAAAA-3’,下游3’- CTTTCCCTCCGCATTGACAC-5’;Il-6引物:上游5’-GCTTTAACAGCAGGCCAGAC-3’,下游3’-GGAAGCACCAGGTGTCAAGT-5’;Tnf-α引物;上游5’-GGTGTCTGGGAAGCTGAGAG-3’,下游3’-CTCTGTCTGGTGCTGGTTGA-5’;Il-1β引物:上游5’-GCTGGCCCTTTGTGTAATGT-3’, 下游3’-AACCATTGCAGGGCTATGAC-5;Rorc引物:上游5’-CCCTTGGGCTGTGTTAATAGTG -3’, 下 游3’-AACTTCTCGTACAAGCCTGGG-5’;Foxp3引物:上游5’-CCCATCCCCAGGAGTCTTG-3’, 下 游3’-ACCATGACTAGGGGCACTGTA-5’。
6.ELISA:收集各组小鼠的外周血血清样本,按照制作商的说明书步骤操作,将其分别与抗IL-17A、IL-6、TNF-α、IL-1β 的抗体对一起孵育,加入底物液和终止液,反应体系置于酶标仪内,将空白孔调零后,测定标本孔的吸收值。
7.统计学方法:所有统计学分析及图表绘制均采用GraphPad Prism 8 进行,采用Mean±SEM 或者violin plot 形式呈现数据。两组之间的差异采用非配对的Student’s t-test 进行评估;P<0.05 被认为具有统计学意义;*表示图中P 值结果(*P<0.05;**P<0.01;***P<0.001)。
结 果
1.灌胃LGG 缓解实验性PD:如图1 所示,相比较于PD 组,PD+LGG 组的PD 小鼠牙槽骨吸收显著缓解。分别测量上颌第二磨牙的腭侧和颊侧釉牙骨质界(cemental-enamel junction, CEJ)到牙槽嵴顶(alveolar bone crest, ABC)的位置,PD 组腭侧牙槽骨吸收均值为208.1 μm,PD+LGG 组腭侧牙槽骨吸收均值为98.72 μm;PD 组颊侧牙槽骨吸收均值为261.7 μm,PD+LGG 组颊侧牙槽骨吸收均值为154.7 μm(图1B,腭侧**P<0.01;图1C,颊侧**P<0.01)。
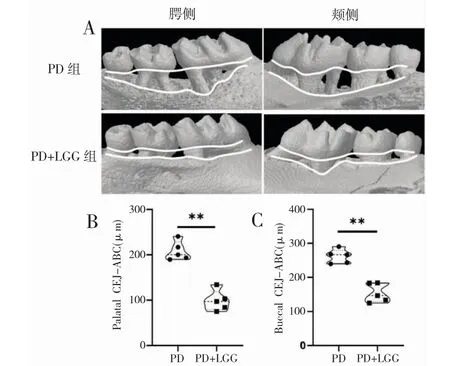
图1 灌胃LGG 减缓实验性PD 的牙槽骨吸收
2.灌胃LGG 下调PD 小鼠下颌淋巴结及脾脏内IL-17A+Th17:为进一步探究灌胃益生菌LGG 缓解PD 的可能机制,采用流式细胞术对牙周引流淋巴结及外周脾脏内Th17 和Treg 的百分比进行检测,结果如图2 所示,PD+LGG 组比PD 组牙周炎小鼠的下颌下淋巴结(SLCs)中促炎性IL-17A+Th17 细胞占CD4+T 细胞的百分比显著下降(图2A,B,(PD+LGG组均值2.46%)versus(PD 组均值0.69%),***P<0.001),但是SLCs 中的免疫抑制性CD25+Foxp3+Treg 细胞占CD4+T 细胞的百分比在两组之间的差异不具有统计学意义(图2C,D,P>0.05)。
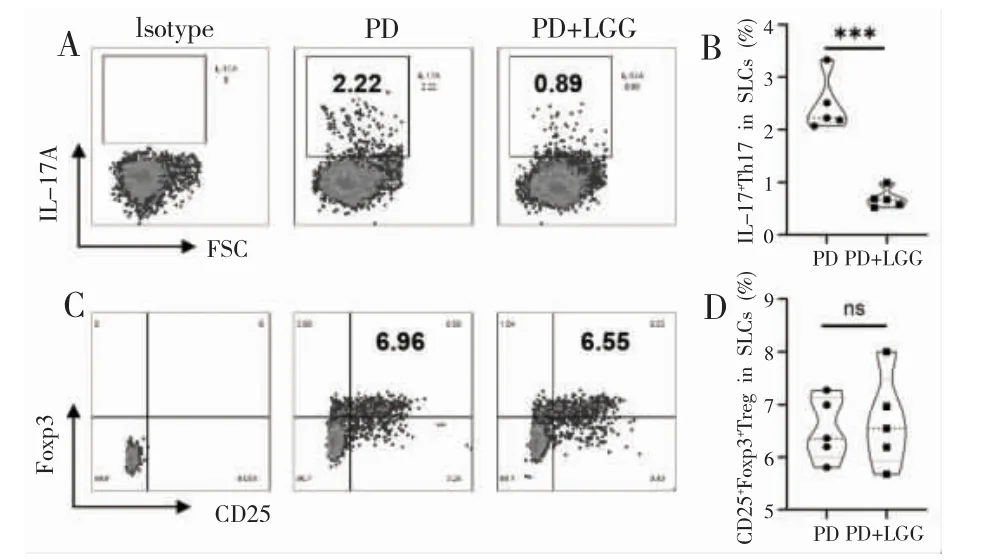
图2 两组PD 小鼠的下颌下淋巴结细胞(SLCs)内IL-17A+Th17 和CD25+Foxp3+Treg 分别占CD4+T 细胞的百分比
同时,PD+LGG 组比PD 组PD 小鼠的脾脏淋巴细胞(SPLs)中促炎性IL-17A+Th17 细胞占CD4+T 细胞的百分比也明显降低(图3A,B,(PD+LGG 组均值1.42%)versus(PD 组均值0.67%),**P<0.01),但SPLs 中的免疫抑制性CD25+Foxp3+Treg 细胞占CD4+T 细胞的百分比在两组之间的差异不具有统计学意义(图3C,D,P>0.05)。

图3 两组PD 小鼠的脾脏淋巴细胞(SPLs)内IL-17A+Th17 和CD25+Foxp3+Treg 分别占CD4+T 细胞的百分比
3.灌胃LGG 下调PD 小鼠的血清内炎性因子水平:为评估灌胃LGG 对PD 小鼠的整体炎症水平的影响,采用ELISA 检测血清中炎性因子的蛋白表达,结果如图4 所示,PD+LGG 组相比于PD 组PD小鼠的血清中IL-17A,IL-6,TNF-α,IL-1β 的表达水平显著下降(图4A,IL-17A,**P<0.01;图4B,IL-6,***P<0.001;图4C,TNF-α,**P<0.01;图4D,IL-1β,**P<0.01),表明灌胃益生菌LGG 能够下调PD小鼠的全身性炎症水平,与此前流式细胞术检测的SPLs 中促炎性Th17 细胞百分比明显降低相吻合。

图4 两组PD 小鼠的血清内炎性因子(IL-17A,IL-6,TNF-α,IL-1β)的蛋白水平
4. 灌胃LGG 下调PD 小鼠牙龈内炎性因子基因:为评估灌胃LGG 对PD 小鼠的牙周局部炎症水平的影响,采用RT-qPCR 检测牙龈内炎性因子的基因表达,结果如图5 所示,PD+LGG 组相比于PD组PD 小鼠的牙龈匀浆内IL-17A,IL-6,TNF-α,IL-1β 的表达水平显著下降(图5A,Il-17a,**P<0.01;图5B,Tnf-α,**P<0.01;图5C,Il-6,*P<0.05;图5D,Il-1β,*P<0.05),同时Th17 的转录因子RORγt的表达也显著下降,但Treg 的转录因子FoxP3 在两组之间未见统计学差异(图5E,Rorc,*P<0.05;图5F,Foxp3,P>0.05)。表明灌胃益生菌LGG 能够下调PD 小鼠的牙周组织内炎症水平,与此前流式细胞术检测的SLCs 中促炎性Th17 细胞百分比明显降低相吻合。

图5 两组牙周炎小鼠的牙龈内炎性因子(IL-17A,IL-6,TNF-α,IL-1β)和转录因子(RORγt,FoxP3)的基因水平
讨 论
在本研究中,本课题组采用灌胃的方式将LGG施用于实验性牙周炎小鼠体内,以探究LGG 能否通过肠道免疫系统而影响牙周炎,发现PD+LGG 组相较于单纯PD 组小鼠牙槽骨吸收显著减缓,并且SLCs 内促炎性IL-17A+Th17 细胞的百分比和牙龈组织内炎性细胞因子的表达均明显降低,表明灌胃LGG 减轻PD 局部的炎症;同时PD+LGG 组小鼠的脾脏淋巴细胞(SPLs)内Th17 和血清内IL-17A,IL-6,TNF-α 和IL-1β 等因子也明显减少,说明灌胃LGG 对PD 小鼠的全身性炎症也具有缓解的作用。
微生物失调是指疾病相关微生物群落中物种相对丰富度或群落结构不平衡的状态,是多种免疫炎症性疾病的触发因素,包括PD[12]。然而PD 的进展很大程度上取决于微生物和宿主免疫反应之间的相互作用,其中CD4+T 细胞及其亚群在此过程中发挥关键作用,尤其促炎性CD4+IL-17+Th17 细胞和免疫抑制性CD4+CD25+Foxp3+Treg 细胞之间的免疫平衡被认为是核心机制[13]。在本实验中发现LGG 的全身性应用(非口腔局部应用)在改善实验性PD 牙槽骨吸收的同时,下调SLCs 中的IL-17A+Th17 细胞百分比,但是对CD25+Foxp3+Treg 细胞的百分比未见统计学差异的影响,表明益生菌LGG 能够经由肠道整体的免疫系统实现对PD 局部炎症的调控。此前Gatej SM 等人通过口内接种P.gingivalis和具核梭杆菌(F.nucleatum)诱导小鼠实验性PD 同时口腔或者全身应用LGG 后发现无论是何种方式应用LGG均能减缓牙槽骨的吸收[14],这与本实验结果相一致。GaoL 等人采用丝线结扎和接种P.gingivalis的方式构建SD 大鼠PD 模型,发现PD 大鼠的牙龈组织内Th17 细胞的关键转录因子RORγt 和促炎性因子IL-17 的表达均显著增高,证实PD 炎症水平与局部Th17 成正相关[13]。这与本实验的结果相一致,即益生菌LGG 下调Th17 细胞的百分比及其转录因子和特异性炎性因子而降低PD 的炎症水平,但是一项随机对照试验在评估益生菌LGG SP1 对Ⅲ期B 级牙周炎患者刮治和根面平整的辅助临床效果时,发现在1 年观察期后,SP1 并没有在附着丧失和牙周袋深度方面表现出具有统计学差异的优势[15]。这与本实验利用PD 小鼠得到的结论不一致,分析原因可能在于III 期B 级的牙周炎患者牙周组织破坏程度已处于比较严重的阶段而且观察周期1 年可能不是最佳有效时间点,因为在另外一项为期30 天和90 天的临床试验中辅助应用益生菌乳酸双歧杆菌治疗慢性PD 明显有益于减缓牙周附着丧失和降低牙周袋深度[16]。
与此同时,本课题组发现灌胃LGG 也能够降低PD 小鼠的全身性炎症水平,体现在PD+LGG 组相较于PD 组SPLs 中Th17 占CD4+T 细胞的百分比明显降低,且血清中IL-17A,IL-6,TNF-α 和IL-1β 的含量也随之下降。以上表明LGG 作为肠道益生菌之一,具有抗炎活性,即使经过胃肠道消化仍能发挥肠道免疫调控作用。此外,也有研究表明LGG 具有调控抗菌肽、细胞因子和趋化因子的分泌以改善肠道的免疫屏障功能[17]。但是本实验对比两组PD 小鼠的下颌下淋巴结和脾脏淋巴细胞中免疫抑制性CD25+Foxp3+Treg 细胞所占百分比,没有发现具有统计学意义的差异,提示LGG 在介导肠道免疫和全身性炎症的过程中主要以Th17 细胞为靶点,而非Treg细胞。此外,Th17 细胞在促进PD 牙槽骨破坏过程中发挥的作用已被充分研究和证实,一方面,Th17表面表达高水平的RANKL,RANKL 与破骨细胞前体细胞表面的RANK 结合,促进破骨细胞前体细胞向破骨细胞分化,加速骨吸收[18,19];另一方面,Th17细胞分泌的炎性因子IL-17 直接增强了破骨细胞形成支持细胞中RANKL 的表达[20]。关于Treg 细胞在牙周炎局部组织内表达增强还是降低仍存争议,其介导骨代谢免疫的内在机制仍不甚清楚[21,22]。
综上所述,本实验揭示了LGG 经由肠道免疫缓解牙周炎的机制很可能在于下调牙周局部和全身性促炎型Th17 细胞。鉴于PD 是多种慢性低度炎性疾病如糖尿病、肥胖、心脑血管疾病、代谢综合征等的重要影响因素,因此有理由相信辅助应用益生菌LGG 在有助于治疗PD 的同时,对伴有系统性疾病的患者具有一定的整体免疫调节功能。
