鞘内注射shRNA慢病毒载体缓解慢性炎性疼痛的机制研究
2023-06-09姜晓阳冯艳茹刘亚华侯彦深新疆医科大学附属肿瘤医院麻醉与围术期医学中心新疆乌鲁木齐8300新疆医科大学附属肿瘤医院营养科新疆乌鲁木齐8300
姜晓阳,冯艳茹,刘亚华,侯彦深 (. 新疆医科大学附属肿瘤医院麻醉与围术期医学中心,新疆 乌鲁木齐 8300;. 新疆医科大学附属肿瘤医院营养科,新疆 乌鲁木齐 8300)
疼痛是临床最难控制、却又最常见的症状之一,是许多疾病(如癌症、烧伤、炎症等)的伴随症状之一[1]。目前,比较公认的疼痛定义为由明确组织损伤或潜在组织损伤引发的机体不愉快的情绪体验,可伴随机体多个系统的生理变化[2]。临床治疗或缓解疼痛的首选方案为世界卫生组织推荐的“三阶梯”止痛原则,但随着药物疗程的延长和给药剂量的增加,患者会出现耐药、成瘾等副作用,使其疼痛症状迁延反复,无法达到预期的疗效[3]。背根神经节(dorsal root gan⁃glia,DRG)是脊髓疼痛信号传入的第一级神经元,是痛觉向中枢传导的纽带,在疼痛信号的产生机制中至关重要[4]。一项针对先天性无痛症患者的研究发现,患者基因测序结果中可见明显的SCN9A基因突变,说明SCN9A基因与疼痛的发生密切相关[5]。Nav1.7由基因SCN9A编码,主要在外周感觉神经元(如DRG)中表达,与疼痛发生密切相关[6]。从基因角度探究疼痛的治疗,已成为临床疼痛治疗的新方向。本研究基于建立的慢性炎性疼痛大鼠模型,探究鞘内注射shRNA慢病毒载体对模型大鼠疼痛行为学及脊髓胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)、OX42蛋白表达的影响,以期为临床慢性炎性疼痛的基因治疗提供参考。
1 材料与方法
1.1 实验动物
SPF级雄性SD大鼠54只,体质量(200±10)g,由新疆医科大学动物中心实验室提供,动物许可证号:SYXK(新)2018-0003。大鼠分笼饲养,自由进食、水。饲养环境:12 h昼夜交替,室温22~24 ℃,相对湿度40%~70%。本研究获我院医学伦理委员会批准(G-201512)。
1.2 主要试剂及仪器
慢病毒载体购自上海吉凯基因技术有限公司,七氟烷购自上海恒瑞医药有限公司,完全弗氏佐剂(complete Freund's adjuvant,CFA)购自赛国生物科技有限责任公司,TRIzol购自Thermo Scientific,SYB⁃RGreen PCR试剂盒、cDNA试剂盒购自Biosystems,增强型RIPA裂解液购自博士德生物工程有限公司,辣根过氧化物酶标记山羊抗兔IgG购自北京中杉金桥生物技术有限公司。
热刺痛仪(PL-200)购自成都泰盟软件有限公司,机械痛测量仪(Electric Von Frey)购自上海玉研科学仪器有限公司,微量注射器(25 μL)购自上海安亭微量进样器厂,GYQ型便携式氧气筒购自冀州市佳光医疗器械有限公司,-80 ℃冰箱、全波长酶标仪(1510)购自赛默飞世尔(苏州)仪器有限公司。
1.3 慢性炎性疼痛大鼠模型的建立
将54只SD大鼠随机分为正常组、空病毒组、慢病毒载体组,每组18只。正常组大鼠注射0.1 mL生理盐水。空病毒组、慢病毒载体组采用七氟烷麻醉大鼠,建立慢性炎性疼痛模型[7]:大鼠右后足底消毒后注射0.1 mL CFA。大鼠右后足肿胀,不能触及地面,表明慢性炎性疼痛模型建立成功。
1.4 大鼠鞘内置管
参考文献[8],大鼠麻醉后取俯卧位,备皮、消毒,在L3、L4皮肤行正中切口至皮下筋膜,钝性分离L3、L4棘突附近的背脊肌、筋膜和韧带,充分暴露L3、L4棘突间隙。然后用弯针从L3椎体棘突处轻轻挑破黄韧带及硬脊膜,沿黄韧带开口处置入PE-10导管,将导管缝扎在黄韧带上,并将导管的外口引出至大鼠颈背部,逐层缝合,最后用热处理的止血钳夹闭导管外口。
1.5 大鼠鞘内注射
设计针对大鼠Nav1.7的shRNA并委托上海吉凯基因技术有限公司合成,构建慢病毒载体LV-SCN9ARNAi,保存于-80 ℃冰箱中。从冰箱取出病毒液,在37 ℃轻轻晃动溶解,将病毒液滴度调整至1×109TU/mL后置于冰盒上,用于鞘内注射。各组大鼠在疼痛模型建立完成当天进行鞘内注射,正常组鞘内注射PBS 10 μL,空病毒组和慢病毒载体组分别鞘内注射空病毒和慢病毒液10 μL。
1.6 大鼠机械缩足阈值(paw mechanical withdrawal threshold,PMWT)及热缩足潜伏期(paw thermal withdrawal latency,PTWL)测定
分别在建模前1 d及建模后第1、3、6、9、13天使用Electric von Frey机械痛测量仪及PL-200热刺痛仪测定PMWT和PTWL。
1.7 大鼠组织样本的取材
参考文献[20],于建模后第3、6、13天每组各处死6只大鼠并完成脊髓及DRG取材:10%水合氯醛腹腔注射麻醉大鼠后,钝性分离腿部肌肉,游离坐骨神经,沿坐骨神经向上追踪至脊椎的椎间孔即可见L4、L5DRG;再沿L4、L5各自神经走行方向将DRG从椎间孔轻柔抽出,并留取L4~L5脊髓节段组织;用4 ℃预冷的PBS缓冲液清洗,分装后,于-80 ℃保存备用。
1.8 Western blot检测
取冻存的大鼠组织,提取组织总蛋白后,按照BCA试剂盒说明书进行蛋白浓度测定。Western blot检测大鼠DRG中Nav1.7和脊髓GFAP、OX42蛋白表达水平。用眼科剪将组织剪成0.1~0.2 g,置于EP管中,加入1 mL RIPA裂解液(80 μL RIPA+10 μL蛋白酶抑制剂+100 μL磷酸酶抑制剂+10 μL PMSF)置于冰上,充分匀浆后4 ℃裂解30 min,4 ℃ 15 000 r/min离心10~15 min,取上清液,BCA法测定蛋白浓度。将待测蛋白样本进行10%SDS-PAGE凝胶电泳,80 V进行浓缩胶电泳,进入分离胶电泳后将电压调整为100 V,待条带全部跑开至分离层胶下缘后停止电泳,然后转移至PVDF膜上,用5% BSA封闭2 h,分别加入GFAP(1∶1 000)、OX42(1∶2 000)、SCN9A(1∶500)一抗,4 ℃孵育过夜后,加入二抗[Navl.7的二抗为辣根过氧化物酶标记山羊抗兔IgG(1∶5 000),β-actin的二抗为辣根过氧化物酶标记山羊抗小鼠IgG(1∶5 000),GFAP的二抗为辣根过氧化物酶标记山羊抗兔IgG(1∶5 000)],温孵1 h。采用化学发光凝胶拍摄仪进行凝胶图像拍摄,ImageJ软件进行条带灰度值分析。
1.9 统计学分析
采用SPSS 22.0统计软件分析数据,计量资料以均数±标准差()表示,组间比较采用单因素方差分析,方差齐时采用LSD法计算其统计值,方差不齐时采用Dunnett's T3法计算其统计值,P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠机械痛阈值测定结果
各组大鼠的PMWT基础值比较差异无统计学意义(P>0.05)。正常组大鼠PMWT值在第1、3、6、9、13天无显著变化(P>0.05)。与正常组大鼠比较,空病毒组和慢病毒载体组大鼠PMWT值在建模后第1天明显下降,在建模后第3天达到最低值,之后逐渐升高,差异有统计学意义(P<0.05)。与空病毒组大鼠比较,慢病毒载体组大鼠建模后第1天的PMWT值差异无统计学意义(P>0.05),从建模后第3天开始,慢病毒载体组大鼠PMWT值逐渐升高,差异有统计学意义(P<0.05),见图1。

图1 各组大鼠机械痛阈值测定结果
2.2 各组大鼠热刺激潜伏期测定结果
各组大鼠的PTWL基础值比较差异无统计学意义(P>0.05)。正常组大鼠PTWL值在第1、3、6、9、13天差异无显著变化(P>0.05)。与正常组大鼠比较,空病毒组PTWL值在建模后第1天明显下降,在建模后第3天下降达最低值,之后较第3天升高,但仍低于基础值,差异有统计学意义(P<0.05);而慢病毒载体组大鼠PTWL值在建模后第1天明显下降,在第3天达到最低值,之后逐渐升高,直至建模后第13天,差异有统计学意义(P<0.05)。与空病毒组大鼠比较,慢病毒载体组大鼠建模后第1天的PTWL值差异无统计学意义(P>0.05),从建模后第3天开始,慢病毒载体组大鼠PTWL值逐渐升高,差异有统计学意义(P<0.05),见图2。
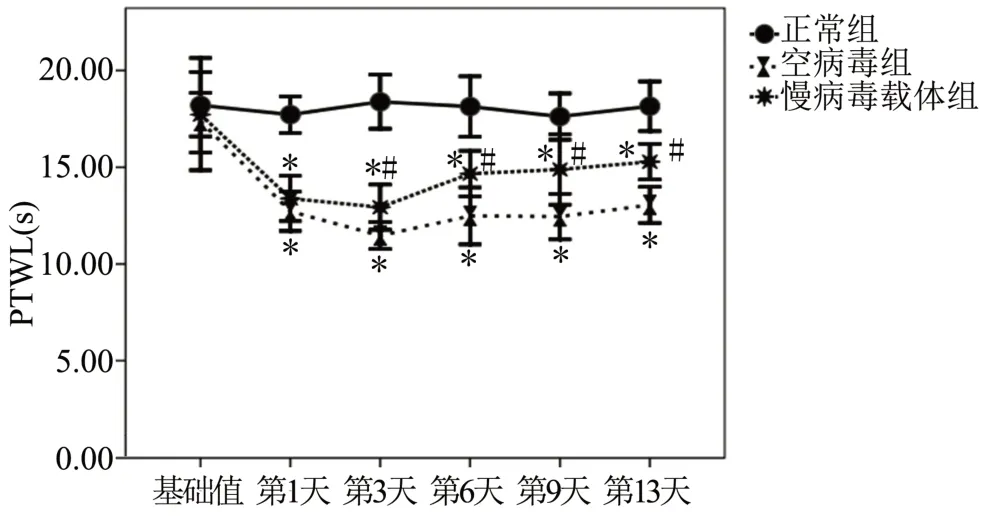
图2 各组大鼠热刺激潜伏期测定结果
2.3 大鼠DRG Nav1.7及脊髓GFAP、OX42蛋白表达
在建模后第3、6、13天,正常组大鼠DRG中Nav1.7及脊髓GFAP、OX42蛋白表达水平基本无变化。在建模后第3、6、13天,与正常组大鼠比较,空病毒组和慢病毒载体组大鼠DRG中Nav1.7及脊髓GFAP、OX42蛋白表达水平增加,差异有统计学意义(P<0.05);在建模后第3、6、13天,与空病毒组大鼠比较,慢病毒载体组大鼠DRG中Nav1.7及脊髓GFAP、OX42蛋白表达水平下降,差异有统计学意义(P<0.05),见图3。
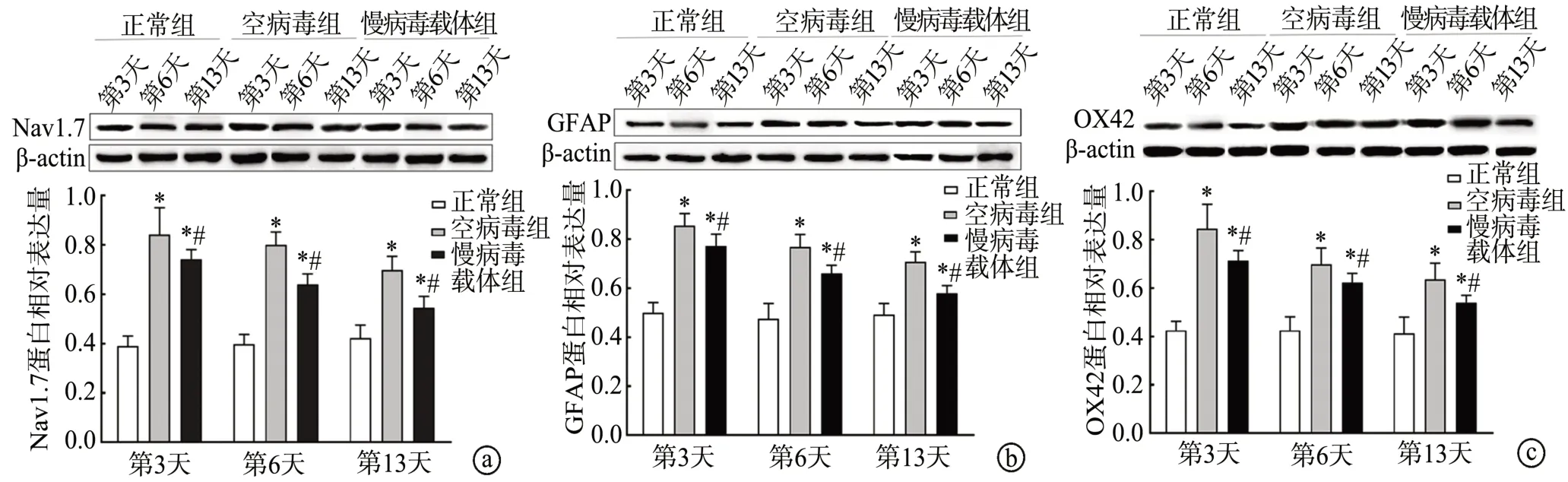
图3 各组大鼠DRG中Nav1.7及脊髓GFAP、OX42蛋白表达
3 讨论
疼痛给患者及其家庭带来了无尽的折磨,然而目前尚无让医师和患者都满意的治疗方法[9]。炎性疼痛模型由于建模方法简单,模型持续时间长,模型动物的疼痛行为学改变明显,在慢性疼痛研究中应用广泛[10]。通过足底注射CFA引起周围炎症,是目前慢性炎性疼痛最常用、最经典的建模方法[11]。因此,本研究采用足底注射CFA建立慢性炎性疼痛模型。在疼痛治疗研究中,常用的评价指标包括PMWT、PTWL、热板反应以及热甩尾反应等[12]。本研究将PMWT、PTWL作为疼痛研究指标,并以此判断疼痛模型是否建立成功。有研究发现,大鼠足底注射CFA后,PMWT显著降低,PTWL明显缩短[13]。本研究结果显示,大鼠右后足注射CFA后,空病毒组大鼠在建模后第1天至第13天PMWT、PTWL值均明显降低;鞘内注射慢病毒载体后,PMWT、PTWL值明显升高,表明鞘内注射LV-SCN9A-RNAi对大鼠的慢性炎性疼痛具有一定的改善作用,鞘内注射LV-SCN9A-RNAi能够抑制Nav1.7的表达,使疼痛阈值升高,从而明显减轻慢性炎性疼痛。
DRG是痛觉信息传入的第一级神经元,其主要传导外周伤害性信息,而传递这些电活动的基础就在于其细胞膜上的电压门控性钠通道,其与疼痛的产生和发展密切相关[14]。有研究表明,编码Nav1.7的SCN9A基因功能缺失性突变是导致痛觉完全消失的原因[15]。潘洪祥等[16]通过建立颞下颌关节炎性痛模型发现,三叉神经内Nav1.7的表达上调,进而参与调节大鼠颞下颌关节炎性痛。本研究结果显示,大鼠右后足注射CFA后,大鼠DRG中Nav1.7表达水平升高;鞘内注射LV-SCN9A-RNAi后,大鼠DRG中Nav1.7表达水平下降,表明鞘内注射LV-SCN9A-RNAi可抑制大鼠DRG中Nav1.7表达,缓解慢性炎性疼痛,DRG中Nav1.7的表达与疼痛的产生密切相关。
脊髓胶质细胞活化是引发疼痛的关键过程。活化的胶质细胞通过强化疼痛循环机制,维持机体疼痛状态并将其放大[17]。GFAP主要存在于星形胶质细胞,CD11b/c单克隆抗体OX42能特异性标记小胶质细胞;GFAP和OX42均为胶质细胞活化的标记物[18-19]。马俊龙等[20]研究发现,益气活血通络方可通过下调脊髓GFAP表达水平,抑制糖尿病神经病理性疼痛大鼠脊髓星形胶质细胞活性。马俊杰等[21]对肌筋膜疼痛综合征大鼠给予艾灸处理后,显著降低了大鼠小胶质细胞标记物OX42的表达,抑制了小胶质细胞活化,缓解了疼痛。本研究结果显示,大鼠右后足底注射CFA后,脊髓GFAP、OX42蛋白表达水平显著增加;大鼠鞘内注射LV-SCN9A-RNAi后,脊髓GFAP、OX42蛋白表达水平显著下降,表明鞘内注射LV-SCN9A-RNAi可能通过抑制胶质细胞活化,抑制大鼠脊髓GFAP、OX42蛋白表达,从而抑制疼痛介质的释放和传导,进而缓解慢性炎性疼痛。
综上所述,鞘内注射LV-SCN9A-RNAi可能通过抑制大鼠DRG中Nav1.7表达,抑制胶质细胞活化,从而抑制大鼠脊髓GFAP、OX42蛋白表达,发挥缓解慢性炎性疼痛的作用。但本研究仅在整体动物水平探讨鞘内注射LV-SCN9A-RNAi对疼痛的改善作用,尚缺少在细胞水平的深入研究作为佐证。
