利用CRISPR-Cas9技术编辑Badh2基因创制优质香型籼稻三系不育系
2023-06-09韦新宇曾跃辉杨旺兴肖长春候新坡黄建鸿邹文广许旭明
韦新宇 曾跃辉 杨旺兴 肖长春 候新坡 黄建鸿 邹文广 许旭明,*
利用CRISPR-Cas9技术编辑基因创制优质香型籼稻三系不育系
韦新宇1,3,**曾跃辉1,3,**杨旺兴2,3肖长春1,3候新坡2,3黄建鸿1,3邹文广2,3许旭明2,3,*
1三明市农业科学研究院生物技术研究所, 福建三明 365500;2三明市农业科学研究院水稻研究所, 福建三明 365500;3福建省(山区)作物遗传改良与创新利用重点实验室, 福建三明 365500
稻米香味是水稻的重要食味品质之一, 其主要受第8染色体上编码甜菜碱脱氢酶基因控制, 该基因突变可导致香味物质2-乙酰-1-吡咯啉(2-AP)的含量增加从而促进香味的产生。本研究以三明市农业科学研究院自主选育的优质籼型杂交稻保持系明太B为受体, 利用CRISPR-Cas9技术对其基因进行编辑和敲除。获得2个T0代转基因纯合突变体植株并对其衍生的48个T1代单株进行鉴定和分析, 获得1个不含转基因载体骨架且在第2外显子插入单个碱基T的纯合突变体株系明太B-。利用半定量PCR和qRT-PCR技术以及气相色谱质谱联用仪(GC-MS)检测基因相对表达量和2-AP含量; 同时采用农业行业标准(NY/T 1433-2014)推荐的48对水稻SSR引物进行指纹图谱分析。结果表明, 该株系基因RNA表达水平显著下调; 籽粒中香味物质2-AP的含量显著增加; 指纹图谱分析发现, 仅1对引物Rm571在野生型和突变体之间鉴定到等位变异, 两组材料遗传差异较小。此外, 本研究还对野生型和突变体T2代植株表型性状、稻米蒸煮食味品质和外观品质指标进行了考察和测定分析。结果表明, 所有指标在两组材料间均无显著差异。进一步采用测交和回交转育方法并结合位点测序分析, 成功选育获得了其对应的纯合香型三系不育系明太A-。通过与恢复系明恢703、明恢3009测配, 其组合产量与国家审定品种明太优703、明太优3009相近且表现出较强的超标优势。此外, 通过与香型恢复系明恢1831测配后发现其组合籽粒中香味物质2-AP含量极显著高于对照组合明太A/明恢1831。因此, 利用CRISPR-Cas9基因编辑技术, 可对水稻香味基因进行精准定向编辑和敲除, 实现对水稻香味性状的改良, 为创制香型籼稻不育系提供理论指导, 从而加快香型杂交稻育种进程。
水稻; CRISPR-Cas9; 基因编辑; 香味;; 2-乙酰-1-吡咯啉(2-AP)
水稻是世界上重要的粮食作物之一。近年来, 随着人们生活水平的稳步提高和膳食结构的不断改变, 国内外市场对优质稻米的需求日益增加, 传统的水稻育种已无法满足人们对优质高产水稻的强烈需求。香味作为考量水稻稻米食味品质的一项极其重要的指标, 其愈来愈受到国内外水稻遗传学家和育种学家的高度关注。同时, 香稻作为水稻中一类特殊的栽培稻群体, 由于其稻米具有独特的香味且食味品质和营养品质优良而被视为水稻中的珍品, 深受广大消费者的青睐[1]。因此, 发掘和创制香稻种质资源, 改善稻米香味品质, 培育优质香稻新品种已成为当前水稻遗传改良的一项重要研究内容。
随着水稻分子生物学和基因组学的不断发展, 许多研究者对水稻稻米香味的来源和分子遗传机理进行了广泛而深入的研究。水稻香味基因从初步定位到分离克隆以及功能分析, 再到目前在水稻遗传育种中的广泛应用, 已经取得了巨大的进展。香稻中香味的遗传基础比较复杂, 但目前大部分研究结果表明, 水稻香味主要受一个编码甜菜碱脱氢酶的细胞核隐性基因控制[2]。该基因位于水稻8号染色体, 包含15个外显子和14个内含子, CDS全长1512 bp, 共编码503个氨基酸[3]。张江丽等[4]对来自国内外不同地区86份香稻种质资源进行了香味基因型的鉴定, 发现其极大部分种质的香味性状受等位基因控制。曾跃辉等[5]对来自我国南方稻区不同省份的32份优质香稻品种进行了基因型鉴定和分析, 研究发现如玉针香、美香占2号、赣香占1号等28份目前在水稻遗传育种中被广泛应用的优质香稻品种的香味性状均来源于水稻8号染色体上编码甜菜碱脱氢酶基因的功能缺失突变, 且主要表现为在基因第7外显子发生8 bp缺失和3个单核苷酸(SNP)位点多态性突变, 属于类型。此外, Shi等[6]和Shao等[7]研究发现在一些不同的地方香稻品种中存在不同类型的等位基因突变, 即表现为基因第7外显子碱基序列正常, 但在第2外显子处发生7 bp碱基缺失的突变类型以及在基因第4和第5外显子之间发生1个803 bp片段缺失的突变类型, 导致基因发生移码突变, 从而产生浓郁的香味。2-乙酰-1-吡咯啉(2-acetyl-1- pyrroline, 2-AP)是一种特殊的具有浓郁爆米花香味的挥发性物质, 已有学者研究表明, 2-AP是水稻稻米香味的特征化合物和主要香气贡献物[8]。在基因编码区或调控区发生突变的香稻品种中, 其所编码的蛋白甜菜碱脱氢酶(BADH2)翻译提前终止, 导致BADH2功能保守的结构域不能正常翻译, 产生无生物活性的甜菜碱脱氢酶, 无法完成脱氢反应, 造成2-AP前体物质4-氨基丁醛含量增加, 进而导致香味物质2-AP在水稻叶片和籽粒中大量合成和积累, 最终使水稻产生浓郁的香味[9-12]。因此,是调控水稻稻米香味的主要基因, 自然突变或通过人工干预改变其DNA遗传信息, 抑制基因的表达, 即可使非香型水稻材料产生香味, 从而创制出新的香稻种质资源。随着生物技术的不断发展, 分子标记辅助选择育种、分子设计育种、全基因组育种以及转基因育种等技术已经成为水稻遗传育种过程中重要且高效的分子育种技术和策略, 可明显提高育种效率, 加快香稻新品种的培育, 从而弥补传统育种中的缺陷和不足, 实现水稻产量的突破和稻米品质的同步提高。近年来, 随着转基因技术的不断发展和成熟, 利用基因编辑技术对目标性状基因进行定点改良已成为行之有效的转基因技术手段之一。其中RNAi技术[13]、ZFN (锌指核酸酶)技术[14]和TALEN (转录激活样效应因子核酸酶)技术[15]在早期的基因功能研究方面被视为有效的基因编辑工具。Niu等[16]利用RNAi技术, 成功降低了日本晴转基因后代植株中基因的表达, 从而使香味物质2-AP的含量明显增加。Chen等[17]通过人工microRNA转基因技术, 同样实现了抑制日本晴中基因的表达, 在转基因株系后代籽粒中2-AP的含量显著提高。Shan等[18]通过TALEN技术, 对日本晴香味基因进行基因组编辑, 通过后代分离鉴定, 在T1代株系中获得了不含转基因克隆载体且香味得到明显改良的纯合突变体材料。近年来, 新推出和发展起来的CRISPR-Cas9 (成簇规律间隔短回文重复技术)是继RNAi、ZFN和TALEN等基因编辑技术推出后的第3代基因编辑技术。由于其具有操作简单、靶基因突变效率高、成本低且易获得纯合突变等特点, 目前已快速发展成为各研究领域中基因编辑和基因修饰方面最为关键的技术之一, 并广泛应用于植物和动物基因功能和遗传改良研究[19-20]。邵高能等[21]通过CRISPR-Cas9技术对常规粳稻品种中花11的香味基因进行编辑, 获得了1株无转基因载体骨架且在第1外显子插入一个碱基T的纯合突变体材料。该材料中基因RNA表达水平显著下调, 籽粒中香味物质2-AP含量显著提高, 成功地对中花11香味基因进行了编辑。祁永斌等[22]利用CRISPR-Cas9技术将常规粳稻品种嘉58和秀水134中的进行编辑, 成功获得了多个在位点发生不同类型突变且无转基因成分的基因编辑株系, 株系籽粒中2-AP的含量均极显著高于非转基因野生型对照品种, 实现了对常规粳稻品种香味性状的定向改良。因此, 利用CRISPR-Cas9基因编辑技术可快速、精准且高效地对水稻香味基因进行编辑, 从而加快香稻育种进程。但目前已报道的利用CRISPR-Cas9技术编辑基因的遗传转化受体如日本晴、中花11、嘉58和秀水134等均为粳稻模式品种或常规粳稻品种, 而在籼稻品种中的应用报道较少, 尤其对籼型三系杂交稻保持系亲本材料香味基因的编辑从而创制香型三系不育系新品种的研究尚未见报道。
籼稻三系不育系作为杂交水稻的重要亲本, 对杂交水稻新组合的培育具有十分关键的作用, 生产应用价值高。但目前籼稻三系不育系的选育主要还是通过常规的杂交、自交和多世代连续回交技术, 若对其作单一香味性状进行改良, 易带来潜在不良性状的连锁累赘, 且周期长, 育种进程缓慢, 目前生产上育成的优质香型籼稻三系不育系较少。因此, 利用CRISPR-Cas9基因编辑技术对水稻香味基因进行定向编辑, 从而实现香味性状的改良, 可有效提高育种效率, 进一步加快优质香型籼稻三系不育系的培育。明太A是三明市农业科学研究院近年来自主选育的优质籼型杂交稻三系不育系, 其具有株型好、米质优、配合力强和异交结实率高等优点。目前已利用该不育系育成国家审定杂交稻新品种3个, 省级审定杂交稻新品种5个。但该不育系不具有香味, 有待进一步集聚香味基因, 以增强其市场竞争力。本研究以明太A同型保持系明太B为研究材料, 利用CRISPR-Cas9基因编辑技术对其香味基因进行定向编辑, 通过PCR鉴定和测序分析获得不含转基因载体骨架且在位点发生纯合突变的基因编辑株系明太B-。进一步通过测交和回交转育方法并结合靶点检测分析, 创制纯合香型三系杂交稻不育系明太A-, 为香型籼稻三系不育系的选育提供新的育种思路, 同时为高产优质香型杂交稻新品种的选育提供新的种质资源。
1 材料与方法
1.1 试验材料
本研究以明太A同型保持系明太B为遗传转化受体, 利用CRISPR-Cas9基因编辑技术并结合农杆菌介导的遗传转化方法对其基因进行敲除, 开展常规的转基因试验, 转基因材料种植于三明市农业科学研究院沙县琅口转基因试验基地, 常规田间种植及管理。
1.2 靶点设计及载体构建
利用生物信息学数据库网站(http://rice.plantbiology.msu.edu/index.shtml), 参考粳稻品种日本晴基因组, 下载水稻香味基因(基因登陆号:) DNA序列。结合https://crispr.cos. uni-heidelberg.de/index.html在线分析工具, 以基因的CDS序列为靶序列, 分别在其第1外显子和第2外显子区域设计靶点, 并通过BLAST比对分析, 确保其特异性。其中Target 1为靶点一, Target 2为靶点二, 分别加上对应的靶点接头。其中Target 1-Fwd和Target 1-Rev为第1外显子设计靶点接头, Target 2-Fwd和Target 2-Rev为第2外显子设计靶点接头。二聚体制备(50 µL体系), 含H2O 40 µL、上下游引物各 5 µL。95℃预变性10 min, 以55℃退火10 min, 最后14℃保持5 min。利用北京唯尚立德生物科技有限公司提供的载体试剂盒将二聚体构建至CRISPR-Cas9载体。10 µL体系含CRISPR-Cas9载体1.5 µL、二聚体2 µL、31I 0.5 µL、T4-ligase 0.5 µL、T4-buffer 1 µL和H2O 4.5 µL, 37℃反应2 h。构建好的Cas9/sgRNA质粒载体通过测序验证后用于水稻遗传转化并对目标基因进行编辑和敲除。
1.3 转基因材料的创建和检测
构建CRISPR-Cas9基因敲除表达载体, 通过农杆菌介导转化保持系明太B愈伤组织, 通过潮霉素抗性筛选获得转基因阳性植株。采用改良的CTAB法提取转基因T0代植株幼苗叶片基因组DNA, 利用潮霉素抗性标记引物-F/R和Cas9核酸酶特异性引物identify-F/R对提取的DNA进行PCR扩增检测。PCR反应体系20 μL, 包括2×PCR MasterMix 10 μL (Vazyme), 正向引物1.0 μL (10 μmol L–1), 反向引物1.0 μL (10 μmol L–1), DNA模板1.5 μL (50 ng μL–1), ddH2O 6.5 μL。PCR反应程序为: 94℃预变性5 min; 94℃变性30 s, 56℃退火30 s, 72℃延伸1 min, 共35个循环; 72℃延伸7 min, 4℃保持。PCR扩增产物通过1%琼脂糖凝胶电泳进行分离和纯化, 出现明显条带的即为转基因阳性植株, 无条带的为阴性植株。T1代材料采用同样的方法筛选无转基因成分单株。
1.4 突变类型分析
根据水稻香味基因序列, 在其靶点位置上下游设计特异性测序引物Seq-F/R, 利用高保真酶Phanta Max Super-Fidelity DNA Polymerase (Vazyme)对基因编辑后代基因靶点相邻序列进行PCR扩增。PCR反应体系50 μL, 包括2×Phanta Max buffer 25 μL, dNTP Mix (10 mmol L–1) 1 μL, 上游引物2.0 μL (10 μmol L–1), 下游引物2.0 μL (10 μmol L–1), Phanta Max Super-Fidelity DNA Poly-merase 1 μL, DNA模板2 μL (50 ng μL–1), ddH2O 17 μL。PCR反应程序为: 95℃预变性3 min; 95℃变性30 s, 57℃退火30 s, 72℃延伸60 s, 共35个循环; 72℃延伸5 min, 4℃保存。PCR扩增产物通过1%琼脂糖凝胶进行电泳和分离, 利用琼脂糖凝胶DNA回收试剂盒(OMEGA)对目的片段进行回收和纯化或连接pMD18-T载体后送大连TaKaRa生物技术有限公司测序。参照野生型明太B基因序列, 并利用Snapgene和DNAMAN等软件对测序结果进行比对和分析, 同时观察峰图是否有套峰出现从而判断其突变类型。测序峰图中有套峰的为杂合突变, 无套峰且测序结果和野生型一致或不一致的分别为未突变和双等位基因纯合突变。
1.5 香味物质2-AP含量测定
采用GC-MS气相色谱质谱联用仪测定香味物质2-乙酰-1吡咯啉(2-AP)的含量, 以2,4,6,-三甲基吡啶(TMP)作为内标, 最低检出限为0.01 mg kg–1。收获野生型和转基因材料成熟种子, 脱壳并将糙米碾磨成粉末, 称取1.0 g米粉样品于5 mL锥形瓶中, 加入1.0 mL质量浓度为0.5 mg L–1的TMP提取试剂, 80℃水浴浸提3 h。取出后自然条件下冷却至室温, 将上清液移至带内插管的进样瓶中, 静置30 min后待测。气体成分以高纯氦气作为传送媒介连续注射至配置有光离子探测器的气相色谱仪, 色谱柱为HP-5MS (30 m×0.25 mm×0.25 μm), 恒压不分流进样,进样量为1.0 μL。具体检测方法参照应兴华等[23], 并做了相应的改进。
1.6 Badh2基因表达分析
利用RNA提取试剂盒(Vazyme)提取野生型和转基因突变体材料苗期叶片总RNA, 使用反转录试剂盒(Vazyme)获得第1链cDNA, cDNA模板稀释一定倍数后用于半定量RT-PCR和荧光定量qRT-PCR, 分析香味基因相对表达量。使用SYBR qPCR Master Mix (Vazyme)作为荧光染料, PCR反应体系为: 2×SYBR qPCR Mix 10 μL, 正向引物和反向引物各0.5 μL (10 μmol L–1), cDNA模板1 μL, ddH2O补至20 μL。PCR反应程序: 94℃预变性1 min; 94℃变性15 s, 57℃退火15 s, 72℃延伸30 s, 共40个循环。以作为内参基因, 基因相对表达量采用2–DDCt方法计算。
1.7 主要农艺性状考察、稻米品质检测以及指纹图谱分析
在水稻成熟期, 分别随机选取野生型和转基因材料T2代植株共5个单株, 对包括株高、穗长、分蘖数、穗总粒数、结实率、千粒重、粒长、粒宽、长宽比、剑叶长和剑叶宽等主要农艺性状进行考察和分析, 分别3次生物学重复。此外, 收获水稻成熟种子, 对包括胶稠度、碱消值、直链淀粉含量和蛋白质含量等稻米蒸煮食味品质以及包括垩白度、透明度、垩白粒率、糙米率、精米率和整精米率等稻米外观品质进行测定, 3次生物学重复。获得的数据通过Microsoft Excel进行统计和分析。此外, 利用农业行业标准(NY/T 1433-2014)推荐的48对水稻SSR核心引物对野生型和转基因株系进行指纹图谱和遗传差异分析。PCR反应体系(10 μL): 2×PCR MasterMix 5 μL (Vazyme), 正向引物和反向引物等体积混合溶液1.0 μL (10 μmol L–1), DNA模板0.8 μL (50 ng μL–1), ddH2O 3.2 μL。PCR反应程序为: 94℃预变性5 min; 94℃变性30 s, 55℃退火30 s, 72℃延伸30 min, 共35个循环; 72℃延伸7 min, 4℃保存。PCR扩增产物通过8%非变性聚丙烯酰胺凝胶电泳进行分离和纯化, 电压120 v, 时间90 min, 利用核酸染料Ultra GelRed (Vazyme)染色20 min后在凝胶成像系统(Bio-Rad)中照相观察。
1.8 明太A-badh2的选育及配组分析
以获得的具有浓郁香味且性状稳定的基因编辑株系为父本, 与野生型三系不育系明太A进行测交和回交转育, 期间利用Seq-F/R引物对回交后代单株靶点进行PCR扩增和测序分析, 筛选位点为纯合突变香味基因型且表型和基因编辑株系一致的单株进行回交, 获得不育性稳定且具有香味基因型的株系明太A-。为鉴定其配合力, 利用已通过农业部国家农作物品种审定委员会审定的杂交稻品种明太优703、明太优3009的恢复系明恢703和明恢3009与其进行试制测配。所配制的杂交组合种植于三明市农业科学研究院沙县琅口转基因试验基地, 3个小区重复, 小区面积13.33 m2,株行距20 cm×20 cm, 单本栽插, 常规田间管理。于成熟期从小区中间选择5个单株对包括播始历期、株高、穗长、有效穗、穗粒数、结实率和千粒重等主要农艺性状进行考察, 同时进行小区测产分析。同样田间栽培和管理条件下种植明太优703、明太优3009及区试对照品种天优华占, 并采取同样的方法对其主要农艺性状进行考察和小区测产分析, 获得的数据通过Excel进行统计和分析。此外, 为鉴定明太A-在杂交稻组合香味性状上的表现, 本研究利用三明市农业科学研究院自主选育的优质香型恢复系明恢1831分别与野生型明太A以及基因编辑后的明太A-进行少量手工试制测配, 获得杂交稻组合明太A/明恢1831和明太A-/明恢1831。同时, 采用目前在水稻育种中被广泛应用的优质香稻品种泰国小香占作为香味对照品种。相应材料种植于三明市农业科学研究院沙县琅口转基因试验基地, 常规田间管理, 待植株完全成熟后, 分别单独收获其种子并利用GC-MS检测籽粒中香味物质2-AP含量。
2 结果与分析
2.1 CRISPR-Cas9表达载体的构建
利用前人研究和设计开发的位点特异性引物(Badh2P1-P10)[6]对明太B香味基因全长序列进行克隆和测序分析。结果表明, 该基因具有完整的CDS编码序列, 属于典型的非香型籼稻品种。此外, 该品种具有株型好、米质优和配合力强等特点。因此, 本研究以明太B作为转基因受体, 借助CRISPR-Cas9基因定点编辑技术开展转基因试验。参照粳稻品种日本晴基因组序列, 获得水稻香味基因全长DNA序列(登录号:), 利用https://crispr.cos.uni-heidelberg. de/index.htmlh和BLAST在线分析和序列比对工具, 分别在基因第1和第2外显子区域设计一条长度为20 bp且特异性较好的靶点序列Target 1 (TGGCCACGGCGATCCCGCAG)和Target 2 (AGGCGAGATCCCGGCGGGCA) (表1)。通过制备二聚体后将其构建至CRISPR-Cas9表达载体(图1-A), PCR扩增测序验证后将含有sgRNA的Cas9表达载体转化至农杆菌感受态EHA105, 并开展转基因试验。

表1 本研究所使用的引物序列
2.2 Badh2基因编辑及靶点突变类型分析
以明太B愈伤组织为转基因受体, 利用农杆菌介导的水稻转基因法进行遗传转化, 共获得15个独立的T0代转基因植株。分单株提取每个转基因植株苗期叶片全基因组DNA, 并利用潮霉素抗性标记引物-F/R和核酸酶Cas9特异性引物identify-F/R对DNA进行PCR扩增检测外源基因。分析发现, 其中10个单株基因组已成功插入了含靶点序列的外源载体, 为转基因阳性植株, 转化阳性率达到66.67% (图1-B, C)。通过设计特异性测序引物Seq-F/R对筛选出的10个阳性转基因植株基因靶点位置相邻序列进行PCR扩增和测序分析。结果显示, 共8个独立的T0代转基因植株材料在PAM附近发生了编辑, 其中6个单株(L1、L2、L3、L8、L13和L15)为杂合突变, 分别在第1外显子或第2外显子处表现出6种不同方式的突变类型(图1-D, E); 2个单株(L5和L7)为双等位基因纯合突变, 分别表现为在基因第2外显子处距离起始密码子ATG下游223 bp和221 bp位置发生1个碱基T的插入和7个碱基GGGCACG的缺失(图1-E),导致基因发生移码突变, 进而影响其相应蛋白BADH2的正常结构和功能。为获得无转基因载体成分的基因编辑株系, 分别单独收获L5和L7 2个T0代转基因植株种子, 继续在转基因试验田种植其T1代分离材料, 每个株系分别种植24个单株。通过提取单株幼苗叶片基因组DNA, 进一步利用潮霉素抗性标记引物和核酸酶Cas9特异性引物以及基因测序引物对外源转基因载体进行鉴定, 并同时对基因靶点位置DNA序列进行PCR扩增和测序分析。研究结果显示, 其2个转基因株系T1代分离单株在基因靶点位置突变特性与其T0代表现一致, 其纯合突变可稳定遗传, 在后代中不再发生分离。但转基因载体在其中一个基因编辑株系L5后代中发生了分离, 24个T1代植株中共检测到5个单株不含有外源转基因载体(图1-F, G); 而在基因编辑株系L7分离的24个T1代植株中, 未检测到不含外源转基因载体的单株(图1-H, I)。根据田间表现, 从L5株系T1代中选择一个长势较好、结实率高且香味浓郁的单株L5-T1-15, 进行进一步加代繁殖并用于后续的功能研究和表型分析, 同时本研究将该株系命名为明太B-。

图1 Badh2基因编辑及其突变类型分析
A: Cas9/gRNA载体图; B:identify-F/R引物对T0代阳性转基因植株PCR检测; C:-F/R引物对T0代阳性转基因植株PCR检测; D, E: 基因编辑株系T0代单株靶点1和靶点2突变类型分析; F, H:identify-F/R引物对T1代基因编辑株系中基因PCR检测; G, I:-F/R引物对T1代基因编辑株系中基因PCR检测。图A中的LB为载体左边界, UBI为UBI启动子,为基因, gRNA为引导RNA, rU6为水稻U6启动子, 35S为35S启动子, Hygro为潮霉素基因, RB为载体右边界。图B和图C中“+”代表阳性对照, “-”代表阴性对照。图D和图E中蓝色字体表示靶点序列, 红色字体表示PAM序列, “-”表示碱基缺失, “+”表示碱基插入。图B、C、F、G、H和I中的M代表2000 bp DNA marker。
A: the vector map of Cas9/gRNA; B: PCR identification of the positive transgenic plant in the gene-editing plants of T0generation withidentify-F/R; C: PCR identification of the positive transgenic plant in the gene-editing plants of T0generation with-F/R; D and E: mutation analysis of Target 1 (D) and Target 2 (E) in the gene-editing plants of T0generation; F and H: PCR detection ofgene in the gene-editing plants of T1generation withidentify-F/R; G and H: PCR detection ofgene in the gene-editing plants of T1generation with-F/R. LB, UBI,, gRNA, rU6, 35S, Hygro, and RB in Fig. A represent the vector left border, UBI promoter,gene, guide RNA, rice U6 promoter, 35S promoter, hygromycin, and vector right border, respectively. “+” and “–” in Fig. B–C represent positive control and negative control, respectively. The nucleotides with blue and red font in Fig. D–E represent Target and PAM sequence, respectively,“-” and “+” in Fig. D–E represent base deletions and base insertion, respectively. M in Fig. B–C, F–H, and I all represent 2000 bp DNA marker.
2.3 转基因后代Badh2基因表达水平检测
通过CRISPR-Cas9基因编辑技术, 获得一个具有浓郁香味的转基因水稻新材料明太B-, 该材料不含外源转基因载体且在基因第2外显子发生单个碱基插入纯合突变。同时研究发现, 明太B-与野生型明太B表现出相似的植株表型。为了进一步研究香味基因在转基因后代中的功能以及在RNA转录水平上的表达情况, 分别提取明太B和转基因突变体材料明太B-T2代植株苗期叶片总RNA, 并通过半定量RT-PCR和荧光定量qRT-PCR技术对基因进行表达水平分析。研究结果显示, 明太B-中基因的相对表达量明显低于野生型明太B, 差异达到极显著水平(<0.01) (图2-A, B)。因此, 通过CRISPR-Cas9基因编辑技术已成功对明太B中的香味基因进行了编辑, 且在转基因材料中, 其基因第2外显子单个核苷酸的插入, 直接导致了该基因发生移码突变, 从而影响了其正常转录和RNA表达水平。
2.4 转基因后代香味物质2-AP含量测定
前期研究表明, 2-乙酰-1-吡咯啉(2-AP)是香稻的香味特征化合物和主要贡献物。为了进一步分析基因突变和表达水平降低是否是导致明太B-产生浓郁香味的关键因素, 本研究收获该突变体材料T2代植株成熟种子, 采用气相色谱-质谱联用技术(GC-MS)对其籽粒中香味物质2-AP的含量进行检测和分析。检测过程中2-AP和TMP在野生型明太B和突变体明太B-两组材料GC-MS总离子色谱中能得到有效的分离(图2-D, E), 研究结果显示, 明太B籽粒中香味物质2-AP的含量为0.052 mg kg–1, 而明太B-籽粒中2-AP的含量达到了0.586 mg kg–1(图2-C)。因此, 相对于野生型对照品种明太B, 突变体材料明太B中香味物质2-AP的含量极显著提高(<0.01)。以上结果表明, 明太B-中基因的突变以及表达下调, 是导致其香味物质2-AP含量增加和积累以及浓郁香味产生的关键因素。
2.5 主要农艺性状考察、稻米品质检测以及指纹图谱分析
为了研究香味基因突变后是否对表型性状及稻米品质产生一定的影响, 本研究对野生型明太B和突变体材料明太B-T2代植株主要农艺性状以及稻米蒸煮食味品质和外观品质等各项指标进行考察和检测。生物学统计分析发现, 所有指标在2组材料间均无显著差异(图3和图4)。此外, 利用农业行业标准(NY/T 1433-2014)中推荐的48对水稻SSR核心引物对明太B和明太B-进行指纹图谱和遗传差异分析。结果显示, 仅1对引物RM571在2组材料基因组DNA中检测到等位变异, 其他引物在2组材料中扩增获得的基因型条带完全一致(图5)。因此, 通过以上数据分析结果表明, 利用CRISPR-Cas9基因编辑技术对明太B中的香味基因进行敲除后获得的转基因突变体材料明太B-与野生型具有较高的遗传相似度, 且在外观表型、稻米品质等各项指标间均无显著差异, 同时该材料不仅表现出浓郁的香味, 而且不含外源转基因载体, 因此可直接应用于后期香型杂交水稻新品种的选育, 从而加快香稻育种进程。

图2 明太B及明太B-badh2中Badh2基因RNA转录水平及香味物质2-AP含量
A, B:基因在明太B和明太B-中的表达水平; C: 明太B和明太B-中2-AP含量; D, E: 明太B和明太B-总离子色谱图及内标2,4,6-三甲基吡啶。图A中为水稻内参基因。图B和图C中数据用平均数±标准差表示(检验: *:< 0.05, **:< 0.01),= 3。图中MTB表示明太B, MTB-表示明太B-。
A–B: the relative expression levels ofin MTB and MTB-analyzed by semi-quantitative RT-PCR (A) and qRT-PCR (B); C: 2-AP content in MTB and MTB-; D–E: the total ion chromatograms (TIC) of 2-AP and TMP (as the internal standard) in MTB and MTB-.in Fig. A was amplified as the control. Values in Fig. B–C are shown as means ± SDs of three biological replicates (Student’s-test: *:< 0.05, **:< 0.01). MTB and MTB-in all figures represent Mingtai B and Mingtai B-, respectively.
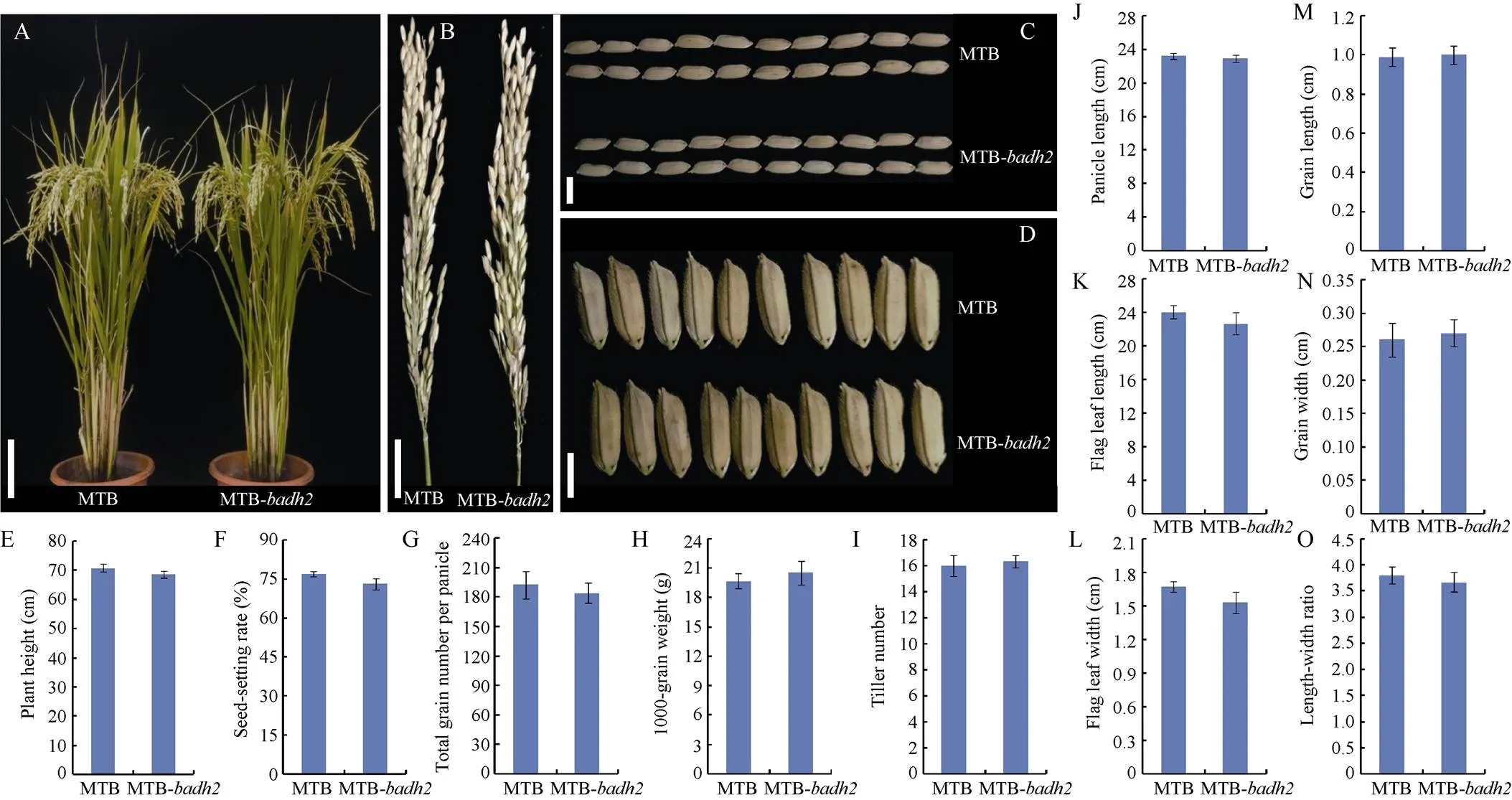
图3 表型性状在明太B和明太B-badh2中的表现
A~D: 野生型明太B和突变体明太B-成熟期植株、穗子和谷粒表型比较; E: 株高(cm); F: 结实率(%); G: 穗总粒数; H: 千粒重(g); I: 分蘖数; J: 穗长(cm); K: 剑叶长(cm); L: 剑叶宽(cm); M: 粒长(cm); N: 粒宽(cm); O: 长宽比。图A中标尺表示10 cm; 图B中标尺表示3 cm; 图C和D中标尺表示0.5 cm。图E~O中数据用平均数±标准差表示(检验: *:< 0.05, **:< 0.01),= 5。MTB: 明太B; MTB-: 明太B-。
A–D: the phenotype comparison of plant, panicle, and grains between wild-type MTB and MTB-mutant at mature stage; E: plant height (cm); F: seed setting rate (%); G: the total grain number per panicle; H: 1000-grain weight (g); I: tiller number; J: panicle length (cm); K: flag leaf length (cm); L: flag leaf width (cm); M: grain length (cm); N: grain width (cm); O: length-width ratio. Bars: 10 cm in A, 3 cm in B, 0.5 cm in C and D. Values in Fig. E–O are shown as means ± SDs of five biological replicates (Student’s-test: *:0.05; **:0.01). MTB: Mingtai B; MTB-: Mingtai B-.

(图4)
A: 胶稠度; B: 碱消值; C: 直链淀粉含量(%); D: 蛋白质含量(%); E: 垩白度; F: 透明度; G: 垩白粒率(%); H: 糙米率(%); I: 精米率(%); J: 整精米率(%)。数据用平均数±标准差表示(检验: *:< 0.05, **:< 0.01),= 3。MTB: 明太B; MTB-: 明太B-。
A: gel consistency; B: alkali spreading value; C: amylose content (%); D: protein content (%); E: chalkiness degree; F: transparency degree; G: chalkiness rate (%); H: brown rice rate (%); I: white rice rate (%); J: head rice rate (%). Values are shown as means ± SDs of three biological replicates (Student’s-test: *:0.05, **:0.01). MTB: Mingtai B; MTB-: Mingtai B-.

图5 野生型和突变体材料指纹图谱分析
每对SSR引物4个样品, 前2个为明太B, 后2个为明太B-; M: 100 bp DNA ladder marker。
Each pair of SSR primer had four samples, the first two were Mingtai B, and the last two were Mingtai B-. M: 100 bp DNA ladder marker.
2.6 明太A-badh2配组优势及香味分析
以筛选获得的具有浓郁香味的基因编辑株系明太B-为父本, 与野生型不育系明太A进行测交和回交转育并结合位点测序分析, 选育获得纯合香型三系不育系明太A-(图6-A)。为了鉴定明太A-的配合力以及在组合产量上的优势, 选用已通过农业部国家农作物品种审定的杂交稻品种明太优703、明太优3009的恢复系明恢703和明恢3009作父本, 利用明太A-作母本进行试制测配, 并对所配制的杂交稻组合明太A-/明恢703、明太A-/明恢3009的主要农艺性状及产量超标优势进行考察和分析。结果表明, 与审定品种明太优703、明太优3009相比, 杂交稻组合明太A-/明恢703和明太A-/明恢3009在主要农艺性状及产量方面没有显著差异; 与区试对照品种天优华占相比, 明太A-/明恢703、明太A-/明恢3009主要农艺性状, 包括穗长、穗粒数、千粒重和结实率均显著高于对照品种, 其中穗长、穗粒数、千粒重达极显著水平(<0.01); 同时, 在产量方面, 2个杂交稻组合相对对照品种天优华占的增产幅度分别达到6.6%和6.0% (表2)。这些结果表明杂交稻组合明太A-/明恢703和明太A-/明恢3009具有较强的产量超标优势, 香味基因编辑后的明太A-依然保持较高的配合力。此外, 为了鉴定香味基因编辑后的明太A-在杂交稻组合香味性状上的表现, 利用自主选育的优质香型恢复系明恢1831分别与明太A以及明太A-进行少量试制测配, 获得杂交稻组合明太A/明恢1831和明太A-/明恢1831 (图6-B)。GC-MS检测分析结果显示, 杂交稻组合明太A-/明恢1831籽粒中香味物质2-AP的含量达到0.212 mg kg–1, 极显著高于对照组合明太A/明恢1831 (0.08 mg kg–1), 且与香味对照品种泰国小香占(0.206 mg kg–1)相近(图6-C)。
3 讨论
香味是影响稻米食味品质的一项极其重要的指标, 是水稻品质改良的一个重要目标性状[24]。全球香稻种质资源丰富, 栽培历史悠久且种植分布范围广泛, 国内外颇有名气的香稻品种有印度的Basmati系列、泰国的KDML105、日本的宫香、美国的Jasmine 85和Della以及我国东北的稻花香、云南的螃蟹谷、广西的靖西香糯和贵州的香禾等, 但这些传统的地方品种不仅具有独特的地理区域局限性, 而且存在产量低、抗病能力差、易倒伏等诸多缺点, 从而限制了其在实际生产和推广上的应用[5,21-22]。目前, 香稻育种主要还是通过香型与非香型水稻品种间杂交、回交等常规育种技术将香味导入现有的优良品种。然而,由于水稻香味性状受隐性基因控制, 在杂交后代群体进行单株选择时容易造成杂合状态下香味基因的丢失以及在水稻籽粒灌浆成熟前很难对目标性状进行鉴定, 同时香味基因可能与产量、品质和抗性基因存在连锁累赘, 导致常规育种在材料选择和鉴定过程中的复杂性和繁琐性。因此, 利用传统育种技术来改良稻米香味以及选育优质香稻新品种不仅费时费力, 且易受到各种不确定因素的影响[21-22,25]。
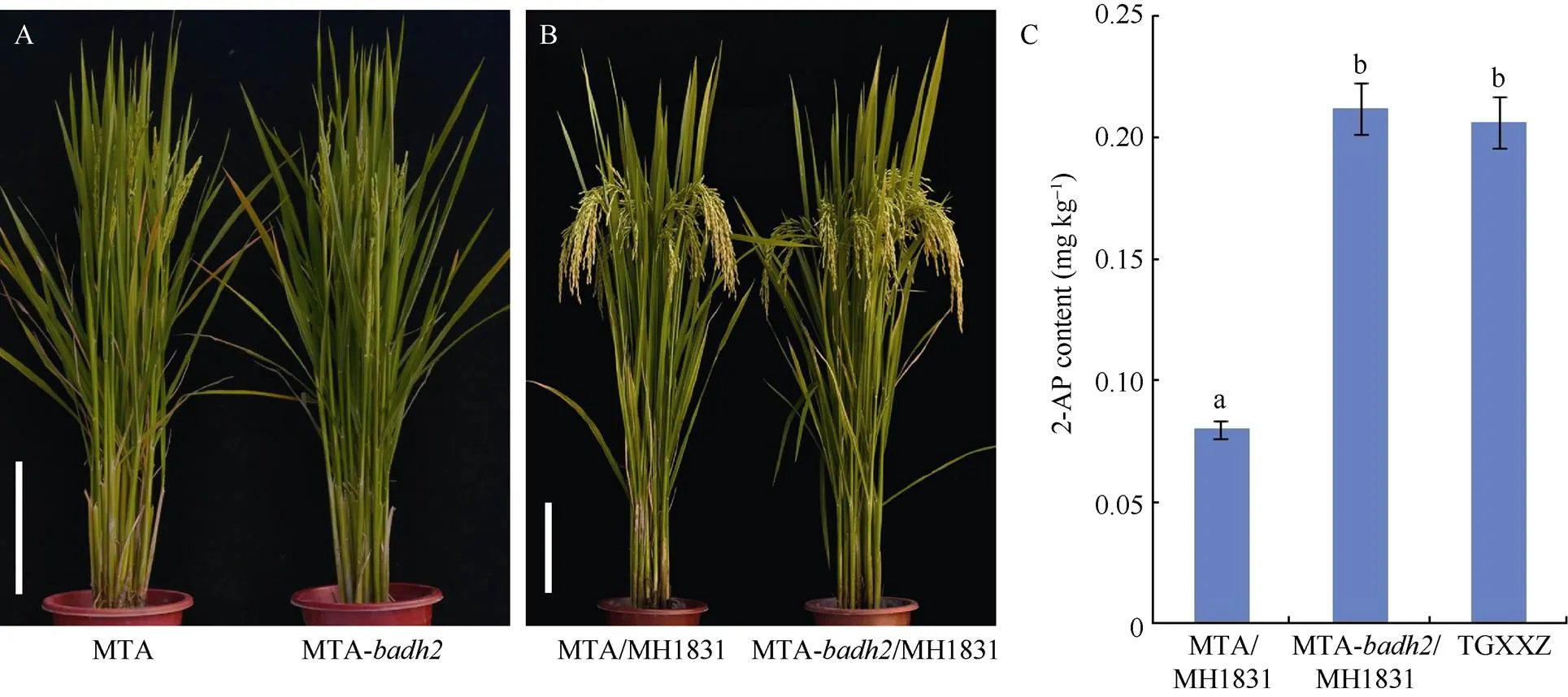
图6 明太A-badh2配制杂交组合明太A-badh2/明恢1831香味物质2-AP含量
A: 明太A和明太A-植株表型; B: 明太A/明恢1831和明太A-/明恢1831植株表型; C: 明太A/明恢1831, 明太A-/明恢1831和泰国小香占香味物质2-AP含量。图A和B中标尺表示20 cm。图C中数据用平均数±标准差表示,= 3, 不同字母表示在0.01水平上差异极显著。MTA: 明太A, MTA-: 明太A-, MTA/MH1831: 明太A/明恢1831, MTA-/MH1831: 明太A-/明恢1831, TGXXZ: 泰国小香占。
A: plant morphology of MTA and MTA-; B: plant morphology of MTA/MH1831 and MTA-/MH1831; C: 2-AP content in MTA/MH1831, MTA-/MH1831, and TGXXZ. Bars: 20 cm in A and B. Values in Fig. C are shown as means ± SDs of three biological replicates. Different letters indicate significantly different at the 0.01 probability level. MTA: Mingtai A, MTA-: Mingtai A-, MTA/MH1831: Mingtai A/Minghui 1831, MTA-/MH1831: Mingtai A-/Minghui 1831, TGXXZ: Taiguoxiaoxiangzhan.

随着生物技术的不断发展, 尤其是香味基因的分离克隆和功能研究以及相应功能标记的开发, 分子标记辅助选择技术、RNAi技术、基因组编辑技术已经广泛应用于香味基因的鉴定、筛选和香味性状的改良以及优质香型杂交稻新品种的选育和创制, 从而大大加快了香稻育种进程[6,26-27]。CRISPR-Cas9技术是目前应用最为广泛的基因组编辑技术, 是继RNAi技术、TALEN核酸酶技术和ZFN锌指核酸酶技术之后发展最为迅速的一个可对基因组进行精准定向敲除和编辑的新技术, 其具有设计构建简单、编辑效率高且易获得纯合突变体等优点, 已成功应用于植物、动物和微生物基因改造等生物工程以及人类疾病诊断和治疗等生物医学领域[28-33]。前人研究表明, 水稻香味主要由8号染色体上编码甜菜碱脱氢酶基因控制, 通过基因编辑等生物技术方法对基因进行定点突变, 可实现水稻香味性状的改良, 从而创制香型水稻新种质。但是, 无论是前期通过RNAi技术或TALEN技术还是目前利用CRISPR-Cas9等基因组编辑技术对香味进行改良从而获得的转基因香型水稻材料, 主要还是以粳型模式品种日本晴和中花11以及粳型常规稻品种嘉58、秀水134和龙粳11等为转化受体, 其中日本晴和中花11本身农艺性状与目前大量推广且在杂交水稻育种过程中广泛应用的优良品种相比存在一定的差距; 嘉58、秀水134和龙粳11虽具有优良性状或优良品质, 但不含有恢复基因, 在进一步直接应用于三系杂交水稻新品种的选育和创制等方面受到一定程度的限制[16-18,21-22,34]。同时, 迄今为止很少有见报道利用基因编辑技术对籼稻品种香味性状进行改良、创制籼型香稻新种质的研究, 尤其是籼型优质三系不育系香稻材料的创制。
明太B是三明市农业科学研究院自主选育的优质籼型三系杂交稻保持系亲本材料, 其对应的三系不育系明太A具有株型好、米质优、配合力强和异交结实率高等优点, 并于2020年6月通过福建省农作物品种审定。前期研究已委托农业农村部稻米及制品质量监督检验测试中心对其米质指标进行了检测, 结果显示: 其垩白度、透明度、胶稠度、直链淀粉含量及碱消值等指标均达部颁一级米品质标准。其所配制的杂交稻组合在2020—2022年期间共有8个通过省级以上审定, 其中明太优703、明太优3009和明太优633已通过农业部国家农作物品种审定, 其米质均达部颁3级以上优质米品质标准。本研究以杂交稻保持系明太B为转化受体, 利用CRISPR- Cas9基因编辑技术, 在水稻基因第1外显子和第2外显子分别设计特异性靶点并对其进行编辑。通过对基因编辑材料T0代进行转基因阳性植株鉴定以及靶点突变类型检测和测序分析, 共获得8个在PAM位点附近发生编辑的单株, 且不同靶点发生的突变类型各不相同。在第1外显子共有3个单株发生突变, 突变类型主要表现为单碱基插入以及不同数量的碱基缺失, 且均为杂合突变。在第2外显子共有5个单株发生突变, 突变类型同样表现为单碱基插入和不同数量的碱基缺失, 其中3个单株为杂合突变, 2个单株为纯合突变。因此, 基因编辑在靶点的突变类型仍具有不可预测性。但不管是由于碱基缺失导致的缺失突变, 还是由于碱基插入导致的移码突变, 均可在后代株系中稳定遗传并影响其目标性状。本研究筛选2个在位点发生纯合突变的T0代转基因植株, 并对其衍生的48个T1代单株进行靶点测序分析以及转基因成分检测, 成功获得了1个不含转基因载体骨架且具有香味的纯合突变体株系明太B-。该株系在基因第2外显子发生一个碱基T的插入, 导致该基因发生移码突变, 进而使基因在RNA转录水平上的表达量显著下调, 最终导致其籽粒中香味物质2-AP的含量显著增加, 从而产生浓郁的香味。此外, 通过采用农业行业标准 (NY/T 1433-2014) 推荐的48对水稻SSR核心引物进行指纹图谱和遗传差异分析时发现, 仅1对引物Rm571在明太B和明太B-间鉴定到等位变异, 说明2组材料具有较高的遗传相似度。前人研究报道CRISPR-Cas9基因编辑技术由于存在脱靶或在转基因过程中受组织培养的影响, 从而容易导致基因编辑后的材料在产量和品质性状上的改变[35]。因此, 基因编辑株系在目标性状得到改良的前提下, 其潜在的突变仍需做进一步的分析。本研究通过对野生型和突变体T2代植株11个表型性状以及4项稻米蒸煮食味品质和6项稻米外观品质指标进行考察和测定分析。结果表明, 所有指标在2组材料间均无显著差异(>0.05)。Nawaz等[36]和孙慧宇等[37]利用CRISPR-Cas9基因编辑技术分别对水稻抗稻瘟病基因和水稻香味基因进行敲除, 获得多个不含转基因成分的抗稻瘟病或香型纯合突变体株系。在株高、穗长、每穗总粒数、结实率、分蘖数和千粒重等主要农艺性状方面同样与野生型无明显差异。此外, 进一步利用明太B-与野生型不育系明太A进行测交和回交转育并结合位点测序分析, 成功选育获得了其对应的纯合香型三系不育系明太A-。为了鉴定香味基因编辑后的明太A-的配合力以及在组合产量上的优势, 利用已通过国家审定的杂交稻品种明太优703、明太优3009的恢复系明恢703、明恢3009与明太A-进行试制测配。结果表明, 明太A-依然具有较高的配合力, 所配制的杂交稻组合在产量上与明太优703、明太优3009相近, 且同样表现出明显的产量超标优势。此外, 由于水稻香味基因为隐性基因, 只有在纯合状态下才能表现出香味性状。因此, 为了进一步鉴定明太A-在香型杂交稻组合配制过程中的实际利用价值以及在组合香味性状上的表现, 本研究利用该不育系与自主选育的优质香型恢复系明恢1831进行少量试制测配, 获得香型杂交稻组合明太A-/明恢1831, 与对照组合明太A/明恢1831以及香味对照品种泰国小香占, 共同种植于三明市农业科学研究院沙县琅口转基因试验基地, 常规田间管理。待植株完全成熟后分别收获其F1代种子, 并利用GC-MS检测其籽粒中香味物质2-AP的含量。结果表明, 明太A-/明恢1831组合籽粒中2-AP含量极显著高于对照组合明太A/明恢1831, 且与香味对照品种泰国小香占相近。因此本研究通过CRISPR-Cas9基因编辑技术并结合常规育种和分子育种技术选育获得的纯合香型三系不育系明太A-, 不仅实现了在香味性状上的明显改良, 同时还保留了野生型明太A的强配合力特性。这为今后杂交稻三系不育系的选育提供了新的育种思路, 同时为后期高产优质香型杂交稻新品种的选育提供了新的种质资源。
4 结论
利用CRISPR-Cas9技术对优质籼型强配合力三系杂交稻保持系亲本材料明太B香味基因进行编辑和敲除, 获得1个不含转基因载体骨架, 且在第2外显子插入单个碱基T的纯合突变体株系明太B-。该株系基因RNA表达水平相对野生型显著下调, 稻米中香味物质2-AP的含量显著增加, 指纹图谱分析发现, 该株系与野生型具有较高的遗传相似度。此外, 其表型性状、稻米蒸煮食味品质和外观品质与野生型无显著差异。进一步与明太A进行测交和回交转育并结合位点测序分析, 获得纯合香型三系不育系明太A-。通过与恢复系明恢703、明恢3009测配, 其组合产量与国家审定品种明太优703、明太优3009相近, 且显著高于区试对照品种, 表明香味基因编辑后的明太A-依然保持较高的配合力和杂种优势。此外, 通过与优质香型恢复系明恢1831测配, 其杂交组合籽粒中香味物质2-AP的含量极显著高于对照组合明太A/明恢1831, 且与香味对照品种泰国小香占相近。因此, 利用CRISPR-Cas9基因编辑技术可实现对籼型水稻三系不育系香味性状的定向改良。
[1] 王春萍, 张现伟, 白文钦, 蒋晓英, 吴红, 林清, 唐永群, 姚雄,张巫军, 唐荣莉, 李经勇, 雷开荣. 新型香稻渝恢2103香味分子遗传特性分析. 作物学报, 2017, 43: 1499–1506. Wang C P, Zhang X W, Bai W Q, Jiang X Y, Wu H, Lin Q, Tang Y Q, Yao X, Zhang W J, Tang R L, Li J Y, Lei K R. Molecular genetic characters of fragrance in a new fragrant rice variety Yuhui 2103., 2017, 43: 1499–1506 (in Chinese with English abstract).
[2] Chen S H, Yang Y, Shi W W, Ji Q, He F, Zhang Z D, Cheng Z K, Liu X N., encoding betaine aldehyde dehydrogenase, inhibits the biosynthesis of 2-acetyl-1-pyrroline, a major component in rice fragrance., 2008, 20: 1850–1861.
[3] Bradbury L M T, Henry R J, Jin Q S, Reinke R F, Waters D L E. A perfect marker for fragrance genotyping in rice., 2005, 16: 279–283.
[4] 张江丽, 李苏洁, 李娟, 普世皇, 普玉娇, 张亮, 谭亚玲, 陈丽娟, 谭学林, 金寿林, 文建成. 不同来源水稻种质资源香味基因位点的鉴定. 分子植物育种, 2015, 13: 727–733.Zhang J L, Li S J, Li J, Pu S H, Pu Y J, Zhang L, Tan Y L, Chen L J, Tan X L, Jin S L, Wen J C. Identification of the fragrant genelocus in rice germplasm resources original from different area., 2015, 13: 727–733 (in Chinese with English abstract).
[5] 曾跃辉, 韦新宇, 黄建鸿, 肖长春, 张锐, 尚伟, 许旭明. 不同来源特种稻香味和黑色种皮基因的鉴定与遗传特性分析. 植物遗传资源学报, 2021, 22: 951–962. Zeng Y H, Wei X Y, Huang J H, Xiao C C, Zhang R, Shang W, Xu X M. Identification and genetic analysis of the genes for fragrance and black pericarp in special rice from different regions., 2021, 22: 951–962 (in Chinese with English abstract).
[6] Shi W W, Yang Y, Chen S H, Xu M L. Discovery of a new fragrance allele and the development of functional markers for the breeding of fragrant rice varieties., 2008, 22: 185–192.
[7] Shao G N, Tang A, Tang S Q, Luo J, Jiao G A, Wu J L, Hu P S. A new deletion mutation of fragrant gene and the development of three molecular markers for fragrance in rice., 2011, 130: 172–176.
[8] Bradbury L M T, Gillies S A, Brushett D J, Waters D L, Henry R J. Inactivation of an aminoaldehyde dehydrogenase is responsible for fragrance in rice., 2008, 68: 609–616.
[9] Bradbury L M T, Fitzgerald T L, Henry R J, Jin Q S, Waters D L E. The gene for fragrance in rice., 2005, 3: 363–370.
[10] Sakthivel K, Sundaram R M, Shobha R N, Balachandran S M, Neeraja C N. Genetic and molecular basis of fragrance in rice., 2009, 27: 468–473.
[11] Okpala N E, Mo Z, Duan M, Tang X. The genetics and biosynthesis of 2-acetyl-1-pyrroline in fragrant rice., 2019, 135: 272–276.
[12] Shao G N, Tang S Q, Chen M L, Wei X J, He J W, Luo J, Jiao G A, Hu Y C, Xie L H, Hu P S. Haplotype variation at, the gene determining fragrance in rice., 2013, 101: 157–162.
[13] Hannon G J. RNA interference., 2002, 418: 244–251.
[14] Cantos C, Francisco P, Trijatmiko K R, Slamet-Loedin I, Chadha-Mohanty P K. Identification of “safe harbor” loci inrice genome by harnessing the property of zinc-finger nucleases to induce DNA damage and repair.2014, 26: 302.
[15] Shan Q, Wang Y, Chen K, Liang Z, Li J, Zhang Y, Zhang K, Liu J, Voytas D F, Zheng X, Zhang Y, Gao C. Rapid and efficient gene modification in rice andusing TALENs., 2013, 6: 1365–1368.
[16] Niu X L, Tang W, Huang W Z, Ren G J, Wang Q L, Luo D, Xiao Y Y, Yang S M, Wang F, Lu B R, Gao F Y, Lu T G, Liu Y S. RNAi-directed downregulation ofresults in aroma (2-acetyl-pyrroline) production in rice (L.)., 2008, 8: 100.
[17] Chen M L, Wei X J, Shao G N, Tang S Q, Luo J, Hu P S. Fragrance of the rice grain achieved via artificial microRNA-induced down-regulation of., 2012, 131: 584–590.
[18] Shan Q W, Zhang Y, Chen K L, Zhang K, Gao C X. Creation of fragrant rice by targeted knockout of thegene using TALEN technology., 2015, 13: 791–800.
[19] Belhaj K, Chaparro-Garcia A, Kamoun S, Patron N J, Nekrasov V.Editing plant genomes with CRISPR/Cas9., 2015, 32: 76–84.
[20] Baltes N J, Voytas D F. Enabling plant synthetic biology through genome engineering., 2015, 33: 120–131.
[21] 邵高能, 谢黎虹, 焦桂爱, 魏祥进, 圣忠华, 唐绍清, 胡培松. 利用CRISPR/Cas9技术编辑水稻香味基因. 中国水稻科学, 2017, 31: 216–222. Shao G N, Xie L H, Jiao G A, Wei X J, Sheng Z H, Tang S Q, Hu P S. CRISPR/Cas9-mediated editing of the fragrant genein rice., 2017, 31: 216–222 (in Chinese with English abstract).
[22] 祁永斌, 张礼霞, 王林友, 宋建, 王建军. 利用CRISPR/Cas9技术编辑水稻香味基因. 中国农业科学, 2020, 53: 1501–1509. Qi Y B, Zhang L X, Wang L Y, Song J, Wang J J. CRISPR/Cas9 targeted editing for the fragrant genein rice., 2020, 53: 1501–1509 (in Chinese with English abstract).
[23] 应兴华, 徐霞, 陈铭学, 欧阳由男, 朱智伟, 闵捷. 气相色谱-质谱技术分析香稻特征化合物2-乙酰基吡咯啉. 色谱, 2010, 28: 782–785. Ying X H, Xu X, Chen M X, Ou-Yang Y N, Zhu Z W, Min J. Determination of 2-acetyl-1-pyrroline in aroma rice using gas chromatography-mass spectrometry., 2010, 28: 782–785 (in Chinese with English abstract).
[24] 彭波, 孙艳芳, 陈报阳, 孙瑞萌, 孔冬艳, 庞瑞华, 李先文, 宋晓华, 李慧龙, 李金涛, 周棋赢, 柳琳, 段斌, 宋世枝. 水稻香味基因及其在育种中的应用研究进展. 植物学报, 2017, 52: 797–807. Peng B, Sun Y F, Chen B Y, Sun R M, Kong D Y, Pang R H, Li X W, Song X H, Li H L, Li J T, Zhou Q Y, Liu L, Duan B, Song S Z. Research progress of fragrance gene and its application in rice breeding., 2017, 52: 797–807 (in Chinese with English abstract).
[25] Hinge V R, Patil H B, Nadaf A B. Aroma volatile analyses and 2AP characterization at various developmental stages in Basmati and Non-Basmati scented rice (L.) cultivars., 2016, 9: 38.
[26] Shi Y Q, Zhao G C, Xu X L, Li J Y. Discovery of a new fragrance allele and development of functional markers for identifying diverse fragrant genotypes in rice., 2014, 33: 701–708.
[27] He Q, Park Y J. Discovery of a novel fragrant allele and development of functional markers for fragrance in rice., 2015, 35: 217.
[28] Liao H K, Gu Y, Diaz A, Marlett J, Takahashi Y, Li M, Suzuki K, Xu R, Hishida T, Chang C J, Esteban C R, Young J, Belmonte J C L. Use of the CRISPR/Cas9 system as an intracellular defense against HIV-1 infection in human cells., 2015, 6: 6413.
[29] 梁敏敏, 张华丽, 陈俊宇, 戴冬青, 杜成兴, 王惠梅, 马良勇. 利用CRISPR/Cas9技术创制抗稻瘟病香型早籼温敏核不育系. 中国水稻科学, 2022, 36: 248–258. Liang M M, Zhang H L, Chen J Y, Dai D Q, Du C X, Wang H M, Ma L Y. Developing fragrant earlyTGMS line with blast resistance by using CRISPR/Cas9 technology., 2022, 36: 248–258 (in Chinese with English abstract).
[30] Gaj T, Gersbach C A, Barbas C F. ZFN, TALEN, and CRISPR/Cas-based methods for genome engineering., 2013, 31: 397–405.
[31] Wang H Y, Yang H, Shivalila C S, Dawlaty M M, Cheng A W, Zhang F, Jaenisch R. One-step generation of mice carrying mutations in multiple genes by CRISPR/Cas-mediated genome engineering., 2013, 153: 910–918.
[32] Mali P, Yang L H, Esvelt K M, Aach J, Guell M, Dicarlo J E, Norville J E, Church G M. RNA-guided human genome engineeringCas9., 2013, 339: 823–826.
[33] Wang Y P, Cheng X, Shan Q W, Zhang Y, Liu J X, Gao C X, Qiu J L. Simultaneous editing of three homoeoalleles in hexaploid bread wheat confers heritable resistance to powdery mildew., 2014, 32: 947–951.
[34] 徐善斌, 郑洪亮, 刘利锋, 卜庆云, 李秀峰, 邹德堂. 利用CRISPR/Cas9技术高效创制长粒香型水稻. 中国水稻科学, 2020, 34: 406–412. Xu S B, Zheng H L, Liu L F, Bu Q Y, Li X F, Zou D T. Improvement of grain shape and fragrance by using CRISPR/Cas9 system., 2020, 34: 406–412 (in Chinese with English abstract).
[35] Endo M, Mikami M, Toki S. Multigene knockout utilizing off-target mutations of the CRISPR/Cas9 system in rice., 2015, 56: 41–47.
[36] Nawaz G, Usman B, Peng H W, Zhao N, Yuan R Z, Liu Y G, Li R B. Knockout ofby CRISPR/Cas9 and iTRAQ-based proteomic analysis of mutants revealed new insights intoresistance in elite rice line., 2020, 11: 735.
[37] 孙慧宇, 宋佳, 王敬国, 刘化龙, 孙健, 莫天宇, 徐善斌, 郑洪亮, 邹德堂. 利用CRISPR/Cas9技术编辑基因改良粳稻香味. 华北农学报, 2019, 34(4): 1–8. Sun H Y, Song J, Wang J G, Liu H L, Sun J, Mo T Y, Xu S B, Zheng H L, Zou D T. Editinggene to improve the fragrance ofrice by CRISPR/Cas9 technology., 2019, 34(4): 1–8 (in Chinese with English abstract).
Development of high-quality fragrantCMS line by editinggene using CRISPR-Cas9 technology in rice (L.)
WEI Xin-Yu1,3,**, ZENG Yue-Hui1,3,**, YANG Wang-Xing2,3, XIAO Chang-Chun1,3, HOU Xin-Po2,3, HUANG Jian-Hong1,3, ZOU Wen-Guang2,3, and XU Xu-Ming2,3,*
1Biotechnology Research Institute, Sanming Academy of Agricultural Sciences, Sanming 365500, Fujian, China;2Rice Research Institute, Sanming Academy of Agricultural Sciences, Sanming 365500, Fujian, China;3Fujian Key Laboratory of Crop Genetic Improvement and Innovative Utilization for Mountain Area, Sanming 365500, Fujian, China
Fragrance is one of the important traits for quality improvement in rice, which is mainly controlled by thegene encoding a betaine aldehyde dehydrogenase on chromosome 8. The mutation ofgene can increase the content of 2-acetyl-1-pyrroline (2-AP) and promote the fragrance production in rice. In this study, thegene in Mingtai B (MTB), an elite maintainer line ofhybrid rice showing high eating quality bred by Sanming Academy of Agricultural Sciences, was edited and knocked out by using CRISPR-Cas9 technology. Two T0transgenic lines carrying homozygous mutation on the loci ofwere generated, and 48 T1individuals derived from these two plants were genotyped by PCR amplification and sequencing analysis. A mutant line named MTB-, which had a single T nucleotide insertion in the second exon ofwithout the vector skeleton, was finally obtained. In our study, the expression ofand the content of 2-AP were determined by semi-quantitative RT-PCR, qRT-PCR, and gas chromatography-mass spectrometry (GC-MS), respectively. Simultaneously, the 48 pairs of SSR markers recommended by “Sector Standard of Agriculture (NY/T 1433-2014)” were used to further analyze the DNA fingerprint and genetic diversity of the MTB and the MTB-. The results showed that theRNA level was significantly decreased in the MTB-compared with the wild-type MTB. In addition, the 2-AP content was dramatically increased in MTB-. DNA fingerprint analysis revealed that only the Rm571 primer pair was specific for identifying allelic variation between wild type and MTB-, suggesting that the genetic diversity between wild type and MTB-was very low. Furthermore, agronomic phenotype, cooking and eating quality, appearance quality of wild type, and MTB-were investigated and analyzed. There was no significant difference between MTB and MTB-. The corresponding stable fragrant CMS line Mingtai A-(MTA-) carrying homozygous mutant on the locus ofwas successfully generated by the conventional test-crossing and back-crossing techniques combined withsequencing analysis. Derived from this CMS line, MTA-/Minghui 1831, MTA-/Minghui 703, and MTA-/Minghui 3009 hybrid combinations had been bred. Among them, the grain yield of MTA-/Minghui 703 and MTA-/Minghui 3009 were significantly increased compared with that of Mingtai you 703 and Mingtai you 3009, which were registered and released by the National Crop variety Appraisal Committee. Moreover, MTA-/Minghui 1831 dramatically increased 2-AP content in the grains compared with MTA/Minghui 1831. Therefore, the CRISPR-Cas9-mediated technology could be used to edit theand improve the fragrance in rice, and it provides the theoretical guidance for development of fragrantCMS line, leading to an accelerated breeding process of fragrant hybrid rice.
rice; CRISPR-Cas9; gene editing; fragrance;; 2-acetyl-1-pyrroline (2-AP)
2023-02-21;
2023-03-03.
10.3724/SP.J.1006.2023.22043
通信作者(Corresponding author):许旭明, E-mail: fj63xxm@sina.com
**同等贡献(Contributed equally to this work)
韦新宇, E-mail: wxy1209@163.com; 曾跃辉, E-mail: 1_zengyuehui_1@163.com
2022-07-11;
本研究由财政部和农业农村部国家现代农业产业技术体系建设专项(CARS-01), 福建省自然科学基金项目(2021J01535, 2021J01536)和三明市科技计划项目(2019-N-4)资助。
This study was supported by the China Agriculture Research System of MOF and MARA (CARS-01), the Fujian Provincial Natural Science Foundation (2021J01535, 2021J01536), and the Sanming Municipal Science and Technology Project (2019-N-4).
URL: https://kns.cnki.net/kcms/detail/11.1809.S.20230302.1455.003.html
This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/).
