乳酸与运动:是敌是友?
2023-06-08邱俊强
曹 维,邱俊强
乳酸代谢是运动科学、临床医学等领域研究的热点。由于运动引起疲劳时往往伴随乳酸大量生成和肌肉pH 值下降,乳酸一直被广泛认为是导致运动能力下降和疲劳发生的原因,存在“乳酸引起运动性代谢性中毒”“排酸跑”等认识误区。随着Brooks(2008)提出“乳酸穿梭”理论以及近年来研究发现的不断深入,乳酸不仅能作为能量底物进行有氧代谢供能,还能作为信号分子作用于靶向部位,调节运动代谢过程,在维持运动表现和调节机体功能等多方面具有积极作用。
1 乳酸
“lactic acid”和“lactate”均翻译为“乳酸”,但两者所代表的物质不同,容易混淆。“lactic acid”是一种酸,“lactate”是“lactic acid”去掉1 个H+后的乳酸根阴离子,两者的化学变化公式为:
目前已知糖酵解过程会产生“lactate”,尚不清楚糖酵解过程是否产生“lactic acid”,也不清楚积累的“lactate”和质子是否为同一来源(Brooks,2018)。在生理pH 状态下,人体内几乎不存在“lactic acid”,99%以上的“lactic acid”解离为“lactate”和H+(邱俊强 等,2019;Crisp et al.,2015)。
2 乳酸是导致运动引起代谢性酸中毒的原因?
糖酵解系统在剧烈运动时发挥主要供能作用,并迅速生成乳酸和H+,同时血液和肌肉内pH 值降低。肌肉pH 值与乳酸和丙酮酸之间呈显著的线性关系,并且乳酸积累与H+的产生直接相关,因此认为乳酸是导致肌肉pH 值降低、代谢性酸中毒和肌肉疲劳的原因之一(Donaldson et al.,1978;Hill et al.,1923),对于运动表现是极其有害的(Cairns,2006)。但随着研究的不断深入,学者们有了不同观点(Hochachka et al.,1933;Wilkie,1979)。
糖酵解过程的一系列反应步骤表明,1 分子葡萄糖或糖原作为底物生成2 分子丙酮酸,并释放2 个或1 个质子。在乳酸脱氢酶A(lactate dehydrogenase A,LDHA)的作用下,1 分子丙酮酸结合1 个质子被还原为乳酸,同时1 个还原型烟酰胺腺嘌呤二核苷酸(reduced nicotinamide adenine dinucleotide,NADH)被氧化成烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)。将反应步骤归纳为式(2)和(3),可以看出,葡萄糖作为底物进行糖酵解代谢时没有质子净生成;糖原作为底物,质子不仅没有净生成,反而减少。丙酮酸转化成乳酸是质子消耗的过程,有利于质子的清除(Robergs et al.,2004)。
Fitts 等(1976)指出,疲劳是由游离H+增加,而不是乳酸所导致的。运动使细胞能量需求增加,ATP 在大量分解为ADP、Pi 和产生能量的同时释放1 个质子,而ADP、Pi、电子和质子也能进入线粒体(直接或间接),作为氧化磷酸化的底物,最终生成ATP、CO2和H2O(刘晓华 等,2008)。Debold(2012)通过体外研究发现,高水平的H+和Pi 抑制肌纤维内肌球蛋白、肌钙蛋白和原肌球蛋白等活动,减少力的产生和诱发疲劳。中、低强度运动时,线粒体生成ATP 能够满足肌肉收缩需求,糖酵解和磷酸原系统作用不明显,细胞内产生的质子可被线粒体用于氧化磷酸化及维持膜间空间的质子梯度,不会积聚;而在高强度或极限强度运动时,肌肉收缩需要更快的能量供应,更多的ATP水解增加了质子释放;此外,剧烈运动更大程度地依赖糖酵解和磷酸原系统快速供能,这2 个系统会利用ADP 和Pi生成ATP,加剧质子堆积。质子生成和质子去除之间的平衡被打破,导致肌细胞pH 值下降,发生代谢性酸中毒(图1)。
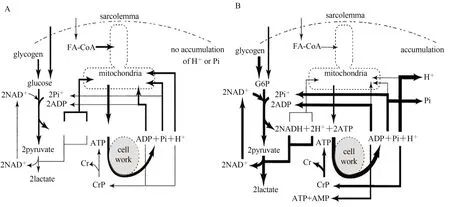
图1 不同运动强度下的骨骼肌能量代谢(Robergs et al.,2004)Figure 1.Energy Metabolism of Skeletal Muscle under Different Exercise Intensities (Robergs et al.,2004)
尽管乳酸不是导致运动引起代谢性酸中毒的根源,但有研究认为,乳酸本身会影响糖酵解限速酶的活性,减少糖酵解途径能量生成。乳酸会直接抑制骨骼肌磷酸果糖激酶(phosphofructokinase,PFK)酪氨酸残基磷酸化,并抑制骨骼肌、心脏、肝脏和肾脏组织内PFK 和果糖-6-磷酸的活性,降低酶变构抑制位点对ATP 的亲和力。乳酸还可以改变己糖激酶结构,使其从线粒体和细胞核中分离,间接抑制酶活性(Leite et al.,2007,2010)。
综上所述,运动引起代谢性酸中毒的真正原因是质子释放及质子释放速率与质子缓冲和去除速率之间的不平衡。乳酸水平升高是运动的伴随结果,可作为反映代谢性酸中毒的间接标志之一(Van Meerhaeghe et al.,2005)。乳酸不仅不是代谢性酸中毒的原因,相反其能够发挥类似缓冲系统和质子清除剂的作用;丙酮酸氧化成乳酸的过程消耗H+,乳酸会在生成后携带H+共同转运出细胞。如果肌肉不产生乳酸,酸中毒和肌肉疲劳将更快发生,并更严重地影响运动能力(Robergs et al.,2004)。
3 乳酸穿梭是乳酸发挥作用的基础理论
Brooks(1986)提出“乳酸穿梭”理论,颠覆了“乳酸是代谢废物”的认知。乳酸能够在生成细胞和利用细胞、脑和组织之间转移,作为能量底物并发挥信号分子的作用,但其无法自由穿过细胞质膜,必须依赖单羧酸转运蛋白(monocarboxylate transporters,MCTs)进行跨膜转运(曾军英 等,2008)。根据穿梭位置,乳酸穿梭分为细胞间乳酸穿梭和细胞内乳酸穿梭。
3.1 MCTs
MCTs 是哺乳动物细胞膜上一类重要的具有14 个亚型的跨膜转运蛋白家族。乳酸的跨膜转运是通过质子偶联MCT 或Na+偶联单羧酸转运蛋白(sodium-coupled monocarboxylate transporters,SMCTs)实现的。MCT1~4具有介导质子与乳酸双向共转运的能力(Jones et al.,2016)。SMCT1(SLC5A8)和SMCT2(SLC5A12)以Na+偶联的运输方式,介导细胞对乳酸的摄取,但其亲和力较低(Adeva-Andany et al.,2014)。
MCT1 分布最为广泛,包括骨骼肌、脑、心肌等多种组织(曾军英 等,2008),在骨骼肌中主要存在于氧化型肌纤维,参与血脑屏障对乳酸的摄取(Lauritzen et al.,2015)。MCT2 的亲和力最强,主要存在于底物浓度较低的组织,在脑内主要位于神经元,尤其是谷氨酸能突触的突触后成分。MCT4 亲和力较低,但转运率较高,主要存在于骨骼肌和脑,在骨骼肌中主要分布在糖酵解型肌纤维,在脑中仅局限于星形胶质细胞(Bergersen,2007)。脑内MCT4和MCT2 的分布特点促使乳酸从星形胶质细胞向神经元转移(Bergersen,2007)。
3.2 细胞间乳酸穿梭
细胞间乳酸穿梭的发生部位包括糖酵解型肌纤维和氧化型肌纤维、骨骼肌和心肌、星形胶质细胞和神经元之间等(图2)。动物实验和人类研究均发现,无论是安静或运动状态,骨骼肌、心脏、脑等组织都在持续生成乳酸(Bergman et al.,1999;Gertz et al.,1988;Glenn et al.,2015)。运动增加肌肉能量需求,糖酵解型肌纤维利用MCT4 将乳酸和H+以1∶1 的比例共同转运出去,通过组织间隙和血液循环到达氧化型肌纤维、心肌等组织,再利用MCT1 进入组织进行有氧代谢或作为主要糖异生前体(王杨文洁等,2020)。在运动过程中,糖酵解型肌纤维中的乳酸和H+共转运约占释放H+的70%~75%(Messonnier et al.,2007)。
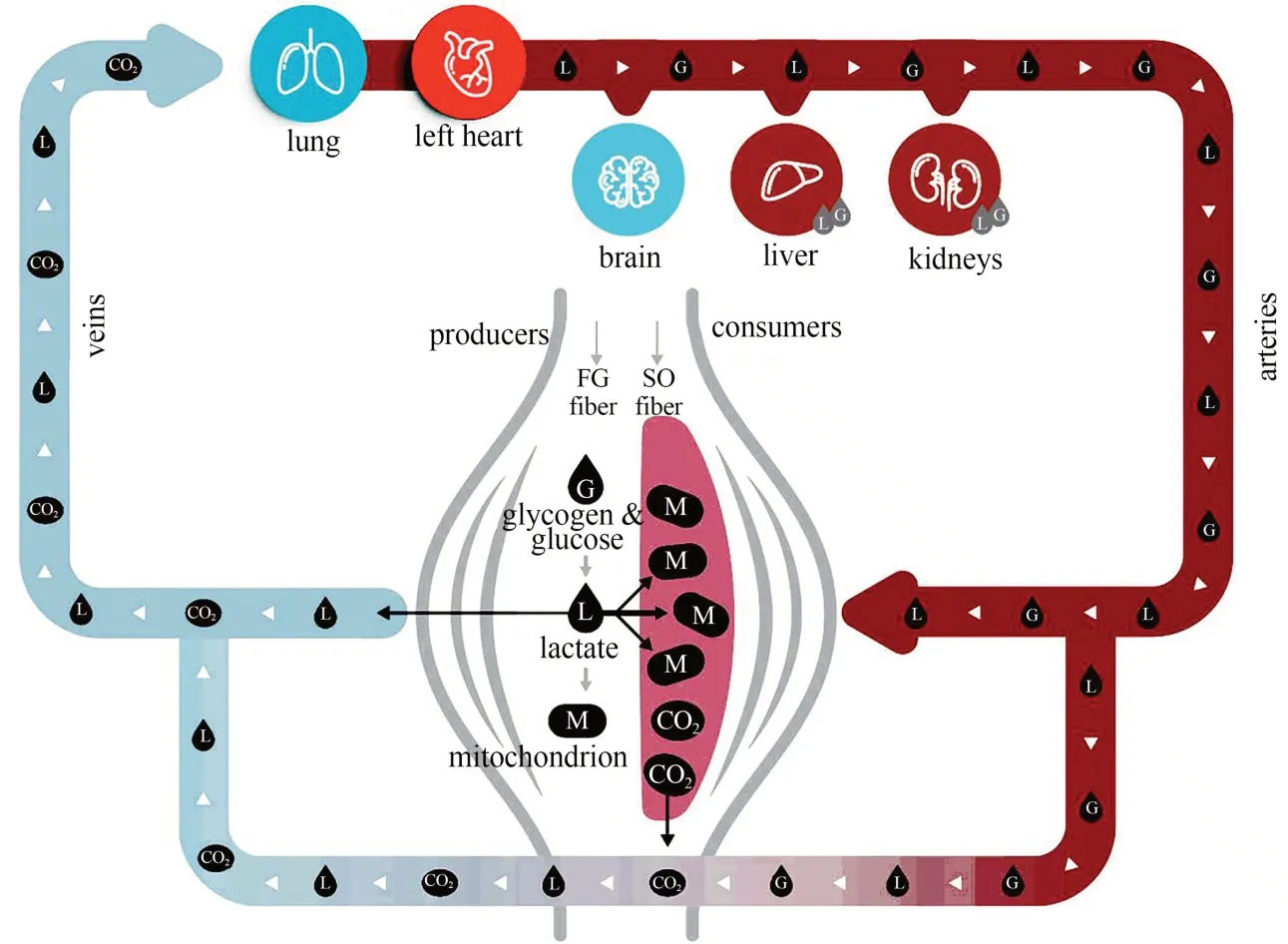
图2 乳酸穿梭示意图(Brooks,2018)Figure 2.Schematic Diagram of Lactate Shuttle (Brooks,2018)
3.3 细胞内细胞质-线粒体乳酸穿梭
乳酸始终在生成和氧化,由于细胞质LDH 活性较高,并倾向于丙酮酸转换成乳酸的方向,细胞中的乳酸含量高于丙酮酸(Rogatzki et al.,2015)。在安静和运动时,人体肌肉中的乳酸浓度比丙酮酸浓度分别高约10 倍和200~400 倍(Henderson et al.,2004)。细胞内的乳酸从细胞质穿梭进入线粒体进行氧化的过程,涉及线粒体乳酸氧化复合物(mitochondrial lactate oxidation complex,mLOC),其结构包括MCT1、细胞外基质金属蛋白酶诱导因子(extracellular matrix metalloproteinase inducer,EMMPRIN/CD147/BSG)、线粒体乳酸脱氢酶(mitochondrial lactate dehydrogenase,mLDH)和细胞色素氧化酶(cytochrome oxidase,COX;图3)。乳酸到达mLDH 所在的线粒体内膜外侧,被mLDH 氧化成丙酮酸。这种由mLDH 催化的内源性乳酸氧化反应,与线粒体电子传递过程中COX 外氧化还原作用有关,在这个过程中同时生成的NADH 和H+通过苹果酸-天冬氨酸和甘油-磷酸穿梭物穿梭进入线粒体(Brooks,2018)。丙酮酸利用MCT1 或线粒体丙酮酸载体(mitochondrial pyruvate carrier,mPC)转运,穿过线粒体内膜进入线粒体,经过三羧酸循环(tricarboxylic acid cycle,TCA)进行有氧氧化供能。
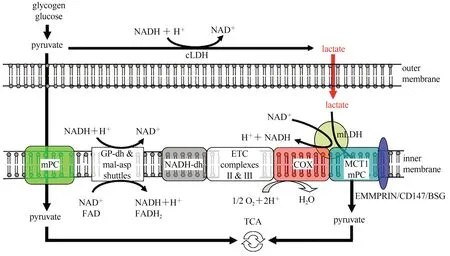
图3 mLOC的作用机制(Brooks,2020)Figure 3.Mechanism of mLOC(Brooks,2020)
综上所述,乳酸穿梭理论把糖酵解代谢和氧化磷酸化过程联系起来,两过程使机体内乳酸通量处于相对平衡的状态,诠释了乳酸作为能量燃料的价值。耐力训练能够增加线粒体数量和体积,增强线粒体氧化酶活性,这是训练提高耐力表现的适应体现,较低水平的刺激物(如ADP)即可激活线粒体氧化磷酸化速率,同时也能降低糖酵解关键酶活性,使乳酸代谢更加稳定。血乳酸水平升高是一种“应激”生物标记物(Poole et al.,2021),在缺氧情况下,氧化磷酸化过程被抑制,氧化速率小于乳酸产生速率,乳酸浓度升高。在氧充足条件下,如在中等强度运动或在活化的星形胶质细胞中,糖酵解过程增强,乳酸氧化速率小于产生速率,其浓度同样会升高。健康状态下,乳酸水平升高是短时现象。但在病理条件下,如癌细胞“warburg”现象,糖酵解酶活性增强,线粒体氧化能力降低,乳酸生成与丙酮酸和NADH 氧化速率不匹配,导致乳酸浓度和通量持续升高(漆正堂,2020)。另外,心力衰竭使心肌细胞线粒体丙酮酸氧化减少和乳酸输出增加,抑制乳酸输出有利于缓解心肌肥大,改善心衰(Cluntun et al.,2021)。
4 乳酸作为信号分子调节代谢
越来越多的研究证实,乳酸不仅是能源物质,还可作为信号分子作用于靶向部位,调节运动代谢过程。
4.1 调节能量代谢
4.1.1 抑制脂肪分解
乳酸是G 蛋白偶联受体81(G protein-coupled receptor 81,GPR81)或羟基羧酸受体1(hydroxycarboxylic acid receptor 1,HCA1)的天然配体和激动剂,可在1~20 mmol/L生理浓度范围内靶向激活GPR81,抑制脂肪细胞分解(Liu et al.,2009)。GPR81 与Gi 信号通路耦合,下调环磷酸腺苷(cyclic adenosine monophosphate,cAMP),降低蛋白激酶A活性,进而降低激素敏感性甘油三酯脂肪酶和脂肪甘油三酯脂肪酶等脂肪分解限速酶的活性(Rooney et al.,2011)。有研究发现,GPR81 缺陷小鼠的胰岛素诱导抗脂解作用减弱,提示GPR81 可能与胰岛素产生协同作用(Wallenius et al.,2017)。此外,乳酸在运动期间通过降低血浆儿茶酚胺水平减少脂肪分解(Fattor et al.,2005)。
4.1.2 影响糖酵解过程
高乳酸水平影响糖酵解限速酶的活性,减少丙酮酸和乳酸的产生,提示乳酸可能限制其他获得能量的方式,并间接有利于自身代谢。
乳酸和低氧诱导因子-1(hypoxia-inducible factor-1,HIF-1)存在潜在的交互控制机制。HIF-1 是一种氧平衡调控因子,由2 个亚单位组成,分别是HIF-1α(氧调节亚单位)和HIF-1β,是代谢适应缺氧的关键。运动,尤其是高强度运动,可以诱导HIF-1 基因表达(Asadi et al.,2020)和活性增加(Abe et al.,2015)。HIF-1 可以上调PFK 表达水平,增强骨骼肌糖酵解能力(Kim et al.,2006)。在缺氧状态下,HIF-1 可与LDHA 基因启动子结合,上调LDHA 基因表达,促进丙酮酸转化成乳酸(Semenza et al.,1996)。HIF-1 还可以上调糖酵解代谢酶丙酮酸脱氢酶激酶-1 蛋白表达,从而降低丙酮酸脱氢酶的活性,减弱丙酮酸氧化成乙酰辅酶A 的作用(Kim et al.,2006)。此外,HIF-1通过增加MCT4 基因和蛋白表达,促进乳酸转运(Ullah et al.,2006)。HIF-1 通过以上机制引起乳酸产生和转运增加,使糖酵解代谢能力增强。
过氧化物酶体增殖物激活受体γ共激活因子-1(peroxisome proliferator-activated receptor γ coactivator-1,PGC-1)是乳酸代谢的关键调节因子。PGC-1包括PGC-1α、PGC-1β和PGC-1 相关共激活剂3 个成员,其中PGC-1α 在氧化代谢活跃的组织部位(如慢肌纤维)更丰富(王慧婷 等,2020)。运动诱导PGC-1α 表达,从而促进线粒体氧化酶基因表达(Wan et al.,2014)。PGC-1α 与LDHB 启动子上的雌激素受体α 结合,上调LDHB 表达,同时下调LDHA 表达,促进乳酸分解,防止运动过程中血乳酸升高过度(Domènech-Estévez et al.,2015)。Kitaoka 等(2016)向小鼠腹腔注射乳酸钠溶液后发现,PGC-1α 基因表达增加。此外,体外实验发现,L6 细胞在高糖、高乳酸钠条件下的乳酸信号级联反应引起活性氧(reactive oxygen species,ROS)生成增加(Hashimoto et al.,2007)。而口服维生素C 抑制了人和大鼠因运动引起的PGC-1α上调(Gomez-Cabrera et al.,2008)。因此,有研究提出乳酸调节PGC-1α 表达可能由ROS 介导,但需要进一步研究的证实。
4.2 促进肌肉合成效应
乳酸激活GRP81,通过蛋白激酶C 依赖性途径、胰岛素样生长因子1 受体反式激活依赖性途径,激活丝裂原活化蛋白激酶/细胞外调节激酶(extracellular regulated protein kinases,ERK1/2)信号通路,以剂量依赖性方式增加C2C12 肌管直径(Li et al.,2014;Ohno et al.,2018)。乳酸还可能激活氧化应激,利用ROS 信号促进C2C12 细胞启动早期分化,推迟后期分化,而加入抗氧化剂后逆转了上述效应(Willkomm et al.,2014)。Oishi 等(2015)的研究结论也支持乳酸的合成代谢效应,乳酸和咖啡因混合物激活肌卫星细胞(Pax7、MyoD)活性和合成代谢(p70S6K 和mTOR 磷酸化)信号,能够使大鼠在低强度运动训练下增加肌肉质量和细胞核数量。
乳酸可能刺激睾酮激素分泌,通过激活mTOR 通路促进蛋白合成。体外和体内实验表明,10 mmol/L 乳酸使大鼠睾丸间质细胞的睾酮水平升高,生理水平的乳酸通过增加腺苷酸环化酶、细胞色素P450scc 和L 型钙通道的活性来刺激大鼠睾丸间质细胞的睾酮生成(Lin et al.,2010)。大鼠在运动期间,乳酸通过直接和间接增加睾丸cAMP 生成,增加睾酮生成(Lu et al.,1997)。
4.3 减轻炎症免疫反应
乳酸能够直接或通过激活GPR81 调节炎症免疫反应(Hu et al.,2020)。乳酸直接抑制骨髓源性巨噬细胞由脂多糖诱导的IL-6、IL-12 p40 和CD40 等促炎分子的产生(Errea et al.,2016)。小鼠巨噬细胞和人单核细胞培养实验表明,乳酸通过与GPR81 和抑制蛋白β2 相互作用,抑制Toll 样受体4 介导的IL-1β、Nod 样受体家族含pyrin 结构域蛋白3 和天冬氨酸蛋白水解酶-1 的诱导,减轻免疫性肝炎小鼠的炎症和器官损伤(Hoque et al.,2014)。此外,乳酸抑制NF-κB 的激活,降低急性胰腺炎和急性肝损伤的严重程度(Hoque et al.,2014;Lerch et al.,2014)。小鼠分娩期间的子宫乳酸水平可升高到9 mmol/L,通过激活GPR81 下调IL-6、趋化因子C-C 基序趋化因子配体2 和前列腺素H 合成酶2 等关键促炎因子的基因表达,减轻子宫炎症(Madaan et al.,2017)。在结肠炎小鼠模型中同样发现,GPR81 通过抑制IL-6、TNF-α 和IL-1β 等促炎因子,诱导IL-10 等抗炎因子分泌,调节肠道炎症免疫反应(Ranganathan et al.,2018)。
5 乳酸调节脑代谢和脑功能
越来越多研究证实,乳酸对于脑具有重要作用,除了作为能量燃料,还作为信号分子调控脑代谢和功能(宗博艺 等,2021)。在一定生理条件下,血乳酸可以通过血脑屏障穿梭入脑发挥相应作用(杨东升 等,2012)。星形胶质细胞-神经元-乳酸穿梭(astrocyte-neuron-lactate shuttle,ANLS),是脑内乳酸发挥重要作用的基础。
5.1 ANLS
即使在氧浓度正常的情况下,星形胶质细胞也会进行有氧糖酵解过程并生成乳酸,通过突触刺激支持神经元功能(Pellerin et al.,1994)(图4)。神经元和星形胶质细胞分别通过葡萄糖转运蛋白(glucose transporter,GLUT)家族的GLUT3 和GLUT1 摄取血液中的葡萄糖,由于星形胶质细胞终足覆盖于毛细血管表面,因此更容易摄取葡萄糖。Calì 等(2019)通过体内实验发现,星形胶质细胞是突触活动期间葡萄糖摄取的主要部位。星形胶质细胞从细胞外吸收乳酸的速度是神经元的4.3 倍,容量是神经元的2.3 倍(Gandhi et al.,2009)。星形胶质细胞内富含LDH5,有利于促进乳酸生成。乳酸由MCT1 和MCT4 从星形胶质细胞转运出来,再由MCT2 转运进入神经元细胞;研究发现神经元和星形胶质细胞的乳酸浓度之间存在梯度(Coggan et al.,2018),便于乳酸从星形胶质细胞释放并穿梭进入神经元(Mächler et al.,2016)。神经元富含LDH1,倾向于将乳酸转化成丙酮酸(张绘宇 等,2013)。有研究发现,在脑活动增强的情况下,兴奋性突触释放的神经递质谷氨酸在谷氨酸-天冬氨酸转运体和谷氨酸转运体-1 的作用下,以Na+共转运的方式进入星形胶质细胞,从而使细胞内Na+浓度升高,激活Na+/K+-ATPase 酶,进一步促进星形胶质细胞的糖酵解过程和乳酸生成,同时谷氨酸转化成谷氨酰胺,扩散到细胞外液,进而进入神经元转换成丙酮酸。
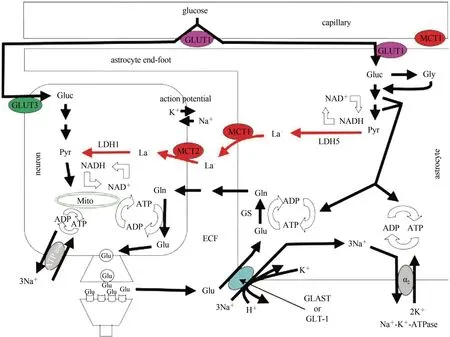
图4 ANLS理论示意图(Gladden,2004)Figure 4.Schematic Diagram of ANLS(Gladden,2004)
神经元本身也能产生和释放乳酸,但其内的MCT2可能在相对较低乳酸水平时即达到饱和,导致神经元无法输出乳酸(Dienel,2012)。脑糖原几乎全部存在于星形胶质细胞,作为“能量储存库”。糖原对神经元是有害的,病理条件下糖原积聚在神经元中,最终导致神经变性(Vilchez et al.,2007)。将糖酵解任务“外包”给星形胶质细胞,反映出星形胶质细胞和神经元之间存在代谢分区的特点(Laughton et al.,2007)。糖酵解速率受到ATP/ADP 比值调控,而ATP/ADP 比值又由线粒体活性和能量消耗决定,星形胶质细胞糖酵解生成乳酸的过程和神经元因能量需求而利用乳酸的过程在空间上的分离,既为糖酵解作用提供了一定的自由度,又使乳酸的产生不受神经元能量状态的影响(Barros,2013)。
5.2 乳酸是脑代谢的能源物质
糖是成人脑的主要能量底物,但越来越多的证据表明,乳酸在脑能量供应上也非常重要。正常生理状态下,脑乳酸浓度约为1.5~5.0 μmol/L(Mosienko et al.,2015)。乳酸在脑和血液循环之间的浓度梯度较小,加上血脑屏障结构的限制,乳酸较少从外周系统进入脑。外周血乳酸浓度正常时,对脑代谢的贡献约为10%(Boumezbeur et al.,2010)。运动能够使脑的主要能源物质由糖转向乳酸,以利于脑在低血糖情况下尽可能维持较高运作水平(Falkowska et al.,2015)。在中等强度运动时,血乳酸水平适当升高,脑对乳酸的摄取较低。当剧烈运动或静脉输注使血乳酸浓度上升到15 mmol/L 或更高时,脑对乳酸的摄取量可能高于葡萄糖,乳酸取代葡萄糖成为主要脑能量底物。大鼠进行力竭运动初期,脑乳酸水平先升高后下降。注射乳酸阻断剂导致大鼠运动能力下降,力竭时间缩短,提示乳酸在运动时发挥为神经元提供能量的重要作用(杨东升 等,2011)。训练有素的受试者进行不同强度运动时,脑乳酸代谢高于对照组,推测运动可以提高神经元和星形胶质细胞之间的乳酸转运能力(Kemppainen et al.,2005)。
5.3 乳酸作为信号分子调节脑代谢
5.3.1 葡萄糖感知
下丘脑,尤其是弓状核,通过调控激素分泌调节食物摄入和外周器官活动。血脑屏障没有把下丘脑和循环系统完全分隔开,靠近营养敏感神经元处可渗透部分离子(Ciofi et al.,2009;Leloup et al.,2016),中枢葡萄糖感应能够控制神经元信号级联,调控外周激素,进而调节葡萄糖摄取和代谢(Mergenthaler et al.,2013)。下丘脑的葡萄糖敏感性依赖于GLUT2 和葡萄糖激酶催化磷酸化葡萄糖的能力,而不受其产物葡萄糖-6-磷酸的影响。研究表明,星形胶质细胞释放的乳酸可能激活葡萄糖敏感神经元,进而影响星形胶质细胞上的GLUT2(Leloup et al.,2016)。
下丘脑神经元和食欲素神经元含有ATP 敏感性K+通道(ATP-sensitive potassium channel,KATP通道),KATP通道介导食欲素神经元信号转导。星形胶质细胞产生的乳酸进入神经元代谢为丙酮酸,并进入TCA 氧化生成ATP,引起细胞内ATP/ADP 比值的变化,导致KATP通道关闭(Matsuo et al.,2005);同时激活食欲素神经元兴奋性,促进觉醒、进食和寻求奖励,以及通过调节交感神经来控制外周血糖水平(Venner et al.,2011)。
5.3.2 调节脑能量代谢
乳酸通过调节GPR81 和NADH/NAD+比值,调节神经元的能量代谢和能量底物利用(Bergersen et al.,2012;Mosienko et al.,2015)。GPR81 在哺乳动物的脑中广泛分布,主要聚集于小脑和海马的兴奋性突触,生理范围浓度的乳酸通过剂量依赖性方式激活小脑和海马的GPR81,从而降低cAMP 水平,以利于神经元葡萄糖和糖原节省(Lauritzen et al.,2014)。另外,乳酸生成后转运到海马神经元生成丙酮酸的过程中,引起细胞内NADH/NAD+比值增加,提升N-甲基-D-天冬氨酸(N-methyl-D-aspartate,NMDA)受体活性,增强Ca2+内流和ERK1/2 磷酸化及可塑性相关基因Arc、c-Fos、Zif268 和脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)的表达(Yang et al.,2014)。但这种作用是在乳酸10~30 mmol/L 的高浓度前提下发生的(Mosienko et al.,2015),因此以上机制的生理意义有待探讨。
5.3.3 调节神经元兴奋性
乳酸激活GPR81,降低钙瞬变频率,通过与Giα亚单位偶联,抑制腺苷酸环化酶-cAMP 级联反应,抑制小鼠皮质层谷氨酸能和γ-氨基丁酸能神经元活动(Herrera-López et al.,2018)。此外,GPR81 还能与Giβγ亚单位相互作用,调节磷脂酶C 以降低神经元兴奋性(de Castro Abrantes et al.,2019)。衰老与脑中某些信号通路的过度激活有关,乳酸调节神经元兴奋性的作用可能为过度激活的信号级联提供一种保护机制,预防记忆减退等(Sun et al.,2017)。
5.4 乳酸介导运动提高认知和记忆
ANLS 是形成长期记忆所必需的过程,星形胶质细胞的糖原分解和乳酸释放对于长期而非短期记忆的形成,以及体内诱发的突触可塑性长时程增强(long-term potentiation,LTP)的维持必不可少。乳酸能有效逆转由MCT抑制和糖原分解药理学抑制(乳酸产生的机制之一)引起的遗忘效应,而等热量葡萄糖没有这种作用。糖原分解和星形胶质细胞乳酸转运蛋白也是诱导记忆形成所需的分子变化的关键,包括诱导磷酸化环磷腺苷效应元件结合蛋白、细胞骨架活性调节蛋白和磷酸化丝切蛋白。
5.4.1 通过BDNF介导运动改善认知
乳酸水平取决于运动强度和持续时间,BDNF 是一种与认知记忆改善相关的生长因子,血乳酸浓度与血浆/血清BDNF 浓度相关(Müller et al.,2020)。相比于中等或较高强度持续运动,高强度间歇运动产生更高浓度的血乳酸,血浆BDNF 浓度也更高(Jiménez-Maldonado et al.,2018)。已有研究表明,运动可促进脑内BDNF 表达,改善认知(于涛,2020)。动物实验证明,乳酸通过SIRT1 依赖性激活海马BDNF 介导运动对空间学习和记忆能力的影响(El Hayek et al.,2019)。运动过程中肌肉释放的乳酸穿过血脑屏障进入脑,激活组蛋白脱乙酰化酶(Sirtuin 1,SIRT1),进而增加转录辅激活因子PGC-1α 和分泌分子纤维连结蛋白III 型域包含蛋白5(fibronectin type III domain-containing protein 5,FNDC5)的水平,通过PGC-1α/FNDC5/BDNF通路,诱导BDNF 表达,从而改善学习和记忆能力。
5.4.2 促进成年海马神经发生
乳酸是成年人海马神经发生的促进因子。海马神经发生,即成年人脑中新神经元的形成,对记忆的形成和消失非常重要(Lev-Vachnish et al.,2019)。Wang 等(2019)研究发现,脑乳酸稳态可能对于中枢神经系统稳定运作至关重要。MCT1 受到脑血管内皮细胞磷酸酶张力蛋白同源物(phosphatase and tensin homology deleted on chromosome ten,PTEN)/磷酸肌醇-3-激酶(phosphinositide 3-kinase,PI3K)/Akt 信号通路的负反馈调节,当小鼠敲除PTEN 基因或MCT1 基因后,脑内乳酸无法转出到血液,脑乳酸水平显著升高,导致海马成体神经干细胞的过度增殖和分化障碍,海马神经发生损害,海马依赖性学习和记忆能力显著下降。也有研究认为,长期乳酸暴露能够以依赖MCT2 的方式促进神经发生,但对空间学习和记忆能力未产生有益影响(Lev-Vachnish et al.,2019)。
5.4.3 促进突触可塑性
乳酸通过增强神经元中NMDA 受体活性、提高NADH/NAD+比值、增强Ca2+内流和ERK1/2 磷酸化促进可塑性相关基因的表达,这可能是星形胶质细胞乳酸诱导神经可塑性的中心机制(Yang et al.,2014)。此外,乳酸在海马区诱导BDNF 表达和酪氨酸激酶受体B 信号传导,诱导谷氨酸突触连接处LTP 和新突触棘的生长(Edelmann et al.,2015),通过促进神经和突触形成,将新生神经元整合到神经元回路中,从而形成记忆印记(Harward et al.,2016)。
5.4.4 刺激血管生成
乳酸通过GPR81 促进ERK1/2 和PI3K/AKT 信号通路的磷酸化,通过感应升高的乳酸浓度增强脑血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)的表达和脑血管生成,血管生成则会导致毛细血管密度增加。已有研究证实,脑灌注与认知能力之间呈正相关,正常衰老个体、阿尔茨海默病和帕金森病患者的脑血管密度增加与维持认知能力和防止脑缺血有重要关联(de Silva et al.,2016)。对小鼠进行高强度间歇运动干预和皮下注射乳酸均能引起血乳酸水平升高,同时增加脑VEGF 蛋白表达和毛细血管密度(Morland et al.,2017)。
6 小结与展望
乳酸是糖酵解无氧代谢过程的最终产物,不仅不会导致运动引起代谢性酸中毒,还能够在一定程度上缓解剧烈运动时的pH 值降低,延缓酸中毒的发生和运动能力下降。乳酸穿梭理论打破了“乳酸是代谢废物”的错误观点,将糖酵解和氧化磷酸化过程联系起来,认为乳酸作为重要的有氧代谢底物和糖异生前体不仅能维持能量稳态,还能作为细胞间信号传导信使,通过不同的信号传导通路作用于靶向部位,调节能量代谢、促进肌肉合成、调节炎症免疫反应等。运动状态下,乳酸代替葡萄糖和糖原成为脑的主要能源物质,以达到节省糖和减缓疲劳的目的,刺激下丘脑调节能量摄入和不同神经元兴奋性。此外,乳酸可以介导运动改善脑认知和记忆功能的过程,对脑代谢和功能具有重要意义。未来研究需进一步探索乳酸代谢对运动表现的影响和人体不同组织部位调节作用的机制,以利于从乳酸代谢角度切入,提升运动表现并充分发挥运动促进健康的作用。
