糖皮质激素替代剂量对腺垂体功能减退症患者激素暴露的影响
2023-06-08夏友娟曹卫娟
夏友娟,曹卫娟
0 引言
腺垂体功能减退症(Hypopituitarism,HP)是指由于下丘脑和(或)垂体全部或大部分受损累及性腺、甲状腺、肾上腺轴,导致一种或多种垂体前叶激素分泌不足所致的内分泌功能减退综合征[1]。糖皮质激素(Glucocorticoid,GC)替代是HP患者治疗的基石。最近研究报道,根据当前对每日皮质醇产生率和口服氢化可的松(Hydrocortisone,HC)生物利用度的测量发现,健康成年人每天的皮质醇产生率为5.2~8.8 mg/m2,平均每天皮质醇产生率约7 mg/m2,相当于HC替代剂量15~25 mg/d,中间HC替代剂量为20 mg/d[2-4]。鉴于HP患者皮质醇生成率较低,而等剂量外源性激素替代高于内源性皮质醇生成率,将可能导致超生理剂量的激素水平。文献报道,超生理剂量GC(30 mg/d)替代激素暴露的风险明显增加[2,5],但生理替代量或小剂量是否亦存在激素暴露风险尚不明确。本研究拟采用回顾性分析HP患者服用不同剂量的GC发生激素暴露的风险,探讨生理剂量尤其小剂量GC替代能否在保证良好生活质量基础上降低激素暴露发生风险,旨在为HP患者寻找合理个性化GC替代剂量。
1 材料与方法
1.1 研究对象
1.1.1 入选标准 选取2010年1月至2020年12月于湖南师范大学附属湘东医院和湖南师范大学第一附属医院确诊的192例HP患者的临床资料进行回顾性分析。①年龄18~80岁,配合随访的患者;②HP诊断标准符合《2016年美国内分泌学会临床实践指南:成人垂体机能减退症激素补充治疗》[3];③至少含促肾上腺皮质激素(ACTH)缺乏并服用糖皮质激素替代的患者;④所有患者均接受1年以上稳定GC剂量替代治疗;⑤检验检查资料完整。其中男81例,女111例,年龄18~80岁,平均年龄(55.30±12.59)岁。本研究通过湖南师范大学附属湘东医院和湖南师范大学附属第一医院伦理委员会批准[湘东伦审2022第(002)号]。
1.1.2 排除标准 ①妊娠期及哺乳期女性;②激素替代治疗前存在相关疾病影响本研究结果;③一过性腺垂体功能减退;④合并垂体后叶受损。
1.2 方法
1.2.1 收集资料 查阅HP患者病历,收集病史、人口学特征、常规生化指标、激素水平及影像学检查(心电图、垂体MRI、骨密度检查等)、糖皮质激素替代种类及剂量、内分泌系统(向心性肥胖、糖尿病)、心血管系统[高血压、血脂异常、非酒精性脂肪肝病(Non-alcoholic fatty liver disease,NAFLD)、冠心病、心肌梗死]、骨骼系统(低骨量、骨质疏松、股骨头坏死)、消化系统(慢性胃炎、消化性溃疡、消化道出血)、神经精神系统(精神症状)。
1.2.2 研究分组与随访 参照 Dineen等[6-7]2项前瞻性研究,所有未接受HC的患者按照氢化可的松当量(Hydrocortisone equivalent,HCeq)计算,根据患者出院后服用GC替代剂量分为小剂量组(HCeq<20 mg/d)(37例)、生理剂量组(HCeq=20 mg/d)(53例)、超生理剂量组(HCeq≥30 mg/d)(102例),部分药物剂量予等价替换[3](20 mg HC=5 mg醋酸泼尼松=4 mg甲泼尼龙),分别占总体的19.3%、27.6%和53.1%。随访患者出院后服用GC剂量、其他激素替代及激素暴露的情况。
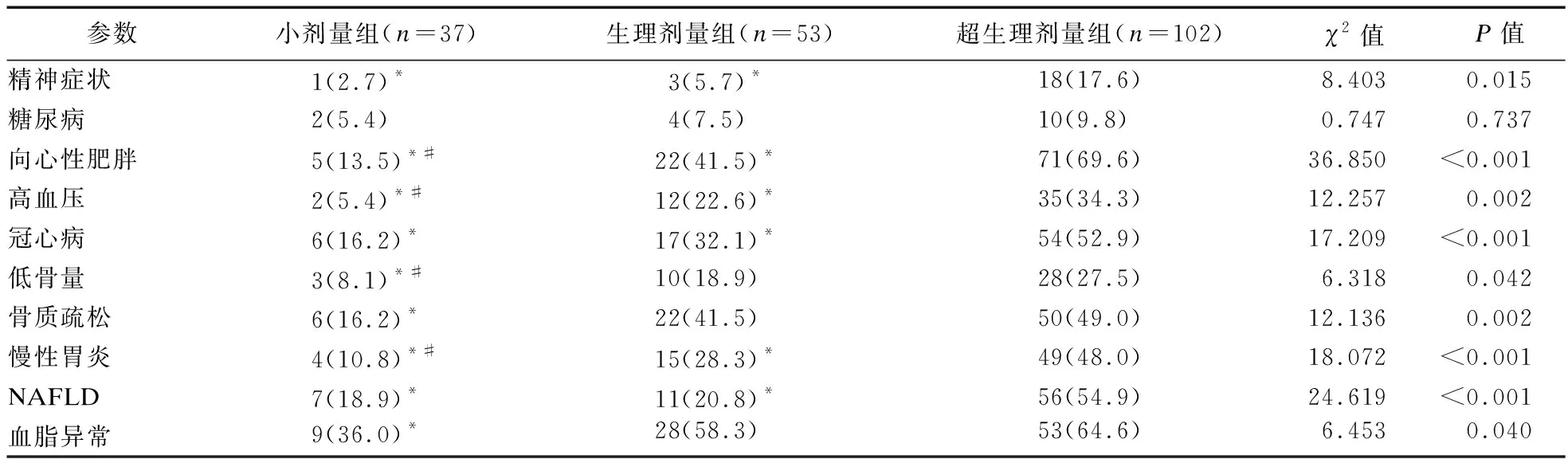
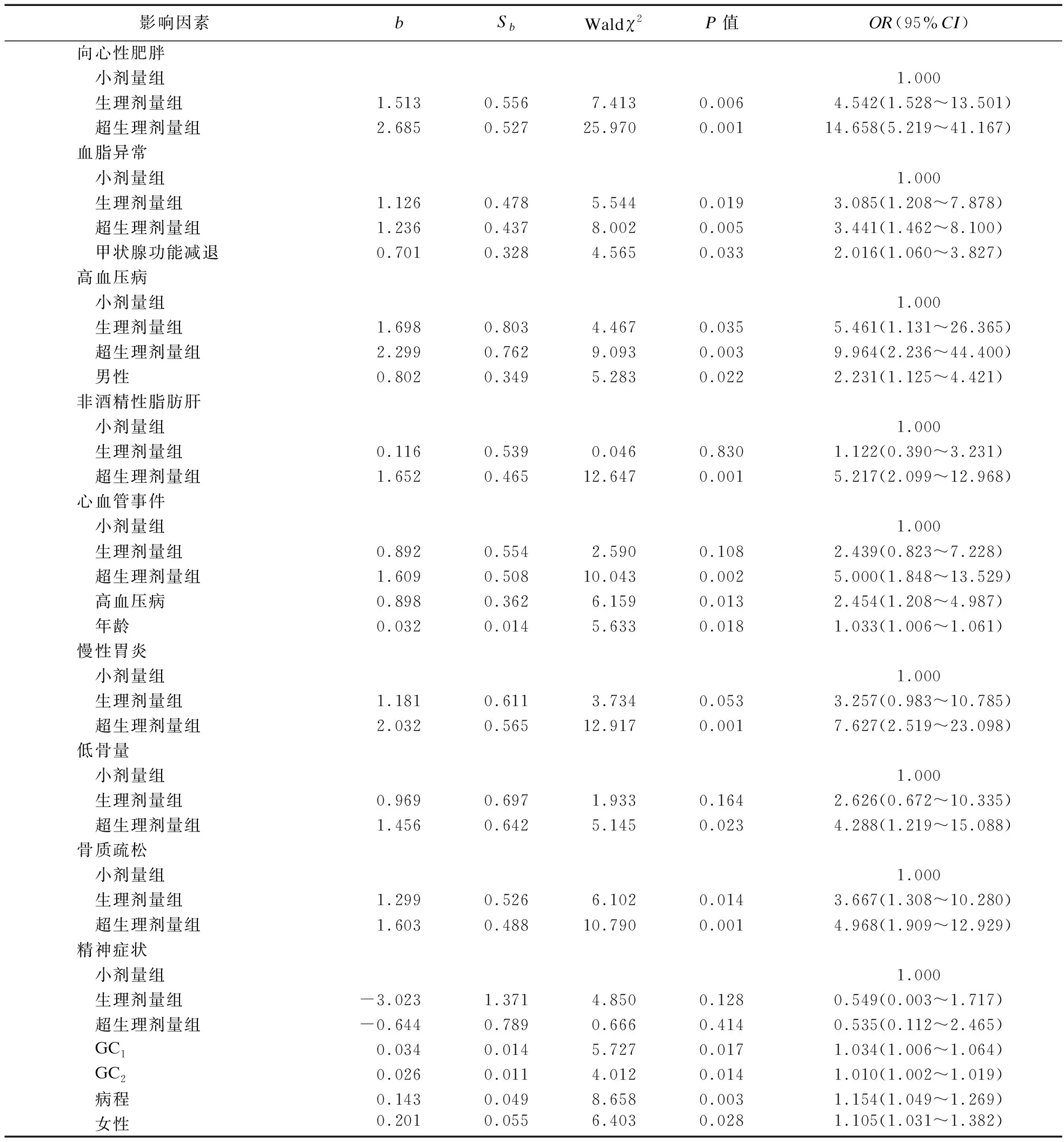
1.2.3 激素暴露的定义 ①高血压病:参照《中国高血压防治指南》[8];②糖尿病、向心性肥胖:参照《中国2型糖尿病医疗标准》(2019年版)[9];③心血管事件:诊断为冠心病、心力衰竭、心肌梗死、冠状动脉重建术或心血管死亡的住院治疗复合终点[10];④低骨量和骨质疏松症:DXA测量分别为腰椎或髋部的-2.5 2.1 三组患者一般临床资料比较 三组患者性别、年龄、病程差异无统计学意义。本研究中,有102例患者长期规律服用超剂量GC替代治疗,占总体53.1%,与规律服用小剂量GC(19.3%)、生理剂量GC(27.6%)患者相比,超生理剂量组收缩压(SBP)、舒张压(DBP)、空腹血糖(FBG)、尿酸(UA)、ALT、AST、总胆固醇(TC)、三酰甘油(TG)、GC1、GC2、GC3更高,HDL-C更低,差异均有统计学意义(P<0.05),故超剂量GC可影响HP患者的血压、血糖、血脂等代谢指标。见表1。 表1 三组患者基线指标比较 2.2 三组患者激素暴露发生情况比较 超生理剂量组激素暴露的人数最多,主要表现为精神症状、向心性肥胖、高血压、冠心病、低骨量、骨质疏松、慢性胃炎、NAFLD、血脂异常,差异均有统计学意义(P<0.05)。①与超生理剂量组相比,小剂量组、生理剂量组精神症状、向心性肥胖、高血压、冠心病、慢性胃炎、NAFLD的发生率较低,小剂量组低骨量、骨质疏松、血脂异常发生率较低,差异均有统计学意义(P<0.05);②与生理剂量组相比,小剂量组向心性肥胖、高血压、低骨量、慢性胃炎的发生率低,差异有统计学意义(P<0.05)。见表2。 表2 糖皮质激素替代剂量对激素暴露发生情况比较 2.3 多因素二元Logistic回归分析 分别以单因素分析中有统计学意义的变量作为因变量,以GC替代剂量和其他对因变量有影响的变量为自变量,进行Logistic分析(α入=0.05,α出=0.10),模型中设定因变量和自变量(如心血管事件:GC剂量、年龄、性别、向心性肥胖、糖尿病、高血压、血脂异常、NAFLD),Logistic回归分析结果显示,以小剂量组为参照,生理剂量及超生理剂量GC是向心性肥胖、血脂异常、高血压病、骨质疏松的危险因素(P<0.05),超生理剂量GC是NAFLD、心血管事件、慢性胃炎、低骨量的危险因素(P<0.05),甲状腺功能减退是血脂异常的危险因素(P<0.05),男性是高血压病的危险因素(P<0.05),高血压病、年龄是心血管事件的危险因素(P<0.05),GC1、GC2、女性、病程是精神症状危险因素(P<0.05)。见表3。 表3 多因素二元Logistic回归分析结果 2.4 生活质量评估 生活质量评估采用SF-36表[15],共随访138例患者(71.9%),54人失联;与超生理剂量组相比,小剂量、生理剂量组在活力、社会功能维度上得分较高,小剂量组更高,差异有统计学意义(P<0.05),与超生理剂量组相比,小剂量组在生理职能、一般健康状态维度上得分较高,差异有统计学意义(P<0.05)。见表4。 表4 GC替代剂量治疗的生活质量评比 研究表明,腺垂体功能减退的发病率逐年增加,激素替代治疗是迄今为止唯一的治疗选择。GC替代是治疗的基石,激素替代治疗的目标是以最小有效剂量去缓解临床症状,最大程度地优化生活质量[1]。Husebye等[4]研究表明,对继发性肾上腺皮质功能不全的患者,推荐每日HC剂量为15~25 mg,分2~3次替代治疗,而部分患者服用的生理替代剂量远高于此。多个研究发现,经常暴露于相对过量的糖皮质激素机体,代谢性疾病、骨密度降低、心血管疾病和死亡风险增加,生活质量严重受损[2,5]。 目前,国内外对HP的研究多集中于病因、临床表现、常规生化等指标的分析上,对于不同剂量GC替代治疗对HP患者激素暴露的影响研究较少,甚至国内外文献没有标准的GC剂量的定义。本研究以Dineen等[6-7]2项前瞻性研究作为参考,将HP患者分为3组,以GC替代剂量(HCeq<20 mg/d)及(HCeq≥30 mg/d)作为切值,进一步了解不同组别患者激素暴露程度差异。本研究中不同GC替代剂量的HP患者在性别、年龄、病程上未见差异。与国内外大样本研究相类似,与低剂量组、生理剂量组对比,超生理剂量组患者SBP、DBP、FBG、UA、AST、ALT、TC、TG、GC1、GC2、GC3更高,HDL-C更低,差异均有统计学意义。说明超生理剂量GC可影响HP患者的血压、血糖、血脂等代谢指标,导致机体糖脂代谢紊乱。Danilowicz等[16]研究证实,GC替代剂量从每日30 mg降低至15 mg可减少腹部脂肪、降低血脂水平和改善生活质量。Behan等[7]研究将10例ACTH缺乏症患者随机分配到3种HC剂量方案:30 mg/d、20 mg/d和15 mg/d,结果表明,服用15 mg/d HC剂量的患者动脉硬化程度更低,夜间血压下降更具生理性。以上研究报道与本研究生化指标提示的结果相符,即超生理剂量GC更易导致糖脂代谢紊乱,激素暴露风险更高。 本研究结果显示,超生理剂量组激素暴露风险显著高于小剂量、生理剂量组,激素暴露主要包括向心性肥胖、血脂异常、NAFLD、高血压病、骨质疏松或低骨量、冠心病等代谢性疾病。与小剂量、生理剂量组相比,超生理剂量组向心性肥胖、高血压病、血脂异常、NAFLD发生率更高,且超生理剂量组心血管疾病(Cardiovascular disease,CVD)发生率高于小剂量、生理剂量组。这与既往研究报道相符,超生理剂量GC可通过诱导代谢综合征(Metabolic syndrome,MS):如肥胖、高血压、胰岛素抵抗、糖脂代谢异常等增加CVD危险因素[17-18]。本研究Logistic回归分析结果显示,以小剂量组为参照,超生理剂量GC(OR=5.000)、高血压病(OR=2.454)、年龄(OR=1.033)为心血管事件的独立危险因素。既往研究显示,GC剂量是CVD的危险因素,超生理剂量GC促使脂肪等代谢组织过度表达11β-羟基类固醇脱氢酶-1,出现内脏肥胖、胰岛素抵抗、血脂异常和高血压等MS表现,且非生理性皮质醇暴露于血管内皮和免疫系统,加速动脉粥样硬化进展[17]。Li等[19]研究发现,MS患者存在左心室肥大、收缩功能受损以及舒张期充盈减少,其可能机制是血管紧张素II的反应增强和过量GC诱导的盐皮质激素受体激活,导致心肌纤维化、心室重构、舒张功能受损,最终导致心力衰竭。众所周知,高血压是冠心病、心肌梗死、心力衰竭等心血管疾病发生发展的危险因素。陈宏等[20]研究发现,高血压发展为冠心病大约需6年,未罹患高血压人群发展为冠心病平均11年,表明高血压在促进动脉粥样硬化进程中起着关键作用,血压升高可以激活血管紧张素-醛固酮系统,血管收缩导致冠脉狭窄甚至冠脉痉挛,继发心血管事件。年龄是CVD不可改变的危险因素,随着年龄增长,人体血管壁弹性下降,CVD风险增加[21]。因此,认识GC替代剂量与心血管危险因素之间的关联,建议使用最低可耐受HC替代剂量,以及积极筛查和管理心血管危险因素降低CVD风险,改善患者生活质量。 GC诱导的骨质疏松(Glucocorticoid-induced osteoporosis,GIOP)是长期大剂量GC导致的最常见继发性骨质疏松,临床表现为骨量减少、骨质疏松甚至股骨头坏死。我国一项纳入3 136例GC治疗患者的研究发现,高达90%的患者存在骨量减少或骨质疏松,其中骨质疏松患病率为41.4%[22]。本研究Logistic回归结果显示,超生理剂量GC(OR=4.288)是低骨量的危险因素,生理剂量(OR=3.667)、超生理剂量(OR=4.968)为骨质疏松的独立危险因素。Ragnarsson等[23]研究表明,GC替代治疗可降低骨密度,是骨骼系统受损的独立危险因素。Schulz等[24]前瞻性研究报道,减少HC替代剂量会导致骨密度增加,增加HC替代剂量骨密度降低,证实小剂量HC更有利于骨形成。GC可能通过促进破骨细胞的分化和成熟来增加骨吸收、加速成骨细胞和骨细胞的凋亡,抑制成骨细胞生成导致骨形成减少[6]。因此,应将GIOP视为可预防的疾病,终生GC替代的患者应给予最小有效替代剂量,并改善生活方式,预防性补钙治疗。 本研究Logistic回归分析结果显示,入院第1天GC剂量(OR=1.034)、第2天GC用量(OR=1.010)、病程(OR=1.154)、女性患者(OR=1.105)是精神症状发生的危险因素,提示病程长的女性患者对GC替代剂量更为敏感。Chatterjee等[25]研究报道席汉综合征患者每日服用30 mg HC和25 μg甲状腺素替代后,出现了精神行为异常表现,改用每日20 mg HC和25 μg甲状腺素,精神症状逐渐缓解。这可能是由于脑皮质醇水平急剧下降和糖皮质激素受体的负反馈抑制减少,长期皮质醇缺乏的患者对外源性类固醇的敏感性增加所致。因此,在HP患者救治中,GC与精神症状的发生呈剂量和时间依赖性,暂停治疗或减少GC剂量可缓解,特别对于病程长的患者,需小剂量GC启始,个性化地调整剂量。 多个研究显示,与健康受试者或服用低剂量GC患者相比,超剂量GC替代治疗患者的生活质量受损,对整体健康的认知降低[26-27]。Ragnarsson等[28]回顾性研究证实,GC剂量与生活质量呈剂量依赖性恶化,每日使用10 mg HCeq的患者生活质量最好,接受25 mg HCeq患者的生活质量最差,推测生活质量与HC剂量之间的负相关可能是由于HP患者非特异性症状而经验性增加HC剂量所致。本研究显示,与生理剂量、超生理剂量组对比,小剂量组在生理职能、一般健康状态、活力、社会功能4个维度上评分均较高,说明小剂量GC替代可改善生活质量,仍强调个性化调整剂量改善预后。由于目前GC替代疗法无法模拟皮质醇分泌的昼夜节律,且缺乏可靠的临床生化监测指标,剂量调整主要依赖于患者的症状及体征,替代过量或不足是导致HP患者生活质量受损的重要原因。因此,避免GC替代过度或不足,需遵循个体化替代原则,尽可能以最小有效剂量缓解皮质醇不足的症状同时又避免激素暴露,加强自我管理可改善生活质量。 综上所述,本研究发现超生理剂量GC是导致HP患者激素暴露的危险因素,建议予以个性化、小剂量GC替代降低激素暴露风险,改善生活质量。由于目前GC替代疗法无法模拟皮质醇分泌的生理节律,且缺乏可靠的临床生化监测指标。因此,开展更可靠的检测方法和研发更符合生理节律的GC替代制剂为当前亟待解决的问题,有待多领域合作研究。
2 结果


3 讨论
