急性Stanford A型主动脉夹层并发心脏压塞术后患者死亡风险因素分析
2023-06-08李峰张瑞成乔博王珂李晓召
李峰 张瑞成 乔博 王珂 李晓召
河南省胸科医院(郑州大学附属胸科医院) 1)心血管外科; 2)感染防控科; 3)综合重症监护病房二病区 郑州 450000
急性Stanford A型主动脉夹层(acute type A aortic dissection,ATAAD)预后极差,症状出现后病死亡率每1 h增加1%~2%,即使外科手术,病死率仍高达18%~34%[1]。ATAAD的并发症包括心脏压塞、主动脉瓣关闭不全、冠状动脉受累、主动脉破裂、肠系膜灌注不良综合征等,其中心脏压塞是急性期死亡的主要原因之一。虽然目前针对ATAAD并发心脏压塞的病理生理学研究及诊治水平较前有所提高,但其病死率仍较高[2],了解ATAAD 并发心脏压塞患者术后死亡风险因素,有助于对此类患者开展有效管理和治疗。
1 资料与方法
1.1研究对象回顾性分析2015-01—2022-12于我院心血管外科收治的ATAAD并发心脏压塞行主动脉外科手术的73例患者的临床资料。入院前或入院后行全程主动脉CTA检查明确诊断为ATAAD。符合ATAAD临床诊断标准(发病14 d内出现任何累及升主动脉和/或延伸至主动脉弓或降主动脉以远的夹层。术前休克状态为心脏压塞因素所致)。采取股动脉插管,单侧或双侧顺行低流量选择性脑灌注(个别患者采取上腔静脉逆行脑灌注)。主动脉近心端操作采用主动脉窦成形、David术、Cabrol术或Bentall术。
1.2研究方法按ATAAD合并心包压塞术后患者生存结局分为死亡组(18例)和对照组(55例)。死亡组为主动脉外科手术后院内出现死亡的患者,对照组为主动脉外科手术后院内治愈的患者。收集和提取入组患者的术前一般资料、术中及术后相关病历资料,主要包括:年龄、体质量、术前休克状态、发病至入院时间、D-二聚体、手术时间、术中出血量、术后24 h内出血量。
2 结果
2.1一般资料共收集73例患者,男54例(74.97%),年龄(54.1±12.1)岁。术后早期死亡18例(24.66%)。2组间的年龄、入院治疗时间、D-二聚体水平、手术时间、休克状态的差异有统计学意义(P<0.05)。见表1。

表1 2组患者的一般资料比较
2.2手术方式死亡组:窦部成形术+升主动脉置换术+孙氏手术9例,Bentall术+孙氏手术2例,Carbrol术+孙氏手术3例,David术+孙氏手术1例,Bentall术+右半弓置换1例,窦部成形术+升主动脉置换术+右半弓置换1例,升主动脉置换术+右半弓置换1例。对照组:窦部成形术+升主动脉置换术+孙氏手术16例,Bentall术+孙氏手术13例,Carbrol术+孙氏手术3例,David术+孙氏手术2例,升主动脉置换术+孙氏手术8例,Bentall术/David术+右半弓置换4例,窦部成形术+升主动脉置换术+右半弓置换4例,升主动脉置换术+右半弓置换4例,窦部成形术+升主动脉置换术1例。
2.3单因素分析结果年龄、术前休克状态、D-二聚体,以及手术时间和早期死亡显著相关(P<0.05);而体质量和发病至入院时间也近乎和死亡相关(P<0.10)。见表2。
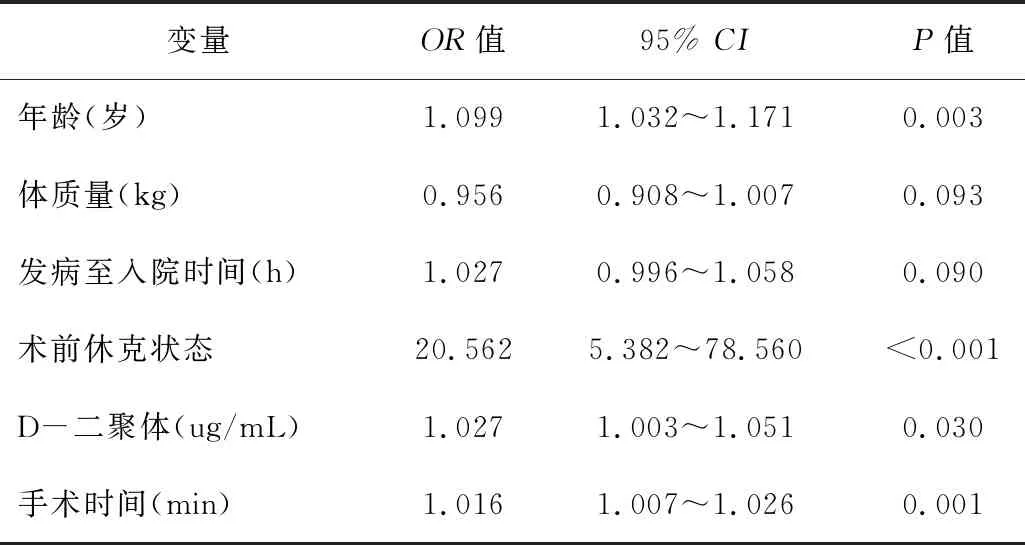
表2 ATAAD并发心脏压塞术后死亡风险因素单因素分析
2.4多因素Logistic回归分析结果将单因素分析中的年龄、体质量、发病至入院时间、术前休克状态、D-二聚体、手术时间(P<0.100)变量纳入多因素Logistic回归分析。结果显示,术前休克状态、D-二聚体、发病至入院时间和手术时间是ATAAD合并心脏压塞术后患者死亡的独立风险因素(P<0.05)。其中术前休克状态和早期死亡强相关(P=0.032)。见表3。

表3 ATAAD并发心脏压塞术后死亡风险因素多因素Logistic回归分析
3 讨论
ATAAD合并心脏压塞是严重的临床危象[3]。ATAAD并发心包积液时,即使未发生心脏压塞,也是心包内发生致命性出血的预兆;发生心脏压塞时,心包顺应性降低,心包腔内压力急剧升高,心室舒张末压力迅速上升,房室瓣提前关闭,引起心室舒张期充盈血量减少,每搏量和心输出量降低。当心脏代偿机制耗尽时,心包腔容量稍微增加即可导致心室舒张压临界增加,使肺循环和体循环充血[4]。
本研究单因素分析结果显示,年龄、术前休克状态、D-二聚体,以及手术时间和早期死亡显著相关。多因素Logistic回归分析结果显示,术前休克状态、D-二聚体、发病至入院时间和手术时间是ATAAD合并心脏压塞术后患者死亡的独立风险因素,其中术前休克状态和早期死亡强相关(OR48.615 ,95%CI: 1.390~1700.888,P=0.032)。
本研究中,术前休克状态是ATAAD并发心脏压塞术后患者死亡的独立风险因素,与Gilon[5]的研究结果类似。有研究发现,ATAAD 患者一旦出现低收缩压时往往提示可能出现心力衰竭、心包积液或夹层破裂出血等危急病情,进入休克状态,预示不良预后[6]。在休克状态下,由于心输出量降低或循环血容量不足,导致组织灌注不足,可引起身体各系统发生凝血功能异常、酸碱平衡紊乱等一系列功能障碍[7]。
D-二聚体是ATAAD患者的早期生物标志物,对ATAAD的诊断有非常重要参考价值,并有助于判断预后[8-9]。心脏压塞是ATAAD的严重并发症之一,病死率高。D-二聚体与心脏压塞的相关性是通过两者都能影响预后而相联系。
发病至入院时间是独立风险因素,研究表明,8%~31%的ATAAD患者合并病死率高的心脏压塞[10-11]。对于ATAAD合并心脏压塞的患者应及时手术,每延迟手术1 h,病死率增加10%[12]。进行控制性心包引流,排出少量积液即可使心包压力急剧下降,改善血流动力学[13]。欧洲心脏病学会(2015年)心包疾病诊断和治疗指南中,心包引流被归类为Ⅱa级推荐[14]。有研究显示,患者在外院转移到心脏中心之前,控制性心包引流可以降低病死率[15-16]。
ATAAD并发心脏压塞后,凝血功能差,考虑与ATAAD并发心脏压塞后引起的炎症反应有关。各种炎性细胞浸润与平滑肌凋亡、转型,以及细胞外基质降解均有推动作用和密切联系。炎症反应导致出血倾向加剧、代谢性酸中毒,从而影响凝血因子的活性和功能,造成止血困难,手术时间延长。手术时间是引起死亡的独立风险因素。
本研究纳入病例较少,统计效能可能较低;对患者的选择亦有一定偏倚,故存在一定局限性。结果尚需继续进行高质量的大样本、多中心研究予以证实。
综上所述,对于ATAAD合并心脏压塞术后患者,术前休克状态、D-二聚体、发病至入院时间和手术时间与死亡独立相关。
