miR-141-3p靶向调控Keap1对缺氧/复氧诱导的心肌细胞凋亡、氧化应激和Nrf2/HO-1通路的影响
2023-06-08秦富吉李妮妮邹延新李凤林
秦富吉,李妮妮,邹延新,李凤林
急性心肌梗死是导致心血管疾病死亡的主要原因,随着冠状动脉介入等再灌注策略在临床的广泛运用,可最大限度地挽救缺血心肌,但恢复冠状动脉血流往往对心肌造成二次损伤,即心肌缺血再灌注损伤,其中氧化应激在缺血再灌注损伤的发病机制中起着非常重要的作用[1-2]。近年来研究发现,miR-141-3p可通过调节心肌细胞存活及凋亡等相关基因改善心肌缺血再灌注损伤,刘大朋等[3]研究发现,脂多糖诱导的心肌细胞中miR-141-3p表达水平明显降低,miR-141-3p可调控Krupec-6(KLF6)的表达影响心肌细胞炎症反应和凋亡。Kelch样环氧氯丙烷相关蛋白1(Keap1)是Kelch家族中的一员,生理状态下与Nrf2形成“门闩-铰链”结构。活性氧(ROS)介导的氧化应激可使Keap1构象发生变化而与Nrf2解离,Nrf2不能继续被泛素化降解,继而转位至细胞核发挥转录活性,激活下游通路发挥抗氧化作用,因此,Keap1在Nrf2/血红素氧合酶1(HO-1)抗氧化应激通路中发挥重要的负性调控作用[4]。本研究通过生物信息学分析显示,Keap1是miR-141-3p的潜在靶基因,但miR-141-3p能否靶向Keap1参与对缺血再灌注心肌细胞凋亡和氧化应激的调控有待阐明。本研究通过建立缺氧/复氧(H/R)H9c2心肌细胞模型,探讨miR-141-3p靶向Keap1对H/R诱导心肌细胞凋亡、氧化应激的分子机制及对制及对Nrf2/HO-1通路的影响。
1 材料与方法
1.1 实验材料 大鼠心肌细胞H9c2购自美国细胞培养物收藏中心(American Type Culture Collection,ATCC)细胞库,V-异硫氰酸荧光素(Annexin V-FITC)细胞凋亡检测试剂盒、细胞毒性试验(CCK-8)试剂盒、ROS染液、4′,6-二脒基-2-苯基吲哚(DAPI)购自碧云天生物技术有限公司,丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽(GSH)检测试剂盒购自南京建成生物科技有限公司,SYBR Green PCR试剂盒购自Thermo公司,逆转录试剂盒购自Fermentas,Lipofectamine 2000试剂购自美国Thermofisher公司,miR-141-3p mimics、miR-NC、Keap1-野生型(WT)质粒和Keap1-突变型(MUT)质粒均购自广州锐博生物科技有限公司,Keap1、Nrf2和HO-1抗体由Proteintech提供,蛋白印迹电泳仪购自美国BIO-RAD公司,实时荧光定量聚合酶链式反应(PCR)仪(ABI 7500)。
1.2 实验方法
1.2.1 细胞H/R模型建立 H9c2细胞采用含10%胎牛血清(FBS)的高糖DMEM培养基,置于37 ℃、5%二氧化碳(CO2)的恒温培养箱中培养,当细胞融合度达到70%时,加入胰蛋白酶消化后进行传代培养。取对数生长期细胞置于无血清DMEM培养基培养,并置于37 ℃、95% N2、5%CO2的培养箱中缺氧培养6 h;然后换为正常培养液,置于37 ℃、5%CO2的培养箱中复氧培养6 h,其中经过H/R处理的心肌细胞作为H/R组。
1.2.2 细胞转染与分组 6孔板接种H9c2细胞,待细胞密度达到70%~80%,按照Lipofectamine 2000操作说明分别转染miR-141-3p mimics、NC质粒,转染6 h后更换培养液。实验分为control组(正常培养的H9c2细胞)、H/R组(H9c2细胞经H/R处理)、H/R+miR-NC组(H9c2细胞NC转染经H/R处理)和H/R+miR-141-3p组(H9c2细胞转染miR-141-3p经H/R处理),每组设3个复孔。
1.2.3 实时荧光定量PCR法检测H9c2细胞中miR-141-3p、Keap1 mRNA表达 取生长状况良好的H9c2细胞,采用Trizol法提取各细胞株总RNA,所得RNA D260/D280>1.7,符合纯度要求。逆转录和PCR反应严格按照试剂盒操作说明进行。PCR反应条件:95 ℃ 10 s,95 ℃ 5 s,60 ℃ 45 s,共40个循环,反应结束后通过分析Ct值,结果采用2-ΔΔCt表示miR-141-3p和Keap1 mRNA相对表达量。
1.2.4 CCK-8法检测各组H9c2细胞存活率 取各组对数生长期的H9c2细胞,培养24 h后,每孔加入CCK-8溶液10 μL,继续培养2 h后,使用全自动酶标仪于波长450 nm处检测各孔吸光度值(OD),计算细胞存活率,细胞存活率(%)=(OD处理组/OD对照组)×100%。
1.2.5 流式细胞仪检测H9c2细胞凋亡 取各组对数生长期的H9c2细胞,按照操作说明分别加入195 μL Annexin V-FITC结合液轻轻重悬细胞、10 μL Annexin V-FITC和5 μL碘化丙啶(propidium iodide,PI)染色液,室温避光孵育15 min,随后进行冰浴。同时以不加Annexin V-FITC及PI的一管作为阴性对照,通过流式细胞仪检测H9c2细胞凋亡情况。
1.2.6 双荧光素酶报告基因实验 先用TargetScan7.1软件预测miR-141-3p与Keap1的3′UTR之间存在碱基互补关系,然后构建野生型及突变型Keap1-3′UTR的报告基因质粒,并将所构建的质粒和miR-141-3p及其阴性对照转染到H9c2细胞中,分为WT+miR-NC组、WT+miR-141-3p mimics组、MUT+miR-NC组、MUT+miR-141-3p mimics组,培养48 h后,严格按照双荧光素酶检测说明书操作,检测各组荧光素酶活性。
1.2.7 蛋白免疫印迹法(Western Blotting)检测H9c2细胞蛋白表达 分别取各组H9c2细胞置于EP试管中,应用细胞裂解液裂解细胞,提取细胞总蛋白,经过聚丙烯酰胺凝胶(SDS-PAGE)电泳、转膜、封闭后,加入稀释后的一抗,室温孵育2 h,TBST洗涤后加入二抗,与膜37 ℃孵育1 h,加入化学发光试剂进行化学发光显影,Image J软件计算条带灰度值,分析蛋白表达量。
1.2.8 酶联免疫吸附测定法(ELISA)检测SOD、MDA、GSH水平 按ELISA试剂盒说明步骤进行检测,用酶联仪在450 nm波长处测定各孔的光密度(OD值),根据OD值所绘制的标准曲线得出SOD、MDA、GSH表达水平。
1.2.9 二氢乙锭(DHE)染色检测ROS含量 用稀释后的DHE染液(稀释浓度为1∶500)染片后,孵育洗涤;用DAPI染液室温避光染核20 min,在荧光显微镜下观察并采集图像,用Image Pro Plus 7.0进行荧光强度分析,计算细胞ROS的含量。
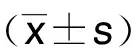
2 结 果
2.1 转染后心肌细胞H9c2中miR-141-3p、Keap1 mRNA表达情况 通过实时定量PCR检测miR-141-3p和Keap1 mRNA在心肌细胞H9c2的表达差异,结果显示,与control组比较,H/R组心肌细胞中miR-141-3p表达量明显下降(P<0.05),Keap1 mRNA表达量明显上升(P<0.05);与H/R+miR-NC组比较,H/R+miR-141-3p组心肌细胞中miR-141-3p水平升高,Keap1 mRNA表达量明显下降,差异均有统计学意义(P<0.05)。详见表1。

表1 各组H9c2细胞miR-141-3p和Keap1 mRNA表达比较
2.2 miR-141-3p对H/R模型H9c2细胞增殖的影响 CCK-8法检测结果显示,与control组比较,H/R组心肌细胞存活率明显降低(P<0.05);与H/R+miR-NC组比较,H/R+miR-141-3p心肌细胞存活率明显升高(P<0.05)。详见图1。

H/R组与control组比较,*P<0.05;H/R+miR-141-3p组与H/R+miR-NC组比较,#P<0.05。
2.3 miR-141-3p对H/R模型H9c2细胞凋亡的作用 与control组比较,H/R组心肌细胞凋亡率明显增加(P<0.05);与H/R+miR-NC组比较,H/R+miR-141-3p组细胞凋亡率明显降低(P<0.05)。详见图2。

H/R组与control组比较,*P<0.05;H/R+miR-141-3p组与H/R+miR-NC组比较,#P<0.05。
2.4 miR-141-3p对H/R模型H9c2细胞氧化应激的影响 采用DHE荧光探针检测ROS含量,绿色荧光为ROS阳性表达,结果显示,与control组比较,H/R组心肌细胞ROS含量明显升高(P<0.05),与H/R+miR-NC组比较,H/R+miR-141-3p组ROS含量明显降低(P<0.05)。ELISA结果显示,与control组比较,H/R组心肌细胞MDA表达水平明显升高(P<0.05),SOD和GSH表达水平明显降低(P<0.05),与H/R+miR-NC组比较,H/R+miR-141-3p组MDA表达水平明显降低(P<0.05),SOD和GSH表达水平明显升高(P<0.05)。详见图3、表2。

图3 各组H9c2细胞ROS的荧光染色图(DHE染色法,×200)

表2 各组H9c2细胞SOD、MDA、GSH含量的比较
2.5 双荧光素酶实验证实miR-141-3p靶向调控Keap1表达 TargetScan等生物学信息软件预测结果显示,Keap1是miR-141-3p的潜在靶基因。双荧光素酶报告结果显示,质粒与miR-NC或miR-141-3p mimics共转染入H/R模型H9c2细胞后,与miR-NC组比较,miR-141-3p mimics组WT Keap1荧光素酶的活力值明显降低,差异有统计学意义(P<0.05),miR-141-3p mimics组MUT Keap1荧光素酶的活力值无明显变化,证明miR-141-3p靶向结合Keap1的3′UTR。Western Blotting进一步验证miR-141-3p与Keap1的靶向调控关系,结果显示,miR-141-3p mimics组H9c2心肌细胞中Keap1蛋白表达明显低于miR-NC组(P<0.05)。详见图4、图5。

图4 miR-NC组与miR-141-3p mimics组Keap1表达双荧光素酶报告

与miR-NC组比较,*P<0.05
2.6 miR-141-3p过表达对H/R模型H9c2细胞Nrf2/HO-1通路的影响 Western Blotting结果显示,与control组比较,H/R组Nrf2、HO-1蛋白水平明显降低(P<0.05);与H/R+miR-NC组比较,H/R+miR-141-3p组Nrf2、HO-1蛋白水平明显升高(P<0.05)。详见图6、表3。

图6 各组H9c2细胞Nrf2、HO-1蛋白表达的条带图

表3 各组Nrf2、HO-1蛋白相对表达量比较
3 讨 论
急性心肌梗死是导致慢性心力衰竭的首要原因,也是死亡率较高的不良心血管事件之一[5]。经皮冠状动脉介入、冠状动脉旁路移植术等治疗方法的广泛开展,明显降低了急性心肌梗死的死亡率,但由于缺血再灌注治疗引发的心肌损伤和心脏重塑严重影响病人预后,Maeda等[6]研究显示,缺血再灌注造成的心肌损伤程度甚至可能远高于缺血造成的损伤。近期研究证实,氧化应激、能量代谢障碍、线粒体功能障碍、炎症反应、细胞凋亡可能是心肌缺血再灌注损伤的主要机制,其中ROS介导的氧化应激导致心肌线粒体功能障碍,并与其他机制相互作用,是导致心肌缺血再灌注损伤的重要环节[7]。本研究结果显示,H9c2细胞发生H/R后,心肌细胞ROS和MDA水平明显升高,GSH和SOD水平明显降低,细胞存活率明显下降,凋亡率明显增加,提示心肌细胞氧化应激损伤和凋亡是缺血再灌注损伤进展的关键,减轻心肌细胞氧化应激损伤和凋亡对防治心肌缺血再灌注损伤具有重要的意义。
miRNA是一种内源性非编码RNA,可通过靶向结合靶基因mRNA,从而调控目的基因的表达,参与心肌缺血再灌注的信号通路,进而调控心肌细胞的存活和凋亡。秦少强等[8]通过构建心肌细胞H/R损伤模型,证实miR-202-5p靶向下调SOX6减轻H/R诱导的心肌细胞氧化应激,促进细胞存活,抑制细胞凋亡。作为miRNA家族成员之一,miR-141-3p是一种内皮细胞中丰富表达的miRNA,与心肌细胞凋亡、内皮细胞增殖和间充质干细胞衰老等有关[9-10],尹岚轩[11]研究发现,miR-141-3p在内毒素血症大鼠心肌组织中下调表达,其可能与心肌损伤发生有关,Zhang等[12]研究发现miR-141-3p模拟物可通过靶向Wnt5a减轻动脉粥样硬化模型细胞的增殖和迁移,从而抑制动脉粥样硬化进展。但miR-141-3p在心肌H/R病理过程的作用机制尚未完全阐明,本研究运用实时荧光定量PCR检测H/R模型H9c2细胞中miR-141-3p的表达发现,miR-141-3p表达减低,进一步通过细胞凋亡、CCK-8等实验证实,外源性上调miR-141-3p可提高H/R模型H9c2细胞的存活率,抑制心肌细胞凋亡。
Nrf2/HO-1是机体调节氧化应激的重要通路,Keap1是Nrf2 的负调控因子[13]。正常生理状态下,Nrf2与Keap1结合并游离在细胞质中,当细胞受到氧化物攻击时,Nrf2与Keap1解偶联并转移入核,造成Nrf2/HO-1通路的激活,增强机体的抗氧化能力。Wang等[14]研究证实过表达miR-200a或si-Keap1可降低脊髓损伤大鼠MDA水平,增加SOD活性和Nrf2表达及其下游HO-1等蛋白表达,发挥抗氧化作用,Chen等[15]研究证实,si-Keap1可抑制高糖介导的ROS积累,活化Nrf2/ARE信号通路,减轻氧化应激损伤。Holmström等[16]研究发现,Nrf2敲除小鼠的胚胎成纤维细胞和神经胶质细胞中的线粒体膜电位和三磷酸腺苷(ATP)合成水平与野生型小鼠细胞比较均出现降低,通过药理途径增强Nrf2的活化,可以保护大鼠免受氧化应激损伤。本研究通过数据库筛查和双荧光素酶报告实验证实,Keap1是miR-141-3p的下游靶基因,并且通过Western Blotting证实miR-141-3p可负性调控Keap1的表达。本研究结果显示,外源性上调miR-141-3p可抑制Keap1的表达,降低心肌细胞ROS和MDA水平,增加GSH和SOD水平,激活Nrf2/HO-1信号转导通路,从而通过减轻H/R模型H9C2细胞氧化应激和凋亡发挥保护作用。
综上所述,miR-141-3p可通过负向调控Keap1减轻心肌细胞氧化应激水平,抑制心肌细胞凋亡,miR-141-3p和Keap1有望成为干预心肌细胞H/R的临床治疗新靶点。
